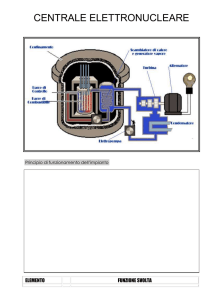
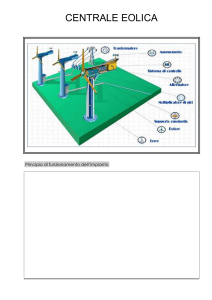
TERMODINAMICA
Premessa
La termodinamica è un sottoinsieme della Fisica che, come ogni teoria fisica o
insieme di teorie, è definita dagli oggetti con cui e su cui opera e dal modo in cui
questi sono messi in relazione tra loro.
Tra questi oggetti, quello più caratteristico è quello che comunemente si intende
come "calore", da cui la termodinamica stessa trae la propria denominazione; la
parola "termodinamica", infatti, potrebbe essere resa con "dinamica dei sistemi che si
scambiano calore", intendendo dire, con questo, che essa si occupa di stabilire il
modo in cui i sistemi fisici evolvono quando sono in grado di scambiarsi calore.
Prima di affrontare il problema di fornire alla parola calore un significato
appropriato e quello di stabilirne la natura, possiamo dare qualche indicazione di
massima sulle caratteristiche generali dei sistemi termodinamici.
Il loro aspetto saliente è che un sistema termodinamico è costituito da un enorme
numero di costituenti individuali: per fissare le idee, dell'ordine del numero di
Avogadro.
Questo mette nell'impossibilità di trattare i sistemi termodinamici con i metodi della
meccanica, dal momento che seguire l'evoluzione di un così grande numero di
particelle prese una ad una è certamente un compito proibitivo.
Ne consegue che l'approccio classico al problema non fa nessun riferimento a una
struttura microscopica dei sistemi termodinamici, ma solo a grandezze ideate ad hoc
per poter dare di essi descrizioni a livello macroscopico.
Un punto di vista più moderno, invece, è in grado di trattare i sistemi termodinamici
mettendo a frutto proprio quello che sembrerebbe essere il loro difetto più grosso,
vale a dire il grandissimo numero di componenenti elementari.
Questo è stato reso possibile dal fatto di avere rinunciato a dare delle cose una
descrizione di tipo deterministico in senso stretto; cioè di avere limitato il fronte delle
certezze al livello in cui ha senso chiedersi che cosa consegue da una cosa, ignorando
il problema di dover giustificare con lo stesso metro modelli che possono essere
considerati come di transizione tra un piano in cui tutto è possibile, seppure con
differenti livelli di possibilità, e uno in cui questa vaga danza di ombre prende la
consistenza delle cose misurabili e relazionabili in modo consueto.
Questo passo è stato reso attuabile dall'introduzione di uno strumento matematico
piuttosto singolare, perché è quello secondo cui i giocatori d'azzardo danno forma ai
loro pronostici: il calcolo delle probabilità e la statistica.
Vedremo in un'altra sezione come questo strumento, seppure applicato ad un
modello ingenuo, possa fornire indicazioni di tutta certezza a partire da un quadro
di assoluta ignoranza.
In questa unità, in ogni caso, non verrà privilegiato nessuno di questi due punti di
vista, vale a dire quello macro e quello microscopico; verrà anzi data per scontata
una loro complementarità, allo scopo di fornire, di volta in volta, elementi utili ad
una compresione più agile dei fatti.
Partiremo proprio da una situazione di questo genere pe poter costruire uno dei
principali concetti operanti nel quadro classico a partire da considerazioni di livello
microscopico.
1
1.
L ' Energia
interna
Si tratta di una grandezza che tende ad una generalizzazione del concetto di
"energia" introdotto in meccanica.
Consideriamo il sistema più semplice possibile, costituito da una particella di massa
m e dotato di una velocità v; per "particella", intenderemo sempre, salvo
controindicazioni, un singolo atomo o una molecola.
Per una particella libera in movimento, dunque, l' energia interna U sarà unicamente
quella cinetica:
m
v
(1)
2
U = 1 mv
2
Il livello immediatamente superiore è costituito da due particelle indipendenti
caratterizzate come in figura; anche in questo caso l'energia interna è esclusivamente
cinetica, ed è la somma dei singoli contributi delle due particelle:
m1
v1
v2
m2
(2)
U=
1 m v2 + 1 m v
2
2 1 1 2
2
2
Per più di due particelle, il discorso non cambia, salvo che cresce il numero degli
addendi:
U=
!
1 m v2
i i
2
La situazione successiva introduce la possibilità di un'interazione tra due particelle,
che in figura è rappresentata da una molla ideale per indicare che si tratta di una
forza di tipo elastico:
2
a
m1
G
m2
(3)
Come si vede, le cose cominciano a complicarsi; non entreremo nel dettaglio, ma ci
limiteremo ad osservare che all'energia interna totale di un simile complesso
contribuirà un termine cinetico dovuto alla vibrazione del sistema T vibr. lungo
l'asse a , uno T rot . , ancora cinetico, associato alla rotazione rigida dell'insieme,
un terzo, sempre cinetico, che corrisponde alla traslazione rigida dell'insieme nei
termini del suo baricentro, T tr . ; infine, un termine potenziale associato all'
interazione elastica interatomica Ui.a. (m.) :
U = Ttr. + T rot.+ T vibr.+ U i.a.(m.)
Questo modello di massima descrive sufficientemente bene una molecola biatomica:
in prima e discreta approssimazione, l'attrazione coulombiana tra due (o più) atomi
in una molecola dipende dalla distanza come la forza elastica.
L'estensione di questo modello a molecole composte da più di due atomi non
presenta particolari problemi concettuali, a questo livello, salvo lo sforzo di
prevedere l'intervento di un maggior numero di variabili per descrivere le vibrazioni
e le rotazioni.
In un sistema costituito da più molecole, il discorso si porrà negli stessi termini che
per le singole particelle: se indipendenti, si tratta solo di fare una somma di termini
come quello precedente, se in interazione si dovrà aggiungere a questo totale un
termine U i m che esprima l'energia potenziale associata al legame intermolecolare.
Se la sostanza sarà costituita da molecole, essa rappresenterà il legame tra molecole;
se da atomi, il legame tra singoli atomi.
Zoomando ulteriormente verso il basso, dobbiamo constatare che anche gli elettroni
sono legati ai nuclei e che quindi deve intervenire un altro termine in ragione di
questo legame intra-atomico: Eg.e., l'energia del guscio elettronico; essa corrisponde
a quella necessaria per ionizzare completamente un atomo.
Infine, anche il nucleo ha una struttura discreta: è composto di "nucleoni", protoni e
neutroni, assemblati al suo interno dall'interazione nucleare "forte". Dunque,
compare un altro termine En., che rappresenta l'energia del legame tra i nucleoni nei
nuclei.
Si ha così:
U = Ttr. + Tvibr. + Trot. + Ui.a.( m ) + Ui.m. + Eg.e. + En.
3
2. Il calore
Esaurito il prblema di definire l'energia interna, possiamo passare a livello
macroscopico e svolgere in esso le nostre considerazioni.
Cominciamo col la constatazione del fatto che, quando un sistema cede o acquista
energia, la sua energia interna subisce una variazione ΔU tale che
ΔU < 0 , in caso di cessione
ΔU > 0 , in caso di assorbimento .
In una trasformazione puramente meccanica, questi scambi possono prodursi solo
mediante svolgimento di lavoro da parte del sistema oppure sul sistema; e
precisamente si ha
L > 0 , se il sistema compie un lavoro esterno
L < 0 , se il sistema riceve lavoro dall'esterno .
Come si vede,
L > 0 ↔ ΔU < 0
L < 0 ↔ ΔU > 0.
Ciò si condensa in una relazione che può essere pensata come una trascrizione e
un'estensione della conservazione dell'energia meccanica, nel senso che ciò che in
meccanica è "energia potenziale" ora, più generalmente, è "energia interna":
L = - ΔU.
(1)
Ma, più in generale, appunto, in una trasformazione siamo ora autorizzati a pensare
che possano avvenire scambi di energia anche secondo modalità diverse da quelle
propriamente meccaniche, cioè attraverso scambi di un qualcosa che chiamiamo
"calore".
Ma che cosa è il calore? Che cosa significa dire che è energia?
E se il calore è energia, per quale motivo lo si deve distinguere da quella meccanica?
Al momento, non è possibile dare una risposta esauriente a queste domande; lo
faremo più avanti, anche se ora cercheremo di chiarire almeno gli aspetti principali
della questione.
Si deve dire, innanzitutto, che il calore è stato riconosciuto in quanto energia in
un'epoca in cui la meccanica aveva già raggiunto uno sviluppo pressochè definitivo e
non era del tutto tramontata la speranza che si potesse ben rappresentare qualunque
fenomeno naturale applicandone opportunamente i principi.
Il calore era stato addirittura assimilato ad un fluido detto "calorico" che doveva
avere la capacità di passare da un sistema ad un altro scorrendo proprio come fanno
i fluidi; l'impossibilità di determinarne la consistenza materiale unitamente allo
sviluppo di considerazioni più appropriate aveva fatto abbandonare ben presto
questo modello.
4
In seguito, come vedremo meglio tra breve, fu possibile realizzare una famosa
esperienza in cui si stabilisceche, date certe condizioni, è possibile fornire energia
meccanica ad un sistema ed ottenere lo stesso risultato che si otterrebbe fornendogli
un'opportuna quantità di quella cosa chiamata calore; per questa via, l'equivalenza
tra l'energia meccanica e quella detta "termica" è cosa vatta, ed è possibile quindi non
solo riconoscere che il calore può essere inteso come una forma di energia diversa da
quella meccanica, ma anche stabilire il senso preciso di questa equivalenza attraverso
misure di energia meccanica e di energia termica.
Questo è, al momento, tutto quello che ci può servire per partire in direzione di tutti
gli approfondimenti del caso; un primo grande passo sarà proprio quello del
prossimo paragrafo.
3. Il Primo Principio della Termodinamica
Ammesso in via preliminare e in attesa di ulteriori specificazioni che il calore è, per la
Fisica, una delle forme possibili dell'energia, possiamo ammettere anche che i suoi
scambi avvengano in piena analogia con quelli che si attuano per via meccanica; e
cioè che
- se U decresce, cioè se ΔU<0, significa che è stato emesso calore,
ovvero che Q<0, e viceversa;
- se U cresce, cioè se ΔU>0, significa che è stato assorbito calore,
ovvero che Q>0, e viceversa.
Questo significa che le variazioni di energia interna e quelle di energia termica hanno
lo stesso segno.
Questi scambi, inoltre, devono avvenire nel rispetto della conservazione dell'energia,
per cui le conversioni di energia interna in termica e viceversa devono essere tali che
Δ Ut = Q
(2)
In questa espressione abbiamo posto l'indice t a piede di U allo scopo di sottolineare
il fatto che questa variazione di energia interna è associata ad uno scambio di energia
termica.
Ora, come già sappiamo, in una trasformazione puramente meccanica, si ha
Δ Um = -L
(3)
Ma allora, se consideriamo una trasformazione di tipo generale, in cui, cioè, i sistemi
si scambino energia sia meccanica che termica, le due condizioni finora considerate
separatamente devono sussistere anche simultaneamente, cioè deve essere,
sommando membro a membro la (2) e la (3)
Δ U = -L + Q (4)
Questa è la forma analitica del Primo Principio della Termodinamica, il cui
enunciato suona semplicemente così:
5
se in una trasformazione un sistema scambia energia sia
meccanica che termica, la variazione della sua energia interna
deve essere uguale alla loro somma algebrica
Il primo principio, scritto nella forma (4), fa presumere che L e Q siano misurati in
unità omogenee, cioè che il calore venga misurato in joules; questa possibilità esiste,
ma va opportunamente discussa, come faremo puntualmente a suo tempo.
In effetti, per come la termologia si è sviluppata prima del riconoscimento della
natura del calore, l'unità di energia termica non è la stessa di quella dell'energia
meccanica; una volta riconosciuta tale natura, questo è un problema del tutto
marginale, riconducibile banalmente alla determinazione di una costante di
ragguaglio, come vedremo.
Lasciando momentaneamente da parte questo aspetto, introduciamo invece un'altra
delle grandezze fondamentali della termologia.
4. La temperatura
Procediamo con alcune definizioni:
- due sistemi si dicono "in contatto termico" quando sono in grado di
scambiarsi energia sottoforma di calore.
- due sistemi si dicono "in equilibrio termico" quando, posti in contatto
termico, non si scambiano calore.
Allora diremo che
- due sistemi A e B in equilibrio termico hanno la stessa temperatura.
Come si vede, non abbiamo assolutamente definito che cosa si intende per
"temperatura", ma solo per "uguale temperatura".
Può sembrare un discorso di lana caprina, ma non è così.
Ma vediamo subito come da questo strano passo iniziale si arrivi con assoluta
chiarezza al concetto di temperatura.
Partiamo allora dal fatto che, una volta convenuto che questo oggetto è una
grandezza fisica, la sua definizione non può che derivare dal fatto di essere
misurabile, cioè, in buona sostanza, dai metodi convenuti per la sua misura.
Misuriamola, dunque.
Per questo, assumiamo due sistemi campione A e B e diciamo che
"tutti i sistemi in equilibrio con A hanno la temperatura tA
e tutti quelli in equilibrio con B hanno la temperatura tB".
Ora decidiamo, arbitrariamente, il valore da attribuire a tA e a tB, dimodochè
abbiamo anche stabilito quale "intervallo di temperatura" separa convenzionalmente
i due valori, nonchè l'ampiezza dell'intervallo unitario.
Abbiamo costruito, in questo modo, un intervallo di temperatura.
6
Così, ad esempio, se il sistema A è costituito dal ghiaccio fondente e quello B da
acqua in ebollizione in condizioni standard predeterminate, e se diciamo che tA=0 e
tB=100, abbiamo costruito una scala centesimale nota come scala Celsius o
centigrada: basta solo estrapolarla per misurare, in linea di principio, qualunque
temperatura.
In questa scala l'intervallo unitario, detto "grado centigrado" °C, è la centesima parte
dell'intervallo tra la temperatura dell'acqua bollente e quella del ghiaccio fondente.
Esistono, naturalmente, infinite possibilità di scegliere le convenzioni ed esistono,
quindi, altre scale di temperatura.
Tra esse citeremo senz'altro quella assoluta o "Kelvin" e, seppure con scarsissimo
entusiasmo, quella diffusa nei paesi anglosassoni, la "Farhenheit".
Nella prima, rimane inalterata l'ampiezza dell'intervallo di riferimento e quindi del
"grado", ma cambiano i riferimenti assoluti; anzi, si riducono addirittura ad uno: lo
zero assoluto, che corrisponde alla temperatura più bassa possibile in natura.
La ragione di questa circostanza, cioè dell'esistenza di un limite inferiore alla
temperatura, apparirà chiara quando, tra non molto, si sarà chiarito a sua volta il
legame tra temperatura e calore.
Di fatto, risulta che suddetta temperatura sia circa -273°C, che vengono a
corrispondere a 0°K o "assoluti".
Col che gli 0°C diventano +273°K ed è quindi immediatamente determinata la
relazione tra temperatura centigrada ed assoluta:
t°C = T°K + 273
(4)
Nella scala Fahrenheit, lo zero centigrado risulta essere 32°F e i 100°C sono 212°F,
dimodochè non viene conservata neppure l'ampiezza del grado unitario: 100°C
diventano 180°F, per cui 1°F= (100/180) = (5/9)°C.
Ne consegue che la formula di conversione tra le due scale è (vedi anche la figura)
t°C = 5(t°F-32)/9
7
(5)
Un'ultima e doverosa considerazione riguarda gli strumenti per la misura della
temperatura; infatti, finora abbiamo solo definito delle scale, ma non gli strumenti
che ne "indicano i gradini", comunemente noti come "termometri".
Ne esistono di vari generi ed i più diffusi sono a "dilatazione termica", uno degli
effetti prodotti dal calore di cui ci occuperemo tra breve; di conseguenza tutto il
discorso è rimandato a quell'occasione.
5. Calore e temperatura
E' banale rilevare come sia noto a tutti che, riscaldando un corpo, si eleva la sua
temperatura; "riscaldare", più propriamente, sta per "fornire calore a...".
Dunque, un nesso tra calore e temperatura indubbiamente sussiste.
Peraltro, non è altrettanto patrimonio del senso comune la loro differenziazione,
anche se nessuno pretenderebbe di riscaldare il proprio appartamento bruciando
fiammiferi, bensì affidandosi ad un sistema di termosifoni.
Sì, perché, a ben pensarci, la fiamma del fiammifero brucia le dita più di un
termosifone, e quindi molti equivoci possono scaturire da un semplice momento di
distrazione che comporta una piccola ustione.
Ma le due cose -calore e temperatura- sono ben diverse tra loro, e tutto nasce dal
fatto che mentre il calore rappresenta un contenuto energetico veicolato nel corso di
una trasformazione da un sistema all'altro o tra le parti di uno stesso sistema, la
temperatura ne esprime, in qualche misura, il "dislivello termico".
Con questa espressione, certamente discutibile, si vuole portare l'attenzione su un
dato di fatto fondamentale, che verrà trattato ed esaurito in un'altra unità:
- il calore fluisce, spontaneamente, dai sistemi a temperatura più alta
a quelli a temperatura più bassa.
Questa circostanza, di carattere veramente fondamentale, è l'aspetto che, nello
stabilire una chiara relazione tra calore e temperatura, ne sancisce la diversa natura.
Ma trasformiamo ora questa relazione qualitativa tra calore e temperatura in
un'opportuna relazione formale tra i due.
Si tratta di una relazione estremamente semplice, perché si constata che
data una massa m di una certa sostanza soggetta ad una variazione Δt
della temperatura, il calore assorbito o ceduto in corrispondenza è
direttamente proporzionale a m e a Δt:
Q = C m ΔT
(6)
Il fattore di proporzionalità C che, visibilmente, corrisponde alla quantità di calore
necessario per produrre una variazione di temperatura di un grado in una massa
unitaria, prende il nome di calore specifico ed è una quantità comprensibilmente
inerente alla sostanza considerata.
Normalmente per "grado" si intende quello centigrado e la massa unitaria è di 1g.
8
Generalmente, C dipende a sua volta da t, ma per intervalli di temperatura
relativamente contenuti può essere considerato costante; per questo viene, di norma,
tabulato entro certi intervalli di temperatura, ad esempio, di 20 gradi in 20 gradi.
A partire dalla (6), è ora possibile definire immediatamente l'unità di calore, la
caloria: è semplicemente il calore specifico di un materiale campione riferito alla
variazione di temperatura di un grado; dato che il calore specifico dipende da t,
occorre anche scegliere convenientemente dove esso si colloca nella scala.
La sostanza prescelta è l'acqua, e il grado campione è quello che cade tra i 14,5°C e i
15,5°C, in corrispondenza di una temperatura che, in media, può essere
ragionevolmente riscontrata in un laboratorio.
Dunque, diremo "caloria" ( cal ) la quantità di calore che eleva la temperatura di un
grammo d'acqua da 14,5°C a 15,5°C.
Di uso molto comune, il suo multiplo Kcal, pari a 1000 cal e riferito, ovviamente, ad
un kilogrammo d'acqua.
6. L'"equivalente meccanico" della caloria
Come abbiamo già avuto modo di rilevare, per ragioni storiche legate all'evoluzione
della Fisica, i discorsi concernenti il calore e quelli riguardanti la meccanica si sono
sviluppati in modo relativamente indipendente, ragione per cui non deve stupirsi
nessuno se l'unità di misura dell'energia meccanica, il joule, è diversa da quella
dell'energia termica, la caloria.
Peraltro, la necessità di uniformare le valutazioni di tali oggetti non poteva nascere
se non dopo il riconoscimento del fatto che il calore è una forma di energia; cosa che
si è prodotta in modo esplicito e completo solo verso la metà dell'ottocento.
A questo punto, si pone il quesito: a quanti joules corrisponde una caloria e
viceversa?
A questa domanda è possibile rispondere ricorrendo ad un'esperienza esemplare
ideata da Joule, e il cui apparato viene schematizzato nella figura sottostante.
Esso consiste in un "recipiente calorimetrico", vale a dire un recipiente
opportunamente isolato termicamente contenente una certa massa M d'acqua; in
essa è immerso un sistema di pale rotanti intorno ad un asse verticale connesso a sua
volta mediante un opportuno marchingegno meccanico ad un filo che sorregge una
massa m, ovviamente soggetta al suo peso mg.
Per ragioni che vedremo subito, lo spazio interno è suddiviso in setti comunicanti,
cioè permeabili all'acqua, ma tali da impedirne la rotazione o, comunque,
l'assunzione di moti ordinati.
Al tutto è associato, naturalmente, un termometro per la misura della temperatura
dell'acqua.
9
m
L'idea è in sè semplice: lasciando cadere il peso per un tratto h, la parte di energia
potenziale mgh che non si converte in energia cinetica del peso (facilmente
valutabile misurando la velocità di caduta del peso) o in energia cinetica di rotazione
delle pale (valutabile a sua volta per una misura della loro velocità di
rotazione)finisce, salvo le perdite meccaniche nel marchingegno di trasduzione del
moto alle pale, per essere incamerata nel sistema.
Ora entra in gioco l'accorgimento dei setti.
Se infatti si è badato ad evitare il famoso moto ordinato dell'acqua, vale a dire che
una parte dell'energia finisca per tradursi in energia cinetica -ordinata- dell'acqua,
tutto quello che entra nel sistema si deve convertire in energia interna.
Bene, detto questo, si procede ad effettuare una serie di cadute del peso ed alla
valutazione dell'energia meccanica trasferita al sistema e si confronta infine la
temperatura del sistema con quella iniziale: si constata un suo incremento.
Poichè si è escluso l'ingresso di energia termica e poichè l'esito, peraltro, è lo stesso
che avrebbe dato l'apporto di energia termica (l'aumento della temperatura), si può
concludere che il lavoro meccanico L entrato nel sistema equivale alla quantità di
calore Q che idealmente può produrre lo stesso effetto, valutabile in termini di
Q = C M' ΔT
Si badi bene che questo calore, nel processo, non è mai esistito nè poteva esistere; si
tratta di un valore nominale, nel senso che la variazione di temperatura per effetto
dell'apporto di energia meccanica può essere letto come se fosse stata fornita al
sistema l'energia termica fittizia espressa dalla formula precedente.
Si noti che la massa del sistema ivi riportata non è propriamente quella dell'acqua,
ma una massa M' che contiene la correzione dovuta al fatto che non solo l'acqua ha
ricevuto energia "termica", ma anche tutto l'apparato contenuto nel calorimetro,
comprese certe sue parti.
Per correttezza, a parte, si calcola il valore di una massa fittizia me detta "equivalente
in acqua del calorimetro" che va ad aggiungersi a quella, reale, dell'acqua.
In sostanza, me è la massa che avrebbe una opportuna quantità d'acqua che avrebbe
assorbito nel corso del fenomeno la stessa energia che ha invece assorbito il
complesso calorimetrico.
In ogni caso, effettuate le misure, si trova che il rapporto tra il lavoro L assorbito dal
sistema e il calore fittizio Q calcolato è pari a circa 4,186 J/cal.
Questo numero un pò speciale viene denominato "equivalente meccanico della
caloria" e costituisce la costante di ragguaglio tra i due metodi di misura: quello
meccanico e quello termico dell'energia.
10
7. Dilatazione termica
Uno degli effetti dell'assorbimento o della cessione di calore da parte di un corpo è
l'alterazione delle sue dimensioni.
Generalmente i corpi si dilatano per riscaldamento e si contraggono se vengono
raffreddati.
Limitando al momento il discorso allo stato solido, questo comportamento è
derivabile dal modello microscopico a cui abbiamo fatto appello per illustrare il
concetto di energia interna; basta aggiungere al quadro l'idea che quanto più si
accresce l'energia interna, tanto più cospicua diventa l'energia posseduta dalle
singole componenti del sistema.
Dal momento che, nello stato solido, gli atomi sono legati tra loro da forze di tipo
elastico, ne consegue che essi oscillano intorno a certe posizioni di equilibrio la cui
ampiezza, come si può facilmente intuire, dipende dall'energia posseduta dal
sistema.
Così, se questa aumenta e, di conserva, cresce la temperatura, ci dobbiamo aspettare
che aumenti l'ampiezza delle oscillazioni; ma allora aumenta il volume virtuale
occupato da ogni atomo, vale a dire il volume entro cui un atomo può essere trovato,
per cui l'insieme degli atomi viene ad occupare uno spazio più esteso.
Questa dilatazione risulta correlata alla variazione di temperatura anche a livello
macroscopico e, anche se non si tratta di una relazione del tutto lineare, entro certi
limiti di approssimazione può essere posta in termini piuttosto semplici.
Così, indicato con lo il valore iniziale della dimensione lineare di un corpo solido e
con to la sua temperatura, quello l(t) relativo alla temperatura t generica è, in prima
approssimazione,
l(t) = lo(1 + λΔt),
in cui l è il "coefficiente di dilatazione lineare", caratteristico del materiale e Δt = t-to
la differenza di temperatura. In genere l è molto piccolo, dell'ordine di 10-5÷10-6.
Questa formula, lo ripetiamo, è valida solo in prima approssimazione; ciò significa
che in realtà al termine lineare dovrebbero seguire altri termini di grado crescente
con coefficienti via via più ridotti; ma per intervalli di temperatura contenuti i loro
contributi si possono trascurare, proprio per il fatto che rappresentano ordini di
grandezza ben al di sotto di qualunque valutazione sperimentale.
Per trasferire il discorso in tre dimensioni e riferirsi alla dilatazione del volume,
basta elevare entrambi i membri della precedente al cubo:
3
3
2
3
2
3
3
V(t) = [l(t)] = lo(1 + !Dt) = V o[1 + 3 !" t + 3 ! ( " t) + ! ( " t) ]
Ora, per quanto si è detto sopra i termini di secondo e terzo grado possono essere
accantonati (il quadrato ed il cubo di l hanno ordini di grandezza molto piccoli
rispetto a l), per cui possiamo scrivere
V(t) = Vo(1 + 3λΔt)
Ciò si può esprimere anche dicendo che il coeficiente di dilatazione in tre dimensioni
è il triplo di quello lineare.
11
Per i liquidi e gli aeriformi le cose vanno in maniera analoga, salvo il fatto che i
coefficienti di dilatazione sono diversi, superiori a quelli dei solidi, per la precisione.
Nel caso specifico dei gas, questo discorso viene sviluppato ampiamente nella
sezione dedicata alla teoria cinetica.
12