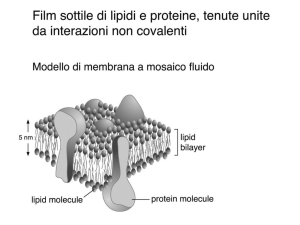
• Gli esosomi sono vescicole extracellulari (<100 nm) che
derivano dal compartimento endocitico della cellula. Essi
sono rilasciati da tutte le cellule nucleate, reticolociti e
piastrine, e si trovano nella maggior parte dei liquidi corporei.
Gli esosomi contengono proteine, lipidi e RNA ed
intervengono nella comunicazione intercellulare, sia a livello
locale che sistemica.
Sono coinvolti in numerosi processi fisiologici, come la
regolazione del sistema immunitario, ed attualmente sono in
corso di sviluppo terapie basate sull’impiego di vescicole
extracellulari che vengono testate clinicamente per il
trattamento di malattie infiammatorie, autoimmuni e cancro.
Regulation of immune responses by extracellular vesicles. Nat Rev Immunol. 2014 Mar;14(3):195-208. doi: 10.1038/nri3622.
Robbins and Morelli
Feb 2014
ESCRT (Endosomal Sorting
Complexes Required for
Transport); ER, reticolo
endoplasmatico; miRNA,
microRNA; t-SNARE (target
delle proteine SNARE);
v-SNARE (vescicole)
Biogenesi degli esosomi
Il complesso ESCRT0 riconosce le
proteine ubiquitinate sul lato citosolico degli
endosomi o del MVB, separa le proteine in
microdomini e lega il complesso ESCRTI,
che a sua volta recluta ESCRTII.
ESCRTI e ESCRTII avviano la formazione
delle ILV all'interno dei MVB.
Successivamente, RNA e proteine
citosoliche sono trasportate verso l'interno
delle vescicole che si formano.
Quindi i complessi ESCRTII reclutano
ESCRTIII che induce la formazione delle
ILV. L’ubiquitina libera (Ub) e le subunità
ESCRT vengono quindi rilasciate nel
citoplasma per essere riciclate.
Biogenesi degli esosomi
Il complesso ESCRT0 riconosce le proteine ubiquitinate sul
lato citosolico degli endosomi o del MVB, separa le proteine in
microdomini e lega il complesso ESCRTI, che a sua volta
recluta ESCRTII.
ESCRTI e ESCRTII avviano la formazione delle ILV all'interno
dei MVB. Successivamente, RNA e proteine citosoliche sono
trasportate verso l'interno delle vescicole che si formano.
Quindi i complessi ESCRTII reclutano ESCRTIII che induce la
formazione delle ILV. L’ubiquitina libera (Ub) e le subunità
ESCRT vengono quindi rilasciate nel citoplasma per essere
riciclate. Alcune proteine (per esempio, la PLP) sono inserite
nelle ILV da meccanismi indipendenti dagli ESCRT attraverso
microdomini ricchi di sfingolipidi, da cui si formano i ceramidi ad
opera delle sfingomielinasi. Il ceramide induce coalescenza dei
microdomini ed innesca la formazione di ILV.
Dagli MVB inizia sia la:
• via secretoria, il traffico
di vescicole si dirige
verso la periferia cellulare
e si fonde con la
membrana plasmatica,
rilasciando le ILV
direttamente o dopo
l'attivazione di recettori di
superficie che scatenano
un flusso di ioni calcio;
• via degradativa, le ILV
si fondono con i
lisosomi. Il pathway
lisosomiale è cruciale per
limitare il signalling dei
recettori attivati da
fattori di crescita.
Biogenesi degli esosomi
Il complesso ESCRT0 riconosce le proteine ubiquitinate sul
lato citosolico degli endosomi o del MVB, separa le proteine in
microdomini e lega il complesso ESCRTI, che a sua volta
recluta ESCRTII.
ESCRTI e ESCRTII avviano la formazione delle ILV all'interno
dei MVB. Successivamente, RNA e proteine citosoliche sono
trasportate verso l'interno delle vescicole che si formano.
Quindi i complessi ESCRTII reclutano ESCRTIII che induce la
formazione delle ILV. L’ubiquitina libera (Ub) e le subunità
ESCRT vengono quindi rilasciate nel citoplasma per essere
riciclate. Alcune proteine (per esempio, la PLP) sono inserite
nelle ILV da meccanismi indipendenti dagli ESCRT attraverso
microdomini ricchi di sfingolipidi, da cui si formano i ceramidi ad
opera delle sfingomielinasi. Il ceramide induce coalescenza dei
microdomini ed innesca la formazione di ILV.
Meccanismo di trasferimento tra cellule di RNA esosomale
mRNA e piccoli RNA non codificanti (miRNA) sono trasportati all'interno del
lume di microvescicole di secrezione. Una volta rilasciate, le vescicole si
fondono con le cellule target.
Gli esosomi, vescicole di origine endocitica di 30-100 nm,
mediano funzioni biologiche diverse, tra cui l'invasione
metastatica del tumore, la comunicazione cellula-cellula e la
presentazione dell'antigene attraverso il trasferimento di
proteine, mRNA e microRNA.
In questo studio abbiamo dimostrato che il miR-10b, altamente
espresso nel carcinoma mammario metastatico rispetto al
cancro al seno non metastatico o alle cellule del seno non
maligne, è attivamente secreto nel mezzo attraverso esosomi
I nostri risultati suggeriscono che una serie di specifici microRNA
può svolgere un ruolo importante modulando il
microambiente tumorale attraverso gli esosomi. Una migliore
comprensione di questo processo può essere di aiuto nello
sviluppo di nuovi agenti terapeutici.
Exosome-mediated transfer of miR-10b promotes cell invasion in breast cancer. Mol Cancer. 2014 Nov
26;13(1):256. Singh et al.
Le vescicole extracellulari (EV), esosomi, microvesicole e
corpi apoptotici, sono rilasciate da un gran numero di tipi
cellulari, intervengono nella comunicazione intercellulare e
svolgono ruoli sia fisiologici che patologici con il loro carico di
proteine, lipidi ed acidi nucleici.
Un campo emergente che in questi ultimi anni sta producendo
risultati sorprendenti riguarda il ruolo degli esosomi nella
fisiologia e nella patologia cardiaca.
In questa review viene messa in evidenza l’attuale conoscenza
del ruolo delle EV nel sistema cardiovascolare, inclusa la
loro origine cellulare, i ruoli funzionali, la loro utilità come
biomarker ed il possibile impiego terapeutico.
Extracellular Vesicles in Heart Disease: Excitement for the Future? Exosomes
Microvesicles. 2014;2(1). doi: 10.5772/58390. Danielson and Das
Gli esosomi vescicole che sono liberate dalle cellule da strutture
multivescicolari o dalla membrana plasmatica. La maggior parte, se non tutti, i
tipi cellulari rilasciano vescicole extracellulari, che quindi entrano in
circolazione nei fluidi corporei. Queste vescicole contengono un sottoinsieme
di proteine, lipidi ed acidi nucleici che sono derivati dalla cellula madre.
Si pensa che le vescicole extracellulari abbiano un ruolo importante nella
comunicazione intercellulare, sia a livello locale che sistemico, in quanto
permettono di trasferire il loro contenuto (tra cui proteine, lipidi e their
contents, including proteins, lipids and RNAs, between cells. RNA) tra le
cellule.
Gli esosomi sono coinvolti in numerosi processi fisiologici, e le vescicole
provenienti dalle cellule immunitarie e non-immunitarie svolgono ruoli
importanti nella regolazione immunitaria.
Sono in sviluppo e si stanno testando clinicamente terapie basate su
vescicole per il trattamento delle malattie infiammatorie, malattie autoimmuni
e il cancro.
Dato l'enorme potenziale terapeutico delle vescicole extracellulari, questa
recensione si concentra sul loro ruolo nel modulare le risposte immunitarie,
così come le loro potenziali applicazioni terapeutiche.
Regulation of immune responses by extracellular vesicles. Nat Rev Immunol. 2014 Mar;14(3):195-208. doi:
10.1038/nri3622. Robbins and Morelli
Feb 2014
• La composizione proteica degli esosomi dipende dal tipo cellulare di
provenienza.
• Negli esosomi si trovano proteine coinvolte nella genesi e nel traffico di
vescicole (ad esempio, TSG101, ALIX, annexine e proteine Rab), nella
trasduzione del segnale (per esempio, kinasi e proteine G),
nell’organizzazione del citoscheletro (per esempio, actina e tubulina), nella
presentazione dell'antigene (per esempio, MHC e proteine da shock termico),
vescicole rivolte alle cellule accettori o alla matrice extracellulare (per
esempio, integrine e MFGE8), ecc. Gli esosomi contengono anche enzimi e
fattori necessari per la sintesi di proteine e RNA.
• Come risultato delle loro proprietà immunomodulanti e di trasportare
antigeni derivati da cellule, gli esosomi sono stati utilizzati per la vaccinazione
positiva o negativa in modelli sperimentali.
Gli esosomi potrebbero anche essere utili come biomarcatori per
l'individuazione o la stadiazione del cancro, e probabilmente per disturbi
infiammatori, immunologici o metabolici.
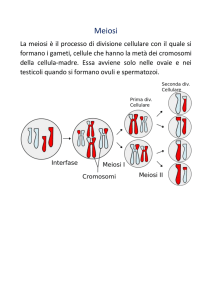
MEIOSI (Prima divisione)
• Crossing over
• Metafase con le tetradi
• In anafase migrano
i cromosomi
• Divisione asimmetrica
(nel sesso femminile)
Nel corso della formazione di un individuo a
partire dallo zigote, le cellule germinali si
differenziano molto presto dalle linee cellulari
somatiche
Tutte le cellule, sia somatiche che germinali,
aumentano di numero dividendosi per mitosi
Solo le cellule germinali possono, una sola
volta nel corso della vita di una singola cellula
germinale, dividersi per meiosi
La meiosi genera cellule aploidi che formeranno i
gameti responsabili della riproduzione
Nelle gonadi femminili, gli ovociti posizionati nelle ovaie prima
della nascita dopo aver subito la replicazione del DNA ed
all’inizio della ricombinazione meiotica che assicura la diversità
genetica della prole potenziale (sono fermi nella profase della
prima divisione meiotica, nutriti ed ingrassati dalle cellule
somatiche che lo circondano nel follicolo
Una volta ogni ciclo mestruale, un aumento delle
gonadotropine induce la maturazione meiotica di un grosso
ovocita, scoppia il follicolo e l’ovocita di secondo ordine si
ritrova solo nelle tube
Nel periodo precedente, attraverso le gap junctions, l'ovocita
primario aveva avuto modo di accumulare tutte le molecole
necessarie per sostenere lo sviluppo di un embrione
Restarting life: fertilization and the transition from meiosis to mitosis - Nat Rev Mol Cell Biol. 2013 Sep;14(9):549-62. doi:
10.1038/nrm3643 - Clift D, Schuh M.
La meiosi è un processo di divisione cellulare
caratteristico degli organismi eucarioti, sia unicellulari
che pluricellulari
Negli organismi pluricellulari la meiosi viene
realizzata soltanto da cellule diploidi specializzate, le
cellule germinali
Con la meiosi, una cellula diploide (2n) dopo aver
replicato il suo DNA (4n), mediante due divisioni
successive forma quattro cellule aploidi (n)
La meiosi porta alla formazione di cromosomi nuovi
attraverso il crossing over
Nella maggior parte dei casi, le cellule aploidi
prodotte dalla meiosi sono (o diventano)
gameti, uovo o spermatozoo
La sessualità comporta l'alternarsi di due
eventi a carico dei nuclei cellulari: la meiosi e
la cariogamia
La cariogamia, che consiste nella fusione dei
nuclei dei due diversi gameti e che talvolta è
preceduta dalla fusione dei citoplasmi, origina
lo zigote, cellula il cui nucleo (2n) è fornito di
una doppia serie di cromosomi a due a due
omologhi
(b) modello del network
mediato da vescicole e
actina per il posizionamento asimmetrico
del fuso per la meiosi I;
(c) modello che illustra come il
complesso ARP2/3
(actin-related protein 2/3)
aiuta a mantenere il fuso
nella metafase II in periferia
mentre l'uovo attende
la fecondazione;
Restarting life: fertilization and the transition from meiosis to
mitosis - Nat Rev Mol Cell Biol. 2013 Sep;14(9):549-62.
doi: 10.1038/nrm3643 - Clift D, Schuh M.
RICOMBINAZIONE
DURANTE LA PROFASE
DELLA MEIOSI I (E
LA RIPARAZIONE
DEL DNA)
Mechanisms and principles of homology search during
recombination. Nat Rev Mol Cell Biol. 2014 Jun;15(6):369-83. doi:
10.1038/nrm3805. Epub 2014 May 14. Renkawitz et al.
Mag 2014
La ricerca delle regioni
omologhe si basa
principalmente su eventi di
sondaggio casuali all'interno
di una zona di prossimità
spaziale. Tuttavia, a seconda
del contesto in cui si verifica,
ricerca di omologia è
influenzata anche da altri
parametri:
(a) la coesina svolge un ruolo
importante nell’assicurare la
prossimità spaziale per
l'efficienza di ricombinazione
(b) per esplorare un volume
più grande (per esempio, per
abilitare una ricombinazione
ectopica non allelica) è di
beneficio una maggiore
mobilità di grandi parti di
genoma.
(c) Il sondaggio alla
ricerca dell’omologia è
accelerato da un
contatto scorrevole
(d) ed è facilitato da
proteine che
aumentano
l'accessibilità DNA
attraverso il
rimodellamento dei
nucleosomi (indicata
da frecce e il punto
interrogativo).
Mechanisms and principles of homology
search during recombination. Nat Rev Mol
Cell Biol. 2014 Jun;15(6):369-83. doi:
10.1038/nrm3805. Epub 2014 May 14.
Renkawitz et al.
Mag 2014
Poiché sembra che
la mobilità della
“cromatina” sia
circa la stessa in
specie diverse, la
percentuale di
genoma che viene
effettivamente
controllato nella
ricerca di
omologia casuale
è dettato
principalmente
dalle dimensioni
dei genomi e dai
volumi nucleari.
Mechanisms and principles of homology search during recombination. Nat Rev Mol Cell Biol. 2014
Jun;15(6):369-83. doi: 10.1038/nrm3805. Epub 2014 May 14. Renkawitz et al.
Mag 2014
GAMETOGENESI
1. abbozzo del flagello; 2. Golgi
3. abbozzo dell’acrosoma
4. centrioli;
6. nucleo
5. mitocondri che si disporranno a spirale nel collo
dello spermatozoo
7. flagello;
8. microtubuli;
9. coda
10. acrosoma
i nucleosomi si arrotolano in solenoidi
MAR = Matrix Attachment Region
Le protammine:
- hanno dimensione pari a circa metà di quella degli
istoni (5-8 KDa)
- il 55 - 70% degli amminoacidici è arginina
- contengono molte cisteine che formano ponti a
disolfuro crociati inter- ed intra-protaminici
- le protamine sostituiscono gli istoni ed
arrotolano il DNA in toroidi
- non tutti gli istoni sono rimossi, sembra
importante che restino zone di cromatina
L’allontanamento degli istoni è facilitato da modificazioni post-traduzionali delle
proteine, quali acetilazione degli istoni, ubiquitinazione e fosforilazione. Al posto degli
istoni si legano prima delle proteine di transizione che sono rimosse per
fosforilazione/defosforilazione per permettere alle protamine di legarsi al RNA
La spermatogenesi nei mammiferi è caratterizzata da due
ondate di espressione di piRNA:
la prima corrisponde ai classici piRNA responsabili del
silenziamento dei retrotransposoni
la seconda riguarda regioni intergeniche nontransposoniche
negli spermatociti in pachitene, ma la funzione di questi
pachitene piRNA è in gran parte sconosciuta.
Qui riportiamo il coinvolgimento dei piRNA del pachitene nel
guidare la massiccia eliminazione di mRNA negli spermatidi di
topo in allungamento.
Pachytene piRNAs instruct massive mRNA elimination during late spermiogenesis. Cell Res. 2014
Jun;24(6):680-700. doi: 10.1038/cr.2014.41. Epub 2014 May 2. Gou et al.
Mag 2014
Il pi-RISC contribuisce al programma di eradicazione degli
mRNA durante la spermiogenesi. ... Tale eliminazione di mRNA
su larga scala innescata dai pi-RISC può facilitare la
condensazione del nucleo e l’estrusione del citoplasma
per il completamento della formazione degli spermatozoi nei
mammiferi.
Pachytene piRNAs instruct massive mRNA elimination during late spermiogenesis. Cell Res. 2014
Jun;24(6):680-700. doi: 10.1038/cr.2014.41. Epub 2014 May 2. Gou et al.
Mag 2014
La zona pellucida delle uova dei mammiferi è
composta da 3 (4 nell’uomo) glicoproteine
Le proteine ZP2, ZP3 e (ZP4)
formano lunghi filamenti
che vengono poi connessi
dalla proteina ZP1 per
formare una rete tridimensionale.
Dopo la capacitazione (modificazione della fluidità della membrana per rimozione
del colesterolo, …), gli spermatozoi possono interagire in modo specifico con le
proteine ZP3 e ZP4, l’aumento intracellulare di ioni Ca++ è anche coinvolto
nell’attivazione della reazione acrosomale che consentirà la fecondazione.
La trascrizione dell’ovocita si ferma verso la fine della fase di crescita
prima della maturazione, quando cromatina è altamente condensata e
circonda il nucleolo. La trascrizione riprende completamente solo allo
stadio di 2 cellule (nel topo) o 4 cellule (nell’uomo), dopo la
fecondazione.
La maturazione degli ovociti, la fecondazione e la moltitudine di
modificazioni cellulari che guidano la transizione da uovo ad embrione si
verificano in assenza di regolazione trascrizionale. Dopo la fecondazione
avviene la commutazione del controllo della espressione genica da
materna ad embrionale.
La riattivazione del genoma, passo finale nella transizione da controllo
materno dell’espressione genica a controllo embrionale, implica l'attivazione
trascrizionale del genoma embrionale di nuova formazione, dello zigote.
La trascrizione è associata ad uno stato aperto della cromatina aperta che
permette di fattori di trascrizione di accedere facilmente al DNA, pertanto il
rimodellamento della cromatina ha un ruolo chiave nell'inizio dell’attivazione
del genoma dello zigote. Il rimodellamento della cromatina da proteine
materne è un passo importante per l'attivazione del genoma dello zigote.
Restarting life: fertilization and the transition from meiosis to mitosis - Nat Rev Mol Cell Biol. 2013 Sep;14(9):549-62. doi: 10.1038/nrm3643 - Clift
FECONDAZIONE
Nelle tube, lo spermatozoo
si lega alla zona
pellucida (matrice
glicoproteica) che
circonda l'uovo
ed i due gameti si
fondono per
formare lo zigote.
L'oocita secondario
riprende la meiosi e
segrega la metà dei
rimanenti cromatidi fratelli
in un secondo globulo polare.
Restarting life: fertilization and the transition from meiosis to mitosis - Nat Rev Mol Cell Biol. 2013 Sep;14(9):549-62. doi:
10.1038/nrm3643 - Clift D, Schuh M.
Reproductive biology: Sperm protein finds its
mate. Nature. 2014 Apr 24;508(7497):466-7. doi:
10.1038/nature13227. Epub 2014 Apr 16.
Wassarman
Apr 2014
Complesso di adesione tra spermatozoo e uovo.
(a) durante la fecondazione, un singolo spermatozoo si lega
alla membrana dell'uovo che si trova sotto la zona pellucida. La
proteina Izumo della membrana dello spermatozoo forma
un complesso di adesione con il recettore Juno della
membrana dell'uovo. Se non si forma questo complesso la
fecondazione non avviene.
(b) dopo la fecondazione Juno viene perso dalla membrana
dell'uovo, uscendo in vescicole extracellulari, impedendo il
legame e la fusione di altri spermatozoi.
(c) al momento
della fecondazione,
una fosfolipasi dello
spermatozoo,
PLCζ, produce
inositolo-trifosfato
che si lega ad un
recettore a canale
ionico sul reticolo
endoplasmatico
con conseguente
rilascio di ioni
Ca2+ che attivano
una proteina kinasi
calmodulina-dipendente
(CaMKII) che, tra i
vari effetti, attiva la demolizione dell’inibitore EMI2, per permettere ad APC/C
di promuovere il completamento della meiosi. L'aumento dei livelli
intracellulari di Ca2+ innesca anche l’esocitosi dei granuli corticali (risposta
corticale), la traduzione di mRNA materni e la transizione da meiosi a mitosi.
Restarting life: fertilization and the transition from meiosis to mitosis - Nat Rev Mol Cell Biol. 2013 Sep;14(9):549-62. doi: 10.1038/nrm3643 Clift D, Schuh M
• Dopo l’ovulazione, se l’ovocita secondario è
fecondato, completa la seconda divisione
meiotica diventando un uovo maturo
• Nel pronucleo maschile si riforma la
cromatina eliminando le protammine e
riformando i nucleosomi con nuovi istoni
• I due pronuclei inizieranno la mitosi insieme
dando origine allo zigote
Dopo la fecondazione, il
macchinario del ciclo
cellulare deve essere
modificato per passare
dalla meiosi alla mitosi
Restarting life: fertilization and the transition from meiosis to mitosis - Nat Rev Mol Cell Biol. 2013 Sep;14(9):549-62. doi: 10.1038/nrm3643 - Clift
D, Schuh M.
Uno dei passaggi più drammatici che viene innescato dalla fecondazione è la
transizione dalle divisioni meiotiche estremamente asimmetriche
dell’ovocita alla divisione simmetrica dell'embrione unicellulare (zigote).
Il posizionamento asimmetrico del fuso meiotico negli ovociti si realizza
utilizzando un complesso meccanismo actina-dipendente che utilizza motori
molecolari che consumano ATP.
Figura: transizione del posizionamento del fuso da asimmetrico a simmetrico:
(a) immagini del posizionamento asimmetrico del fuso ad opera della F-actina
durante la meiosi I negli ovociti di topo;
Restarting life: fertilization and the transition from meiosis to mitosis - Nat Rev Mol Cell Biol. 2013 Sep;14(9):549-62. doi: 10.1038/nrm3643 - Clift D,
Schuh M.
(d) modello che mostra
come i due pronuclei ed
il primo fuso mitotico
sono posizionati al centro
dello zigote spingendo
i microtubuli dell’aster
contro la corteccia;
(e) modello che mostra
come i due pronuclei ed
il primo fuso mitotico sono
posizionati al centro dalla
dineina che è ancorata in
vari punti del citoplasma.
Restarting life: fertilization and the transition from meiosis to mitosis - Nat Rev Mol Cell Biol. 2013 Sep;14(9):549-62. doi: 10.1038/nrm3643 - Clift
D, Schuh M.
Una rapida serie di mitosi produce otto
piccole cellule embrionali (blastomeri)
che aderiscono tra loro formando la
morula. Le due successive mitosi
generano due differenti popolazioni di
cellule, quelle all'interno che costituiranno
l'embrione e quelle all’esterno che
daranno origine al tessuto extraembrionale necessario per supportare lo
sviluppo embrionale in utero.
Restarting life: fertilization and the transition from meiosis to mitosis - Nat Rev Mol Cell Biol. 2013 Sep;14(9):549-62. doi:
10.1038/nrm3643 - Clift D, Schuh M.
Dopo diverse
divisioni
mitotiche,
lo zigote
formerà la
morula
La successiva
formazione di una cavità piena di liquido
porta alla formazione della blastocisti
che si impianta nella parete uterina
Allo stadio di 32 cellule, all’interno dell’embrione si
inizia a formare una cavità piena di liquido, che
continua a crescere mentre l'embrione matura in
blastocisti. Arrivata nell’utero, la blastocisti si
stacca dalla zona pellucida per legarsi alla parete
uterina su cui l'embrione si continua a sviluppare.
La transizione da uovo ad embrione è una delle
trasformazioni cellulari più drammatiche e complesse
della biologia umana. La cellula risultante dalla
fecondazione, lo zigote, è in grado di generare
tutte le cellule del corpo umano.
Restarting life: fertilization and the transition from meiosis to mitosis - Nat Rev Mol Cell Biol. 2013 Sep;14(9):549-62. doi:
10.1038/nrm3643 - Clift D, Schuh M.
La fecondazione innesca un programma cellulare complesso
che trasforma due gameti altamente specializzati, uovo e
spermatozoo, in un embrione totipotente. I legami che
uniscono i cromatidi fratelli vengono rimodellati per sostenere
il passaggio da meiosi riduzionale a mitosi equazionale,
reintroducendo il centrosoma che è assente nell’uovo.
L’imprinting genomico viene selettivamente cancellato e
ripristinato, ed il controllo dell’espressione delle proteine si
sposta da traduzionale a trascrizionale.
Con la fecondazione, i genomi aploidi di ciascun gamete
vengono riuniti per formare il genoma diploide nuovo ed
unico dell’individuo che nascerà.
Restarting life: fertilization and the transition from meiosis to mitosis - Nat Rev Mol Cell Biol. 2013 Sep;14(9):549-62. doi:
10.1038/nrm3643 - Clift D, Schuh M.
La riattivazione del genoma, passo finale nella
transizione da controllo materno dell’espressione
genica a controllo embrionale, implica l'attivazione
trascrizionale del genoma embrionale di nuova
formazione, dello zigote.
La trascrizione è associata ad uno stato aperto della
cromatina aperta che permette di fattori di
trascrizione di accedere facilmente al DNA, pertanto il
rimodellamento della cromatina ha un ruolo chiave
nell'inizio dell’attivazione del genoma dello zigote.
Il rimodellamento della cromatina da proteine
materne è un passo importante per l'attivazione del
genoma dello zigote.
Restarting life: fertilization and the transition from meiosis to mitosis - Nat Rev Mol Cell Biol. 2013 Sep;14(9):549-62. doi: 10.1038/nrm3643 - Clift
D, Schuh M.
Il DNA degli spermatozoi umani è altamente metilato, quello
delle uova un pò meno. Subito dopo la fecondazione si ha
una rapida demetilazione, che è maggiore nello spermatozoo,
e che prosegue fino alla blastocisti. Durante il successivo
sviluppo embrionale la metilazione ricomincia per consentire
alle cellule di trasmettere alle cellule figlie le opportune istruzioni
sul controllo dell’attività dei geni e guidare il differenziamento.
Cellular memory erased in human embryos. Nature. 2014 Jul 31;511(7511):540-1. doi: 10.1038/nature13648.
Epub 2014 Jul 23. Reik and Kelsey
Lug 2014
Dopo la fecondazione, i genomi parentali devono essere riprogrammati
per la totipotenza, ed il macchinario del ciclo cellulare deve essere
modificato per passare dalla segregazione riduzionale dei cromosomi
(meiosi) alla segregazione equazionale dei cromosomi (mitosi).
Al momento della fecondazione, il genoma materno è organizzato in
cromosomi bloccati nella metafase II, il genoma paterno è privo di
cromatina, strettamente compattato nella testa dello spermatozoo. Nello
zigote esiste inizialmente una notevole differenza nello stato cromatina dei
genomi parentali che deve essere risolto per garantire la segregazione
accurata dei cromosomi durante la prima divisione mitotica.
Dopo la fecondazione, mentre il pronucleo femminile completa la seconda
divisione meiotica, nel pronucleo maschile si riforma la cromatina
eliminando le protammine e riformando i nucleosomi con nuovi istoni, con la
variante di usare H3.3 al posto dell’istone H3.
Alla fine del processo, i due pronuclei anche se strutturati in cromatina,
conservano alcuni pattern di metilazione degli istoni specifici dei due
genitori, in particolare nelle regioni di eterocromatina pericentromerica che
saranno gradualmente riequilibrate durante le prime mitosi embrionali.
Restarting life: fertilization and the transition from meiosis to mitosis - Nat Rev Mol Cell Biol. 2013 Sep;14(9):549-62. doi:
10.1038/nrm3643 - Clift D, Schuh M.
Lo zigote acquisisce la totipotenza dalla riprogrammazione della
cromatina dei genomi parentali, che coinvolge una demetilazione globale
del DNA. Durante le prime divisioni mitotiche dell'embrione, entrambi i
genomi parentali subiscono una massiccia demetilazione che è massima
allo stadio di blastocisti.
La demetilazione del genoma dell'embrione non è totale, una piccola
porzione dei geni hanno imprinting, il che significa che saranno espressi
solo da uno dei due cromosomi parentali, protetti da una particolare
metilazione al momento della formazione dei gameti che non sarà
modificata durante la riprogrammazione epigenetica dell'embrione. Questi
loci imprinted saranno protetti dalla demetilazione dalla presenza di PGC7.
Subito dopo la fecondazione avviene non solo il rimodellamento della
cromatina ma anche la riorganizzazione dei collegamenti fisici tra i
cromosomi che devono essere riorganizzati per sostenere la segregazione
equazionale dei cromatidi fratelli nelle successive mitosi. Il passaggio dalla
meiosi alla mitosi comporta un cambiamento radicale nella complesso
della coesina sui cromosomici.
Restarting life: fertilization and the transition from meiosis to mitosis - Nat Rev Mol Cell Biol. 2013 Sep;14(9):549-62. doi:
10.1038/nrm3643 - Clift D, Schuh M.
RIPROGRAMMAZIONE
EPIGENETICA
NELLO SVILUPPO
L'identità delle cellule è determinata da specifici
pattern di espressione genica che dipendono dalle
interazioni tra fattori di trascrizione e DNA nel contesto
della cromatina.
Durante lo sviluppo, le modificazioni epigenetiche
stabilizzano l'espressione genica e garantiscono
che i modelli di metilazione del DNA e di modificazione
degli istoni siano reintegrati nelle cellule in mitosi.
La cancellazione globale delle marcature
epigenetiche si verifica naturalmente in due fasi del
ciclo di vita dei mammiferi, ma può anche essere
artificialmente progettata utilizzando una varietà di
strategie
di
riprogrammazione.
Epigenetic programming and reprogramming during development - Nat Struct Mol Biol. 2013
Mar;20(3):282-9. doi: 10.1038/nsmb.2489. Epub 2013 Mar 5. Cantone and Fisher
Mag 2014
Programmazione epigenetica e riprogrammazione durante il ciclo di vita del
topo
TE, trophoectoderm;
PE primitive endoderm
Epigenetic programming and reprogramming during development - Nat Struct Mol Biol. 2013
Mar;20(3):282-9. doi: 10.1038/nsmb.2489. Epub 2013 Mar 5. Cantone and Fisher
Programmazione/riprogrammazione epigenetica nel topo
Le modificazioni epigenetiche sono importanti per la
determinazione delle linee e dell'identità cellulare durante lo
sviluppo. La riprogrammazione globale del paesaggio epigenetico
segna invece la conversione di cellule differenziate a cellule
totipotenti o pluripotenti, al momento della fusione dei gameti
(spermatozoi e ovociti) nello zigote e nelle cellule germinali (PGC)
dopo la loro specificazione dall’epiblasto somatico dell'embrione
post-impianto.
Due popolazioni di cellule pluripotenti si stabiliscono ex vivo nella
finestra temporale in cui avviene una vasta riprogrammazione
epigenetica. Queste cellule sono le ESC e le cellule germinali
embrionali (EGC), che derivano dalla massa cellulare interna della
blastocisti e dalle PGC a E8.5-E13.5, rispettivamente. I grandi
eventi di rimodellamento (ad esempio la demetilazione del DNA e
la riattivazione del cromosoma X) sono evidenziati con frecce
colorate.
Epigenetic programming and reprogramming during development - Nat Struct Mol Biol. 2013
Mar;20(3):282-9. doi: 10.1038/nsmb.2489. Epub 2013 Mar 5. Cantone and Fisher
Variazioni epigenetiche durante la riprogrammazione in vivo
Epigenetic programming and reprogramming during development - Nat Struct Mol Biol. 2013
Mar;20(3):282-9. doi: 10.1038/nsmb.2489. Epub 2013 Mar 5. Cantone and Fisher
Variazioni
epigenetiche
durante la
riprogrammazione
in vivo:
(a) Schema delle
modificazioni globali
del DNA e degli istoni
che portano
all’attivazione
trascrizionale del
genoma embrionale
tra lo zigote terminale
(solo genoma paterno)
e lo stadio di 2 cellule. Dopo la fecondazione, i genomi dei gameti sono
sottoposti a diversa programmazione epigenetica; il genoma paterno è per lo
più oggetto di rimodellamento epigenetico nella fase di zigote, il genoma
materno a poco a poco perde le modifiche repressive durante le successive
divisioni cellulari.
Epigenetic programming and reprogramming during development - Nat Struct Mol Biol. 2013
Mar;20(3):282-9. doi: 10.1038/nsmb.2489. Epub 2013 Mar 5. Cantone and Fisher
Variazioni Epigenetiche durante la riprogrammazione in vivo
Epigenetic programming and reprogramming during development - Nat Struct Mol Biol. 2013
Mar;20(3):282-9. doi: 10.1038/nsmb.2489. Epub 2013 Mar 5. Cantone and Fisher
Variazioni
epigenetiche
durante la
riprogrammazione
in vivo:
(b) cambiamenti
epigenetici globali
durante lo sviluppo
della linea germinale
dalle PGC (E6.5)
all’arresto
mitotico/meiotico
a E13.5.
Le due principali
fasi di riprogrammazione
possono essere distinte durante la migrazione delle PGC verso le creste
genitali (E7.5-E10.5) e al momento del loro arrivo nelle gonadi (E10.5-E12.5).
Epigenetic programming and reprogramming during development - Nat Struct Mol Biol. 2013
Mar;20(3):282-9. doi: 10.1038/nsmb.2489. Epub 2013 Mar 5. Cantone and Fisher