Sindrome da distress respiratorio acuto
Apparato respiratorio - Cenni di anatomia
L'apparato respiratorio è l'insieme degli organi e delle strutture che consentono gli
scambi gassosi tra l'ambiente circostante (carico di ossigeno) e l'organismo umano (il
cui sangue è carico di anidride carbonica). Il funzionamento dell'apparato respiratorio
risulta dunque strettamente connesso al funzionamento del sistema circolatorio. Gli
organi afferenti l'apparato respiratorio permettono gli scambi gassosi tra l'ambiente
esterno e l'organismo. L'apparato respiratorio è formato da naso, faringe, laringe,
trachea, polmoni, pleura, bronchi e bronchioli.
Naso
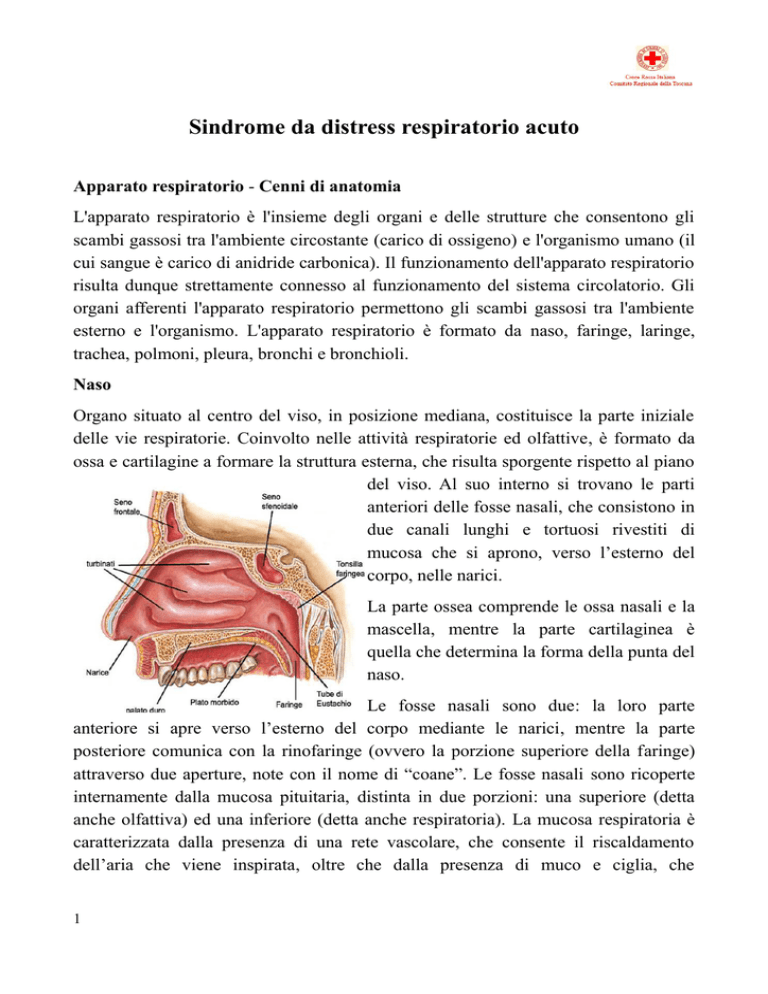
Organo situato al centro del viso, in posizione mediana, costituisce la parte iniziale
delle vie respiratorie. Coinvolto nelle attività respiratorie ed olfattive, è formato da
ossa e cartilagine a formare la struttura esterna, che risulta sporgente rispetto al piano
del viso. Al suo interno si trovano le parti
anteriori delle fosse nasali, che consistono in
due canali lunghi e tortuosi rivestiti di
mucosa che si aprono, verso l’esterno del
corpo, nelle narici.
La parte ossea comprende le ossa nasali e la
mascella, mentre la parte cartilaginea è
quella che determina la forma della punta del
naso.
Le fosse nasali sono due: la loro parte
anteriore si apre verso l’esterno del corpo mediante le narici, mentre la parte
posteriore comunica con la rinofaringe (ovvero la porzione superiore della faringe)
attraverso due aperture, note con il nome di “coane”. Le fosse nasali sono ricoperte
internamente dalla mucosa pituitaria, distinta in due porzioni: una superiore (detta
anche olfattiva) ed una inferiore (detta anche respiratoria). La mucosa respiratoria è
caratterizzata dalla presenza di una rete vascolare, che consente il riscaldamento
dell’aria che viene inspirata, oltre che dalla presenza di muco e ciglia, che
1
provvedono all’umidificazione ed alla depurazione dell'aria stessa. La porzione di
mucosa olfattiva ospita invece le cellule olfattive, i bulbi olfattivi ed i nervi olfattivi
che, intercettati i segnali olfattivi, li trasmettono al cervello.
Esternamente ciascuna delle due fosse presenta delle sporgenze ossee, a loro volta
ricoperte di mucosa, ovvero i turbinati inferiore, medio e superiore. Le due fosse
nasali sono separate dal setto nasale, formato da cartilagine ed osso. Il tetto delle due
fosse nasali è costituito dall’osso etmoide.
Faringe
Canale che mette in comunicazione la gola con l’esofago. Di struttura muscolo mucosa, rappresenta sia il primo tratto del tubo digerente (riceve infatti il bolo
alimentare dalla bocca attraverso la deglutizione) che una parte delle vie aeree
superiori: nella faringe si immette l’aria
proveniente dal naso, che quindi si immette
nella laringe.
Questo canale, lungo circa 15 centimetri,
decorre posteriormente alle cavità nasali,
alla bocca ed alla laringe e si sviluppa
verticalmente dalla base cranica fino alla
sesta vertebra cervicale. La forma ricorda
quella di un imbuto: più largo nella parte
superiore, si restringe man mano che va
verso il basso, acquisendo gradualmente un
aspetto tubulare.
La faringe viene generalmente suddivisa in tre tratti: la porzione posteriore delle vie
aeree nasali (rinofaringe), la cosiddetta gola (orofaringe) e la parte laringea
(laringofaringe). La rinofaringe e l’orofaringe sono separate da una specifica porzione
del palato: il palato molle (che rappresenta il prolungamento del palato duro). Le
cavità nasali comunicano con la faringe mediante le coane, la bocca tramite l'istmo
delle fauci (ovvero la stretta apertura che rappresenta la transizione dalla cavità orale
a quella faringea, delimitata superiormente dal margine libero del palato molle, da
due coppie di pieghe della mucosa ai lati e dalla base della lingua) e la laringe,
tramite l'orifizio laringeo. Tutte queste comunicazioni si effettuano in corrispondenza
della parete anteriore dell'organo, che si presenta quindi incompleta per molta parte.
2
Laringe
Organo deputato alla fonazione, ovvero all’emissione dei suoni. È situata nel collo,
tra la faringe e la trachea, e si presenta come un cilindro cavo. La laringe permette
anche il passaggio dell’aria inspirata (da naso e bocca verso i bronchi) ed espirata
(dai bronchi verso naso e bocca). È provvista
di un dispositivo di chiusura (l'epiglottide)
che, durante la deglutizione, impedisce che il
cibo masticato (bolo alimentare) passi nelle
vie respiratorie.
La forma e la consistenza rigida che la
caratterizzano sono dovute alle cartilagini
(undici in tutto, di cui cinque principali) che
fanno parte della sua struttura. Le varie
cartilagini sono articolate tra loro tramite
legamenti; la mobilità delle varie porzioni
cartilaginee e di tutto l'organo è data dalla presenza di un ricco apparato muscolare.
Idealmente la laringe viene suddivisa in tre porzioni: una porzione superiore,
chiamata anche “sopraglottica” (posta all’altezza dell’epiglottide), la cui cavità
prende il nome di vestibolo della laringe; una porzione centrale, che si trova a livello
della glottide e, al di sotto di quest’ultima, una porzione inferiore, composta
esternamente da muscoli e rivestita internamente da una mucosa. La laringe ha inizio
dietro la lingua, dove termina la faringe, e continua nella trachea.
Mediamente in un soggetto adulto è lunga 4 centimetri per 4 centimetri di larghezza e
3,5 centimetri di diametro; queste dimensioni, però, possono variare da individuo a
individuo, in base all’età ed al genere sessuale.
Durante la pubertà questo organo va incontro a maggiori cambiamenti: se
nell’infanzia, infatti, è di dimensioni piuttosto ridotte, durante gli anni della
maturazione sessuale cresce rapidamente, per poi attestarsi sulle dimensioni
definitive. Alcune delle modificazioni a cui va incontro nella pubertà comportano i
cambiamenti nel tono della voce tipico di questo periodo della vita, rilevabili
soprattutto nei maschi. Nelle donne quest’organo, rispetto agli uomini, è solitamente
più corto.
3
Trachea
Organo dell’apparato respiratorio che mette in comunicazione la laringe con la
porzione iniziale dei bronchi, nei quali si biforca all’altezza della quinta vertebra
dorsale, dividendosi nei due alberi
bronchiali, destro e sinistro. La biforcazione
bronchiale viene detta carena o sperone
tracheale. La trachea consente il passaggio
dell’aria.
Posizionata davanti all’esofago e a forma di
cilindro cavo lungo circa 12 centimetri, è
costituita da una sovrapposizione di
cartilagini a forma di ferro di cavallo poste
orizzontalmente e sovrapposte le une sulle
altre. Tra una cartilagine e l’altra sono
interposte delle strutture fibrose chiamate legamenti tracheali o legamenti anulari. La
parte posteriore, formata dalle aperture delle cartilagini, è chiusa da tessuto
muscolare. Esternamente il tessuto che la compone è fibrocartilagineo; internamente
le pareti sono invece ricoperte da mucosa.
La funzionalità principale della trachea è consentire il passaggio dell’aria che dalla
laringe arriva ai bronchi.
Bronchi e bronchioli
Condotti di forma cilindrica compresi tra la biforcazione della trachea ed i bronchioli,
i bronchi permettono ed assicurano il
passaggio dell’aria dalla trachea fino ai
bronchioli ed agli alveoli polmonari.
All’interno del corpo umano i bronchi
principali sono due: bronco destro e bronco
sinistro. La loro struttura ricorda la forma di
un albero, da cui la comune definizione di
albero bronchiale. Esternamente sono
rivestiti da una guaina fibrocartilaginea e
muscolare, che conferisce loro un aspetto
semirigido. Internamente sono ricoperti da
4
una mucosa, sulla cui superficie sono presenti delle ciglia, il cui compito è quello di
eliminare i batteri, la polvere e tutte le particelle inalate dall’ambiente esterno, ed
alcune ghiandole. Seguendo la ramificazione dell’albero bronchiale si può notare su
ciascun lato, andando dal tratto extrapolmonare a quello intrapolmonare: il bronco
principale, composto da un bronco esterno ed uno interno; due o tre bronchi lobari ed
alcuni bronchi segmentali, dai quali originano i bronchi terminali. Le diramazioni
bronchiali si fanno via via più piccole, fino ad arrivare ai bronchioli. I bronchioli
sono le piccole diramazioni terminali dei bronchi all’interno dei polmoni, con un
diametro inferiore ad un millimetro. Alle loro estremità si trovano gli alveoli
polmonari che, a loro volta, si diramano in sacchi (o infundiboli) alveolari, piccole
strutture a forma di sacchetto disposte a grappolo d’uva, che rappresentano la parte
terminale delle vie respiratorie, attraverso le cui pareti avvengono gli scambi gassosi
con il sangue. Le pareti dei bronchioli sono caratterizzate da un epitelio a cellule
cubiche, presenza di muscolatura liscia e di tessuto connettivale elastico.
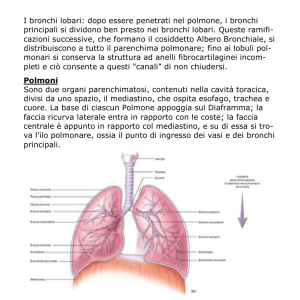
Polmoni e pleura
Organi (due) preposti alla fornitura di ossigeno all’organismo ed alla eliminazione
dell’anidride carbonica dal sangue, ovvero agli scambi gassosi fra aria e sangue
(processo noto con il nome di ematosi). Sono situati nella cavità toracica nelle
cosidette logge polmonari, delimitate
inferiormente dal diaframma, superiormente
dalle strutture che si trovano nella parte
superiore del torace (come il plesso
brachiale), esternamente dalla gabbia
toracica e dai muscoli intercostali,
internamente dal mediastino, spazio
compreso tra la colonna vertebrale e lo
sterno, che comprende al suo interno il
cuore, l'esofago, la trachea, i bronchi, il timo
ed i grossi vasi. Hanno un alto grado di
elasticità, che favorisce l'espulsione dell'aria
durante l'espirazione. Come accade anche nel caso dei reni, un solo polmone è
sufficiente a garantire il funzionamento di tutto il processo.
Il polmone destro è formato da tre lobi (superiore, medio ed inferiore), separati da
5
una fessura obliqua e da una orizzontale, mentre il sinistro da due lobi (superiore ed
inferiore), separati da una fessura obliqua. I lobi sono ulteriormente suddivisi in
segmenti broncopolmonari, ognuno dei quali viene servito da un bronco segmentale; i
bronchi segmentali a loro volta si suddividono in strutture via via sempre più piccole
fino ad arrivare agli alveoli polmonari, ovvero le strutture responsabili degli scambi
gassosi tra l’aria ed il sangue.
I polmoni sono avvolti da una membrana sierosa, la pleura, a sua volta formata da
due foglietti, i foglietti pleurici: il foglietto
pleurico parietale, che li riveste esternamente
e li divide dalla parete toracica; il foglietto
pleurico viscerale, che aderisce alla loro
superficie interna. La sommità del foglietto
pleurico parietale viene chiamata cupola
pleurica:
è
collocata
proprio
in
corrispondenza della fossa sopraclavicolare e
corrisponde all’apice del polmone. I due
foglietti pleurici sono in contatto continuo tra
loro: ad assicurare e favorire lo scorrimento
dell’uno sull’altro è una sottile pellicola di liquido pleurico, che si trova nello spazio
compreso tra i due foglietti, la cui presenza è indispensabile per permettere ai
polmoni di seguire i movimenti dei muscoli ai quali aderiscono durante la
respirazione. I due foglietti delimitano una cavità virtuale, la cavità pleurica, che non
comunica né con l’esterno né con altri organi ed in cui si forma una pressione
negativa, che permette ai polmoni di espandersi durante l'inspirazione.
Dal punto di vista istologico la pleura è considerata come un mesotelio, ovvero un
tessuto che conserva caratteristiche tipiche sia degli endoteli (ovvero il sottile tessuto
che delimita internamente il lume nei vasi sanguigni o linfatici) sia degli epiteli (i
tessuti che rivestono la superficie esterna o tappezzano le cavità interne del corpo) e
che, quindi, somiglia sia agli uni che agli altri.
La forma dei polmoni ricorda quella di due coni. La loro grandezza varia in base allo
sviluppo dell’organismo: nei maschi adulti generalmente misurano al massimo circa
25 centimetri di lunghezza, mentre il diametro alla base è di circa 16 cm. Il polmone
sinistro risulta leggermente più piccolo del destro. Nelle donne questi valori risultano
6
solitamente inferiori. Anche il peso varia molto in base allo stadio di sviluppo fisico:
nel feto nato a termine della gestazione che non ha respirato il polmone pesa 60-65
grammi, mentre nel neonato arriva a 80-100 grammi. In età adulta il polmone destro
nell’uomo arriva a pesare intorno ai 680 grammi, mentre quello sinistro intorno ai
620 grammi (nella donna, come accade per le dimensioni, anche il peso risulta
inferiore).
La capacità polmonare (ovvero la quantità d’aria che può essere contenuta nei
polmoni) varia da soggetto a soggetto ed in base alla fase della respirazione: in una
3
fase di inspirazione ordinaria i polmoni possono contenere 3400 - 3700 cm di aria,
3
mentre in fase di inspirazione forzata può raggiungere i 5000 - 6000 cm .
Eziologia
L'Organizzazione Mondiale della Sanità (OMS) definisce la Sindrome da Distress
Respiratorio Acuto (ARDS) come
“un danno diffuso dei capillari
alveolari,
determinante
grave
insufficienza
respiratoria
con
ipossiemia arteriosa refrattaria alla
somministrazione di ossigeno”.
Una consensus conference USA Europa nel 1994 ha definito i criteri
diagnostici della sindrome da
distress respiratorio nell'adulto:
esordio acuto
infiltrati polmonari bilaterali
suggestivi di edema
nessuna
evidenza
di
ipertensione atriale sinistra
(PCWP < 18 mmHg)
Rapporto PaO2/FiO2 < 200
Gli stessi criteri, ma con un
rapporto PaO2/FiO2 < 300,
7
definiscono il danno polmonare acuto (Acute Lung Injury, ALI). Viene innescata da
varie patologie acute, che danneggiano direttamente o indirettamente il polmone,
quali sepsi, polmoniti primitive batteriche o virali, inalazione di materiale gastrico,
trauma toracico diretto, shock prolungato o grave, ustioni, embolia grassosa,
semiannegamento, emotrasfusione massiva, bypass cardiopolmonare, tossicità da O 2,
pancreatite emorragica acuta, inalazione di fumo o di altri gas tossici, assunzione di
certi farmaci. L'incidenza della ARDS è stimata essere > 30% in presenza di sepsi.
Anche se viene definita "dell'adulto", tale sindrome si verifica anche nei bambini
(Sindrome da Distress Respiratorio Neonatale - NRDS).
Fisiopatologia
Poco si sa sul danno polmonare iniziale. Modelli animali suggeriscono che Globuli
Bianchi (GB) e piastrine attivati si accumulino nei capillari, nell'interstizio e negli
alveoli; essi possono rilasciare
prostaglandine, radicali di O2
tossici, enzimi proteolitici ed
altri mediatori (quali il fattore di
necrosi
tumorale
e
le
interleuchine), che danneggiano
le
cellule,
provocano
infiammazione e fibrosi ed
alterano il tono broncomotore e
la reattività vasale.
Quando gli epiteli dei capillari polmonari e degli alveoli vengono danneggiati,
plasma e sangue penetrano negli spazi interstiziali ed intra - alveolari. Ne risultano
inondazione alveolare ed atelettasia; quest'ultima è dovuta in parte alla riduzione
dell'attività surfattante. Il danno è disomogeneo ed interessa soprattutto le zone
polmonari declivi. Entro 2 o 3 giorni si sviluppa una flogosi interstiziale e
broncoalveolare e le cellule epiteliali ed interstiziali proliferano. In seguito, il
collagene può accumularsi rapidamente, causando grave fibrosi interstiziale entro 2 o
3 settimane. Tali modificazioni patologiche provocano bassa compliance polmonare,
ridotta capacità residua funzionale, squilibri ventilazione - perfusione, aumento dello
spazio morto fisiologico, grave ipossiemia ed ipertensione polmonare.
8
Sintomi, segni e diagnosi
La ARDS si sviluppa di solito entro 24 - 48 ore dall'evento patologico o dalla malattia
iniziale. Per prima compare la dispnea, solitamente accompagnata da respiro rapido e
superficiale. Durante l'inspirazione può essere presente retrazione intercostale e
soprasternale. La pelle può apparire cianotica o chiazzata e può non migliorare con la
somministrazione di O2. L'auscultazione può evidenziare crepitii, ronchi o sibili, ma i
reperti possono risultare normali. La diagnosi precoce richiede un alto livello di
sospetto, evocato dall'insorgere di dispnea in situazioni cliniche che predispongono
alla ARDS. Una diagnosi presuntiva può essere formulata mediante un'emogasanalisi
arteriosa (EGA) e una rx del torace. La prima mostra inizialmente un'alcalosi
respiratoria acuta: una PaO2 molto bassa, una PaCO2 normale o bassa ed un elevato
pH. L'rx del torace evidenzia di solito infiltrati alveolari bilaterali diffusi, simili
all'edema polmonare acuto cardiogeno, ma l'ombra cardiaca è di regola normale.
Tuttavia, le modificazioni osservabili alla rx spesso tardano di molte ore rispetto alle
alterazioni funzionali, cosicché l'ipossiemia può apparire sproporzionatamente grave
rispetto all'edema osservabile alla rx. Una PaO2 estremamente bassa spesso persiste
nonostante elevate concentrazioni di O2 inspirato (FiO2), indicando uno shunt
polmonare destro - sinistro attraverso le unità polmonari addensate atelettasiche e non
ventilate.
Dopo il trattamento immediato dell'ipossiemia, sono indicati ulteriori accertamenti
diagnostici. Qualora esista il dubbio che il paziente abbia uno scompenso cardiaco,
un catetere di Swan-Ganz nell'arteria polmonare può essere utile. Tipicamente, la
pressione polmonare arteriosa a catetere incuneato (Pulmonary Arterial Wedge
Pressure, PAWP) è bassa (< 18 mm Hg) nella ARDS e alta (> 20 mm Hg) nello
scompenso cardiaco. Se si considera probabile un'embolia polmonare, che può
mimare una ARDS, bisogna ricorrere ad appropriate procedure diagnostiche (p. es.,
l'angiografia polmonare), dopo aver stabilizzato il paziente. La polmonite da
Pneumocystis carinii e, occasionalmente, altre infezioni polmonari primitive possono
simulare la ARDS e vanno prese in considerazione, specialmente in pazienti
immunocompromessi; può essere indicata la biopsia polmonare o il lavaggio
broncoalveolare in corso di broncoscopia.
Come detto, L'American - European Consensus Conference definisce la ARDS in
9
base ai seguenti criteri: un rapporto PaO 2/FiO2 < 200 (indipendentemente dalla
Pressione Positiva di Fine Espirazione - PEEP), infiltrati bilaterali alla rx del torace
antero - posteriore e, se misurata, una PAWP di 18 mm Hg o nessun segno clinico di
ipertensione ventricolare sinistra.
Complicanze e prognosi
Possono verificarsi sovrainfezioni batteriche secondarie dei polmoni, particolarmente
da batteri aerobi gram - (come Klebsiella, Pseudomonas e Proteus sp.) e dal gram +
Staphylococcus aureus, specialmente i ceppi meticillino-resistenti; scompenso
sistemico multiorganico, soprattutto insufficienza renale e complicanze relative ai
presidi terapeutici invasivi; queste complicanze si associano ad un'alta morbilità e
mortalità.
Un
pneumotorace
ipertensivo
può
insorgere
improvvisamente in seguito al
posizionamento di un catetere
venoso centrale ed all'uso di
respiratori a pressione positiva
(PPV) e alla pressione positiva
tele - espiratoria (PEEP). Sono
indispensabili il riconoscimento ed
il trattamento rapidi per prevenire
un esito letale. Tachicardia,
ipotensione ed un improvviso
incremento
delle
pressioni
inspiratorie di picco richieste per
la
ventilazione
meccanica
suggeriscono la possibilità di un
pneumotorace. Un pneumotorace
che insorge tardivamente nel corso
di una ARDS rappresenta un
segno infausto, poiché esso si
associa di regola ad una grave compromissione del polmone ed alla necessità di alte
pressioni ventilatorie. Senza un'adeguata reintegrazione del volume intravascolare, la
PPV e la PEEP possono diminuire il ritorno venoso, causando una riduzione della
10
gittata cardiaca e del trasporto complessivo di O2 ai tessuti, contribuendo allo
scompenso secondario multiorganico.
Il tasso di sopravvivenza nei pazienti con ARDS grave che ricevono un trattamento
adeguato è di circa il 60%; se la grave ipossiemia della ARDS non viene riconosciuta
e trattata, un arresto cardiorespiratorio si verifica nel 90% dei pazienti. Coloro che
rispondono prontamente al trattamento, presentano di solito una disfunzione o
inabilità respiratoria residua di grado lieve o assente. I pazienti che richiedono un
prolungato supporto ventilatorio con FiO 2 > 50% hanno maggiori probabilità di
sviluppare una fibrosi polmonare. Nella maggior parte dei pazienti che sopravvivono
alla patologia acuta, la fibrosi polmonare regredisce dopo diversi mesi, ma il
meccanismo che porta a tale risoluzione non è noto.
Terapia
L'ossigenazione deve essere preservata e la causa del danno polmonare acuto deve
essere corretta. Una cura meticolosa è necessaria per prevenire la deplezione
nutrizionale, l'intossicazione da O2, le sovrainfezioni, i barotraumi e l'insufficienza
renale, che può essere peggiorata da una deplezione del volume intravascolare.
Mentre la diagnosi è in corso, l'ipossiemia potenzialmente letale deve essere trattata
con un'alta FiO2 e monitorata con ripetute emogasanalisi o con un pulsossimetro.
Una pronta intubazione endotracheale con ventilazione meccanica e PEEP può
rendersi necessaria per mantenere l'apporto di O2, dal momento che l'ipossiemia è
spesso refrattaria all'inalazione di O2 con maschera facciale.
Il volume intravascolare è spesso depleto all'inizio della ARDS, perché la sepsi è la
causa determinante, perché è stata somministrata una terapia diuretica prima che la
ARDS fosse sospettata o perché l'inizio del trattamento con PPV riduce il ritorno
venoso. Nonostante la presenza di edema alveolare devono essere somministrati
liquidi endovena, se necessari, per ripristinare la perfusione periferica, la diuresi e la
PA. Monitorare il volume vascolare è importante perché sia l'ipovolemia che
l'iperidratazione sono dannosi. I reperti obiettivi e la pressione venosa centrale
possono essere male interpretati in pazienti gravemente malati sottoposti a
ventilazione meccanica; se persiste una grave ipossiemia, se è scarsa la perfusione
cutanea, se lo stato mentale è compromesso o se la diuresi è ridotta (< 0,5 ml/kg/h), si
11
rende immediatamente necessario un indice attendibile del volume intravascolare. Un
catetere di Swan-Ganz è utilizzato di solito per controllare il volume delle infusioni,
specialmente se è necessaria la PEEP. Tuttavia l'uso dei cateteri di Swan-Ganz non è
scevro da rischi. Uno stretto controllo quotidiano del peso del paziente, delle entrate e
delle uscite totali di liquidi è altrettanto essenziale per la gestione dei liquidi. Come
regola, un paziente con ARDS sta meglio se tenuto "asciutto", con la restrizione dei
liquidi e con l'attento uso di diuretici, fino a che la gittata cardiaca e la perfusione
tissutale non sono compromesse.
Se la sepsi è o può essere la causa della ARDS, una terapia antibiotica empirica deve
essere iniziata in attesa dei risultati delle colture. Esami colturali di controllo e
colorazioni di Gram sull'espettorato o sull'aspirato tracheale possono essere d'aiuto
nell'individuare precocemente una sovrainfezione polmonare e nel guidare la terapia
antibiotica. Le infezioni degli spazi chiusi devono essere drenate. L'alimentazione
deve essere cominciata entro 48-72 ore; la via enterale va preferita, poichè protegge il
rivestimento mucoso intestinale.
Nella ARDS i corticosteroidi non hanno efficacia dimostrata, sebbene qualche studio
suggerisca miglioramenti in alcuni pazienti con ARDS nella fase tardiva
fibroproliferativa, che si può sviluppare dopo 7-10 giorni di ventilazione meccanica.
Le infezioni polmonari coesistenti devono essere escluse in questi pazienti, che
spesso sono febbrili e mostrano leucocitosi, con o senza infezione.
Molti approcci alla prevenzione ed alla gestione della ARDS si sono dimostrati
infruttuosi o inconcludenti. I trattamenti, che non hanno migliorato la prognosi né
prevenuto la ARDS, comprendono gli anticorpi monoclonali contro l'endotossina, gli
anticorpi monoclonali contro il fattore di necrosi tumorale, l'antagonista del recettore
per l'interleuchina-1, la profilassi (l'uso precoce) con la PEEP, l'ossigenazione
extracorporea con membrane e la rimozione extracorporea di CO 2, l'albumina
endovena, l'espansione del volume ed i farmaci cardiotonici per aumentare il
trasporto sistemico di O2, i corticosteroidi nelle fasi precoci della ARDS, l'ibuprofene
parenterale per inibire la ciclo - ossigenasi, le prostaglandine E 1 e la pentossifillina.
Diversi approcci sono promettenti, ma necessitano di ulteriori studi.
La posizione prona può migliorare sostanzialmente l'ossigenazione in alcuni pazienti,
probabilmente perché tale posizione ridistribuisce la perfusione e lo scambio dei gas
12
a zone polmonari più normali, precedentemente non declivi. Se questa tecnica
migliori lo scambio gassoso e se possa ridurre la durata della ventilazione meccanica
e migliorare la sopravvivenza complessiva non è ancora chiaro. Il posizionamento del
paziente è difficile da eseguire.
L'inalazione di ossido nitrico può migliorare significativamente l'ipertensione
polmonare e l'ossigenazione arteriosa in pazienti che hanno una grave forma di
ARDS, senza causare ipotensione sistemica. Resta ancora da dimostrare se l'ossido
nitrico migliori la sopravvivenza e se l'uso prolungato favorisca il danneggiamento
polmonare da parte di sottoprodotti dell'ossido nitrico, come l'anione perossinitrito.
Il ketoconazolo può aiutare a prevenire la ARDS, inibendo la formazione ed il
rilascio del fattore di necrosi tumorale dai macrofagi. I suoi benefici clinici in piccoli
studi preliminari necessitano di conferme in studi controllati più ampi. Gli studi
iniziali sugli aerosol di surfattante sintetico nei pazienti adulti con ARDS sono stati
deludenti. Migliori dispositivi di erogazione e preparazioni di surfattante naturale di
mammiferi possono migliorare la stabilità alveolare, ridurre l'atelettasia e lo shunt
intrapolmonare e migliorare le proprietà antibatteriche ed antiinfiammatorie del film
liquido alveolare; sono in corso nuovi studi relativi a tali approcci.
Ventilazione meccanica: la maggior parte dei pazienti richiede l'intubazione
endotracheale e la respirazione assistita con un ventilatore meccanico a volume
predeterminato. L'intubazione tracheale e la PPV vanno prese in considerazione se la
frequenza respiratoria è > 30/min o se è necessaria una FiO2 > 60% mediante
maschera facciale per mantenere la PO2 intorno a 70 mm Hg per più di alcune ore. In
alternativa all'intubazione, una maschera a pressione positiva continua nelle vie aeree
può erogare efficacemente PEEP nei pazienti con ARDS lieve o moderata. Tali
maschere non sono consigliate per pazienti con stato di coscienza depresso, per il
rischio di inalazione e devono essere sostituite da un ventilatore se il paziente
progredisce verso una grave forma di ARDS o se mostra segni di fatica dei muscoli
respiratori con aumento della frequenza respiratoria e della PCO2 arteriosa.
Le impostazioni convenzionali in un ventilatore a volume predeterminato nell' ARDS
sono un volume corrente da 10 a 15 ml/kg, una PEEP di 5 cm H2O, una FiO2 del
60% e la modalità assistita - controllata innescata dal paziente. Si può in alternativa
fare uso della ventilazione obbligatoria intermittente con una frequenza iniziale di 10
13
- 12 atti respiratori/minuto con PEEP.
Vi è la preoccupazione che alte pressioni e volumi di ventilazione nella ARDS
possano peggiorare il danno
polmonare, ma questo effetto non
è stato dimostrato. Anche una
PEEP
troppo
bassa
può
danneggiare
il
polmone,
facilitando la ripetuta chiusura ed
apertura delle unità polmonari
periferiche
instabili.
Questo
problema può essere superato con
volumi correnti piccoli (6 - 8
ml/kg) ed una PEEP più alta (tra
10 e 18 cm H2O).
L'obiettivo dei volumi correnti ridotti è di impedire che gli atti respiratori generati dal
ventilatore superino il punto di inflessione (o di deflessione) superiore della curva
pressione-volume del paziente e che causino iperdistensione polmonare. Oltre questo
punto, il polmone diventa piuttosto rigido e piccoli aumenti del volume corrente
portano ad un ampio incremento del plateau pressorio (la pressione necessaria per
mantenere il polmone e la parete toracica distesi dopo che il flusso inspiratorio è
terminato). Per ragioni tecniche, il punto di inflessione superiore non viene misurato
spesso direttamente. Viene invece misurato il plateau pressorio di ventilazione, che
nella maggior parte dei pazienti non deve superare i 25 - 30 cm H 2O (o i 20 - 25 cm
H2O secondo alcuni ricercatori). Con un volume corrente ridotto, la frequenza
respiratoria del ventilatore può essere aumentata per mantenere adeguati livelli
arteriosi di pH e di PCO2. Alcuni pazienti rimangono ancora in ipercapnia ed in
acidosi respiratoria, solitamente ben tollerate. Se il pH arterioso scende sotto 7,20,
può essere prescritta una infusione lenta di bicarbonati.
Teoricamente, la PEEP impostata dovrebbe essere di diversi cm di acqua superiore al
punto di inflessione inferiore della curva pressione - volume del paziente, per
facilitare un ampio reclutamento ed una piena aerazione degli alveoli. Se il punto di
inflessione inferiore non è misurato direttamente, una PEEP di 10 - 15 cm H 2O è
14
spesso sufficiente. Con un adeguato valore di PEEP, la FiO2 del ventilatore può
generalmente essere diminuita a un livello < 50-60%, più sicuro, cosicché il paziente
raggiunga una PaO2 di 60 mm Hg o una saturazione arteriosa in O2 (SaO2) del 90%.
2
Per un adeguato trasporto di O2 ai tessuti, l'indice cardiaco deve essere di 3 l/min/m ;
occasionalmente, sono necessari farmaci cardiotonici parenterali o l'infusione di
liquidi.
Alternativamente, può essere utilizzata una ventilazione meccanica a pressione
predeterminata, soprattutto per i pazienti con ARDS grave. La pressione inspiratoria e
la durata sono programmate ed il volume corrente varia con l'impedenza respiratoria;
sono quindi evitate alte pressioni inspiratorie di ventilazione, ma spesso si provoca
un'ipercapnia permissiva. Questo approccio è spesso combinato con la ventilazione a
rapporto inverso, nella quale è programmata una durata della inspirazione uguale o
maggiore di quella dell'espirazione. Questa tecnica può reclutare e riespandere più
unità polmonari rispetto a quanto la PEEP non riesca a fare da sola (in parte
producendo una PEEP intrinseca o auto - PEEP), cosicché FiO2 pericolosamente alte
possono essere ulteriormente ridotte. Questa tecnica è mal sopportata e richiede la
sedazione del paziente, spesso associata ad un farmaco che paralizza la muscolatura.
Il momento appropriato per lo svezzamento è indicato da segni persistenti di un
miglioramento della funzione respiratoria (cioè una ridotta necessità di O 2 e di
PEEP), dal miglioramento osservato alla rx e dalla risoluzione della tachipnea. I
pazienti senza preesistenti patologie polmonari possono essere solitamente svezzati
con facilità; difficoltà nello svezzamento possono indicare un'infezione non trattata o
una nuova localizzazione infettiva, iperidratazione, broncospasmo, anemia,
alterazioni elettrolitiche, disfunzione cardiaca o un cattivo stato nutrizionale, con
conseguente indebolimento dei muscoli respiratori. Se tali condizioni vengono
trattate, lo svezzamento può essere realizzato usando la ventilazione obbligatoria
intermittente per ridurre la frequenza degli atti respiratori artificiali, spesso con una
quota di pressione di supporto o tramite periodi di respirazione spontanea di durata
sempre maggiore attraverso una valvola a T connessa al tubo endotracheale. Una
PEEP bassa (5 cm H2O) viene di solito mantenuta durante lo svezzamento.
15
Legenda
Acidosi respiratoria
Diminuzione del pH per diminuita ventilazione, con
accumulo di CO2 e pCO2 (pressione parziale
dell'anidride carbonica) > 44 mm/Hg
Alcalosi respiratoria
Innalzamento dei livelli di pH ematico con
iperventilazione, maggiore eliminazione di CO2 con
l’aria espirata e pCO2 < 36 mm/Hg
Anticorpi monoclonali
Anticorpi dotati di un’alta specificità verso un
determinato antigene e costruiti attraverso tecniche di
ingegneria genetica
Atelettasia
Assenza patologica di aria negli alveoli polmonari
(definita anche “collasso del polmone”)
Capacità residua
funzionale
Quantità di aria contenuta nel polmone al termine di
un'espirazione normale
Catetere di Swan-Ganz
Dispositivo di monitoraggio emodinamico di svariati
parametri pressori, che consentono un'approfondita
analisi della funzione cardiocircolatoria
Compliance polmonare
Indice della distensibilità polmonare. Definisce la
variazione del volume polmonare in seguito a variazioni
unitarie della pressione transpolmonare applicate al
polmone stesso, ovvero la differenza tra la pressione
interna al polmone e quella esterna
Crepitii
Rumori patologici umidi. Possono essere grossolani
inspiratori precoci (da passaggio di boli di aria attraverso
vie aeree occluse in maniera intermittente per presenza
di muco, ispessimento della mucosa o condizioni che
rendono le pareti delle vie aeree più facilmente
collassabili); fini inspiratori tardivi (da apertura
improvvisa in successione di vie aeree di piccolo
diametro, precedentemente collabite); grossolani in espiratori (da gorgogliamento dell'aria attraverso
secrezioni bronchiali in vie aeree di ampio calibro
(grossi bronchi, trachea).
Edema polmonare acuto
Aumento dei liquidi nello spazio extravascolare
(interstizio ed alveoli) a livello del parenchima
polmonare
16
Emogasanalisi (EGA)
Prelievo di sangue arterioso effettuato a livello delle
arterie radiale, brachiale o femorale, che permette di
misurare la quantità di ossigeno, di anidride carbonica
ed il pH del sangue
Fattore di necrosi
tumorale
Citochina pro - infiammatoria in grado di svolgere
numerose funzioni di regolazione sulle risposte
immunitarie. E' anche un importante mediatore delle
risposte infiammatorie sia acute che croniche
FIO2
Frazione inspirata di ossigeno. Indica la percentuale di
ossigeno (O2) inspirata
Ketoconazolo
Farmaco antimicotico
Indice cardiaco
Parametro emodinamico cardiovascolare ottenuto
dividendo la gittata (o portata) cardiaca per minuto e per
metro quadrato di superficie corporea; valori normali:
2,8-4,2 l/min per metro quadro
Interluechine
Sostanze di natura polipeptidica (citochine) che
inducono e attivano le cellule del sistema immunitario.
Sono secrete da vari tipi cellulari: macrofagi, monociti,
cellule dendritiche, fibroblasti e cellule endoteliali. Sono
prodotte anche in risposta ad infezioni batteriche, alla
presenza di TNF (Tumor Necrosis Factor) ed in seguito
all’interazione delle cellule produttrici con linfociti T
CD4 positivi. La loro principale funzione è quella di
mettere in comunicazione tra loro le cellule del sistema
immunitario e stimolarle ad organizzare una risposta
immunitaria
Ipercapnia
Aumento nel sangue della concentrazione di anidride
carbonica (CO2)
Lavaggio broncoalveolare Procedura medica in cui un broncoscopio ottico è fatto
passare attraverso la bocca o il naso fino nei polmoni;
una piccola quantità di liquido è schizzata nel polmone e
quindi raccolta per essere esaminata. Questa procedura
in genere viene eseguita come metodo di analisi per la
diagnosi di alcune malattie polmonari
17
Permette di mantenere una pressione positiva all’interno
Maschera a pressione
positiva continua (CPAP) delle vie aeree per tutto il ciclo respiratorio durante la
ventilazione spontanea, mantenendo la pervietà delle vie
aeree inferiori
Ossido nitrico
Mediatore intracellulare. Agisce come miorilassante,
vasodilatatore, inibitore dell'aggregazione piastrinica
PA
Pressione Arteriosa
PaCO2
Pressione parziale di anidride carbonica nel sangue
arterioso. Indica la quantità di anidride carbonica
presente nel sangue
PaO2
Pressione parziale di ossigeno nel sangue arterioso.
Indica la quantità di ossigeno presente nel sangue
PAWP
Pressione arteriosa polmonare
catetere di Swan-Ganz)
PEEP
Pressione positiva di fine espirazione, cioè la pressione
esistente all'interno dei polmoni (pressione alveolare)
alla fine dell'espirazione maggiore della pressione
atmosferica (la pressione all'esterno del corpo)
PCWP
Pressione capillare polmonare
catetere di Swan-Ganz)
Perfusione polmonare
Flusso ematico al minuto attraverso il circolo polmonare
Pressione inspiratoria di
picco
Pressione
massima
(picco)
l'inspirazione nelle vie aeree
Prostaglandine
Sostanze autacoidi che agiscono, tra l'altro, come
vasodilatatori, vasocostrittori, inibitori dell'aggregazione
piastrinica, mediatori fisiologici dell'aggregazione
piastrinica, broncocontratturanti, broncodilatatori
Rantoli
Rumori patologici umidi, prodotti quando nel lume
bronchiale o in una cavità polmonare patologica è
contenuto un fluido liquido, per cui l'aria che l'attraversa
si divide in bolle più o meno grosse, dando origine, una
volta scoppiate, a vibrazioni sonore intermittenti,
percepite sia nell'inspirazione che nell'espirazione. Se
prodotti per il passaggio dell'aria attraverso la trachea ed
il laringe, vengono definiti rumori agonici o rantoli
18
d'incuneamento
d'incuneamento
raggiunta
(v.
(v.
durante
tracheali
Ronchi
Rumori patologici secchi di origine bronchiale. Si
generano per il passaggio di aria attraverso un lume
bronchiale stenosato dalla presenza di secreto denso e
vischioso, da turgore della mucosa bronchiale, da
spasmo, da compressione dall'esterno. Tendono a essere
più evidenti nella fase espiratoria
SaO2
Quota di ossigeno legato all’emoglobina, espressa
attraverso la quantità percentuale di emoglobina saturata
Scompenso sistemico
multiorganico
Alterazione della funzione degli organi, generalmente
associata a shock, sepsi, sindrome da risposta
infiammatoria sistemica. Solitamente sono coinvolti due
o più apparati
Shunt polmonare
Passaggio di sangue dal distretto venoso a quello
arterioso in assenza di una adeguata ossigenazione. La
conseguenza è la presenza di sangue venoso misto a
quello arterioso con un deficit del contenuto totale di
ossigeno responsabile di una diminuzione della
disponibilità di ossigeno
Sibili
Rumori patologici secchi di origine bronchiolare (v.
ronchi)
Spazio morto fisiologico
Componente del parenchima polmonare nel quale non
avvengono scambi con il sangue a causa di deficit nella
perfusione o nella ventilazione
Surfattante (polmonare)
Complesso tensioattivo fosfolipoproteico (cioè composto
da lipidi e, in minor misura, da proteine), secreto dalle
cellule alveolari (pneumonici) di classe II.
Impedisce il collasso degli alveoli più piccoli e
l'eccessiva espansione di quelli più grandi, aumenta la
compliance polmonare, previene l'atelettasia, facilita il
reclutamento delle vie aeree collassate.
Ventilazione polmonare
Quantità d’aria che raggiunge gli alveoli in un minuto
Volume corrente
Quantità di aria che viene mobilizzata con ciascun atto
respiratorio non forzato (circa 500 ml)
Zone polmonari declivi
A paziente, ad es., supino quelle dorsali. Contengono
proporzionalmente meno aria rispetto a quelle
soprastanti
19
Bibliografia
Humanitas Research Hospital – Humanitas.it: “Anatomia apparato
respiratorio”;
MSD - Italia.it: Manuale Merck: “Malattie dell'apparato respiratorio. Sindrome
da distress respiratorio nell'adulto”;
Università degli Studi di Firenze – Facoltà di Medicina e Chirurgia - Corso di
Laurea in Infermieristica:
◦ Prof. M. Marsili: Nozioni di Anestesia e Rianimazione;
◦ Prof. D. Prisco: Nozioni di Medicina interna;
Wikipedia, l'enciclopedia libera.
20