23/03/15
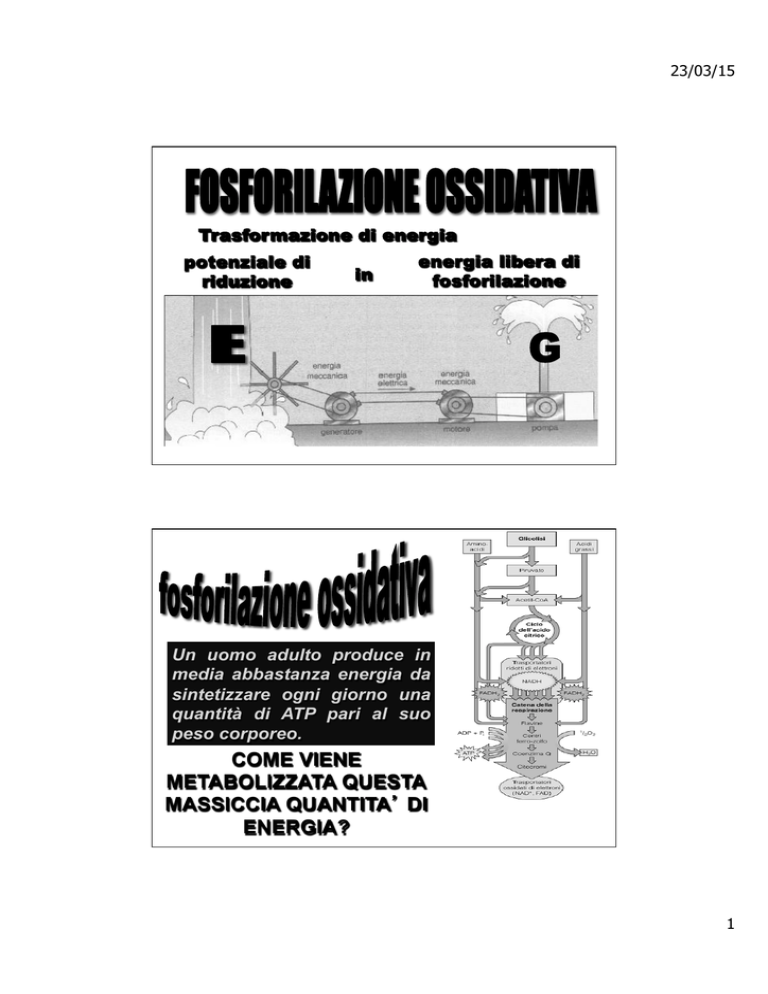
Trasformazione di energia
potenziale di
riduzione
in
energia libera di
fosforilazione
Un uomo adulto produce in
media abbastanza energia da
sintetizzare ogni giorno una
quantità di ATP pari al suo
peso corporeo.
COME VIENE
METABOLIZZATA QUESTA
MASSICCIA QUANTITA’ DI
ENERGIA?
1
23/03/15
L a m a g g i o r p a r t e
dell’energia liberata durante
l’ossidazione dei carboidrati,
dei grassi e aminoacidi nelle
cellule aerobiche e resa
disponibile all’interno del
mitocondrio come equivalenti
riducenti ( H o elettroni), è
raccolta nella Catena
respiratoria che la dirige verso
l’ossigeno che sarà ridotto ad
H2O. L’energia liberata da questo
processo sarà poi intrappolata
nella formazione di ATP da ADP e
Pi.
2
23/03/15
Permeabile a molte
molecole
Impermeabile a molte
molecole e ioni incluso l’H
+ .
Contiene
q I complessi della
catena respiratoria
q I trasportatori di ADP e
ATP
q L’ATP sintasi
q Altri trasportatori di
membrana
La densità delle
creste è
determinata
dall’attività
respiratoria
della cellula
N
versante
matrice
Nei procarioti la
fosforilazione
ossidativa avviene
sulla membrana
interna cellulare
P
versante
citosolico
Membrana interna
70% di proteine
30% lipidi
3
23/03/15
Il flusso degli e- nelle reazioni di ossido-riduzione è
responsabile, direttamente o indirettamente, di tutto il
lavoro prodotto dagli organismi viventi.
Le cellule contengono una grande varietà di molecole che
si comportano da TRASDUTTORI ENERGETICI
Sostanza meno
affine
eForza elettromotrice
fem
Sostanza più
affine
Il trasporto biologico di
elettroni consiste in una
serie di ossidazioni e
riduzioni accoppiate:
REAZIONI REDOX
Per capire la logica di
questo meccanismo
occorre capire
come si calcola
L’ENERGIA
LIBERA ottenibile
da una REAZIONE
REDOX
4
23/03/15
OSSIDAZIONI BIOLOGICHE
POTENZIALE
REDOX
PRODUZIONE DI ENERGIA
VARIAZIONE DI
ENERGIA LIBERA
Come si calcola il ΔG ottenibile
da una reazione REDOX ?
La misura della tendenza di un riducente
a perdere elettroni è determinata dal suo
potenziale di ossidazione E ( capacità di
cedere elettroni) ma anche dal potenziale
di ossidazione della molecola ossidante
(capacità di ricevere elettroni).
Facilità
a cedere
elettroni
In condizioni
standard ( 25°C,
1M )
E0 dell’elettrodo
ad idrogeno è = 0
Facilità ad
acquistare
elettroni
In condizioni standard (25°C, conc. 1M) il potenziale di
ossido riduzione (o potenziale di ossidazione) diventa:
POTENZIALE STANDARD DI OSSIDAZIONE E°.
5
23/03/15
In una reazione
spontanea
gli elettroni scorrono
dalla semicella a più
basso potenziale a
quella a più alto
potenziale
* Questo valore è specifico della riboflavina che
lega la succinato deidrogenasi
ΔE° rappresenta la
tendenza di un
composto riducente
a perdere elettroni,
nello stesso senso in
cui il pKa
rappresenta la
tendenza di un acido
a perdere protoni
In BIOCHIMICA le condizioni standar d
comprendono anche un valore di pH pari a 7 e
il Potenziale standard di ossido-riduzione
diventa E0’
a pH 7 la coppia
e il
2H+/H2
NADH + H+ / NAD+
E0’= - 0,42 Volt
E0’ = - 0,32 Volt
Ne deriva che il NADH cederà elettroni all’idrogeno a
pH = 0 ma accetterà elettroni dall’idrogeno a pH 7
La coppia
O2/H2O
E0’ = +0,82 Volt
presenta una forte tendenza
ad ossidare le altre sostanze
La fotosintesi, che
ossida l’H2O ad O2,
richiede per realizzare
questo compito un
considerevole apporto
di energia sottoforma
di luce
6
23/03/15
Tanto più è elevato in una coppia redox il valore di
E°’ tanto maggiore è la tendenza di questa coppia
ad ossidare un altro substrato. Questa tendenza
determinata dal ΔE0’(differenza di potenziale tra
l’accettore e il donatore di elettroni) scriviamola
ora in termini quantitativi di Energia Libera (ΔG0’)
ΔG0’ = -n F ΔE0’ = -n F [E0’(accettore) – E0’(donatore)]
n = numero di elettroni trasferiti
F = costante di Faraday ( 96,5 KJ / mole Volt)
ΔE0’ = differenza di potenziale standard di
ossido/riduzione della coppia redox
quando
ΔE0’ negativo
ΔG0’ positivo reazione non favorita
NADH + H+ + ½ O2
NAD+ +H2O
Reazione altamente ESOERGONICA
ΔG0’ = -n F ΔE0’ = - 2 (96,5) [ 0,82- ( - 0,32) ] = - 220 kJ/ mole
Gli elettroni dal NADH vengono trasferiti all’ossigeno
attraverso una catena composta di tre complessi proteici
Il flusso di elettroni attraverso la catena respiratoria
causa la fuoriuscita di protoni dalla matrice
mitocondriale.
7
23/03/15
Gli elettroni dal NADH
vengono trasferiti
all’ossigeno attraverso
una catena composta di
tre complessi proteici
Il flusso di elettroni
attraverso la catena
respiratoria causa la
fuoriuscita di protoni
dalla matrice
mitocondriale.
Poiché la membrana mitocondriale interna è impermeabile agli ioni e
soprattutto ai protoni, si crea una forza motrice generata dai protoni che
determinano un gradiente di pH e da un potenziale elettrico
transmembrana.
L’ATP viene sintetizzato quando i protoni rientrano nella matrice
mitocondriale attraverso un complesso enzimatico.
Gli elettroni arrivano alla catena respiratoria con la molecola
riducente di
NADH prodotto dalle diverse deidrogenasi nel
catabolismo dei grassi, zuccheri e aminoacidi.
Gli e- vengono trasferiti all’O2
attraverso una catena
composta di tre complessi
proteici che sono anche
pompe protoniche chiamati:
NADH-Q reduttasi
( complesso mitocondriale I )
Citocromo reduttasi
(complesso mitocondriale III )
Citocromo ossidasi
(complesso mitocondriale III )
(complesso mitocondriale II) Succinato Q reduttasi
(succinato deidrogenasi) trasporta elettroni all’ossigeno ma
non è una pompa protonica
8
23/03/15
In una reazione spontanea
gli elettroni scorrono dalla
semicella a più basso
potenziale a quella a più
alto potenziale
Gli elettroni fluiscono lungo la
catena respiratoria
attraversando una differenza di
potenziale di 1,1 Volt dalla
coppia redox NADH/NAD+ al la
coppia O2/H2O
In una
reazione
spontanea
gli elettroni
scorrono
dalla
semicella a
più basso
potenziale di
ossidazione
a quella a più
alto
potenziale di
ossidazione
Flavoproteine e proteine ferro-zolfo sono cofattori
dei complessi della catena respiratoria
9
23/03/15
Le flavo proteine
sono componenti
dei complessi I e II
Le proteine ferro-zolfo sono componenti dei complessi I, II e III e possono
contenere 1, 2 o 4 atomi di ferro legati alle cisteine
•
Il NADH proveniente dalle diverse deidrogenasi del
catabolismo si lega all’enzima trasferendo i suoi
elettroni al gruppo prostetico FMN della NADH-Q
reduttasi o NADH deidrogenasi
Inizio
NADH + H+ + FMN D FMNH2 + NAD+
NADH-Q reduttasi
Complesso
multimerico
composto da 25
singole cat.
polipeptidiche e
da vari centri
ferro zolfo
10
23/03/15
NADH + H+
NAD+
FMN
Fe2+S
CoQ
FMNH2
Fe3+S
CoQH2
Gli elettroni sono
poi trasferiti al
coenzima Q
UBICHINONE
(prodotto della
reazione )
Derivato chinonico
con una lunga coda
isoprenoide
Il flusso di elettroni dal NADH all’ubichinone attraverso la
NADH-Q reduttasi, che è una pompa protonica, causa il
TRASPORTO di 4H+ dalla MATRICE al versante CITOSOLICO
della MEMBRANA MITOCONDRIALE INTERNA
NADH + H+
NAD+
FMN
Fe2+S
CoQ
FMNH2
Fe3+S
CoQH2
L’energia di
ossidazione che si
sviluppa nella
reazione viene
spesa per pompare
protoni contro il
gradiente
elettrochimico
transmembrana
11
23/03/15
L’UBICHINOLO diffonde
all’INTERNO della membrana
mitocondriale interna dal
complesso I al complesso III,
dove viene ossidato (perde gli
elettroni) in un processo che
comporta ancora lo
spostamento di protoni
attraverso la membrana
L’UBICHINONE è anche il
punto di ingresso degli
elettroni trasportati dal FADH2
Complesso II
Succinato deidrogenasi
Succinato CoQ reduttasi
Il FADH2 ( gruppo prostetico)
NON SI DISSOCIA dall’enzima
ma passa prima i suoi elettroni ad
un centro Fe-S e quindi al CoQ
12
23/03/15
Al coenzima Q
arrivano anche gli
elettroni da altri
enzimi flavinici : dalla
glicerolo-3-fosfato
deidrogenasi e
dall’acil-CoA
deidrogenasi
SECONDA POMPA PROTONICA
Proteina di colore
rosso contenente u
gruppi eme
Tre classi
distinguibili in
base agli spettri
di assorbimento
alla luce
I gruppi eme
presenti nei
citocromi
13
23/03/15
CICLO DELL’UBICHINONE
Sulla struttura del complesso III e sugli studi biochimici delle
reazioni redox è stato proposto un ragionevole modello:
Forma semichinonica
radicale libero
14
23/03/15
Equazione netta
QH2 + 2Cit C(oss) + 2H+N
Q + 2 Cit C(rid) + 4H+P
L’ubichinone trasporta 2 e- a trasportatori di 1 solo eCITOCROMO C
piccola proteina solubile nello
spazio intermebrana che può legarsi mediante
interazioni elettrostatiche alla superficie esterna della
membrana interna trasporta 1 elettrone al quarto
complesso multienzimatico la
QUARTA
POMPA
PROTONICA
Trasporta
gli elettroni dal citocromo C
all’O2 molecolare riducendolo
ad H2O. Costituita da 13
subunità, pm = 204 KD
Ogni qual volta 4 e- passano dal
citocromo attraverso i centri
eme a e a3 e il centro rame CuB
all’ossigeno 4H+ della matrice
vengono adoperati per formare
H2O ed 4H+ sono pompati nello
spazio intermembrana
sfruttando l’energia della
reazione redox
4 Cit C(rid) + 8H+N + O2
4Cit C(oss) + 4H+P + 2H2O
15
23/03/15
L’energia rilasciata durante il trasferimento di
elettroni viene efficientemente conservata in un
GRADIENTE PROTONICO
NADH + H+ + ½ O2
FADH2 + H+ + ½ O2
NAD+ + H2O
FAD + H2O
NADH + 11 H+N + ½ O2
E-FADH 2+ 6 H+N + ½ O2
ΔG0’= - 220 KJ/mol
ΔG0’= - 150 KJ/mol
NAD+ + 10 H+P + H2O
E-FAD + 6H+P + H2O
16
23/03/15
Gran parte di questa energia
viene usata per pompare protoni
attraverso la membrana interna
mitocondriale
Il trasporto respiratorio
degli elettroni può essere
considerata come una
serie di reazioni
ESOERGONICHE
accoppiate in cui
l’energia libera totale
resa disponibile
dall’ossidazione del
NADH da parte dell’O2, è
rilasciata in una serie di
piccoli passi, alcuni dei
quali sono
sufficientemente
esoergonici da produrre
31 KJ/mole necessari per
promuovere la sintesi di
ATP
4H+
4H+
2H+
17
23/03/15
La teoria chemiosmotica proposta da Peter Mitchell nel
1961, postula che il processo di ossidazione e quello di
fosforilazione sono associati da un gradiente di protoni
attraverso la membrana mitocondriale in modo che la forza
motrice protonica data dalla differenza di potenziale
elettrochimico azioni il meccanismo di sintesi dell’ATP.
ADP + Pi + nH+P
ATP +H2O + nH+N
Energia di
trasporto di
elettroni
Trasporto attivo
di protoni
sintesi di ATP
porzione di
membrana
mitocondriale
interna ottenuta
da cuore di
bovino: mostra
particelle a forma
di bottone
Preparazione purificata delle
particelle a forma di bottone
ottenute da mitocondri di
fegato di ratto.
18
23/03/15
ADP + Pi
ATP + H2O
Questo grande complesso enzimatico catalizza la
formazione di ATP a partire da ADP e Pi accompagnato
dal flusso di protoni dal lato P al lato N della membrana
mitocondriale interna
L’ATPsintasi o COMPLESSO V
è formato da due DOMINI
FUNZIONALI
FO
Sensibilità all’
oligomicina
F1 (il bottone)
F1 proteina periferica catalizza la sintesi di ATP (F1 ATPasi)
FO proteina integrale di membrana ha un canale per i protoni
ADP + Pi
ATP +H2O
ΔG0’ = 0
Quando l’ATP è sulla superficie di F1 è
stabile quanto l’ADP
L’ATPsintasi rende l’ATP stabile quanto i suoi
prodotti di idrolisi tenendolo saldamente legato e
fornendo in questo modo l’energia necessaria per
controbilanciare quella richiesta dalla sintesi.
L’enzima lega l’ATP con affinità maggiore che per
l’ADP
19
23/03/15
La maggior barriera energetica è determinata dal
rilascio di ATP e non dalla sua formazione
L’energia richiesta per il rilascio dell’ATP è
fornita dalla forza motrice protonica
Struttura del complesso F1
9 subunità: α3 β3 γ δ ε
Un dominio è in
contatto con una
sub. βvuota
20
23/03/15
Le sequenze aa delle
sub. β sono uguali
ma le conformazioni
differiscono a causa
dell’associazione
con sub. γ . Le
differenze si
estendono ai loro siti
di legame per l’ATP
e ADP
β-ATP
β-ADP
β-vuota
Questa differenza è di cruciale importanza per il
meccanismo d’azione dell’intero complesso
21
23/03/15
Il complesso Fo costituisce il
CANALE PROTONICO ed è
composto da tre subunità a
Eliche trans-membrana
perpendicolari al piano
della membrana disposte
in cerchi concentrici
b2
c10-12
La catalisi rotazionale sta alla base del meccanismo
di variazione di legame per la sintesi di ATP
I 3 siti attivi di F1
catalizzano a turno la
sintesi di ATP
2) Forma β--ATP
Stato di equilibrio
3) Forma β--vuota
ATP sintetizzato
Lascia la superfice
Cambiamento conformazionale
1) ADP e Pi si legano
al sito β-ADP
22
23/03/15
Modificazioni
conformazionali
Dovute al passaggio di
protoni attraverso la
porzone Fo dell’
ATPsintasi
Il passaggio di protoni
provoca la rotazione
del cilindro delle sub. c
e della γ
ad esso
attaccata.
Ogni rotazione di 120°
pone a contatto la sub.
γ con una nuova sub. β
costringendola ad
a s s u m e r e l a
conformazione β-vuota
23
23/03/15
xADP +xPi + ½ O2 + H+ + NADH+
X = rapporto P/O
xATP + H2O + NAD+
si supponeva n° intero
Rapporto maggiore di 1 quando viene ossidato
il NADH rispetto al succinato
Substrato
N°protoni
NADH
10
Succinato
6
N° e- / ATP Rapporto P/
O
4
2,5
4
1,5
I disaccoppianti dissociano il flusso di elettroni della
catena respiratoria dalla fosforilazione
24
23/03/15
Agiscono dissipando il gradiente di protoni
Valinomicina : IONOFORO
Nigericina: antiporto K+/H+
PROTEINA CANALE PER GLI IONI H+
Piante calde che
emanano cattivo odore
ARACEE
Processo respiratorio alternativo
Filodendri
Gigli bianchi
cavoli
Producono calore
prima
dell’impollinazione
determinando
l’evaporazione di
molecole maleodoranti
L’energia che
potrebbe essere
conservata come
ATP viene rilasciata
sottoforma di calore
25
23/03/15
MITOCONDRI
DISACCOPPIANTI
TESSUTO BRUNO
ADIPOSO
26












