L’ACQUA
L’acqua è una delle sostanze più diffuse sulla terra: il volume totale è stimato in 1 360 000 000
km3, la maggior parte contenuta nei mari e negli oceani. L’acqua è indispensabile per la vita (anche
il corpo umano è costituito in gran parte di acqua) e per tutte le attività produttive agricole e
industriali.
Un ELEMENTO è una sostanza che non
si può decomporre in altre sostanze più
semplici.
L’acqua non è un ELEMENTO,
ma un COMPOSTO
Un COMPOSTO è una sostanza formata
dall’unione di più ELEMENTI.
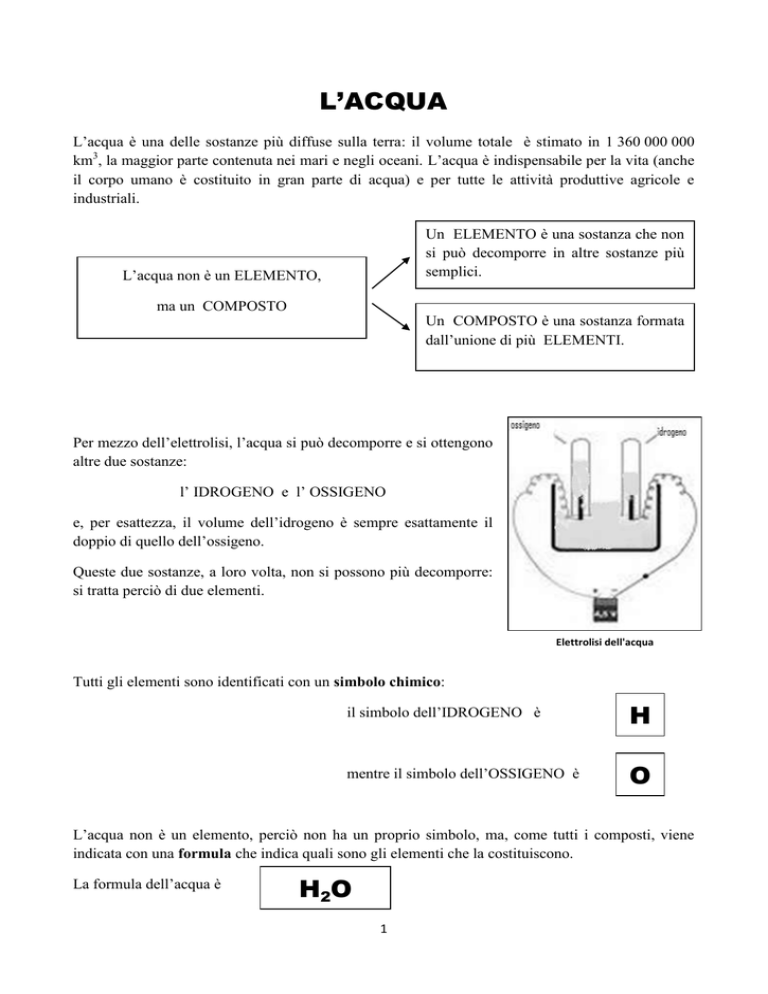
Per mezzo dell’elettrolisi, l’acqua si può decomporre e si ottengono
altre due sostanze:
l’ IDROGENO e l’ OSSIGENO
e, per esattezza, il volume dell’idrogeno è sempre esattamente il
doppio di quello dell’ossigeno.
Queste due sostanze, a loro volta, non si possono più decomporre:
si tratta perciò di due elementi.
Elettrolisi dell'acqua
Tutti gli elementi sono identificati con un simbolo chimico:
il simbolo dell’IDROGENO è
H
mentre il simbolo dell’OSSIGENO è
O
L’acqua non è un elemento, perciò non ha un proprio simbolo, ma, come tutti i composti, viene
indicata con una formula che indica quali sono gli elementi che la costituiscono.
La formula dell’acqua è
H2O
1
Questa formula indica non solo che l’acqua è composta da idrogeno (H) e ossigeno (O), ma anche
che l’idrogeno è presente in quantità doppia rispetto all’ossigeno, come specificato dal numero (2)
dopo il simbolo dell’idrogeno.
Se potessimo osservare la materia ad enorme ingrandimento, potremmo vedere che l’acqua è
costituita da tante piccole particelle (invisibili ad occhio nudo, ma anche ai più potenti microscopi)
che vengono chiamate molecole.
Ogni molecola è costituita poi da particelle ancora più piccole, chiamate atomi.
Nel caso dell’acqua, la molecola è costituita da 3 atomi: 2 di idrogeno e 1 di ossigeno.
Perciò la formula H2O ci dice anche che ogni molecola di acqua è formata dall’unione di 2 atomi
di idrogeno e di 1 atomo di ossigeno.
Molecola di acqua
H
Atomo di
idrogeno
O
Atomo di
ossigeno
H
Atomo di
idrogeno
Nell’elettrolisi le molecole dell’acqua vengono rotte e i singoli atomi tornano liberi: si ottiene però
una quantità di idrogeno doppia dell’ossigeno, proprio perché in ogni molecola ci sono 2 atomi di
idrogeno e un solo atomo di ossigeno.
L’idrogeno e l’ossigeno non sono gli unici elementi. Esistono 88 elementi naturali, più un numero sempre crescente
di elementi artificiali creati dalle reazioni nucleari, ed ognuno ha un proprio simbolo.
Ecco alcuni degli elementi più importanti:
Alluminio
Argento
Azoto
Calcio
Carbonio
Cloro
Elio
Ferro
Al
Ag
N
Ca
C
Cl
He
Fe
Fluoro
F
P
H
I
Hg
Ne
Au
O
Fosforo
Idrogeno
Iodio
Mercurio
Neon
Oro
Ossigeno
Piombo
Potassio
Rame
Silicio
Sodio
Uranio
Zinco
Zolfo
Pb
K
Cu
Si
Na
U
Zn
S
Tutta la materia presente nell’intero universo, compresi gli esseri viventi, è formata dalla combinazione di questi
elementi.
2
L’acqua, normalmente, è un liquido trasparente, incolore e inodore.
Se viene raffreddata può passare allo stato solido
(ghiaccio), ma perché questo avvenga bisogna che
--------->
processo di solidificazione
--------->
processo di ebollizione
Naturalmente se il ghiaccio viene riscaldato al di
sopra di 0 °C, torna allo stato liquido
--------->
processo di fusione
e la stessa cosa succede al vapore acqueo,
raffreddato al di sotto di 100 °C
--------->
processo di condensazione
la temperatura arrivi a
0 °C
Se invece viene riscaldata a
100 °C,
l’acqua
passa allo stato aeriforme (o gassoso) e prende il
nome di vapore acqueo
Riassumendo:
- l’acqua è allo stato liquido ad una temperatura
compresa fra
0 °C
e
100 °C;
- è allo stato solido ad una temperatura inferiore
a
0 °C;
- è allo stato aeriforme (o gassoso o di vapore)
ad una temperatura superiore a
100 °C.
La temperatura di 0 °C è detta anche punto di
fusione dell’acqua.
La temperatura di 100 °C è detta anche punto di
ebollizione dell’acqua.
Tutto questo vale però solo per l’acqua pura e alla pressione atmosferica.
3
Se nell’acqua sono sciolte altre sostanze, in genere, il punto di fusione si abbassa e il punto di
ebollizione si innalza.
Per esempio se si sciolgono in 100 g di acqua 35 g di sale da cucina (cloruro di sodio) la soluzione
ottenuta rimane liquida molto al di sotto di 0 °C e solidifica solo a -21,3 °C: è questo il motivo per
cui in inverno viene sparso il sale sulle strade al fine di evitare la formazione del ghiaccio.
Lo stesso fenomeno avviene se si aumenta la
pressione (ad es. in autoclave l’acqua bolle a
120 – 130 °C).
Se invece la pressione diminuisce, il punto di
ebollizione si abbassa (sul Monte Bianco
l’acqua bolle a 84 °C) e il punto di fusione si
innalza.
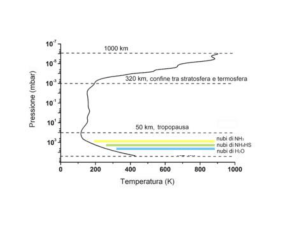
A pressione molto bassa (meno di un centesimo
della pressione atmosferica) compare un nuovo
fenomeno:
la
sublimazione,
cioè
la
trasformazione diretta del solido (ghiaccio) in
vapore: in pratica a pressioni molto basse il liquido non esiste più.
4
L’esistenza di tre stati fisici (solido, liquido, gassoso) non è una caratteristica dell’acqua ma
riguarda la maggior parte delle sostanze, anche se le temperature di fusione e di ebollizione possono
essere molto diverse. Ad esempio:
il rame fonde a 1084 °C e bolle a 2360 °C;
il ferro fonde a 1535 °C e bolle a 2880 °C;
l’ossigeno fonde a -218,9 °C e bolle a -182,9 °C;
l’idrogeno fonde a -259 °C e bolle a -252,8 °C.
Nel solido le molecole sono strettamente “impacchettate” in modo
estremamente regolare e lasciano pochissimo spazio vuoto. Non sono proprio
ferme, ma hanno solo un moto vibratorio.
solido
Nel liquido le molecole stanno ancora abbastanza vicine fra loro, ma si
muovono e perciò non sono più disposte in modo regolare e lasciano un po’ di
spazi vuoti.
Nel gas le molecole si muovono di più e sono molto più
lontane le une dalle altre, per cui lo spazio vuoto è molto
ampio.
liquido
gas
In genere, considerando lo stesso volume, in un liquido ci sono meno molecole di quante ce ne
siano in un solido (più spazio vuoto) e meno ancora ce ne sono in un gas.
In altre parole, di solito quando una sostanza passa dallo stato solido allo stato liquido la sua
densità diminuisce; e diminuisce ancora di più quando passa dallo stato liquido allo stato gassoso.
L’acqua però rappresenta una eccezione: il ghiaccio ha una
struttura particolare con molti spazi vuoti, che nel liquido,
quando le molecole sono libere di muoversi,
vengono in parte occupati.
Dopo la fusione, l’acqua liquida ha così una
densità maggiore del ghiaccio solido, perciò
un blocco di ghiaccio sull’acqua liquida
galleggia, essendo meno denso.
Struttura del ghiaccio
Per questo in inverno, anche quando uno specchio d’acqua ha la
superficie completamente ghiacciata, resta sempre, al di sotto,
un strato liquido nel quale possono
sopravvivere i pesci e gli altri esseri viventi.
Sempre per questo fenomeno, riempiendo completamente di acqua un bottiglia di
vetro e lasciandola all’aperto d’inverno è possibile che la bottiglia si rompa: infatti,
se la temperatura scende al di sotto di 0 °C, l’acqua congela, ma essendo il
ghiaccio meno denso dell’acqua liquida, dovrebbe occupare un volume più grande,
per cui non riesce più a stare tutto all’interno della bottiglia, con inevitabili
conseguenze.
5
Tutti i corpi (solidi, liquidi o gassosi) quando vengono riscaldati si dilatano, cioè il loro volume
aumenta e quindi la loro densità diminuisce.
Ancora una volta però l’acqua si comporta in modo speciale: infatti riscaldando l’acqua liquida ad
una temperatura compresa fra 0 e 4 °C, si nota che la densità aumenta anziché diminuire, fino a
raggiungere il valore massimo (di 1000 kg/m3 o 1 kg/dm3) proprio a 4 °C.
La densità dell’acqua, perciò, non solo aumenta passando dallo stato solido allo stato liquido, ma
continua ad aumentare per riscaldamento anche dopo la fusione, fino ad arrivare a 4 °C.
Questo comportamento è dovuto al fatto che la struttura del ghiaccio non si distrugge
completamente al momento della fusione, ma continuano ad esistere gruppi di 2 o 3 molecole che
restano legate fra loro e lasciano perciò molto spazio vuoto. Solo a 4 °C i gruppi si rompono
completamente e lo spazio vuoto viene completamente occupato.
Al di sopra di questa temperatura, continuando a riscaldare, la densità diminuisce come per tutte le
altre sostanze.
6
L’evaporazione
Un liquido passa spontaneamente allo stato aeriforme a qualunque temperatura, senza che venga
portato all’ebollizione. Si osserva con facilità lasciando un piccolo strato di acqua all’aperto: dopo
un certo tempo l’acqua asciuga completamente, anche se la temperatura è ben lontana da 100 °C.
Il fenomeno viene chiamato evaporazione e, al contrario
dell’ebollizione, interessa solo le molecole poste alla superficie del
liquido, che si staccano dalla superficie stessa e si disperdono
nell’aria.
Avviene più rapidamente quando
- la superficie del liquido è più ampia;
- la temperatura è più elevata;
- spira vento;
- l’aria circostante è meno umida (più secca).
L’aria contiene sempre una certa quantità di vapore acqueo che rende appunto l’aria più o meno
umida. Quando in una stanza è presente molto vapore acqueo (ad esempio quando si è fatta bollire
una pentola di acqua in un ambiente chiuso) è possibile vedere i vetri appannati: è appunto il vapore
acqueo che, incontrando una superficie fredda, condensa, formando piccole bollicine di acqua
liquida.
La convezione
Quando l’acqua posta in recipiente viene riscaldata sopra un
fornello, si notano dei movimenti nella massa acquosa che
diventano sempre più intensi avvicinandosi alla temperatura di
ebollizione.
La situazione può essere meglio evidenziata se si mette
nell’acqua un po’ di segatura e si usa un recipiente trasparente.
Si nota che l’acqua nel centro del recipiente si muove dal basso
verso l’alto, mentre vicino alle pareti laterali scende dall’alto
verso il basso.
Il fenomeno prende il nome di convezione. Si spiega con il fatto che l’acqua presente sul fondo,
essendo più vicina alla fiamma, si riscalda per prima, diventa meno densa e comincia a salire verso
l’alto. Salendo però si raffredda e allora comincia a scendere, sostituta da altra acqua che nel
frattempo è stata riscaldata.
7
Il fenomeno della convezione è sfruttato negli impianti di riscaldamento, dove l’acqua viene
riscaldata da una caldaia posta in cantina e sale fino ai piani superiori per poi ridiscendere alla
caldaia per essere nuovamente riscaldata.
2_____________________
L’acqua calda riscalda il
metallo dei termosifoni che
trasmettono il calore
all’ambiente
Il fenomeno della convezione non avviene
solo nei liquidi ma anche nei gas, in
particolare nell’aria, e può essere
evidenziato osservando i movimenti
dell’aria al di sopra di un calorifero.
8
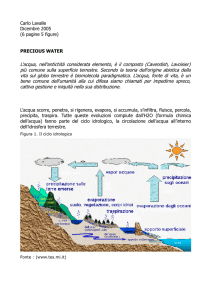
Il ciclo dell’acqua
La quantità di acqua presente sulla terra resta più o meno sempre la stessa, ma subisce continue
trasformazioni che costituiscono il ciclo dell’acqua.
Tutta l’acqua liquida presente nei mari, nei corsi d’acqua, nel terreno ed anche negli esseri viventi,
evapora in continuazione, per cui una notevole quantità di vapore acqueo si disperde nell’atmosfera.
Poiché l’aria a contatto con il terreno è più calda dell’aria sovrastante, nell’atmosfera esistono moti
convettivi che portano le molecole dell’acqua ad alta quota.
Se nell’atmosfera sono presenti granelli di polvere, si possono formare goccioline di acqua liquida.
Infatti, perché possa formarsi una goccia di acqua sono necessarie miliardi di molecole, per cui
occorre una superficie (come i vetri di una stanza) su cui le molecole possano ammassarsi.
9
I granelli di polvere nell’atmosfera costituiscono appunto questa superficie: qui si formano le
goccioline di acqua, che poi, spinte dal vento, si riuniscono a formare le nubi.
Qualche volta, quando non esistono moti convettivi nell’atmosfera, può succedere che una nube si
formi anche a livello del suolo, formando la nebbia.
Le goccioline di acqua all’interno delle nubi, scontrandosi fra loro per i moti del vento, diventano
sempre più grandi e pesanti, e alla fine ricadono al suolo formando le precipitazioni.
A seconda della temperatura degli strati di aria incontrata, le precipitazioni possono essere:
pioggia (acqua liquida)
neve
(acqua solida)
se la temperatura è superiore a 0 °C
se la temperatura è inferiore a 0 °C
qualche volta la pioggia, mentre sta scendendo, incontra nell’atmosfera delle forti correnti che la
riportano verso l’alto dove la temperatura è inferiore a 0 °C: le gocce di acqua ghiacciano
rapidamente formando chicchi di ghiaccio che possono anche essere molto grandi e che ricadono
velocemente al suolo, costituendo la grandine.
Una volta tornata al suolo, l’acqua, in parte scorre nei corsi d’acqua e torna al mare, in parte viene
assorbita dal suolo e può raccogliersi nelle falde sotterranee che scorrono anch’esse verso il mare, in
parte viene assorbita dagli esseri viventi (vegetali e animali).
In ogni caso l’acqua torna all’atmosfera per evaporazione e il ciclo si ripete.
10