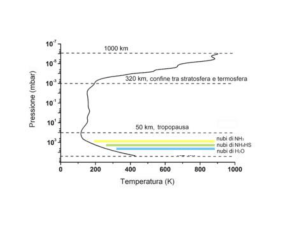
1
Basi chimiche e organizzazione della “vita”
ACQUA
H
H
O
Tra i vari componenti degli organismi viventi, l’acqua
occupa indubbiamente un ruolo importantissimo, pari a
quello svolto dal carbonio. È nell’acqua che la vita ha avuto
origine e solo dopo un lunghissimo periodo gli organismi
hanno colonizzato la terraferma. Senz’altro le caratteristiche degli esseri viventi sono state plasmate in funzione
delle proprietà di questo composto, senza il quale nessun
organismo può sopravvivere a lungo.
ⴚ
ⴙ
H
O
ⴙⴚ
ⴚ
H
H
Le proprietà dell’acqua sono dovute
ai legami idrogeno tra le sue molecole
L’acqua ha la formula chimica H2O e la disposizione spaziale degli atomi di idrogeno e dell’atomo di ossigeno, per
formare la molecola, fa sì che questo composto si comporti
come un dipolo elettrico (Figura 1.1). L’ossigeno, essendo
più elettronegativo, attira mediamente di più gli elettroni,
di conseguenza presenta una parziale carica negativa di
0,66 unità elettrostatiche (u.e.s.), mentre ciascuno dei
due atomi di idrogeno presenta una parziale carica positiva di 0,33 u.e.s. L’ossigeno, in ibridazione sp3, presenta
una coppia di elettroni non condivisa ed ha la possibilità
di formare quattro legami idrogeno fungendo da donatore
per due di essi e da accettore per gli altri due (Figura 1.2).
Ogni molecola di acqua ne tiene, quindi, legate a sé altre
quattro. In questa conformazione spaziale si possono verificare dei cambiamenti che dipendono dalla temperatura.
Per interpretare correttamente la natura di questi cambiamenti, dobbiamo ricordare che la stabilità di un legame
è inversamente proporzionale alla sua lunghezza: quanto
minore sarà la lunghezza del legame, tanto maggiore sarà
l’energia richiesta per romperlo. In una situazione quale
quella descritta nella Figura 1.2, un atomo di ossigeno
lega due atomi di idrogeno covalentemente (legame più
stabile) e due di idrogeno di altre due molecole di acqua
con un legame idrogeno, più lungo di quello covalente e
quindi meno stabile. Se si fornisce energia al sistema sotto
forma di calore, ogni atomo di ossigeno romperà i legami
covalenti, che scambiava con due atomi di idrogeno, trasformandoli in ponti di idrogeno. Contemporaneamente
i due legami idrogeno, scambiati con altre due molecole
di acqua, si trasformeranno in legami covalenti. Quando
l’acqua è allo stato solido (ghiaccio), il cambiamento
appena descritto non avviene ed i legami idrogeno e covalenti sono stabili. Nel passaggio dallo stato solido a quello
liquido circa il 16% dei legami idrogeno è statisticamente
rotto. Allo stato liquido, quindi, ogni molecola d’acqua è
legata alle molecole vicine da 3,6 legami idrogeno e al di
sopra della temperatura di fusione (passaggio da solido a
liquido) non cambia il numero di legami idrogeno, ma si
H
O
δ
O
ⴙ
H ⴙ ⴚ
O
H
H
H
Figura 1.2 I quattro legami idrogeno che possono essere
formati da una molecola d’acqua. Lo schema non rispetta la reale
disposizione spaziale, tetraedrica, essendo l’ossigeno in ibridazione sp3.
modifica la loro vita media. Nel ghiaccio essi sono stabili
(Figura 1.3), mentre allo stato liquido durano solo una
piccolissima frazione di secondo (10–11 sec); passando allo
stato di vapore essi diventano altamente instabili. Il rapidissimo “lampeggiare” dei legami idrogeno consente alle
molecole d’acqua di scivolare una sull’altra conferendo
fluidità e stabilità al sistema.
La rigidità dei legami allo stato solido fa sì che la densità
del ghiaccio sia inferiore a quella dell’acqua allo stato liquido
e ciò ha reso possibile la vita delle specie marine, anche nelle
zone polari caratterizzate dalla presenza dei ghiacciai.
Le proprietà dell’acqua che scaturiscono dalla sua
struttura sono quelle di seguito elencate.
1) Elevata coesione: è dovuta alla tendenza delle molecole di acqua ad unirsi tra loro. Ciò consente all’acqua,
per esempio, di essere portata in alto nello xilema degli
alberi (Figura 1.4).
2) Elevata tensione superficiale: poiché ogni oggetto che
deve penetrare in una massa d’acqua deve rompere
δ
H δ
Figura 1.1 La molecola dell’acqua (H2O).
2
O
H
Figura 1.3 Nel ghiaccio, le molecole di acqua occupano
posizioni fisse che formano un reticolo.