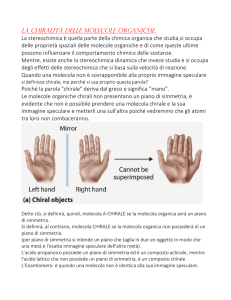
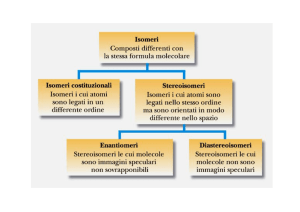
LA CHIRALITÀ DELLE MOLECOLE In chimica la chiralità è la proprietà di una molecola di essere non sovrapponibile alla sua immagine speculare. Infatti le molecole che hanno immagini speculari non sovrapponibili, quelle che esistono in due forme enantiomere, ossia quando una molecola non è identica alla sua immagine speculare, sono dette CHIRALI. Al contrario, una molecola sovrapponibile alla propria immagine speculare nelle tre dimensioni è definita ACHIRALE. Per verificare se una molecola è chirale, bisogna vedere se essa possieda un piano di simmetria. Qualora non avesse tale piano di simmetria, allora la molecola è chirale, in caso contrario è achirale. Per piano di simmetria si intende un piano che taglia in due una molecola o un oggetto in modo che una metà è l’esatta immagine speculare dell’altra. Possono essere un esempio di molecole chirali quelle che contengono un atomo di carbonio, ibridato sp3, legato a quattro sostituenti diversi. Oltre al piano di simmetria, la più comune causa per definire la chiralità delle molecole organiche è la presenza di uno STEREOCENTRO o CENTRO CHIRALE. Lo stereocentro è un atomo Tetraedrico che presenta quattro gruppi diversi legati ad esso. Un esempio è l’atomo di carbonio dell’acido lattico che è uno stereocentro Tetraedrico in quanto è legato a: -­‐-­‐OH, -­‐-­‐H, -­‐-­‐CH3, -­‐-­‐CO2H. Per specificare la configurazione intorno a uno Stereocentro, viene utilizzato il sistema R,S. Infatti per assegnare tale configurazione è necessario sistemare i gruppi legati ad esso in ordine di priorità. Per determinare tale priorità ci si avvale di regole ben precise: 1. La priorità è basata sul numero atomico; l’atomo col numero atomico più alto viene per primo, quello col numero atomico più basso viene per quarto. 2. Se non riusciamo ad assegnare tale priorità sui primi atomi, si osservano i numeri atomici degli atomi che vengono per secondi, per terzi o quarti, fin quando non troviamo una differenza. 3. Gli atomi che portano legami multipli vanno considerati equivalenti a un egual numero di atomi con legami semplici. Una volta assegnata la priorità, orientiamo la molecola nello spazio di modo che il gruppo con priorità più bassa sia diretto lontano da noi. Mentre i gruppi con priorità più alta si proiettano verso di noi. Leggendo poi i tre gruppi con priorità più alta, si può determinare una configurazione R, se la lettura procede in senso orario, si avrà una configurazione S se la lettura è in senso antiorario. Tale configurazione fa perno sulla determinazione degli enantiomeri e diastereomeri. I primi hanno configurazioni opposte in tutti gli stereocentri, mentre i diastereomeri hanno configurazioni opposte solo in qualche stereocentro, ma la stessa configurazione in qualche altro stereocentro. Inoltre gli enantiomeri sono dotate di attività ottica. Una sostanza otticamente attiva viene posta in un tubo, attraversato dalla luce piano-­‐ polarizzata, dove avviene la rotazione del piano. L’enantiomero che ruota verso destra il piano della luce polarizzata è detto DESTROGIRO e si indica con il segno (+) davanti al nome del composto, quello che invece lo fa ruotare verso sinistra è detto LEVOGIRO e si indica con il segno (-­‐). Una miscela contenente quantità equimolecolari di due enantiomeri, viene detta FORMA RACEMICA O DL, per indicare che essa contiene quantità uguali degli enantiomeri destrogiro e levogiro. La miscela Racemica non presenta attività ottica in quanto la rotazione (+) di un enantiomero compensa esattamente la rotazione (-­‐) dell’altro enantiomero. Vi sono anche composti achirali, che pur contenendo stereocentri, prendono il nome di COMPOSTI MESO. Essi presentano sì degli stereocentri, ma sono complessivamente achirali in quanto possiedono un piano di simmetria.