SAPIENZA UNIVERSITA’ DI ROMA
1a Facoltà di Medicina e Chirurgia
Dipartimento di Fisiopatologia Medica
PATOLOGIA IPOTALAMO-IPOFISI
Antonio F. Radicioni
[email protected]
Rappresentazione schematica asse
ipotalamo-ipofisi-gonadi
IPOTALAMO
IPOFISI ANTERIORE
Rappresentazione schematica asse
ipotalamo-ipofisi-gonadi
•ACTH
•GH
•FSH - LH
•TSH - PRL
IPOFISI ANTERIORE
IPOTALAMO
•CRH
•GHRH
•GnRH
•TRH
CELLULE DELL’ADENOIPOFISI
• Secernenti PRL
• Secernenti ACTH
• Secernenti GH
• Secernenti LH-FSH
• Secernenti TSH
20%
15%
50%
10%
5%
CLASSIFICAZIONE EZIOPATOGENETICA
DELL’IPOPITUITARISMO
• Ipopituitarismo funzionale
•Malnutrizione, digiuno prolungato
• Ipopituitarismo organico
•Congenito
•Acquisito
CLASSIFICAZIONE EZIOPATOGENETICA
DELL’IPOPITUITARISMO
• Ipopituitarismo organico
• Congenito
•Agenesia e ipoplasia ipofisaria
•S. di Kalmann
•S. della “sella vuota”
•Deficit isolato di ormoni ipofisari
• Acquisito
•Lesioni tumorali occupanti spazio
•Iatrogeno
•Ipofisite autoimmune
•Vascolare
•Traumi
•Istiocitosi, Sarcoidosi, Emocromatosi
SINDROME DI KALLMANN
IPOGONADISMO IPOGONADOTROPO
ANOSMIA, IPOSMIA
Delezione nel braccio corto del cromosoma X (Xp 22.3)
Gene KAL codifica per una proteina di adesione
coinvolta
nella migrazione dei neuroni GnRH-secernenti e dei
neuroni olfattivi nella regione dellipotalamo mediobasale
Sindrome di Kallmann
R.S.
R.S. Età:
Età:21
21aa
aa
altezza:
altezza:182.1
182.1
peso:
peso: 78.900
78.900
FSH:
FSH:0.32
0.32mUI/mL
mUI/mL
LH:
LH:0.08
0.08mUI/mL
mUI/mL
Te:
Te:1.10
1.10ng/mL
ng/mL
DHT:
DHT:22.6
22.6ng/mL
ng/mL
E2:
E2:12.8
12.8pg/mL
pg/mL
PRL:
PRL:7.20
7.20ng/mL
ng/mL
Quesito diagnostico: anorgasmia
Sindrome di Kallmann
R.S.
R.S. Età:
Età: 30
30 aa
aa
altezza:
altezza:
peso:
peso:
FSH:
FSH: 1.62
1.62 mUI/mL
mUI/mL
LH:
LH: 0.12
0.12 mUI/mL
mUI/mL
Te:
Te: 5.30
5.30 ng/mL
ng/mL
Fte:
Fte: 36.30
36.30 pg/mL
pg/mL
DHT:
DHT: 116.0
116.0 ng/mL
ng/mL
E2:
E2: 18.9
18.9 pg/mL
pg/mL
PRL:
PRL: 6.16
6.16 ng/mL
ng/mL
DIAGNODI DIFFERENZIALE
IPOGONADISMO IPOGONADOTROPO
• DEFICIT IPOFISARIO MULTIPLO (IPOPITUITARISMO)
- IDIOPATICO
- SECONDARIO
a patologie dell’ipofisi o di strutture adiacenti
Tumori
Craniofaringoma, Germinoma,
Glioma, Meningioma, Pinealoma
Disordini infiltrativi
Sarcoidosi, Emocromatosi,
Istiocitosi X
Trauma cranico
Terapia radiante
Ipofisite
DIAGNOSI IPOPITUITARISMO
Indagini di 1° livello
FSH, LH, GH, PRL, TSH, ACTH
E2, T, FTe, Cortisolo, FT3, FT4, IGF1
DIAGNOSI IPOPITUITARISMO
Indagini di 2° livello
Asse somatotropo > Test al GHRH +
Arginina (1µg/Kg + 30 g/100 ml ev)
Asse tiroideo > Test al TRH (200 µg ev in
bolo)
Asse surrenalico > Test all’ACTH (250 µg
ev)
> Test al CRH (100 µg ev)
Asse gonadico > Test al GnRH (100 µg ev)
TEST AL GnRH:
Soggetto normale
BARATTA SERGIO 05/07/99
1000
Te
INHB
FSH
LH
400
350
25
800
20
400
INHB (pg/mL)
600
250
15
200
10
150
100
200
5
LH & FSH (mUI/mL)
Te (ng/dL)
300
50
0
0
0
0
15
30
45
60
90
120
1440
time (min)
TEST AL GnRH: IPOGONADISMO
IPOGONADOTROPO congenito
CARDILLO ZALLO LUCA 15/07/99
Te
INHB
FSH
LH
400
1000
350
25
800
20
300
15
200
10
150
100
200
5
LH & FSH (mUI/mL)
Te (ng/dL)
400
250
INHB (pg/mL)
600
50
0
0
0
0
15
30
45
60
90
120
1440
time (min)
DIAGNOSI IPOPITUITARISMO
Indagini di 3° livello
RMN con contrasto
angio-RMN (aneurismi dell’a.
carotide interna
TERAPIA IPOPITUITARISMO
Cortisone acetato (25 mg + 12,5 mg)
L-tiroxina sodica (50 µg – 25 µg)
Rec-GH (0,025-0,035 mg/kg/die – 0,15-0,3
mg/die)
Esteri del testosterone (100-250/14-28 gg im
IPOGONADISMO IPOGONADOTROPO
POST-CH DOPO T
Te
Te
E2
E2
10
10
8
8
Te (ng/mL)
Te (ng/mL)
Free-Te (pg/mL)
Free-Te (pg/mL)
700
700
DHT
DHT
FTe
FTe
30
30
20
20
35
35
600
600
500
500
6
6
400
400
300
300
4
4
10
10
30
30
25
25
20
20
200
200
2
2
0
0
40
40
800
800
Testoviron depot 250 fl i.m.
0
0
100
100
0
0
7
7
14
14
21
21
0
0
15
15
10
10
Tempi (gg)
Tempi (gg)
Livelli di degli steroidi sessuali in paziente di 37 anni, affetto
da ipogonadismo ipogonadotropo post-chirurgico (adenoma
ipofisario GH-secernente), dopo testosterone i.m.
E2 (pg/mL)
E2 (pg/mL)
12
12
DHT (pg/mL)
DHT (pg/mL)
40
40
Sindrome della “sella vuota”
C.A.
C.A. Età:
Età:51
51aa
aa
altezza:
altezza:147,1
147,1
peso:
peso: 39,2
39,2
FSH:
FSH:0.35
0.35mUI/mL
mUI/mL
LH:
LH:0.05
0.05mUI/mL
mUI/mL
Te:
Te:0.08
0.08ng/mL
ng/mL
Fte:
Fte:0.01
0.01pg/mL
pg/mL
DHT:
DHT:44.0
44.0ng/dL
ng/dL
PRL:
PRL:30.60
30.60ng/mL
ng/mL
TSH:
TSH:1.23
1.23uUI/mL
uUI/mL
FT3:
FT3:2.35
2.35pg/mL
pg/mL
FT4:
FT4:0.71
0.71ng/dL
ng/dL
SHBG:
SHBG:107
107nmol/L
nmol/L
E2:
E2:3.09
3.09pg/mL
pg/mL
ACTH:
ACTH:31.0
31.0pg/mL
pg/mL
Cortisolo
Cortisolo::72.0
72.0ng/mL
ng/mL
SINDROME DELLA SELLA VUOTA
INCIDENZA:
5-23% in casistiche autoptiche
DEFINIZIONE:
Lo spazio subaracnoideo si espande nella sella turcica
riempiendola parzialmente con liquido
cerebrospinale, determinando un aumento del
volume della stessa con conseguente appiattimento
dell’ipofisi.
Incontinenza del diaframma
sellare (micromeningocele
intrasellare)
SINDROME DELLA SELLA VUOTA
CAUSE:
•Intervento chirurgico all’ipofisi
•Terapia radiante
•Infarto ipofisario post-partum (Sindrome di
Sheehan)
•Terapia medica (ex bromocriptina)
I tumori ipofisari PRL e GH secernenti, sono soggetti
ad infarti emorragici subclinici, inducendo un
affondamento della cisterna soprasellare nella stessa
sella.
SINDROME DELLA SELLA VUOTA
SINDROME DELLA SELLA VUOTA
RMN immagine in
sagittale: ipofisi
compressa con parsiale
riempimento della sella
turcica da liquido
cerebrospinale.
TUMORI IPOFISARI
1)
2/3: neoplasie con basso ritmo di crescita
- se non funzionanti, non sono rilevabili clinicamente, e la
loro scoperta è accidentale;
- se funzionanti, danno gravi sindromi cliniche
(acromegalia, malattia di Cushing…) e possono essere
letali anche se la proliferazione tumorale è bassa;
2)
1/3: tumori a rapida crescita
• funzionanti o non funzionanti
•diventando invasivi, creano problemi da compressione
meccanica e/o ipopituitarismo per disfunzione dei tessuti
ipofisari circostanti;
3)
0,1% può diventare maligno
diffondendo metastasi all’interno o all’esterno della
scatola cranica.
TUMORI IPOFISARI
NEOPLASIE
REGIONE IPOTALAMO-IPOFISI
Classificazione di Hardy
Intrasellari
Soprasellari Invasivi
NEOPLASIE
REGIONE IPOTALAMO-IPOFISI
TUMORI INTRASELLARI
ADENOMI IPOFISARI (15-20%)
Secernenti
Non secernenti
Microadenomi
(
< 1 cm)
Macroadenomi
(
> 1 cm)
NEOPLASIE
REGIONE IPOTALAMO-IPOFISI
TUMORI EXTRASELLARI
Cranifaringiomi
(residui epiteliali tasca di Rathke)
Cisti dermoide, epidermoide
Meningiomi
Gliomi
Cisti di Ratke
ADENOMI IPOFISARI
ADENOMI SECERNENTI
-
PRL
GH
ACTH
TSH, FSH e lh
75%
20%
10%
5%
65%
NON SECERNENTI (silenti) 25%
•ACTH
•GH
•FSH - LH
•TSH - PRL
IPOFISI ANTERIORE
IPOTALAMO
•CRH
•GHRH
•GnRH
•TRH
ADENOMA GH-secernente
Soggetti in età evolutiva (Gigantismo):
- Accellerazione velocità di crescita
- Alta statura
Soggetti adulti (Acromegalia):
- Ispessimento estremità e tessuti molli
- Artralgie
- Intolleranza glucosio, diabete mellito
- Ipertensione arteriosa, cardiomiopatia
- Ipogonadismo
- Visceromegalia
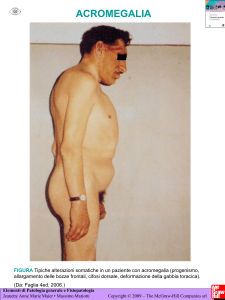
Acromegalia
CAUSE DI ACROMEGALIA
Eccessiva secrezione di GH
• Adenomi ipofisari (95% dei casi di Acromegalia)
• Adenomi ectopici (nel seno sfenoidale)
• Adenocarcinoma ipofisario (rarissimo)
Eccessiva secrezione di GHRH
• Eutopico: amartoma, ganglioneuroma
• Ectopico:carcinoidi,microcitoma,adenoma
surrenalico, feocromocitoma
PRESENTAZIONE CLINICA
Segni di malattia
• Ingrossamento delle estremità
• Splancnomegalia
• Artrosi
• Ispessimento della cute
• Diastasi dentaria
• Ipertensione arteriosa
• Ipertricosi
• Gozzo
• Aumento ponderale
• IGT
• Diabete
• Galattorrea
%
98
90
76
70
65
55
43
40
40
40
25
4
FENOTIPO
FENOTIPO
ACROMEGALIA: Diagnosi
Strumentali:
• RMN
• Campo Visivo
Laboratorio:
• Valutazione dei restanti basali ipofisari:
PRL, LH, FSH, ACTH, TSH
• Dosaggio Testosterone, 17-β-estradiolo,
Progesterone, Cortisolo, FT3, FT4
Giustina et al. 2000 JCEM
– AACE Guidelines 2004
ACROMEGALIA: Diagnosi
Test funzionali
• OGTT - 75 g di glucosio per os - (test di
soppressione)
Dosaggio del GH ai tempi 0’ – 30’ – 60’ – 90’ –
120’
• Profilo GH in 5 punti (a digiuno)
Dosaggio del GH ai tempi 0’ – 30’ – 60’ – 90’ –
120’
• Dosaggio IGF-1
AACE Guidelines 2004
ACROMEGALIA: Diagnosi
Criteri diagnostici
Media dei valori del profilo di GH > 2,5 ng/ml
Nadir del GH durante OGTT > 1 ng/mL
IGF-I superiore al range di normalità per età
Giustina et al. 2000 JCEM
– AACE Guidelines 2004
ALGORITMO DIAGNOSTICO
Segni e sintomi
Diagnosi biochimica
GHRH ?
RMN
Adenoma GH secernente
MACROADENOMA GH-SECERNENTE
RMN IPOFISI
ACROMEGALIA: Complicanze
Cardiovascolari
Cardiopatia specifica
Aritmie
Ipertensione arteriosa
Osteoarticolari
Osteoartrosi
Modificazioni della massa
ossea
Respiratorie
Sleep apnea
Metaboliche
Diabete mellito
Dislipidemia
Endocrine
Gozzo multinodulare
Neuromuscolari
Cefalea
Neuropatia
Tunnel carpale
Miopatia prossimale
Neoplastiche
Colon-retto: polipi iperplastici,
adenomi, carcinomi
Ipertrofia prostatica
ACROMEGALIA: Diagnosi complicanze
Cardiovascolari
Ecocardiografia, Holter Pressorio, Holter ECG (?)
Metaboliche
Glicemia basale e a 120’ dopo Carico Orale di Glucosio
Profilo lipidico
Endocrine
Ecografia tiroide
Osteoarticolari e neuromuscolari
MOC
Valutazione del tunnel carpale
Neoplastiche
Colonscopia
ACROMEGALIA: Terapia medica
Gli analoghi della somatostatina (a lento
rilascio):
• Octreotide LAR 10 mg, 20 mg, 30 mg
1 fl i.m. ogni 14, 28 giorni
• Lanreotide 30 mg SR
1 fl i.m. ogni 14 giorni
• Lanreotide 60 mg, 90 mg, 120 mg Autogel
1 fl s.c. ogni 14, 28, 42, 56, 70 giorni
Dopamino-agonisti (nei casi di adenomi misti
GH-PRL sec.)
• Cabergolina
AACE Guidelines 2004
ACROMEGALIA: Terapia medica
Gli analoghi della somatostatina sono farmaci
efficaci nella normalizzazione dei livelli
ematici di GH/IGF-1 nel 50-70% dei pazienti.
Diversi studi hanno dimostrato che questa
normalizzazione è accompagnata a un
miglioramento della performance cardiaca
(con
non
completa
regressione
della
miocardiopatia acromegalica) in particolar
modo nei soggetti giovani e a una regressione
della sintomatologia legata all’eccesso di GH
nel 75 % dei pazienti.
ACROMEGALIA: Terapia medica
Octreotide LAR
Riduce i livelli di GH:
al di sotto dei 5 ug/l nel 86-100% dei casi
al di sotto dei 2 ug/l nel 39-75%
al di sotto del 1 ug/l nel 24-40%
Normalizza i livelli di IGF-1 nel 65,3 % dei casi
Riduce il volume tumorale nel 71 % dei casi
Gillis JC, Drugs 1997;53:681-699
ACROMEGALIA: Terapia medica
Antagonisti del recettore del GH:
• Pegvisomant 10 mg, 15 mg, 20 mg
1 fl s.c. al dì
Si è dimostrato efficace nella normalizzazione dei livelli
sierici di IGF-1 nel 90% del pazienti.
E’ indicato nei casi resistenti alla terapia con analoghi
della somatostatina.
Non si conoscono gli effetti sulle complicanze della
malattia e la sua efficacia in associazione con gli
analoghi
ALGORITMO DIAGNOSTICO
Adenoma GH secernente
Neurochirurgia
Controindicazioni all’ INCH
Analoghi della Somatostatina
GH > 1 IGF-1
GH > 1 IGF-1
Antagonista del GH
GH > 1 IGF-1
Radioterapia
AACE
Guidelines
2004
•ACTH
•GH
•FSH - LH
•TSH - PRL
IPOFISI ANTERIORE
IPOTALAMO
•CRH
•GHRH
•GnRH
•TRH
ADENOMA ACTH-secernente
dimensioni medie 3 mm
centrali
RM +Gd tecnica dinamica
sampling venoso:
dd ACTH ectopico = 100%
lateralizzazione 70%
ADENOMA ACTH-secernente
EPIDEMIOLOGIA
• 8-10% degli adenomi ipofisari
• > microadenomi
• Primitivo
• Secondario a surrenectomia bilaterale
(S. di Nelson)
ADENOMA ACTH-secernente
CLINICA
SINDROME DI
DI CUSHING
CUSHING
SINDROME
• 90% Adenoma ipofisi:
80% microadenoma
20% macroadenoma
•10% Iperplasia delle cellule ACTH-secernenti per
eccessiva produzione di CRH o per
gangliocitomi
ADENOMA ACTH-secernente
CLINICA
SINDROME DI
DI CUSHING
CUSHING
SINDROME
• obesità centrale
• ipertensione arteriosa
• arti sottili
• debolezza muscolare
• facies lunare
• fragilità vasale con ecchimosi
• gibbo dorsale
• Amenorrea
• strie rubre all'addome ed alle cosce
• Osteoporosi
• acne
• alterazioni psichiche
• Irsutismo
• DM
• calcolosi renale
• ipokaliemia
ADENOMA ACTH-secernente
CLINICA
• Cefalea
• Sintomi visivi
• Disfunzione ipotalamo-ipofisaria
• Paralisi dei nervi cranici
• Idrocefalo
• Interessamento del tessuto cerebrale
circostante
ADENOMA ACTH-secernente
LABORATORIO
•↑ ACTH
•↑ CORTISOLO / 24h
•Test al CRH
•Test di soppressione con DXA
DIAGNOSTICA PER IMMAGINI
• RMN ipofisi o TAC cranio
• RMN o TAC surrene
ADENOMA ACTH-secernente
TERAPIA
•CHIRURGICA:
- adenomectomia per via transfenoidale se
microadenoma. Attenzione: insufficienza surrenalica
acuta secondaria transitoria
300 mg ev IDROCORTISONE il giorno dell’interrvento
- emi-ipofisectomia del lato che dimostra elevati livelli
di ACTH al cateterismo bilaterale dei seni petrosi inferiori
ADENOMA ACTH-secernente
Risoluzione 85% microadenomi e 30-40%
macroadenomi
Recidiva è modesta nei primi aa post-CH e sale al 30% a
10 aa dall’intervento
TERAPIA SOSTITUTIVA: per 6-12 mesi, fino al
ripristino della funzione dell’asse ipotalamo-ipofisi-surrene
•ACTH
•GH
•FSH - LH
•TSH - PRL
IPOFISI ANTERIORE
IPOTALAMO
•CRH
•GHRH
•GnRH
•TRH
•ACTH
•GH
•FSH - LH
•TSH - PRL
IPOFISI ANTERIORE
IPOTALAMO
•CRH
•GHRH
•GnRH
•TRH
Rilascio di PRL: fattori fisiologici
Gravidanza
Suzione del capezzolo e /o
stimolazione dell’areola
Stress
Dolore
Esercizio fisico
Sonno
Rilascio di PRL:
fattori biochimici e farmacologici
STIMOLATORI
Ipoglicemia
Estrogeni, TRH
INIBITORI
Iperglicemia
Glucocorticoidi, T4
Antagonisti
(fenotiazine, metoclopramide)
Precursori (5-idrossi-triptofano)
GnRh ass.peptides (GAP)
Peptidi oppioidi (morfina, encefaline)
H2-antagonisti (cimetidina)
Iperaminoacidemia
Agonisti (l-dopa, bromocriptina,
dopamina, cabergolina)
Antagonisti (metisergide)
PRL: funzioni fisiologiche
Bilancio idroelettrolitico
Lattazione
Immunoregolazione
Metabolismo
Metabolismo
Riproduzione
Comportamento
Comportamento
Crescita
Crescita ee sviluppo
sviluppo
Influenza sull’asse riproduttivo
Ipotalamo
Ghiandola mammaria
↓Secrezione del GnRh
Crescita lobulo-alveolare
↓Frequenza e pulsatilità LH
↑ Sintesi proteine del latte, lipidi ,
lattosio
Ovaio
Azione luteotropica
↑Secrezione di progesterone
dal corpo luteo
↓Produzione di estrogeni da
parte delle c.della granulosa
↓L’aromatasi
Utero
↑ Recettori ed effetti progestinici
↑ Recettori estrogenici
↓ Metabolismo progestinico
↓ Contrazione miometriale
↑ Attività secretoria endometriale
ADENOMA PRL
Donna:
- Oligomenorrea, amenorrea, anovulazione
- Galattorrea spontanea o indotta
- Sintomi da ipoestrogenismo (secchezza
vaginale, dispareunia, vampate di calore)
- Infertilità
Uomo:
- Riduzione libido
- Disfunzione erettile
- Galattorrea e ginecomastia
- Infertilità
IPERPROLATTINEMIA
• F/M 5:1
•
PRL >20ng/ml
•
30% donne infertili o con disturbi mestruali
•
Adenoma ipofisario PRL-secernente (60-70%)
CAUSE DI IPERPROLATTINEMIA
PATOLOGIA
IPOFISARIA
•Tumori PRL-secernenti
•Tumori GH-secernenti
Sindrome di Cushing
•Sindrome della sella vuota
•Tumori ipofisari clinicamene
non funzionanti
•Traumi del peduncolo
PATOLOGIA
IPOTALAMICA
•Craniofaringioma
•Meningioma
•Disgerminoma
•Glioma
•Linfoma
•Metastasi
•Tubercolosi
•Sarcoidosi
•Granuloma eosinofilo
•Irradiazioni
CAUSE DI IPERPROLATTINEMIA
CAUSE NEUROGENICHE
•Stimolazione nervi intercostali:
-Traumi/lesioni del torace
- Herpes zoster
FARMACI
- Post-mastectomia
•Fenotiazine
- Ustioni locoregionali
•Antidepressivi triciclici
•Metoclopramide
•Cimetidina
…altre…
•Metildopa
•Reserpina
•Insufficienza renale cronica
•Bloccanti i canali del Ca
•Cirrosi Epatica
•Cocaina
•Ipotiroidismo primario
•Produzione ormonale ectopica
VALORI ELEVATI DI PRL
>20 e <200ng/ml:
Prolattinoma
Ipotiroidismo
IperPRL idiopatica/deconn.
ipotalamo-ipofisi
Terapia con farmaci anti-DA
Gravidanza
Allattamento
Micropolicistosi ovarica
>200ng/ml:
Prolattinoma
SEGNI E SINTOMI DI IPERPROLATTINEMIA
Primari
•Oligomenorrea, amenorrea (65%)
•Infertilità, anovulatorietà
•Sintomi da carenza estrogenoica
•Galattorea (30-40%) non correlata
al livello di PRL
Minori
•Riduzione della densità ossea
•Ritenzione idrica
•Edema palpebrale
•Acne
SEGNI E SINTOMI
DELL’IPERPROLATTINEMIA
Segni locali
di compressione
Cefalea
Emianopsia bitemporale:
per compressione della parte
mediana del chiasma ottico da parte
dell’adenoma
SEGNI E SINTOMI
DELL’IPERPROLATTINEMIA
nell’uomo
PRL
Disfunzione erettile
Perdita della libido
Galattorrea
Ipogonadismo
Oligozoospermia
[ T ] con = [GT]
ADENOMA IPOFISARIO
PRL-SECERNENTE
¾ MICROPROLATTINOMA (<1.0 cm)
¾ MACROPROLATTINOMA (>1.0 cm)
¾ ADENOMA MISTO (GH+PRL)
¾ ADENOMA A CELLULE STAMINALI (aggressivo)
¾ PSEUDOPROLATTINOMI
ADENOMA IPOFISARIO
PRL-SECERNENTE
• Si sviluppa nelle regioni laterali
dell’adenoipofisi
• Si espande occupando la sella e comprimendo
le rimanenti zone dell’adenoipofisi e la
neuroipofisi
• All’esame microscopico le cellule mostrano
segni di attività secretoria
ADENOMA IPOFISARIO
PRL-SECERNENTE
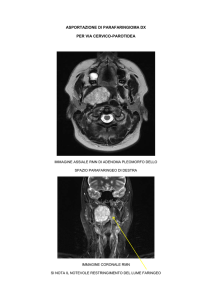
Esame RM ipofisi con m.d.c.: adenoma ipofisario a sede mediana (massima estensione,
al di sopra del diaframma sellare = 3,8 cm (grado D sec. Hardy)).
Comprime e disloca in alto e posteriormente il chiasma ottico e compressione del III
ventricolo con relativa parziale ostruzione.
IPERPROLATTINEMIA: DIAGNOSI
Anamnesi:
E.O.:
cicli mestruali
fertilità
gravidanze
Laboratorio:
sessualità
libido
ipotiroidismo
ipopituitarismo
storia farmacologica
PRL 0-15
TSH, FT3, FT4
FSH, LH, E2, T (nell’uomo)
fz epatica
fz renale
Test di gravidanza (donne)
esame comparato mammelle con
spremitura del capezzolo
Esami strumentali: RMN ipofisi con m.d.c.
IPERPROLATTINEMIA: TERAPIA
Medica:
Dopamino-agonisti
(Bromocriptina, cabergolina)
Chirurgica:
microchirurgia transfenoidale
craniotomia transfrontale
Radioterapia: se assenza di risoluzione
dopo terapia medica e chirurgica
ADENOMA PRL
TERAPIA (DOPAMINO-AGONISTI)
BROMICRIPTINA
5-20 mg/die
CABERGOLINA
0,5-1 mg x 2 /sett.
ADENOMA IPOFISARIO
TSH-SECERNENTE
EPIDEMIOLOGIA
•1:1.000.000
•0.5% della totalità dei tumori ipofisari
•M:F=1:1.5
•2/3 secernenti solo TSH
•1/3 secernente TSH e GH o PRL o GT o subunità α
degli ormoni glicoproteici
•80% sono macroadenomi (>1.0 cm)
ADENOMA IPOFISARIO
TSH-SECERNENTE
CLINICA
• sintomatologia tireotossica di media entità
(tachicardia, diminuzione del peso, ecc)
• Gozzo
• 50% Difetti del campo visivo da compressione
• 15% Cefalea
• 1/3 oligo-/a-menorrea
• Esoftalmo (per invasione da parte del tumore e
non per la tireotossicosi)
ADENOMA IPOFISARIO
PRL-SECERNENTE
LABORATORIO
• =/↑ TSH
• ↑ FT3
• ↑ FT4
• =/↑ SUBUNITA’ α
•Rapporto TSH/ SUBUNITA’ α > 5.7
DIAGNOSTICA PER IMMAGINI
•RMN ipofisi o TAC cranio
ADENOMA IPOFISARIO
PRL-SECERNENTE
LABORATORIO II LIVELLO
•TEST DI STIMOLO CON TRH
•TEST DI SOPPRESSIONE CON T3
•TEST DI SOPPRESSIONE CON DOPAMINA
Ma presentano risposta normale nell’80% dei casi
ed assente nel 20%
ADENOMA IPOFISARIO
PRL-SECERNENTE
TERAPIA
•CHIRURGIA transfenoidale o subfrontale
(prima dell’intervento è necessario:
- ristabilire l’eutiroidismo con farmaci antitiroidei (MMZ
20-30 mg/die o PTU 200-300 mg/die);
- annullare gli effetti cardiaci con propanololo (80-120
mg/die);
- tentare di ridurre il volume del tumore e la secrezione di
TSH con octreotide (100 mcg i.m. 2-3/die).
ADENOMA IPOFISARIO
PRL-SECERNENTE
TERAPIA
•Se la escissione chirurgica non è completa, è
necessario proseguire con la TERAPIA
RADIANTE
ADENOMA IPOFISARIO
PRL-SECERNENTE
TERAPIA
•Se i pazienti sono inoperabili, si procede con la
TERAPIA MEDICA
-Agonosti della DA (20-60 mg/die)
-Octreotide (100-300 mcg i.m. x 2-4/die)
-Lanreotide (30-60 mcg i.m. / 7-14 die)
Effetto collaterale: COLELITIASI
ADENOMA IPOFISARIO
PRL-SECERNENTE
•Dosaggio TSH, FT3 ed FT4 / a
•RMN oTAC / 2aa
•
•
•
•
Il gene che codifica per il GH si trova sul braccio lungo del
cromosoma 17 (q22-24) ed occupa circa 66,5 kb
Il gene GH-N viene espresso nelle cellule somatotrope dell’ipofisi
anteriore
Il trascritto principale è lungo circa 1300 nucleotidi e codifica per un
peptide di 217 aminoacidi (pre-GH), contenente una sequenza
segnale di 26 residui; dopo il clivaggio proteolitico della sequenza di
segnale si ottiene il peptide maturo di 191 aminoacidi e 22 kD di
peso molecolare
L’ormone della crescita circola nel sangue come una famiglia
eterogenea di peptidi di differente peso molecolare di cui il 22 kD
(85%) ed il 20 kD (15%) sono i principali
GH-R
GH
JA K
-2
-2
J AK
STAT
STAT
IRS-1/2
STAT STAT
P13
se
Kina
MAPK
nucleo
Effetti rapidi
Insulino-simili
• Il
recettore
dell’ormone
della
crescita è una proteina glicosilata di
620 aminoacidi di 110 kD il cui gene
si trova sul cromosoma 5 (p13.1-12)
• è costituito da un dominio
intracellulare (246 aa), una porzione
transmembrana (24 aa) ed un
dominio extracellulare (350 aa)
• Il GH lega 2 molecole identiche del
recettore, ciascuna delle quali
riconosce due diversi domini sulla
faccia opposta della molecola
dell’ormone
• La dimerizzazione attiva il recettore
ed induce l’associazione di una
tirosin-kinasi (JAK2)
IGF-1
• L’IGF1 è un peptide a singola
catena di 70 aminoacidi con 3 ponti
disolfurici
• Il gene che codifica per l’IGF1 è
localizzato sul braccio lungo del
cromosoma 12 (p13.1-12)
• L’IGF1 circola legato a proteine
vettrici IGFBPs
Secrezione media di GH nelle 24 ore
% del valore pre-puberale
250
200
150
100
50
0
pre-puberta
tarda pub
20-30 anni
30-60 anni
>60 anni
Asse Ipotalamo-ipofisi e regolazione della secrezione di IGF1
GHRH
SS
IGF1
GH
DEFICIT DI GH (GHD)
• Deficit di GH ad esordio in età pediatrica
• Deficit di GH ad esordio in età adulta
• Deficit di GH dell’anziano
• DEFICIT ISOLATO
• DEFICIT MULTIPLO
DEFICIT DI GH NELL’ADULTO
Cause più frequenti di deficit di GH nell’adulto
Adenomi ipofisari non funzionanti
30.7 %
Craniofaringiomi
13 %
Idiopatici
12.8 %
Adenomi ipofisari ACTH secernenti
7.3 %
Traumi
2%
Irradiazione
2%
Chirurgia
0.9 %
Adenomi PRL secernenti
11.1 %
Altro
20.2 %
(Dati da “GH Replacement in Adult” – The first 5 years of KIMS: 2753 pazienti)
Azione GH - IGF-1 nell’adulto
• Aumenta la captazione e potenzia
l’utilizzazione del glucosio
• Induce lipolisi
• Aumenta la captazione degli aa. potenziandone
l’utilizzazione: aumenta la massa magra
• Migliora la resistenza all’esercizio fisico
• Migliora la performance cardiaca
(in particolare l’attività diastolica)
• Stimola
il
rimodellamento
osseo:
differenziazione e attivazione ostoclasti
Benessere psico-fisico: migliore qualità di vita!
Diagnosi di deficit di GH nell’adulto
Storia clinica
•
Deficit di GH durante l’infanzia
•
Trattamento per deficit di GH durante l’infanzia
•
Tumore ipofisario o ipotalamico
•
Chirurgia della regione ipofisaria
•
Altra terapia ormonale sostitutiva (Ipogonadismo,
Ipotiroidismo, Iposurrenalismo)
•
Irradiazione (per terapia antitumorale o altre cause)
•
Chirurgia/Trauma cranico
Diagnosi di deficit di GH nell’adulto
Sintomatologia soggettiva
•
Astenia ed affaticabilità mentale
•
Mancanza di forza/resistenza, facile affaticabilità fisica
•
Incapacità a fronteggiare la vita quotidiana
•
Mancanza di iniziativa, umore depresso
•
Incremento ponderale/insoddisfazione del proprio aspetto
•
Intolleranza al caldo
•
Mancanza di concentrazione/memoria
•
Facile irritabilità
•
Mancanza desiderio sessuale
Diagnosi di carenza di GH nell’adulto
Sintomatologia obiettiva
• Obesità diffusa con incremento del rapporto vita/fianchi
• Cute secca e sottile, capelli secchi
• Massa muscolare scheletrica ridotta
• Disfunzioni cardiache
• Bassa statura
• Aspetto caratterizzato da affaticamento, stanchezza
• Depressione (malattia percepita, isolamento sociale,
anergia, iporeattività emozionale, carente vita sessuale)
NEUROTRASMETTITORI E REGOLAZIONE
DELL’ASSE IPOTALAMO-IPOFISI
Sistema α-adrenergico
Clonidina (r. α2-adrenergico)
Sistema colinergico
Acetilcolina (r. muscarinici)
Piridostigmina (inib. Colinesterasi)
Atropina
n. periventricolare ant.
n. arcuato
n. ventromediale
+
-
GHRH
+
GH
SS
REGOLAZIONE METABOLICA DELL’ASSE
IPOTALAMO-IPOFISI
Glucosio ↑
Acidi grassi liberi (FFA)
Pasto proteico
Aminoacidi
Arginina
Insulina
Esercizio fisico
GHRH
+
+
Blocco
R-GHRH
GH
SS
Diagnosi di carenza di GH nell’adulto
Esami di laboratorio
•
Esame emocromocitometrico, Creatininemia, Colesterolo (totale,
HDL, LDL), Trigliceridi, Funzionalità epatica, Glicemia ed
Insulinemia basali e post prandiali
•
GH, IGF-1, IGFBP-3
•
Tests di stimolo per la secrezione di GH:
9
9
9
9
9
ITT
Arginina
Clonidina
GHRH + Arginina
GHRH + Piridostigmina
Cut off: picco di GH < 3 µg/L
The phenotype of adults with partial growth hormone
deficiency
Murray. Horm Res 2005
Growth hornone deficiency – GHD
Growth hornone insufficiency – GHI
picco GH < 3 µg/L
3 µg/L < picco GH < 7 µg/L
Composizione corporea alterata
Profilo lipidico irregolare
Attività cardiaca ridotta
Ridotta resistenza all’esercizio fisico
Resistenza insulinica
Aumentata mortalità
Terapia con r-hGH (1/5)
Current Guidelines for Adult GH Replacement
(Doga, Bonadonna, Gola et al; 2005, Reviews in Endocrine & Metabolic Disorders)
Isolato
50%: GHD durante l’infanzia
GHD nell’adulto:
Deficit ormonali multipli
Tumori o trattamenti
antitumorali
ITT: picco GH < 3 µg/L
Diagnosi
+
Manifestazioni cliniche
Obiettivo trattamento
Correzione anomalie correlate al deficit
Massimizzare benefici e minimizzare effetti collaterali
Terapia con r-hGH (2/5)
Dose iniziale: 0,15 – 0,30 mg/die s.c. alla sera
Risposta clinica e biochimica (IGF-1)
No benefici
Incrementi graduali dose – mensili
(max 0,42 mg/die)
Interruzione trattamento
Controlli endocrinologici inizialmente mensili
Stabilizzazione terapia: controlli semestrali - annuali
Terapia con r-hGH (3/5)
Monitoraggio:
¾
IGF-1
¾
Metabolismo glucidico e lipidico
¾
Fondo Oculi
¾
Funzione tiroidea (il GH aumenta la conversione extratiroidea di T4 a T3)
¾
Funzione surrenalica ( il GH potrebbe diminuire la concentrazione di cortisolo
circolante per diminuzione delle proteine cortisolo – leganti)
¾
Funzione cardiovascolare
¾
Rilevazioni antropometriche (Peso, circonferenza fianchi, …)
¾
DEXA
Terapia con r-hGH (4/5)
Sicurezza e Controindicazioni
¾ Diabete mellito o aumentata tolleranza glicidica: non costituiscono
controindicazioni alla terapia sostitutiva
¾ Background retinopatia stabile: no controindicazione
¾ Gravidanza: non costituisce una controindicazione assoluta, consigliata
l’interruzione della terapia
¾ CONTROINDICAZIONI ASSOLUTE:
Æ Tumori maligni
Æ Ipertensione endocranica benigna
Æ Retinopatia diabetica preproliferativa o profilerativa
Terapia con r-hGH (5/5)
Specialità farmaceutiche somatotropina
(da DNA ricombinante)
¾
Genotropin (Pfizer)
¾
Humatrope (Lilly)
¾
Nutropin Aq (Ipsen)
¾
Saizen click.easy (Serono)
¾
Zomacton 4 (Ferring)
Terapia con r-hGH
• Benedini, Dalle Carbonare, Albiger et al. Horm Metab Res 2006
9 Riduzione adiposità centripeta
9 Migliore elasticità vasale, decremento spessore intimale di tutte le arterie
9 Riduzione insulinemia (migliore sensibilità all’ insulina)
9 Riduzione colesterolemia (totale, HDL, LDL), trigliceridemia
• Aberg, Brywe, Isgaard. Scientific World J 2006
9 Proliferazione cellule progenitrici e nuovi neuroni, oligodendrociti e circolazione
vasale dell’ippocampo
• Giannoulis, Sonksen, Umpleby et al. JCEM 2006
9 Aumento massa magra
9 Incremento forza muscolare
9 Riduzione massa grassa
9 Aumento contenuto minerale osseo (BMD)
Conclusioni (1/2)
DOSAGGIO IGF-1
PARAMETRO DI SCELTA
Monitoraggio terapia
Dose ottimale di mantenimento
per ciascun paziente
Marker più sensibile per riconoscere un
eccesso di GH
Conclusioni (2/2)
Scopo terapia sostitutiva con GH nell’adulto
Invertire o prevenire le alterazioni GH-correlate
(composizione corporea e metabolismo)
+
Migliorare la performance fisica e generale
senza introdurre nuovi rischi o effetti
collaterali legati ad un trattamento
inadeguato
DEFICIT DI GH NELL’ANZIANO
Volume 323
July 5, 1990
Number 1
EFFECTS OF HUMAN GROWTH HORMONE IN MEN OVER 60 YEARS OLD
Rudman D, Feller A G, Nagraj H S et al.
In middle and late adulthood alla people experience a series of progressive
alterations in body composition. The lean body mass shrinks and the mass of
adipose tissue expands. The contraction in lean body mass reflects atrophic
processes in skeletal muscle, liver, kidney, splee, skin, and bone. ….
….. Reduced availability of growth hormone in late adulthood may contribute
to such changes.
Volume 323
July 5, 1990
Number 1
EFFECTS OF HUMAN GROWTH HORMONE IN MEN OVER 60 YEARS OLD
Rudman D, Feller A G, Nagraj H S et al.
21 uomini in buono stato di salute, età 61 – 81 aa, IGF-1 < 350 U/L
Somministrazione rec-hGH s.c.: 0,03 mg/Kg x 3/sett. per 6/12 mesi
soggetti
pre-terapia
durante terapia
1
6
8
12
guppo 1 (n. 12)
240 ± 86
230 ± 66
680 ± 180
910 ± 312
gruppo 2 (n. 9)
240 ± 69
240 ± 108
220 ± 123
300 ± 201
mesi
Peso corporeo: =
Massa magra:
+ 8,8%
Densità minerale vertebre lombari: + 1,6 %
Tessuto adiposo: - 14,4
Modificazioni della secrezione di GH nell’anziano
• Riduzione dell’ampiezza dei picchi secretori di GH, più evidente
nelle ore notturne
• Riduzione della concentrazione integrata dell’ormone nelle 24 ore.
• I livelli sierici di IGF-1, strettamente correlati con queli del GH,
decrescono gradualmente con l’età.
• Ridotta secrezione di GH e di IGF-1 in risposta allo stimolo con
GHRH, così come ad altri stimoli quale L-dopa, clonidina,
esercizio fisico; invariate o variabili, invece, quelle in risposta ai
test con ipoglicemia insulinica e con arginina.
• Non modificazioni del contenuto ipofisario di GH anche se alcuni
autori hanno descritto una riduzione del numero e delle
dimensioni delle cellule somatotrope.
RECENTI ACQUISIZIONI: GH/IGF-1 & AGING
• Do deficiencies in growth hormone and insulin-like growth factor-1
IGF-1) shorten or prolong longevity. Laron Z. Mech Ageing Dev 2005
9 Pazienti con deficit di GH-IGF1 nonostante mostrino segni precoci di
invecchiamento, hanno un’attesa di vita superiore e raggiungono età di
80-90 anni.
9 Modelli animali con deficit di GH per mutazione del gene, hanno una
durata della vita statisticamente superiore rispetto ai controlli.
• Somatopause reflects age-related changes in the neural control of
GH/IGF1 axis. Giordano R. et al. J Endocrinol Invest 2005
9 L’ipofunzione dell’asse GH/IGF1 nell’anziano è conseguente alle
modificazioni età-correlate nel controllo neurale delle cellule
somatotrope.
Conclusioni (1/2)
IGF-1 (Ottimale)
PREVENZIONE MORBILITA’ ASSOCIATA
CARENZA
PROTEZIONE NEURONALE
CARDIO PROTEZIONE
SENSIBILIZZAZIONE INSULINICA
PROTEZIONE OSTEOPOROSI
Longevita’
ECCESSO
CANCRO
STRESS OSSIDATIVO
Longevita’
Conclusioni (2/2)
Il deficit dell’asse GH/IGF-1costituisce o no un
positivo e fisiologico adattamento alla condizione
di aging?
By answering this question one is not simply
finding new phylosophical paradigm but also the
rational basis for anti-aging drug interventions.