ANATOMIA PATOLOGICA
Dott. Arena
12/03/2007
Definizione di MORTE IMPROVVISA:
decesso repentino, naturale e non violento, inaspettato, che avviene entro 1-6 ore dall’esordio dei
sintomi. L’OMS ha accettato recentemente un intervallo di tempo maggiore rispetto alle 6 ore
dall’esordio dei sintomi, estendendolo fino alle 24 ore. Tuttavia estendere l’intervallo a 24 ore
significa includere nella definizione di morte improvvisa molti casi di infarto del miocardio. Quindi
per rendere più selettiva la definizione parliamo di morte improvvisa quando il decesso
sopraggiunga entro e non oltre 6 ore, in un soggetto sano o in un soggetto il cui stato di salute
precedente al decesso non lasciasse presagire un esito così repentino. L’incidenza è di 300000400000 individui/anno negli USA e di 100-200casi ogni 1000000 all’anno. Nel giovane con meno
di 35 anni l’incidenza è più bassa e in Italia è pari a 1/100000/anno, valore che aumenta nel giovane
competitivo a 2-3/100000/anno. Il valore di riferimento di 35 anni si utilizza per distinguere tra
morte improvvisa PRECOCE e morte improvvisa TARDIVA, che riconoscono delle cause
distinte. Noi parleremo soprattutto della morte improvvisa precoce, cioè quella che interviene prima
dei 35 anni di età.
La CAUSA della morte improvvisa è definita come quella malattia che dà inizio ad una serie di
eventi che portano al decesso.
Cause cardiovascolari
Sono correlate a malattie di tutte le componenti cardiache: malattie coronariche, malattie
miocardiche, malattie vascolari, anomalie del tessuto di conduzione, patologie delle grandi arterie.
Il meccanismo è l’evento fisiologico terminale che è prodotto dalla causa di morte, quindi la morte
è il primo sintomo della malattia ma è anche l’evento terminale. Distinguiamo dal punto di vista
patogenetico due grosse categorie di morte improvvisa: una morte improvvisa elettrica e una morte
improvvisa meccanica. Quella elettrica si verifica in caso di fibrillazione ventricolare o asistolia,
quella meccanica si verifica quando c’è un improvviso impedimento alla progressione del sangue,
come succede nel tamponamento cardiaco o nell’embolia polmonare.
Tra le cause di morte improvvisa meccanica, una delle più frequenti è la rottura aortica che
coinvolga tutta l’aorta, non solo l’aorta nel tratto intrapericardico, come si può verificare in una
dissezione di un aneurisma del tratto ascendente, in una sindrome di Marfan o in casi di patologia
valvolare aortica congenita, che determinano un grosso sfiancamento del bulbo aortico, che esita
poi in una rottura.
Può essere una rottura nel tratto toracico e avremo anche qui una morte improvvisa meccanica da
emotorace, un grosso aumento delle pressioni nel cavo pleurico e il cuore ha un ostacolo troppo
grande per cui va in dissociazione elettromeccanica.
Anche la rottura dell’aorta lontano dal cuore, in retroperitoneo, nel tratto addominale, in sede
prevalentemente sottorenale, provoca una morte improvvisa meccanica.
Altre cause meccaniche sono l’embolia polmonare e lo shock emorragico.
Quando si parla di morte improvvisa elettrica il discorso si complica perché non c’è la stessa
evidenza anatomopatologica sul cadavere e il rilievo macroscopico è spesso assente. Dobbiamo
andare a cercare tutte le altre cause: patologie delle coronarie, patologie congenite o acquisite del
miocardio, eventuali valvulopatie, alterazioni del tessuto di conduzione(anche qui bisogna fare una
dissezione anatomica del tessuto di conduzione, andando a trovare i vari punti nodali al fine di
vedere se ci sono alterazioni,infiltrazioni o sostituzioni delle fibre di Purkinje con tessuto fibroso).
La morte improvvisa elettrica può inoltre essere dovuta ad anomalie congenite del tessuto di
conduzione, sia che esse vengano operate sia che non vengano operate.
CORONARIE: sono due una dx e una sx, l’unica variabile che si considera in anatomia è la
dominanza dx o sx, cioè se c’è un ramo discendente posteriore che deriva dalla circonflessa di dx o
dalla circonflessa di sx rispettivamente, oppure si parla di circolazione coronarica bilanciata se i
due rami convergono verso la crus. In realtà esistono una serie di anomalie congenite che vanno
conosciute, solitamente è raro che la diagnosi venga fatta su un soggetto sano. Sono rari i casi di
anomalie congenite sintomatiche a tal punto da portare il paziente a fare una visita cardiologica
specifica; di solito vengono scoperte al tavolo autoptico.
Sono o anomalie di origine o anomalie di decorso. Le più frequenti sono le anomalie di decorso.
Possiamo avere delle varianti soprattutto nella distribuzione dei rami antero-laterali e diagonali. Le
anomalie di decorso intramiocardico si hanno quando la coronaria non ha un decorso
subendocardico ma entra direttamente all’interno del miocardio. Questo può determinare, durante la
contrazione, una riduzione importante del volume, per cui una coronaria normale, anche senza una
patologia acquisita aterosclerotica o degenerativa in genere, per la sistole può andare incontro a
problemi ischemici.
Le anomalie di origine sono o dall’aorta o dall’arteria polmonare. Ovviamente le più gravi sono
quelle dall’arteria polmonare per la diversa pressione parziale di ossigeno all’interno della stessa.
Dall’aorta abbiamo diverse possibilità di origine dell’arteria: possono nascere dal seno di Valsalva
controlaterale, per cui abbiamo una coronaria di dx che origina dall’orifizio della coronaria sx e
viceversa; possiamo avere un ramo circonflesso sx che non è di pertinenza della coronaria di sx ma
viene dalla coronaria di dx; possiamo avere un’origine anomala della coronaria,alta, al di sopra del
limite anatomico dato dal lembo libero della valvola semilunare. Ci possono essere poi delle
anomalie di natura intimale, di plicatura ostiale, cioè ci sono dei piccoli peli che vanno a chiudere
l’ostio della coronaria con un meccanismo a valvola che determina un’alterazione del flusso.
Un caso molto frequente è che dallo steso seno di Valsalva originano sia il ramo di dx sia il ramo di
sx, ma il ramo di sx prima di dare il tronco comune può dividersi ulteriormente in ramo circonflesso
r discendente anteriore, dando un tronco comune che passa tra l’aorta e la polmonare. Questa è una
delle anomalie più frequenti e viene riconosciuta anche in vivo perché questi pazienti hanno
solitamente dei problemi di dispnea, di facile affaticamento, in quanto la stessa sistole, la stessa
dilatazione del bulbo aortico determina compressione sul piccolo ramo coronarico, con poussèe
ischemiche.
1 Caso clinico:
paziente di sesso femminile, trovata morta presso la sua abitazione. Il reperto macroscopico è un
cuore di spessore lievemente aumentato( spessore normale del VS è di 1,5 cm, 0,5-0,8 per il VD),
senza alcun segno di ischemia recente. Esaminando le coronarie si evidenzia un’origine comune tra
la coronaria di dx e la coronaria di sx, un unico ostio per la discendente anteriore e per la
circonflessa. Questa è considerata un’anomalia benigna, riscontrata in corso di coronarografia, ma
in questo caso è l’unica causa di morte.
2 Caso clinico:
si osserva la discendente anteriore con ramo circonflesso completamente ipoplasico, si notano rami
antero-laterali completamente occlusi, questo è ciò che succede nei casi di coronaria ipoplasica,
abbiamo una zona di ischemia pregressa con sostituzione cicatriziale e notevole riduzione dello
spessore del ventricolo di sx. Notiamo come il territorio di distribuzione dell’area ischemica sia
esattamente il territorio di irrorazione della coronaria ipoplasica.
Vengono illustrati altri casi in cui rami della discendente anteriore o della circonflessa terminano in
cordoncini fibrosi.
Altra causa di morte improvvisa cardiaca è la presenza di 3 muscoli papillari nel ventricolo di sx
invece che2. questa è una ragazza di 17 anni, epilettica, trovata morta.
Se queste erano le patologie congenite, veniamo ora alle patologie acquisite: aterosclerosi, embolia,
dissezione oppure processi infiammatori.
Primo caso in cui si vede una parete arteriosa di medio calibro, siamo nell’epicardio, e questo è un
grosso infiltrato infiammatorio a tutto spessore nella parete. Non è molto frequente trovare la
flogosi dei vasi coronarici perché in genere è a carico dei piccoli vasi intraparenchimali.
Questa è una sezione fatta al congelatore, durante un’autopsia, questo ispessimento della parete che
noi vediamo dal punto di vista istologico, ha un correlato macroscopico. Si vede, a livello
istologico, una parete coronarica ispessita e biancastra. E’ stato poi possibile evidenziare un
infiltrato T cellulare mediante immunoistochimica.
In molti casi di morte improvvisa tardiva e negli alcolisti si repertano dei cuscinetti intimali detti
endomiocardal humps ed è stato dimostrato come essi si associno anche a tutta la patologia
anginosa per deposito sottointimale di tessuto ialino.
Altre cause acquisite di morte improvvisa cardiaca sono: dissezione della circonflessa, rottura di
una placca aterosclerotica con formazione di un trombo, arterite con sostituzione fibrosa.
Per quanto riguarda la patologia a carico del tessuto muscolare, riconosciamo come causa di morte
improvvisa tardiva un pregresso episodio ischemico che abbia dato una cicatrice.
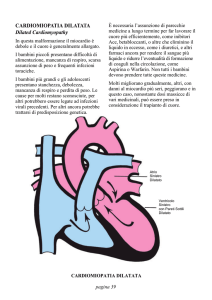
Abbiamo poi tutte le cardiomiopatie: la cardiomiopatia ipertrofica,la cardiomiopatia aritmogena del
ventricolo dx, la cardiomiopatia dilatativa e la cardiomiopatia conseguente a miocardite.
Tra le patologie valvolari ricordiamo il prolasso della mitrale e la stenosi aortica sia congenita che
acquisita. La stenosi aortica acquisita, cioè sclerodistrofica calcifica, è la causa più frequente di
morte improvvisa cardiaca.
Nel reperto anatomopatologico del prolasso della mitrale si osservano delle corde tendinee
afflosciate con caratteristico aspetto “a paracadute” del lembo valvolare, perché rigonfio.
Tra le cause più frequenti di morte improvvisa elettrica troviamo invece il blocco seno-atriale, il
blocco atrio-ventricolare, alterazioni dei canali del sodio.
Nei casi di morte improvvisa cardiaca il substrato è rappresentato da patologie subacute o croniche
e l’evento precipitante può essere di qualsiasi tipo( stress, emozione, fatto ischemico acuto,
alterazioni elettrolitiche, farmaci).
Tra le cause certe(macroscopiche) annoveriamo:
embolia polmonare, rottura dell’aorta, shock emorragico, infarto del miocardio con rottura del
muscolo papillare(con conseguente insufficienza mitralica ed edema polmonare acuto), mixoma e
metastasi, trombosi a livello dell’orifizio valvolare, occlusione coronarica acuta, trombosi
aterosclerotica o arteritica, dissezione coronarica ed embolia, l’origine della coronaria sx dal tronco
della polmonare.
Tra le cause probabili abbiamo invece:
placche aterosclerotiche con stenosi critiche, cicatrici, cardiomiopatie, miocardite diffusa, prolasso
mitralico con lieve insufficienza valvolare, stenosi aortica, origine anomala dell’arteria coronaria sx
dal seno, eccitazione ventricolare con diagnosi elettrocardiografica certa, blocco, cardiopatie
congenite.
Cause possibili minori: coronaria dx che origina da un seno sx, origine alta della coronaria, ramo
circonflesso sx che origina da dx, plicatura ostiale, segni focali di miocardite, prolasso mitralico
senza insufficienza valvolare.
La diagnosi di morte improvvisa è una diagnosi di esclusione.
Un cuore è definito normale quando non è ipertrofico, non presenta segni di occlusione coronarica,
non ha placche stenosanti >75%, non ci sono anomalie congenite o atri difetti strutturali, non ci
sono valvulopatie o aneurismi parietali,non ci sono pregressi fatti ischemici e sostituzione adiposa o
fibro-adiposa del miocardio,non troviamo infiltrato infiammatorio né anomalie del tessuto di
conduzione.
In italia una delle cause più frequenti di morte improvvisa al di sotto dei 35 aa. è la displasia
aritmogena del ventricolo dx, nota anche come cardiomiopatia aritmogena del ventricolo dx.
l’incidenza è 1/10000, circa il 20% di tutte le morti cardiache, prevale nel sesso maschile, nel 50%
dei casi c’è familiarità e nel 50% dei casi si sa quale gene è coinvolto.
La diagnosi differenziale si pone con la cosiddetta adipositas cordis, con l’infiltrazione adiposa del
ventricolo dx e con una variante della displasia aritmogena. La diagnosi deve essere ovvia quando
troviamo una ipertrofia del ventricolo dx, molto maggiore rispetto al ventricolo sx, dovuta a
sostituzone fibro-adiposa con lo sviluppo di aneurismi parietali nel cosiddetto triangolo della
displasia, che sta tra l’apice, l’infundibolo(tronco della polmonare) e la parete inferiore
sottotricuspidale.
L’adipositas cordis comporta un aumento del grasso nel tessuto subepicardico, soprattutto a livello
dei solchi atrioventricolari ed interventricolari, senza rarefazione del miocardio sottostante.
L’infiltrazione adiposa è invece data dalla dissociazione delle fibre miocardiche, in assenza di
fibrosi sostitutiva, con un confine epi-miocardico ancora conservato. Ciò significa che i tralci
adiposi dissoceranno le fibre miocardiche senza però invadere l’endocardio. Questo è frequente nei
soggetti morti per causa extracardiaca, specie a livello dell’apice e della parete antero-laterale del
VDx. Qual è allora la differenza tra adipositas cordis ed infiltrazione adiposa?
In entrambi i casi l’assenza di alterazioni a livello nucleare e citoplasmatico nel miocita è
considerato un criterio di esclusione di cardiomiopatia aritmogena del VDx.
Questo è il classico cuore di una cardiomiopatia aritmogena dx, si osserva la notevole atrofia del
VDx, maggiore rispetto al VSx, si fa una prova di transilluminazione, cioè si mette contro luce la
parete ventricolare dx per vedere se passa la luce; questo è considerato macroscopicamente
suggestivo per un’eventuale cardiomiopatia aritmogena. Lo spessore è molto ridotto(<0.8 cm) e ci
sono delle zone di ipertrofia compensatoria con dilatazione pseudoaneurismatica del VDx.
A livello istologico osserviamo tre elementi fondamentali: grasso, muscolo e tessuto cicatriziale.
Il reperto di fibrosi sostitutiva è fondamentale per porre diagnosi di cardiomiopatia aritmogena. Si
osserva un effetto citopatico, con nuclei dal profilo irregolare ed ipertrofia degli stessi
miocardiociti. Le aree di sostituzione cicatriziale si presentano come delle aree biancastre.
1 Caso clinico:
sesso maschile, nato nel 1940, giunto morto in pronto soccorso con le seguenti notizie cliniche:
“pregressa cardiopatia ischemica, arresto cardiaco, insufficienza respiratoria e shock cardiogeno”.
Si inizia con l’esame esterno, si vedono delle alterazioni, che in parte sono dovute ai fenomeni
cadaverici, in parte sono alterazioni dovute alla patologia. Si osserva una lieve cianosi nel letto
ungueale e nei padiglioni auricolari, fratture costali associate alle manovre rianimatorie. Si
osservano le ipostasi, un fenomeno post-vitale, sono delle macchie rosso-vino,causate dll’accumulo
di sangue nelle porzioni declivi nel soggetto morto.
Aprendo si osserva un cuore di 790g con dilatazione, aprendo poi il pericardio, vediamo una grossa
auricola di dx, notiamo un aumento del grasso epicardico. Studiando il cuore sul tavolino,
osserviamo una forma globosa, dilatazone del cuore che ci fa intuire il lavoro compiuto per vincere
un’aumentata resistenza. C’è endocardiofibrosi circonferenziale e sottoendocardica quindi
dobbiamo pensare che, se c’è fibrosi c’è stato un fenomeno ischemico cronico per cui il cuore ha
perso per ischemia dei miocardiociti e li ha sostituiti con tessuto cicatriziale. Sicuramente è un
coronarosclerotico.
2 Caso clinico:
viene mostrato un altro cuore in cui spiccano i tralci fibrosi e l’assottigliamento della parete
cardiaca, si parla in questo caso di pseudoaneurisma cordis, esito di un proceso ischemico cronico.
Laddove sia possibile individuare delle aree più scure nell’ambito della regione ischemica
biancastra, li intendiamo come segni di riacutizzazione della pregressa cardiomiopatia ischemica.
La conferma si ha solo con l’istologia; facciamo il vetrino ed osserviamo una zona di fibrosi, piccoli
vasi occlusi ma soprattutto congestione ,piccoli stravasi interstiziali ,aspetto ondulato delle fibre
miocardiche(tipico del danno ischemico acuto) colore non omogeneo del miocardiocita, con
vacuolizzazioni biancastre(segno iperacuto di ischemia),strie nel citoplasma, degenerazione
idropica. Di solito accanto a segni di pregresso infarto si collocano miocardioiociti ipertrofici.
Nella sezione di una coronaria epicardica osserviamo una placca organizzata, una sostituzione quasi
fibrosa, una stenosi importante(>75%).
Trattandosi di un blocco cardiaco, a livello epatico, troviamo una forte congestione dei sinusoidi
con glicogenosi nucleare. A livello renale troviamo un infiltrato pielonefritico. A livello polmonare
ci sono dei macrofagi ripieni di emosiderina per insufficienza cardiaca congestizia.
Epicrisi: infarto del miocardio riacutizzato in soggetto con coronarosclerosi grave e
pseudoaneurisma cordis. Stasi ematica pluriviscerale, segni di pielonefrite cronica, cellule di
Bizozzero a livello alveolare
3 Caso clinico: soggetto di 55 aa. giunto cadavere al pronto soccorso. Aprendo il mediastino si
osserva una camicia di sangue che va a rivestire completamente il cuore.
Quali sono le cause di tamponamento cardiaco? Rottura del cuore,del bulbo aortico o di una
coronaria, pugnalata, infiltrato tumorale, diatesi emorragica. Sezionando il cuore si osserva una
grossa emorragia con una soluzione di continuità a tutto spessore nella parete anteriore. Il sangue
infiltra il tessuto adiposo; in questi casi si trova o una compressione ab estrinseco delle coronarie o
un interessamento delle piccole diramazioni nervose subepicardiche. Possiamo dunque avere una
morte improvvisa sia per tamponamento cardiaco sia per motivi elettrici, perché viene inibito
qualsiasi tipo di stimolo nervoso.
Epicrisi: emopericardio da rottura di cuore in infarto iperacuto del miocardio.
4 Caso clinico:
soggetto di 25 aa. giunto cadavere al pronto soccorso. All’autopsia si osserva un’ipertrofia del
miocardio, con cuscinetto subaortico nel cono di efflusso, con effetto stenotizzante. Sono 3 cm di
ipertrofia settale, si osserva una deformazione del lembo aortico della mitrale ed aumento di
spessore. Da un lato abbiamo una insufficienza mitralica, dall’altro una stenosi aortica. La causa di
morte è l’ipertrofia settale con formazione del cuscinetto che ostruisce il cono di efflusso.
Osservando al vetrino il tessuto miocardico, notiamo tessuto fibroso(assolutamente anomalo in un
soggetto di 25aa.), che denuncia un problema di vascolarizzazione. Ci sono delle aree in cui il cuore
non è più un sincizio funzionale, ma le fibre si incrociano perpendicolarmente e non danno una
contrazione efficace. Si evidenziano dei rari focolai infiammatori cronici, aspetti cardiomiopatici
con grossi nuclei a “corna di cervo”, vacuolizzazione, tutti elementi che testimoniano una
sofferenza ischemica.
La diagnosi differenziale va posta con: stenosi valvolare aortica, amiloidosi, cardiopatia ipertensiva
e ramificazione del setto.
Scompenso cardiaco
Un cuore normale nella donna pesa 250-300 g, 350 nel maschio. Si dice che corrisponda alle
dimensioni del pugno chiuso del soggetto. Un cuore si definisce ipertrofico quando spessore e peso
superano i valori indicati per sesso ed età.
Ci sono 5 meccanismi alla base della fisiopatologia del cuore:
1. l’insufficienza di pompa
2. l’ostruzione del flusso
3. il reflusso valvolare
4. alterazoni della conduzione cardiaca
5. interruzione della continuità del sistema cardiocircolatorio.
1.Un muscolo danneggiato si contrae debolmente o in modo inadeguato e le cavità non riescono a
svuotarsi completamente. In altre situazioni, invece, il miocardio non riesce a rilasciarsi a
sufficienza.
2. Nel caso di stenosi aortica si ha ostruzione al flusso, la valvola non si apre , c’è un aumento della
pressione nella camera ventricolare, come succede nell’ipertensione e questo sovraccarica la pompa
cardiaca.
3. Il reflusso attraverso la valvola tricuspide; il flusso è retrogrado e si altera la normale dinamica
cardiocircolatoria.
4. Il cuore non produce delle contrazioni uniformi e valide.
5. Si verifica nella rottura del cuore o dei vasi, nelle ferite di arma da fuoco e negli shock
emorragici.
Si parla di insufficienza cardiaca quando il cuore non riesce a pompare una quantità di sangue
sufficiente a soddisfare le necessità metaboliche dei tessuti oppure riesce a farlo solo mantenendo
un’elevata pressione di riempimento.
Con il meccanismo di Frank-Starling il cuore riesce ad aumentare la propria forza di contrazione
aumentando la distensione delle fibre miocardiche.
Con l’ipertrofia il cuore riesce ad aumentare la massa di tessuto contrattile.
Anche il sistema renina-angiotensina-aldosterone, il peptide natriuretico atriale e la norepinefrina
sono fondamentali nella regolazione dell’attività cardiaca.
Qual è il rilievo anatomopatologico dell’insufficienza cardiaca? I reperti sono a carico delle
funzioni renali, cerebrali e polmonari. Nell’insufficienza cardiaca sx c’è aumento della pressione
venosa nel circolo polmonare, congestione ed edema polmonari. I polmoni sono pesanti e umidi,
omogeneamente di colore rosso cupo anziché rosei. Si osserva un trasudato perivascolare, un
ampiamento edematoso dei setti, accumulo di liquidi negli spazi. A livello radiografico si formano
delle strie caratteristiche, per aumento della trama.
A livello renale si osserva ridotta gittata, ipoperfusione renale, attivazione del sistema reninaangiotensina. C’è marcata congestione del letto capillare; i capillari sono dilatati e ingorgati di
sangue.
A livello encefalico troviamo un encefalopatia ipossica che dà irritabilità, perdita della capacità di
attenzione, irrequietezza e stato soporoso, fino al coma.
Nell’insufficienza cardiaca dx si osserva una dilatazione del ventricolo di dx, c’è uno sfiancamento
che va sotto il nome di “medializzazione del setto”.
A livello epatico si osserva una epatomegalia congestizia con aspetto “a noce moscata”,cioè
l’alternanza di aree marroni ad aree giallastre. Nelle regioni pericentrali del lobulo epaticoc’è una
maggiore sofferenza all’ipossia, condizione che, mediante sostituzione fibrosa, può esitare in un
quadro che viene definito cirrosi cardiogena.
A livello renale c’è un aumento di congestione, possono esserci dei versamenti pleurici ed edema
pretibiale.
Chiara