INTRODUZIONE
La
Farmacovigilanza
è
quella
disciplina
scientifica
che
si
occupa
fondamentalmente di valutare il rischio connesso all’impiego dei farmaci e nel
monitorare l’incidenza degli effetti indesiderati potenzialmente associati ai
trattamenti con lo scopo ultimo di promuovere un uso più razionale e sicuro dei
medicinali.
Sebbene, infatti, i farmaci siano autorizzati all’immissione in commercio soltanto
quando ne venga accertata una determinata sicurezza, ciò non garantisce una
totale assenza di rischio per il paziente.
Gli studi clinici pre-marketing forniscono informazioni abbastanza esaurienti
sull’efficacia dei farmaci, ma per svariate ragioni (popolazioni selezionate, ridotta
dimensione del campione, durata limitata, indicazione ristretta ecc.) non possono
garantire dati adeguati relativamente alla sicurezza del loro impiego. Ne consegue
che, dopo l’immissione in commercio, gli operatori sanitari e i pazienti si trovano
nella condizione di continuare a sperimentare il farmaco, in un campo di
applicazione diverso da quello degli studi registrativi (1).
Gli obiettivi della farmacovigilanza possono essere così sintetizzati:
o la precoce identificazione di reazioni avverse da farmaci (Adverse
Drug Reactions, ADR) ed interazioni tra farmaci precedentemente
sconosciute, non note;
o il riconoscimento dell’aumento nella frequenza di reazioni avverse
note;
o l’individuazione dei fattori di rischio e dei possibili meccanismi alla
base delle reazioni avverse;
3
o la valutazione degli aspetti quantitativi delle analisi rischio/beneficio;
o
la diffusione delle informazioni necessarie agli operatori sanitari per
migliorare la prescrizione dei farmaci;
o l'educazione e l'informazione dei pazienti.
Le principali fonti di informazione sulla sicurezza dei farmaci nella sorveglianza
post-marketing sono rappresentate da:
o sistemi
di
segnalazione
spontanea
di
ADR
(aneddotica
e
volontaria/organizzata);
o studi epidemiologici (caso-controllo, studi di coorte);
o dati di prescrizione;
o altre metodologie, quali il PEM (Prescription Event Monitoring) ed il
record-linkage.
Questi metodi, generalmente, differiscono per il loro campo di applicazione.
Possono essere adoperati sia per formulare delle ipotesi (Hypothesis-Generating
Methods), individuando cioè ADR sconosciute, o per verificare delle ipotesi
(Hypothesis-Testing Methods), accertandone la validità.
La segnalazione spontanea, principale metodica di farmacovigilanza, rappresenta
un sistema efficace per l’individuazione di ADR rare o insolite (prevalentemente,
reazioni avverse di tipo B) che si verificano in associazione all’uso dei farmaci.
La focomelia da talidomide, la sindrome oculomucoso-cutanea da practololo, la
neutropenia da cloramfenicolo sono tutti esempi di ADR individuate attraverso la
metodica della segnalazione spontanea (2-3).
4
L’identificazione di potenziali reazioni avverse necessita tuttavia di un processo
successivo sistematico di verifica e quantificazione. La possibilità di avere
evidenze da altre fonti rimane quindi una condizione imprescindibile, perché le
autorità sanitarie intervengano sul farmaco in questione prendendo i
provvedimenti più idonei.
LA SEGNALAZIONE SPONTANEA: GENERALITA’
Nel 1968 l'OMS si è fatta promotrice del Programme for International Drug
Monitoring, un progetto pilota che prevede la centralizzazione dei dati mondiali
sulle ADR, per monitorarle e così rendere possibile l'identificazione di quelle che
per la loro rarità non possono essere identificate dai trial clinici. A questo
programma, nel 2010, partecipano ormai 134 Nazioni, fra cui anche l'Italia,
presente a partire dal 1975 (4).
È questo il sistema di segnalazione volontaria, ma organizzata, che si basa sulla
compilazione di un’apposita scheda da parte dell’operatore sanitario ogni
qualvolta egli osservi, nell’ambito della pratica quotidiana, un evento clinico che
sospetta essere una ADR. In Inghilterra, la yellow card è stata utilizzata a tal fine
sin dal 1964; negli Stati Uniti viene impiegato il modulo Medwatch che è sempre
più ampiamente distribuito ai medici per incoraggiare la segnalazione.
Nel compilare la scheda, il segnalatore deve indicare l'età ed il sesso del paziente,
la terapia farmacologica completa (e comprensiva della posologia), cui il paziente
era sottoposto al momento della reazione avversa, il tipo di reazione ed una serie
di altri dati che serviranno a coloro che dovranno analizzarla per stabilire se
effettivamente esiste una relazione di causalità fra farmaco (o farmaci) ed evento
5
avverso. Nel compilare la scheda il segnalatore non deve chiedersi se la reazione
sospettata può o meno essere validata, poiché il sistema è stato creato per
integrare le diverse segnalazioni e generare allarmi in base alla valutazione di più
rapporti provenienti da differenti fonti.
Pertanto si chiede di segnalare una sospetta reazione avversa, ben sapendo che il
sospetto non è certezza.
Una volta compilata, la scheda va inviata ai centri di farmacovigilanza istituiti
dalle Autorità Regolatorie competenti dei singoli Paesi. Le segnalazioni vengono
poi convogliate per l’Europa all’European Medicines Evaluation Agency (EMA)
e per tutti i Paesi, inclusi quelli europei, all’Uppsala Monitoring Centre, che è
l’agenzia istituita dall’Organizzazione Mondiale della Sanità per creare un
archivio internazionale delle ADR (4-5).
Il punto di forza della segnalazione spontanea consiste nel fatto che essa può
investigare su tutti i farmaci per l’intera durata della loro commercializzazione,
estendendo l’indagine all’intera popolazione dei pazienti in terapia farmacologica,
senza pertanto essere limitata ad una singola ipotesi a priori (come nel caso degli
studi pre-marketing).
Questa metodica è particolarmente indicata per individuare reazioni avverse rare
(pertanto non identificabili prima che un gran numero di pazienti venga esposto al
farmaco) o interazioni tra farmaci (es. rabdomiolisi da interazione fra gemfibrozil
e cerivastatina) oppure quei casi in cui esista una lunga latenza fra la
somministrazione del farmaco e lo sviluppo della reazione avversa (es.
ipertensione polmonare da fentermina).
6
Grazie ai suoi indubbi vantaggi, la segnalazione spontanea ha portato negli anni
all’identificazione di svariate ADR gravi o inattese; ciò ha comportato il ritiro dal
commercio di numerosi farmaci o il recepimento di informazioni aggiuntive utili
ad un loro uso più sicuro.
Le principali limitazioni del sistema di segnalazione spontanea sono invece
rappresentate dalla enorme sottosegnalazione o under-reporting e dal fatto che i
dati ottenuti (numero di segnalazioni di ADR) manchino di un “denominatore” di
riferimento (numero di pazienti esposti) (6).
Sebbene l'entità dell’under-reporting, cioè la mancata segnalazione di un numero
sufficiente di report per una valutazione di tipo quantitativo delle ADR, sia
ampiamente variabile a seconda dei diversi Paesi, è certo che il numero di ADR
segnalate a livello internazionale costituisce una percentuale minima di quelle che
realmente si verificano nella pratica clinica (secondo alcuni studi inferiore al
10%).
Per migliorare la quantità e la qualità dei dati che vengono raccolti, e quindi per
aumentarne il valore epidemiologico, è necessario educare gli operatori sanitari
sui benefici che il sistema di segnalazione spontanea può apportare alla comunità,
sia in termini di riduzione del rischio per il paziente che di risparmio delle risorse
per curare le reazioni avverse.
Al tempo stesso, i dati, una volta analizzati, dovrebbero essere rapidamente
comunicati agli operatori sanitari, in modo che le informazioni ottenute possano
essere utilizzate per conseguire benefici pratici nel trattare i pazienti. Solo così la
segnalazione di una ADR non sarà più considerata come un mero adempimento
burocratico, come attualmente accade.
7
Come definito da Ronald Meyboom (7), i sistemi di segnalazione spontanea
nazionali ed internazionali, che ad oggi rappresentano la principale fonte di
informazione in farmacovigilanza, si basano su quattro assunti fondamentali:
1. la necessità di una struttura organizzata che assicuri la raccolta, la
validazione, l’analisi e la distribuzione dei dati;
2. l’impiego dei dati ottenuti durante la sorveglianza post-marketing, da parte
delle
Autorità
Regolatorie
in
collaborazione
con
le
industrie
farmaceutiche, per la regolamentazione dell’uso del farmaco (es. revisione
della scheda tecnica, sospensione o ritiro del farmaco);
3. l’uso di adeguate metodologie e procedure scientifiche che assicurino una
corretta interpretazione dei dati;
4. la comunicazione e l’educazione ed, in particolare, la diffusione
dell’informazione sulla sicurezza a prescrittori, farmacisti e pazienti (feedback) (7).
Il significato della segnalazione
Come si è detto, il principale obiettivo della Farmacovigilanza è l’individuazione
di eventi clinici avversi connessi all’uso dei medicamenti, che siano ignoti o nuovi
in termini di aspetto clinico, gravità o frequenza (8).
Ciò comporta la ricerca di segnali preliminari di tali eventi. L’OMS definisce
come segnale “una informazione riferita su una possibile relazione causale tra un
evento avverso ed un farmaco, relazione che sia ignota o precedentemente
documentata in modo incompleto”.
8
Il sistema della segnalazione spontanea è un metodo capace di “generare” delle
ipotesi (segnale d’allarme); la validità di tali ipotesi può essere confermata solo
attraverso studi epidemiologici formali.
In linea di principio, qualsiasi manifestazione clinica indesiderata e non voluta in
corso di terapia medica può avere un’eziologia farmacologica e quasi tutti i
farmaci sono capaci di causare numerosi tipi di reazioni avverse.
Le ADR possono essere multiformi, eterogenee e, spesso, anche imprevedibili.
Presentano spesso sintomatologia sovrapponibile a quella di patologie comuni e
per questo possono non essere riconosciute. La diagnosi di ADR si configura,
quindi, come una delle più difficili in campo medico.
In presenza di un evento clinico indesiderato nel corso di un trattamento
farmacologico, una volta escluse tutte le altre possibili cause patogenetiche e
sospettando che l’evento possa essere dovuto ad uno o più farmaci utilizzati per la
terapia, il sanitario ha la possibilità, ma anche l’obbligo deontologico (e di legge),
di segnalare il suo sospetto.
L’operatore sanitario non osserva una “reazione avversa”, bensì un “evento
clinico indesiderato”, durante una terapia medicamentosa.
La convinzione che nel segnalare una ADR non vi possa essere certezza (cosa che
richiede ben altra documentazione e ben altre prove) dovrebbe eliminare in parte
la preoccupazione di una responsabilità e facilitare la tempestiva segnalazione.
E’ auspicabile che il segnalatore segua il percorso clinico-diagnostico appropriato
per la raccolta di dati completi e di buona qualità. Alla luce di quanto sopra è
preferibile riferirsi alla segnalazione di ADR con il termine “segnalazione di
sospetta ADR”.
9
La validazione delle segnalazioni
A fronte di un evento avverso e di un farmaco sospettato di averlo causato, per
stabilire un rapporto di causalità è necessaria un’analisi attenta del procedimento
diagnostico dell’evento.
La relazione di causalità farmaco-ADR dovrà essere valutata, analizzando:
il rapporto temporale fra l’uso del farmaco e l’insorgenza della reazione.
Le caratteristiche dell’evento avverso. Infatti, i sintomi e segni dell’evento
possono coincidere con alcuni di quelli già noti per quel farmaco o per
composti chimicamente o farmacologicamente correlati ad esso. Alcuni
segni e sintomi sono patognomici. Ad esempio, in un paziente che assume
digossina, una combinazione di arresto cardiaco ed aritmia ectopica quasi
certamente sarà dovuta al farmaco. Tuttavia, la mancanza di queste
informazioni non dovrebbe essere usata per escludere una associazione,
specialmente con nuovi farmaci, poiché una ADR potrebbe essere non
ancora conosciuta o prevedibile in base alle caratteristiche farmacologiche.
Per
esempio,
i
corticosteroidi,
usati
comunemente
come
immunosoppressori, possono causare reazioni allergiche.
La frequenza dell’evento. E’ un elemento importante sapere quanto esso è
frequente nella popolazione generale e se possa essere associabile all’uso
del farmaco. Per esempio, la cefalea è un disturbo relativamente frequente
e quindi la sua associazione con un farmaco può essere casuale. Al
contrario, l’anemia aplastica ha un’incidenza bassa e spesso è associata
all’uso di farmaci e quindi è più probabile che si tratti di un’ADR.
10
Gli
esami
strumentali
e
di
laboratorio.
La
valutazione
della
concentrazione plasmatica del farmaco, le biopsie e le prove allergiche
possono aiutare la diagnosi, stabilire la funzionalità dell’organo e fornire i
mezzi per il controllo di cosa accade dopo l’eventuale riduzione della dose
o sospensione della terapia o il cambio della stessa. Ad esempio, le analisi
di funzionalità tiroidea sono eseguite di routine prima di iniziare la
somministrazione di amiodarone, che può causare non soltanto patologie
tiroidee, ma comportare anche alterazioni dei test di funzionalità, anche
quando la funzione della tiroide è normale, rendendo in tal modo più
difficile l’interpretazione del fenomeno.
L’effetto della sospensione del farmaco (dechallenge). Nella maggior parte
dei casi, se l’evento dipende dal farmaco, la sospensione della sua
somministrazione (se possibile) e la risoluzione dell’evento senza alcuna
terapia (dechallenge positivo) facilitano la valutazione dell’imputabilità.
Alla fine di questo processo dovrebbe essere possibile stabilire la relazione di
causalità (Box 1), spesso facendo anche uso di algoritmi, quali quello di Naranjo
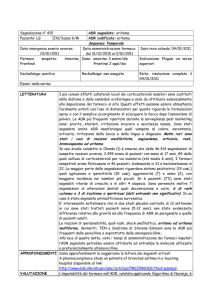
(Tabella 1) e quello di Hutchinson (Tabella 2) (9-10).
11
Box 1: Criteri* per l’attribuzione della relazione di causalità delle sospette reazioni
avverse.
*riferiti secondo il WHO International Drug Monitoring Programme (5)
CERTA
Un evento clinico (inclusa l'alterazione di un parametro di laboratorio) che
insorga con una plausibile sequenza temporale dall'assunzione del farmaco e che
non può essere spiegato da patologie concomitanti, né dalla concomitante
assunzione di altri farmaci o sostanze chimiche.
La risposta alla sospensione del farmaco (dechallenge) dovrebbe essere
clinicamente plausibile.
La reazione deve essere definita farmacologicamente o fenomenologicamente,
seguendo una procedura di risomministrazione (rechallenge), se necessario.
PROBABILE
Un evento clinico (inclusa l'alterazione di un parametro di laboratorio) che
insorga con una plausibile sequenza temporale dall'assunzione del farmaco e che
non può essere spiegato da patologie concomitanti, né dalla concomitante
assunzione di altri farmaci o sostanze chimiche. La reazione deve essere già
stata osservata per il farmaco sospettato.
La reazione deve migliorare con il dechallenge.
Non è necessario il rechallenge perché la reazione avversa rientri in questa
definizione.
POSSIBILE
Un evento clinico (inclusa l'alterazione di un parametro di laboratorio) che
insorga con una plausibile sequenza temporale dall'assunzione del farmaco, ma
che potrebbe essere spiegato da patologie concomitanti o dalla concomitante
assunzione di altri farmaci o sostanze chimiche.
Le informazioni sulla sospensione del trattamento possono essere mancanti o
poco chiare.
IMPROBABILE
Un evento clinico (inclusa l'alterazione di un parametro di laboratorio) con un
rapporto temporale che rende il rapporto causale improbabile ed in cui altri
farmaci, sostanze chimiche o malattie silenti forniscono altre plausibili
spiegazioni.
CONDIZIONALE / NON CLASSIFICATA
Quando è un evento (inclusa l'alterazione di un parametro di laboratorio) che
viene riportato come una reazione avversa, che necessita di più dati per una
appropriata valutazione o per la quale si stanno valutando dati ulteriori.
NON VALUTABILE / NON CLASSIFICABILE
Una segnalazione che riporta una reazione avversa che non può essere giudicata
a causa della mancanza o contradditorietà delle informazioni e che non può
essere verificata o supportata da altre informazioni.
12
Tabella 1. ALGORITMO DI NARANJO
SI NO
1. Ci sono rapporti precedenti conclusivi su questa reazione?
NON SO
+1
0
0
2. L’evento è comparso dopo la somministrazione del farmaco? +2
-1
0
3. La reazione è migliorata alla sospensione del farmaco?
+1
0
0
4. La reazione è ricomparsa alla risomministrazione del
+2
-1
0
5. Ci sono cause alternative?
-1
+2
0
6. La reazione è ricomparsa dopo somministrazione di un
-1
+1
0
+1
0
0
8. La gravità della reazione era dose-dipendente?
+1
0
0
9. Il paziente aveva già presentato una reazione di questo tipo
+1
0
0
+1
0
0
farmaco?
placebo?
7. Sono state rinvenute concentrazioni tossiche del farmaco
nell’organismo?
ad un farmaco uguale o simile?
10. L’evento avverso era stato confermato da elementi
oggettivi?
Interpretazione: ≤ 0 dubbia; 1-4 possibile; 5-8 probabile; ≥ 9 certa
Tabella 2. ALGORITMO DI HUTCHISON
ELEMENTI
A FAVORE INCERTI CONTRARI
1
Esperienza precedente
+1
0
-1
2.
Cause alternative
+2
0
-1
3.
Fattore temporale
+1
0
-2
4.
Livelli del farmaco (sangue)
+1
0
-1
5.
Dechallenge
+1
0
-1
6.
Rechallenge
+1
0
-1
Totale
+7
0
-7
Interpretazione: < 0 dubbia; 0-3 possibile; 4-5 probabile; 6-7 certa
13
ORGANIZZAZIONE DELLA SEGNALAZIONE SPONTANEA A
LIVELLO INTERNAZIONALE
Negli ultimi anni un numero crescente di Paesi ha espresso il desiderio di partecipare
al Programme for International Drug Monitoring dell’OMS per ricevere supporto
nello sviluppo del proprio sistema di monitoraggio nazionale.
Tra i diversi Paesi membri, esistono numerosi modelli organizzativi di segnalazione
spontanea, designati dalle autorità regolatorie competenti e che mostrano alcune
peculiarità dovute a differenze di carattere storico e legislativo.
Ciò sembra naturale, in quanto ciascun sistema di farmacovigilanza, non soltanto
deve adattarsi alla realtà socio-economica del Paese stesso (organizzazione sanitaria,
numero di abitanti, ecc.), ma deve considerare nel dettaglio, tramite azioni mirate a
livello locale, i problemi farmaco-correlati (produzione, distribuzione ed utilizzo dei
farmaci; genetica, dieta e tradizioni locali; uso di terapie alternative non
convenzionali).
Come regola generale un sistema di sorveglianza post-marketing dei farmaci è rivolto
al monitoraggio delle segnalazioni di sospette reazioni avverse tramite l'uso di un
archivio unico che permetta di ottenere una veduta generale su scala nazionale.
In passato, in numerosi Paesi il modello principale dei sistemi di monitoraggio è stato
quindi caratterizzato da una struttura “di tipo centralizzato” con un unico centro
nazionale responsabile della raccolta di tutte le segnalazioni inviate dagli operatori
sanitari.
Attualmente, al fine di implementare il sistema della segnalazione spontanea, molti
Paesi preferiscono adoperare una struttura “di tipo decentralizzato” con un centro
nazionale che funzioni come punto di riferimento per alcuni centri regionali, che
14
svolgano, a loro volta, un’attività capillare di farmacosorveglianza nelle rispettive
regioni di appartenenza.
Nonostante la regionalizzazione richieda più personale e più mezzi e quindi possa
essere più costosa, un sistema di monitoraggio decentralizzato può garantire una
maggiore efficacia in termini di quantità e qualità di segnalazioni di reazioni avverse,
specialmente quando le nazioni sono grandi o hanno culture regionali diverse.
Oggi, diverse Nazioni sono sul punto di attivare i loro sistemi in conformità con
quest'ultimo modello, ed i Paesi che già hanno una lunga tradizione nel monitoraggio
dei farmaci, stanno cambiando i loro programmi andando verso la decentralizzazione.
Nonostante sia difficile affermare quale sia un “sistema ideale” di segnalazione
spontanea, sono stati evidenziati negli ultimi anni fattori determinanti che potrebbero
contribuire alla diffusione della cultura della farmacovigilanza (11).
Un’attiva informazione di ritorno, individuale e collettiva (bollettini di
farmacovigilanza, dear doctor letter, ecc.), la facile reperibilità delle schede e la
presenza di linee guida chiare, alla luce delle esperienze internazionali, sono gli
elementi essenziali per il raggiungimento di quegli obiettivi, definiti dall’OMS come
Gold standard della segnalazione spontanea.
Tali obiettivi sono rappresentati da:
o un tasso annuale di 300 segnalazioni per milione di abitanti;
o il 30% delle segnalazioni riguardanti reazioni avverse gravi;
o segnalazioni provenienti da almeno il 10 % dei medici del territorio
nazionale.
15
IL SISTEMA DI SEGNALAZIONE SPONTANEA IN ITALIA
La normativa
La farmacovigilanza in Italia è regolata da norme e procedure che coinvolgono
molti soggetti, con ruoli ben definiti: gli operatori sanitari in qualità di segnalatori,
le Aziende Sanitarie Locali, le Direzioni Sanitarie delle strutture ospedaliere e
degli Istituti di ricovero e cura a carattere scientifico (IRCCS), le Aziende
Farmaceutiche, le Regioni e l’Agenzia Italiana del Farmaco (AIFA), tramite
l'Ufficio di Farmacovigilanza.
A livello internazionale, tutte le Agenzie o Enti preposti alla farmacovigilanza
sono in costante contatto tra loro e anche con l’EMA, ente sovranazionale, cui le
Autorità Sanitarie degli Stati membri fanno riferimento nel territorio dell'Unione
Europea, e con l'Organizzazione Mondiale della Sanità (OMS).
La legge primaria nazionale vigente in materia di farmacovigilanza, che ha
abrogato il D.L.vo 95/03, è il D.L.vo 24 aprile 2006 n. 219, di attuazione della
Direttiva 2001/83/CE e successive modifiche e della Direttiva 2003/94/CE (12) .
Per quanto concerne l’ambito di applicazione, il D.L.vo 219/06 riguarda le
segnalazioni spontanee, da letteratura e da studi osservazionali; non si applica
invece alle segnalazioni di reazioni avverse che si verificano nel corso di
sperimentazioni cliniche, la cui gestione è regolamentata dal D.L.vo 211/03.
Il D.L.vo 219/06, regolamentando il funzionamento del sistema nazionale di
farmacovigilanza, che fa capo all’AIFA, assegna a ciascun soggetto coinvolto
compiti precisi e prevede specifici obblighi, integrati dalle norme previste dai
Decreti 24 maggio 2002, 6 novembre 2003 e 12 dicembre 2003, dalle procedure
16
via via comunicate dall’AIFA, attraverso il suo sito web e la Rete Nazionale di
Farmacovigilanza e dalle linee guida comunitarie contenute nel Volume 9A di
EudraLex.
Compiti dell’AIFA
Raccogliere e valutare informazioni utili per la sorveglianza dei
medicinali, con particolare riguardo alle reazioni avverse, all’uso
improprio ed all’abuso, tenendo conto anche dei dati relativi ai consumi;
promuovere il processo di informatizzazione di tutti i flussi di dati
necessari alla farmacovigilanza, gestendo e coordinando, in particolare, la
rete telematica nazionale di farmacovigilanza, che collega le strutture
sanitarie, le regioni e le aziende farmaceutiche;
collaborare con l’EMA, con i competenti organismi degli altri Stati
membri dell’Unione Europea (UE) e con la Commissione europea alla
costituzione ed alla gestione di una rete informatizzata europea, per
agevolare lo scambio delle informazioni inerenti la farmacovigilanza dei
medicinali commercializzati nella UE;
promuovere e coordinare, anche in collaborazione con l'Istituto Superiore
di Sanità (ISS), studi e ricerche di farmacoutilizzazione, farmacovigilanza
attiva e farmacoepidemiologia;
adottare, coadiuvata dalle regioni, iniziative atte a promuovere le
segnalazioni spontanee da parte degli operatori sanitari;
promuovere iniziative idonee per la corretta comunicazione delle
informazioni relative alla farmacovigilanza ai cittadini ed agli operatori
sanitari;
17
provvedere, avvalendosi della Commissione Tecnico Scientifica (CTS) e
in collaborazione con il Consiglio Superiore di Sanità (CSS), a predisporre
la relazione annuale sulla farmacovigilanza da presentare al Parlamento;
organizzare, con la partecipazione dell’ISS, riunioni periodiche con i
responsabili di farmacovigilanza presso le Regioni, per concordare le
modalità operative relative alla gestione della farmacovigilanza;
provvedere affinché tutte le segnalazioni di sospette reazioni avverse gravi
da medicinali verificatesi sul territorio nazionale siano messe a
disposizione dell’EMEA, degli altri Stati membri e del titolare
dell’autorizzazione all’immissione in commercio (AIC) entro 15 giorni
solari dalla data di ricevimento della loro comunicazione, dando
tempestiva notizia al pubblico del contenuto di tali segnalazioni;
informare immediatamente l'EMA, gli altri Stati membri della UE ed il
titolare dell’AIC, su eventuali modifiche, sospensioni o revoche di una
AIC;
revocare o modificare, se è il caso, il proprio provvedimento nel rispetto di
quanto deciso dalla Commissione UE;
assicurare l’osservanza delle disposizioni in materia di farmacovigilanza,
ispezionando i locali, le registrazioni e i documenti dei titolari di AIC;
analizzare e controllare le sospette reazioni avverse gravi relative a
medicinali autorizzate con procedura di mutuo riconoscimento o
decentrata, qualora l’Italia sia lo Stato membro di riferimento.
18
Compiti delle Regioni (da svolgere avvalendosi anche di appositi Centri di
Farmacovigilanza.)
Collaborare, singolarmente o d’intesa fra loro, con l’AIFA nell’attività di
farmacovigilanza, fornendo elementi di conoscenza e valutazione ad
integrazione dei dati che pervengono all’Agenzia stessa;
provvedere, nell’ambito delle proprie competenze, alla diffusione delle
informazioni al personale sanitario ed alla formazione degli operatori nel
campo della farmacovigilanza;
collaborare a fornire i dati sui consumi dei medicinali, mediante
programmi di monitoraggio sulle prescrizioni a livello regionale.
Obblighi del titolare di AIC
Registrare in modo dettagliato tutte le sospette reazioni avverse da farmaci
osservate in Italia, nell’Unione Europea o in un Paese terzo;
registrare e notificare, entro al massimo 15 giorni da quando ne ha avuto
notizia, le reazioni avverse gravi verificatesi in Italia, segnalate da
personale sanitario alla struttura sanitaria di pertinenza del segnalatore o,
qualora impossibile, all’AIFA;
registrare e notificare all’AIFA, con la stessa tempistica di cui sopra,
qualunque altra sospetta reazione avversa grave di cui sia venuto a
conoscenza;
provvedere a che siano notificate all’AIFA, con la stessa tempistica di cui
sopra, le sospette reazioni avverse gravi e inattese e la presunta
19
trasmissione di agenti infettanti attraverso un medicinale verificatesi in un
Paese terzo;
segnalare all’AIFA, secondo modalità e tempi con essa stabiliti, le sospette
reazioni avverse gravi, verificatesi nella UE, relative ai medicinali
autorizzati con procedura di mutuo riconoscimento o decentrata, quando
l’Italia è il Paese membro di riferimento;
disporre, a titolo stabile e continuativo, di un responsabile del servizio di
farmacovigilanza in possesso di laurea in medicina o farmacia o CTF, o di
laurea specialistica in scienze biologiche o chimica ad indirizzo organicobiologico, purchè sia stato superato un esame di farmacologia annuale
(pari a 12 crediti formativi nel relativo settore scientifico-disciplinare). Il
responsabile del servizio di farmacovigilanza deve essere persona diversa
dal responsabile del servizio scientifico, ma in condizione di usufruire di
tutti i dati di tale servizio;
inviare all’AIFA, su CD-ROM, i rapporti periodici di aggiornamento sulla
sicurezza (PSUR) almeno ogni sei mesi a partire dal rilascio dell’AIC fino
alla prima commercializzazione e successivamente o immediatamente, su
richiesta, oppure ad intervalli regolari come da schema seguente: ogni sei
mesi per i primi due anni dalla data di rilascio dell’AIC e quindi una volta
all’anno per i due anni seguenti. Successivamente, gli PSUR devono
essere presentati ogni tre anni e congiuntamente alla domanda di rinnovo
dell’AIC;
20
utilizzare la terminologia medica concordata a livello internazionale per le
segnalazioni di reazioni avverse (Medical Dictionary for Regulatory
Activities, MedDRA);
notificare preventivamente o contestualmente all’AIFA le informazioni su
problemi di farmacovigilanza, relative ai propri medicinali, dirette al
pubblico;
diffondere ai medici prescrittori le note informative e gli aggiornamenti
sulla sicurezza , secondo indicazioni, tempi e modalità stabilite dall’AIFA,
ogni qualvolta emergano nuove informazioni relative al profilo di
tollerabilità del medicinale;
trasmettere trimestralmente, per via informatica, i dati di vendita in base al
D.D. 24.05.02; tale obbligo è esteso anche alle aziende responsabili della
commercializzazione dei medicinali.
Obblighi del responsabile del servizio di farmacovigilanza delle aziende
farmaceutiche
Assicurare l’istituzione e il funzionamento di un sistema atto a garantire
che le informazioni su tutte le presunte reazioni avverse comunicate al
personale dell’azienda ed agli informatori scientifici del farmaco, siano
raccolte, ordinate e accessibili in un unico luogo;
assicurare che tutte le informazioni relative alla sicurezza dei medicinali,
successive all’atto di autorizzazione, siano portate rapidamente a
conoscenza del personale sanitario, anche tramite i contatti del servizio di
informazione scientifica della propria azienda;
21
elaborare i rapporti periodici di aggiornamento sulla sicurezza (Periodic
Safety Updated Report = PSUR);
trasmettere per via telematica al sistema nazionale di farmacovigilanza le
segnalazioni di sospette reazioni avverse gravi da letteratura verificatesi in
Italia;
trasmettere alla struttura sanitaria di pertinenza le segnalazioni di sospette
reazioni gravi o inattese avvenute sul territorio nazionale, ricevute
direttamente dal segnalatore e non tramite la rete nazionale di
farmacovigilanza;
trasmettere ad ogni richiesta dell’AIFA informazioni supplementari ai fini
della valutazione dei benefici e dei rischi di un medicinale, comprese le
informazioni riguardanti i volumi di vendita o di prescrizione dello stesso;
presentare all’AIFA ogni altra informazione rilevante ai fini della
valutazione dei benefici e dei rischi relativi ad un medicinale, incluse
appropriate informazioni su studi di sicurezza post-autorizzativi.
Obblighi delle strutture sanitarie (AUSL, AO, IRCCS pubblici e privati,
Policlinici universitari pubblici e privati)
Nominare un responsabile di farmacovigilanza della struttura in possesso
di laurea in medicina o farmacia o CTF o di laurea specialistica in scienze
biologiche o chimica ad indirizzo organico-biologico, purchè sia stato
superato un esame di farmacologia annuale (pari a 12 crediti formativi nel
relativo settore scientifico-disciplinare).
22
Obblighi del responsabile di farmacovigilanza delle strutture sanitarie
Provvedere a registrarsi alla rete nazionale di farmacovigilanza, al fine
dell’abilitazione necessaria per la gestione delle segnalazioni;
provvedere, previa verifica della completezza e della congruità dei dati,
all’inserimento delle segnalazioni nella banca dati della rete nazionale di
farmacovigilanza entro e non oltre 7 giorni dal ricevimento della
segnalazione;
richiedere al segnalatore aggiornamenti delle sospette reazioni avverse
gravi ed ogniqualvolta ritenuto necessario;
aggiornare la scheda inserita in rete;
agevolare la ricerca attiva da parte del responsabile di farmacovigilanza
delle aziende farmaceutiche di informazioni aggiuntive sulle segnalazioni;
acquisire dal segnalatore, per tutte le reazioni avverse ad esito fatale, una
relazione clinica dettagliata, da trasmettere all’AIFA entro 15 giorni solari;
conservare presso la struttura sanitaria le schede originali di segnalazione
(inoltrandole in copia all’AIFA, alla Regione di appartenenza o al Centro
di Farmacovigilanza individuato dalla Regione ove dagli stessi richiesto).
Obblighi dei medici e degli altri operatori sanitari
I medici e gli altri operatori sanitari sono tenuti a segnalare: tutte le sospette
reazioni avverse gravi o inattese di cui vengono a conoscenza nell'ambito della
propria attività; tutte le sospette reazioni avverse osservate, gravi, non gravi, attese
ed inattese da tutti i vaccini e dai medicinali posti sotto monitoraggio intensivo ed
inclusi in elenchi pubblicati periodicamente dall'AIFA. I medici e gli altri
23
operatori sanitari devono trasmettere le segnalazioni di sospette reazioni avverse,
tramite l'apposita scheda, tempestivamente, al responsabile di farmacovigilanza
della struttura sanitaria di appartenenza (AUSL, Azienda Ospedaliera, IRCCS);
questi entro 7 giorni dal ricevimento della scheda di segnalazione, provvede al suo
inserimento nella Rete Nazionale di farmacovigilanza (previa verifica della
completezza e della congruità dei dati). L’inserimento da parte del responsabile
locale di farmacovigilanza genera un messaggio di avvenuto inserimento
all’AIFA, all’azienda farmaceutica produttrice del farmaco implicato nella ADR e
al Centro regionale di farmacovigilanza (ove presente) informandoli che nella
RNF è stata registrata una nuova segnalazione.
Le segnalazioni (spontanee o da studi osservazionali o da letteratura) di ADR che
si sono verificate in Italia vengono raccolte mediante la Rete Nazionale di
Farmacovigilanza (RNF), attiva dal novembre 2001.
L’attuale sistema italiano di farmacovigilanza si basa sulla RNF. La rete
garantisce da un lato la raccolta, la gestione e l’analisi delle ADR e dall’altro la
pronta e capillare diffusione delle informazioni diramate dall’AIFA in merito alla
sicurezza dei farmaci, attraverso un network che coinvolge l’AIFA, le 20 Regioni
e le Province Autonome di Trento e Bolzano, 204 Unità Sanitarie Locali, 112
Ospedali, 38 Istituti di Ricerca e Cura a Carattere Scientifico e 561 industrie
farmaceutiche.
Dal 2006 le attività di farmacovigilanza sono state potenziate attraverso il
consolidamento della rete nazionale (con il coinvolgimento dei centri regionali) ed
il suo collegamento ad Eudravigilance ed al Centro Organizzazione Mondiale
della Sanità per il Monitoraggio Internazionale dei Farmaci di Uppsala.
24
Flusso delle segnalazioni
Il percorso delle informazioni in Italia è descritto nello schema seguente (Fig 1):
Figura 1. Il flusso delle segnalazioni
Schema del sistema di farmacovigilanza in Italia
Industria
Farmaceutica
Medici
ed altri operatori sanitari
tempestivamente
Invio scheda
cartacea
Aziende Sanitarie Locali o
Direzioni Sanitarie (Ospedali)
Inserimento nel database
ministeriale
entro 7 giorni
AIFA
ufficio di
Farmacovigilanza
Entro 15 giorni per effetti gravi
25
Regioni o
Centri FV
EMEA
Scheda di segnalazione
Figura 2. La scheda di segnalazione di sospetta reazione avversa da farmaco
26
La scheda di segnalazione dovrebbe essere considerata come una cartella clinica
semplificata, a fronte della quale il segnalatore deve non solo compilare nel modo
più esauriente possibile i vari campi, bensì chiedersi quanto comprensibile sarà il
suo sospetto per gli altri.
Il sistema di segnalazione, infatti, prevede che la scheda venga prima o poi
validata e tale validazione sarà tanto più facile, quanto più il caso clinico riportato
nella scheda sarà accompagnato da informazioni esaurienti.
La scheda di segnalazione può essere vista anche dal responsabile dell’azienda
farmaceutica del farmaco sospettato, ma il nome del segnalatore è oscurato. Ciò
significa che una azienda farmaceutica, qualora necessiti di ulteriori informazioni
circa la segnalazione, non ha possibilità di contattare direttamente il segnalatore,
ma ha bisogno di interpellare il responsabile della farmacovigilanza che ha
inserito i dati della scheda per avere informazioni aggiuntive dal segnalatore.
Il responsabile della farmacovigilanza dovrà, quindi, contattare l’operatore
sanitario e fungere da intermediario, garantendo l’anonimato del segnalatore,
salvo diversa disposizione di quest’ultimo.
27
SCOPO DELLA TESI
Negli ultimi anni, la ricerca clinica in campo oncologico ha portato
all’introduzione in terapia di molti farmaci innovativi, con una conseguente
aumentata efficacia dei trattamenti. Sui farmaci di nuova generazione (farmaci
biologici o a target molecolare) si concentrano grandi aspettative per alcune
patologie oncologiche le cui possibilità terapeutiche sono tuttora limitate.
Tuttavia, la disponibilità di nuovi farmaci efficaci si accompagna ad alcune
criticità.
Le registrazioni dei nuovi farmaci vengono spesso fatte dalla FDA per gli Stati
Uniti e dall'EMA per l'Europa sulla base di processi di valutazione accelerati o di
studi basati su indicatori di efficacia surrogati, quale ad esempio la riduzione della
massa tumorale invece che la riduzione della mortalità. Questo fenomeno
racchiude in sé elementi positivi e negativi. È sicuramente un elemento positivo,
soprattutto quando le innovazioni riguardano tipologie di cancro contro le quali
non esistono trattamenti efficaci o ne esistono pochi, la possibilità di registrare
farmaci anche per patologie poco frequenti (per le quali è difficile condurre ampi
studi randomizzati) e rendere disponibili in tempi brevi le innovazioni
terapeutiche. D'altra parte, però, un elemento problematico è costituito dalla
necessità di confermare nel tempo se l'effetto sugli indicatori surrogati si traduce
in forme più sostanziali di beneficio per i pazienti. Purtroppo raramente le aziende
farmaceutiche che ottengono una registrazione accelerata di un nuovo farmaco
hanno poi interesse a condurre studi adeguati che confermino l'efficacia del
farmaco registrato. Ne consegue che una più ampia dimostrazione dell'efficacia di
questi farmaci può solo essere cercata attraverso sperimentazioni post-registrative
28
promosse dai ricercatori o attraverso la valutazione prospettica del loro impatto
nella pratica clinica. A parte questo, le registrazioni accelerate comportano la
necessità di un attento monitoraggio a medio e lungo termine degli effetti avversi,
che potrebbero non essere stati sufficientemente evidenziati durante gli studi
registrativi.
In questo contesto, la farmacovigilanza post-marketing, e in modo particolare la
segnalazione spontanea delle ADR, diventa fondamentale per meglio definire il
profilo beneficio/rischio dei nuovi farmaci oncologici, per valutare nella pratica
clinica reale il loro profilo di sicurezza complessivo e l’impatto sulla qualità di
vita del paziente. I pazienti del “mondo reale” spesso hanno caratteristiche
differenti (patologie multiple, corredo genetico, usi off-label, etc.) rispetto a quelli
arruolati negli studi registrativi e quindi sono a maggior rischio di ADR e di
interazioni tra farmaci.
Gli antineoplastici, termine che comprende agenti molto diversi tra loro, sono
considerati farmaci con un elevato numero di effetti avversi soprattutto quando si
parla di farmaci a meccanismo convenzionale citotossico.
D’altra parte, in contrasto alle aspettative iniziali relative alla loro supposta
selettività per i tessuti neoplastici, spesso le terapie con le nuove molecole hanno
dimostrato di potere causare effetti avversi e problemi inaspettati (per esempio,
cardiotossicità da trastuzumab e inibitori chinasici, sindrome veno-occlusiva
epatica da gemtuzumab ozogamicina, “ipersensibilità” da anticorpi monoclonali,
polmonite interstiziale da gefitinib, ecc.).
In passato i farmaci antineoplastici non sono stati oggetto di attenzione prioritaria
nei programmi nazionali o internazionali di farmacovigilanza e, in aggiunta, è
29
stata assente la cultura della segnalazione delle ADR tra gli oncologi. Solo
recentemente è stata sottolineata la chiara e preminente importanza delle attività di
FV in ambito oncologico (13).
E’ paradossale che il numero di segnalazioni di reazioni avverse riguardanti i
farmaci oncologici pervenute alla Rete Nazionale di Farmacovigilanza sia stato
tradizionalmente proporzionalmente più basso di quello degli altri farmaci. Il
livello estremo di “under-reporting” in oncologia può essere, almeno in parte,
legato al fatto che una serie di reazioni vengono considerate come assolutamente
abituali ed attese (per esempio, mielodepressione, mucositi, nausea e vomito,
alopecia); gli oncologi sono in genere molto attenti nel documentarne la frequenza
e gravità nel corso dei trial, come anche nel cercare di prevenirle e gestirle, ma
ritengono, dato che queste reazioni non rappresentano una novità, che la necessità
di segnalarle nella pratica clinica di routine imponga un faticoso e inutile lavoro
burocratico. Va detto che questo certamente non può e non deve applicarsi al caso
di tossicità meno scontate, come quelle causate dai nuovi farmaci a meccanismo
molecolare orientato ed anche dagli stessi antineoplastci tradizionali. Rispetto ad
altri medici, gli oncologi hanno, tra l’altro, dei doveri aggiuntivi unici rispetto alla
segnalazione delle ADR, in quanto, in generale, sono i soli ad usare gli
antineoplastici quali farmaci altamente specialistici e pertanto a garantirne la
sicurezza di fronte alla comunità.
Tuttavia, esaminando la letteratura scientifica (tramite, per esempio, una ricerca su
PubMed
e
immettendo
parole
chiave
come
“Drug
surveillance”,
“Pharmacovigilance”, “ADR”, “Anticancer drugs” o “Antineoplastic drugs”,
ecc.), si trovano pochissimi articoli dedicati al tema della “farmacovigilanza in
30
oncologia”. Estremamente informativo sugli aspetti discussi è un articolo di
Ladewski LA et al. apparso nel 2003 su Journal of Clinical Oncology (14). E’
stata esaminata la velocità di comparsa di informazioni e provvedimenti
cautelativi (quali revisioni del foglietto illustrativo, Dear Doctors Letters e articoli
su riviste scientifiche indicizzate) relativi a venticinque ADR gravi da farmaci
oncologici identificate nel periodo 2000-2002 negli USA. Sostanzialmente, si è
confermato che le reazioni avverse frequenti erano state facilmente individuate,
tipicamente nei trial ma anche con le segnalazioni (MedWatch), e con una più o
meno accettabile rapidità di disseminazione della nuova informazione (come
tempo trascorso a partire dall’approvazione della FDA). Invece, le reazioni più
rare erano state soprattutto individuate dalle segnalazioni spontanee o dai case
report, con tempi di latenza molto elevati nella comparsa dell’informazione (anche
35,9 anni nel caso della mielodepressione grave da tioguanina in soggetti
geneticamente suscettibili e 34,9 anni per i decessi da vinblastina somministrata
per via intratecale).
Ne deriva quindi che, anche in oncologia, la mancata segnalazione di un evento
grave o inatteso è un’insostituibile occasione d’allarme perduta, con rallentamento
del processo d’informazione e degli eventuali provvedimenti necessari.
Il criterio che deve essere seguito dagli oncologi per l’individuazione delle
reazioni avverse da segnalare deve essenzialmente rispondere alla domanda “mi
attendevo questo risultato?”. Per cui, nel caso di un trattamento con un farmaco
citotossico leucopenizzante è chiaro che una modesta riduzione dei globuli
bianchi è un fenomeno atteso; ma una grave leucopenia, che modifichi i piani
terapeutici o che imponga terapie non previste di routine, è una reazione avversa.
31
Tuttavia, per le reazioni non gravi o note, bisogna tenere conto che, come già
esposto, per i farmaci oncologici e per tutti quelli che vengono utilizzati in aree
nelle quali non sono disponibili terapie efficaci, è frequente il fenomeno della
rapida immissione in commercio prima che si concluda tutta la sperimentazione,
una procedura “accelerata” che si basa su risultati d’efficacia intermedi. Questi
farmaci quindi non sono ancora conosciuti nel loro profilo di sicurezza
complessivo, un elemento indispensabile a valutare i riflessi sulla qualità della
vita del paziente. Per questo è importante che gli eventi avversi, anche non gravi e
già noti, dei farmaci oncologici di recente introduzione vengano segnalati in fase
post-marketing, al fine di poterli quantificare, non solo nella situazione particolare
dei trial, ma anche nella pratica clinica quotidiana.
Tenendo conto di tutto questo, l’AIFA ha istituito il Registro dei Farmaci
Oncologici sottoposti a Monitoraggio (RFOM) con lo scopo di verificare l’uso
appropriato di questi farmaci, raccogliere dati utili ad integrare quanto emerso nel
corso delle sperimentazioni cliniche e sensibilizzare i medici alla segnalazione
delle sospette reazioni avverse. Per questi medicinali la segnalazione di sospetta
reazione avversa, che, come si è visto, dà conto del giudizio clinico sulla
imputabilità del farmaco e sulla potenziale rilevanza dell’evento osservato, va
inviata, compilando e stampando l’apposita scheda generata dal Registro, affinché
questi possa provvedere al suo inserimento nella Rete Nazionale di
Farmacovigilanza. Solo attraverso questo sistema di farmacovigilanza le
segnalazioni di sospetta reazione avversa possono essere esaminate in maniera
cumulativa e, eventualmente, generare segnali d’allarme o confermare il rapporto
beneficio/rischio del prodotto.
32
In base alle precedenti considerazioni, risulta evidente l’opportunità di potenziare
la farmacovigilanza in oncologia, dato che essa può produrre effetti utili in
molteplici direzioni. In questo contesto si sono inserite le mie indagini e le mie
analisi principalmente relative all’esperienza maturata nel corso della mia
collaborazione con il “Centro di consulenza ed informazione sugli effetti tossici
da farmaci antitumorali e sulle ADR in pazienti neoplastici” nell’ambito del
“Progetto regionale per lo sviluppo della Farmacovigilanza” della Regione Sicilia.
Gli obiettivi principali del Centro sono:
o stimolare la segnalazione spontanea delle ADR in campo oncologico
in termini di quantità e qualità delle segnalazioni;
o fornire informazioni agli operatori sanitari sul profilo rischio-beneficio
dei farmaci oncologici e sulle ADR in oncologia;
o promuovere la cultura della farmacovigilanza in oncologia;
o colmare il divario esistente fra la Sicilia e le altre regioni in termini di
numero di segnalazioni di ADR.
33
PROGETTO PER L’ORGANIZZAZIONE DELLA
FARMACOVIGILANZA IN SICILIA
E’ opinione ormai consolidata che i modelli organizzativi sottesi all’attività di
farmacovigilanza nei Paesi in cui la stessa ha ricevuto maggiore impulso,
prevedono al loro interno l’istituzione di Centri di Riferimento Regionale
(CRR), con competenze e requisiti specifici, cui sono affidati compiti quali lo
studio e l’approfondimento dei segnali, le operazioni di sorveglianza delle
codifiche e la validazione delle informazioni relative alle segnalazioni di sospette
reazioni avverse da farmaci e, più in generale, la formulazione del feed-back ai
segnalatori e l’attività di reporting e di formazione agli operatori sanitari.
Ai CRR, oltre ai compiti istituzionali, sono stati affidati il controllo di qualità
delle operazioni di codifica e, su esplicita richiesta delle strutture sanitarie che
manifestino temporanee difficoltà operative, le attività di gestione delle
segnalazioni di sospette reazioni avverse nella rete (inserimento, annullamento,
aggiornamento, ecc). A tale scopo al referente scientifico di ciascun Centro
Regionale presente in Italia è stata rilasciata l’abilitazione per l’accesso alla Rete
Nazionale di Farmacovigilanza previo consenso da parte delle Regioni stesse.
La Regione Sicilia ha organizzato a partire dal 2003 il sistema di
farmacovigilanza secondo un assetto funzionale che prevede i Centri di
Riferimento Regionali.
Il progetto si articola in una struttura piramidale con 3 livelli crescenti di
competenza e responsabilità:
34
1.
Dipartimenti del Farmaco delle Aziende Sanitarie Provinciali e servizi di
farmacie delle Aziende Ospedaliere, Aziende Policliclinico e IRCCS della
Regione Sicilia
2.
Quattro Centri referenti qualificati, che collaborano con l’Ufficio di
Farmacovigilanza Regionale e con l’Agenzia Italiana del Farmaco.
Tali centri sono:
a)
Centro referente per la segnalazione spontanea organizzata, allocato
presso il Dipartimento Clinico Sperimentale di Medicina e
Farmacologia dell’Università degli Studi di Messina;
b)
Centro di consulenza ed informazione sugli effetti tossici da farmaci in
donne gravide ed in neonati e da erbe medicinali e dai prodotti da esse
derivati, allocato presso il Dipartimento di Farmacologia Sperimentale
e Clinica dell’Università degli Studi di Catania;
c)
Centro di consulenza ed informazione sugli effetti tossici da farmaci
antitumorali e sulle ADR in pazienti neoplastici, allocato presso la
Sezione di Farmacologia “P: Benigno” del Dipartimento di Scienze per
la Promozione della Salute “G. D’Alessandro” dell’Università di
Palermo;
d)
Centro di consulenza ed informazione sulle sospette reazioni avverse
da vaccini (vaccinovigilanza), allocato presso l’Assessorato della
Salute della Regione Sicilia.
3.
L’Ufficio di Farmacovigilanza Regionale, allocato presso il Dipartimento
Pianificazione Strategica, Servizio 7 – Farmaceutica, dell’Assessorato della
Salute della Regione Sicilia.
35
Il Progetto si articola come descritto di seguito (vedi lo schema a fine paragrafo):
Dopo aver inserito la scheda di sospetta ADR nella Rete Nazionale di
Farmacovigilanza (RNF) dell’AIFA i Responsabili della Farmacovigilanza
di ASP, AO ed IRCCS siciliane inoltrano tale scheda in copia al Centro
Referente per la Segnalazione Spontanea Organizzata che ha sede presso il
Dipartimento di Medicina e Farmacologia dell’Università di Messina.
Presso il Centro Referente viene elaborata, da personale medico e
farmacista competente ed appositamente incaricato, una risposta al
segnalatore (feedback individuale) per ciascuna segnalazione pervenuta, in
base alla letteratura disponibile sulla possibile associazione causale tra
farmaco assunto ed ADR insorta. Al fine di migliorare la completezza
delle informazioni riportate nella scheda di segnalazione, nella risposta
vengono anche indicati i campi eventualmente non compilati della scheda.
E’ cura del Centro Referente far pervenire ai centri di consulenza ed
informazione sopra descritti le schede di segnalazione di sospette ADR
relative agli specifici ambiti di competenza, al fine di fornire commenti al
segnalatore, per il tramite del Responsabile di farmacovigilanza:
Il Centro Referente per la segnalazione spontanea organizzata, cui è
affidata la responsabilità tecnico-scientifica del progetto, effettua il
controllo di qualità e la valutazione dell’imputabilità (causality
assessment) di tutte le schede di segnalazione inserite dai responsabili di
farmacovigilanza siciliani nella RNF, stimola i follow-up, particolarmente
per reazioni avverse inaspettate e gravi e/o fatali, ed attua la ricerca e
36
l’approfondimento dei segnali di allarme in ambito nazionale mediante
analisi dei dati presenti nella RNF.
Questo sistema, non solo obbedisce ai suggerimenti dell’Organizzazione
Mondiale della Sanità intesi ad aumentare stabilmente il numero e la qualità delle
segnalazioni di ADR e quindi dei potenziali segnali d’allarme, ma anche:
valorizza il responsabile della farmacovigilanza nella sua attività
d’informazione sul rischio/beneficio dei farmaci;
contribuisce ad una operazione di educazione continua e personalizzata
degli operatori sanitari;
tende a creare, attraverso un contatto educativo/formativo ripetuto, una
rete di segnalatori esperti nella segnalazione.
37
SCHEMA DEL SISTEMA DI FARMACOVIGILANZA IN
SICILIA
38
METODI
Come già visto, dal gennaio 2003 la Regione Sicilia ha attivato un “Progetto
regionale per lo sviluppo della Farmacovigilanza”; nel gennaio 2007 è stata
approvata la prosecuzione del progetto adeguandolo all'evoluzione della
normativa comunitaria e nazionale nel settore. Fin dall’inizio, il Progetto si è
fortemente interessato all’oncologia con l’istituzione di un Centro referente
dedicato, il “Centro di consulenza ed informazione sugli effetti tossici da farmaci
antitumorali e sulle ADR in pazienti neoplastici”.
Il Centro si occupa di valutare la qualità delle segnalazioni di ADR in oncologia e
la loro interpretazione; interviene nelle operazioni di codifica e di inserimento
attribuite al responsabile di farmacovigilanza referente laddove, per documentata
temporanea difficoltà operativa, questi ne faccia esplicita richiesta; stimola, per
particolari segnalazioni, la ricerca d'altri dati o il follow up di singoli pazienti
tramite il responsabile di farmacovigilanza referente; elabora un commento alla
segnalazione
da
inviare
al
segnalatore
tramite
il
responsabile
della
farmacovigilanza referente (feedback); fornisce continuamente un servizio di
informazioni aggiornate agli operatori sanitari attraverso il responsabile della
farmacovigilanza referente; sviluppa progetti di farmacovigilanza complementari
alla segnalazione spontanea, di monitoraggio continuo in particolari strutture o su
particolari popolazioni, studi di coorte o caso controllo, ed altri; avvia iniziative
(giornate di studio, incontri, etc.) destinate a stimolare la farmacovigilanza, in
ambito sia ospedaliero sia dei medici di medicina generale, con particolare
riguardo al campo dei farmaci antitumorali; elabora eventuali programmi
39
scientifici, con l'obiettivo di identificare e di documentare la frequenza di reazioni
avverse da antiblastici gravi, imprevedibili, a distanza, più o meno conosciute.
Inizialmente la mie indagini si sono concentrate sulla valutazione della
segnalazione spontanea
in
ambito oncologico nella regione Sicilia e
sull’identificazione di criticità come la drammatica sottosegnalazione (solo
quattro segnalazioni nel 2002!) e delle possibili motivazioni del fenomeno. Sono
stati coinvolti i responsabili di farmacovigilanza delle Aziende ospedaliere e ASl
dove sono presenti i maggiori centri oncologici dell’isola e, dove richiesto, si è
proceduto tramite incontri individuali a sensibilizzare gli oncologi sulla
importanza della segnalazione spontanea e ad istruirli sulle modalità di
segnalazione. Particolare attenzione è stata rivolta al RFOM dell’AIFA come
fonte di informazione sulla sicurezza dei farmaci oncologici; si è attivata una
collaborazione con l’Ufficio Sperimentazione e Ricerca dell’AIFA che ha
permesso di acquisire informazioni sulle segnalazioni spontanee tramite registro
inserite dagli operatori sanitari della Regione; confrontando le segnalazioni
presenti nel registro con quelle inserite nella Rete Nazionale di farmacovigilanza,
si è evidenziato che le segnalazioni presenti in rete erano nettamente inferiori a
quelle presenti nel Registro; per recuperarle si è proceduto ad identificare i
segnalatori, che, tramite i responsabili di farmacovigilanza, sono stati sollecitati a
procedere alla segnalazione secondo la normativa vigente. Si è proceduto, ove
richiesto, alla raccolta diretta delle schede uniche di segnalazione dagli operatori
sanitari, in modo da stimolarli ed istruirli sulla importanza e sulle modalità della
segnalazione tramite registro.
40
Particolare attenzione è stata dedicata alla richiesta dell’AIFA di sensibilizzare gli
operatori sanitari interessati alla segnalazione spontanea di osteonecrosi delle ossa
mascellari (Osteonecrosis of the Jaw, ONJ) da bifosfonati, dato che le
segnalazioni presenti nella Rete Nazionale di Farmacovigilanza rappresentano una
minima parte dei casi italiani.
Le segnalazioni spontanee pervenute al centro, raccolte ed archiviate, sono state
valutate caso per caso, anche al fine di identificare eventuali segnalazioni doppie.
La possibile imputabilità dei farmaci nelle ADR è stata stabilita utilizzando
specifici algoritmi, come quello di Naranjo. Si è quindi proceduto alle analisi
quantitative e qualitative dei dati raccolti.
41
RISULTATI
Vengono di seguito illustrati i dati delle segnalazioni spontanee di sospette
reazioni avverse da farmaci in campo oncologico provenienti dalla regione Sicilia
inserite nel periodo compreso tra l’1 gennaio 2008 ed il 31 gennaio 2010 (periodo
di svolgimento della mia attività di indagini del Corso di Dottorato).
Viene in particolare fornita una dettagliata descrizione della tipologia di tali
reazioni avverse, oltre che delle caratteristiche dei pazienti, utilizzando i dati
ottenuti dalla RNF dell’AIFA.
Sono state anche selezionate tutte le segnalazioni di sospette ADR inviate dagli
operatori sanitari della regione Sicilia presenti nella RNF dalla data della sua
istituzione nel novembre 2001 fino al 31 dicembre 2007; questo ai fini di valutare
l’andamento delle segnalazioni nel corso di questo periodo in comparazione con il
periodo 2008-2010. Anche in questo caso si è proceduto all’identificazione delle
schede di sospetta ADR in cui fosse imputato almeno un farmaco antineoplastico,
o un farmaco di supporto nel paziente oncologico, o un farmaco che avesse
indotto neoplasia come sospetta ADR.
Nel periodo novembre 2001-31 dicembre 2010, sono state inserite nella RNF 407
segnalazioni di ADR in ambito oncologico, secondo i criteri sopra menzionati.
Di seguito vengono confrontate per ogni anno, a partire dall’anno 2001 e fino al
2010, il numero di segnalazioni spontanee di sospette ADR in oncologia e il
numero totale delle segnalazioni per tutti i farmaci, provenienti dalla Sicilia
(Tabella 3).
42
Tabella 3 Percentuale delle segnalazioni di ADR in oncologia rispetto alle
segnalazioni totali provenienti dalla Sicilia per anno
2001 2002
N.Report
2
5
oncologici
N. Report Totali 148 265
% Report
oncologici
1,3% 1,9%
rispetto ai report
totali regionali
2003
2004
2005 2006 2007 2008 2009
17
4
14
21
17
50
123
154
355
480
479
472
479
607
636
807
4,8%
0,8%
2,9% 4,4% 3,5% 8,2% 19,3% 19,0%
Nel 2001 la percentuale di segnalazioni di sospette ADR oncologiche provenienti
dalla Sicilia corrispondeva all’ 1,3% del totale delle segnalazioni regionali, mentre
nel 2002 la stessa percentuale era pari a 1,9%. Dopo l’avvio del progetto regionale
(1 gennaio 2003), tale percentuale è lievemente aumentata (4,8% del totale), ma
dati più significativi si sono registrati dopo il rinnovo nel 2008 del Progetto
Regionale per lo sviluppo della farmacovigilanza.
D’altra parte, nel 2008, in Italia, in seguito alle varie iniziative precedentemente
esposte, le segnalazioni spontanee totali di ADR hanno mostrato un rilevante
incremento quantitativo rispetto agli anni precedenti; sono stati infatti inseriti nel
database della rete nazionale 11.493 segnalazioni di sospette reazioni avverse a
farmaci e vaccini. Il tasso di segnalazione a livello nazionale è passato dal valore
di 164,8 segnalazioni per milione di abitanti del 2007 al valore di 192,7 del 2008.
Nel 2009, il numero di segnalazioni è ulteriormente cresciuto (numero totale
14.571) con un tasso di segnalazione di 246 per milione di abitanti. I dati della
Regione Sicilia riflettono questo trend positivo, infatti le segnalazioni di sospette
ADR insorte nel 2008 sono state in totale 607, corrispondenti ad un tasso di
segnalazione di 121 per milione di abitanti; nel 2009 le segnalazioni sono state in
43
2010
totale 636 per la regione Sicilia, corrispondenti ad un tasso di segnalazione di 127
per milione di abitanti; nel 2010 sono state in totale 807 il numero più elevato
dall’inizio del progetto. I numeri regionali sono ancora lontani dal gold standard
previsto dall’OMS.
Il numero di segnalazioni di sospette reazioni avverse occorse in pazienti
oncologici segnalate dagli operatori sanitari della regione Sicilia è cresciuto nel
tempo in linea con i dati regionali. Si è passati da quattro segnalazioni nel 2001 a
154 nel 2010. Nel 2008 sono state riportate 50 segnalazioni di sospette ADR in
oncologia con un incremento in percentuale del 194 % rispetto all’anno
precedente, nel 2009 (n = 124) si è avuto un ulteriore incremento del 148%
rispetto ai dati del 2008, infine nel 2010 si è registrato il più alto numero di
segnalazioni oncologiche da quando è partito il progetto (154 segnalazioni che
corrispondono al 19,0% d i tutte quelle provenienti dalla regione Sicilia).
DISTRIBUZIONE DELLE SEGNALAZIONI IN ONCOLOGIA
SICILIANE
Di seguito è descritta la distribuzione delle segnalazioni di sospette reazioni
avverse in ambito oncologico (rapportate al numero totale di ADR) nelle diverse
strutture sanitarie siciliane (Tabella 4) pervenute all’AIFA nel triennio 20072009. I dati del 2010 vengono riportati successivamente a causa della
rimodulazione della rete ospedaliera i Sicilia.
44
Tabella 4. Distribuzione delle segnalazioni di ADR oncologiche e di ADR totali
negli anni 2007, 2008, 2009 per AUSL/AO/IRCCS
Strutture sanitarie
A.O. Cannizzaro– CT
A.O. Civile M.P.Arezzo –RG
A.O. Garibaldi – CT
A.O. Gravina di Caltagirone (CT)
A.O. Ospedali Civili Riuniti – Sciacca (AG)
A.O. Papardo-Piemonte* (ME)
A.O. S. Elia – CL
A.O. S.Antonio Abate – TP
A.O. S. Giovanni di Dio (AG)
A.O. Umberto I – Enna
A.O. Umberto I – SR
A.O. V. Cervello – PA
A.O. V.Emanuele Ferrarotto S.Bambino – CT
A.O. Villa Sofia CTO – PA
A.O.Vittorio Emanuele III – Gela (CL)
A.R.N.A.S Civico-Di Cristina-M. Ascoli – PA
Azienda Universitaria Policlinico – CT
Azienda Universitaria Policlinico – ME
Azienda Universitaria Policlinico – PA
IRCCS Oasi Maria SS – Enna
Fondazione Ist. San Raffaele Giglio –PA*
IRCCS Neurolesi – Meg
ISMETT – PA*
Totale A.O. e I.R.C.C.S.
A.S.L. AGRIGENTO
A.S.L. CALTANISSETTA
A.S.L. CATANIA
A.S.L. ENNA
A.S.L. MESSINA
A.S.L. PALERMO
A.S.L. RAGUSA
A.S.L. SIRACUSA
A.S.L. TRAPANI
AIFA
Totale A.U.S.L.
Totale complessivo Report oncologici
Totale complessivo
* Strutture abilitate o rimodulate dal 2008
45
2007
1 (16)
0
0
0
0
6
8
16
0
1 (3)
0 (3)
0 (1)
0 (4)
0 (2)
1 (1)
2 (15)
0 (2)
0 (36)
9 (43)
0
14 (156)
1 (49)
0 (4)
1 (74)
0 (4)
0 (84)
1 (67)
0 (28)
0 (2)
0 (10)
3 (322)
17
17 (478)
2008
0 (14)
13 (14)
3 (6)
0
1 (2)
0 (6)
4 (13)
0 (21)
0
0
0 (5)
3 (12)
0 (5)
0
0 (1)
1 (26)
2 (8)
0 (28)
11 (60)
0
3 (3)
0 (1)
41 (225)
2 (65)
0 (4)
1 (59)
0 (10)
2 (94)
1 (90)
1 (40)
0
2 (20)
9 (382)
50
50 (607)
2009
0 (17)
1 (2)
0 (10)
0
0 (4)
0 (3)
0 (2)
1 (13)
0
2 (14)
0 (14)
0 (2)
0
0
0 (1)
29 (52)
0((29)
3 (37)
60 (101)
0(60)
(4)
4 (7)
0 (1)
3 (35)
103 (319)
(103)
6 (85)
7 (28)
5 (63)
0(11)
1 (63)
0 (34)
1 (20)
0 (3)
0 (9)
0 (1)
20 (316)
123
123 (636)
(123)
Tabella 5 Distribuzione delle segnalazioni oncologiche nel 2010 suddivise per
ASP /AO/IRCCS
Strutture sanitarie
A.O. Cannizzaro– CT
A.O. Civile M.P.Arezzo –RG
A.R.N.A.S Garibaldi – CT
A.O. Gravina di Caltagirone (CT)
A.O. Ospedali Civili Riuniti – Sciacca (AG)
A.O. Papardo-Piemonte* (ME)
A.O. S. Elia – CL
A.O. S.Antonio Abate – TP
A.O. S. Giovanni di Dio (AG)
A.O. Umberto I – Enna
A.O. Umberto I – SR
A.O. V. Cervello – Villa Sofia " PA
A.O. V.Emanuele Ferrarotto S.Bambino – CT
A.O.Vittorio Emanuele III – Gela (CL)
A.R.N.A.S Civico-Di Cristina-M. Ascoli – PA
Azienda Universitaria Policlinico – CT
Azienda Universitaria Policlinico – ME
Azienda Universitaria Policlinico – PA
IRCCS Oasi Maria SS – Enna
Fondazione Ist. San Raffaele Giglio –PA*
IRCCS Neurolesi – ME*
ISMETT – PA*
Totale A.O. e I.R.C.C.S.
A.S.P AGRIGENTO
A.S.P CALTANISSETTA
A.S P. CATANIA
A.S P. ENNA
A.S.P MESSINA
A.S.P PALERMO
A.S.P RAGUSA
A.S.P SIRACUSA
A.S.P TRAPANI
AIFA
Totale A.S.P.
Totale complessivo Report oncologici
TOTALE Report RNF
* Strutture abilitate o rimodulate dal 2008
46
2010
0
8
3
0
0
0
0
0
0
0
0
2
4
0
9
1
48
25
0
3
103
6
3
25
4
3
9
0
0
1
51
154
807
Nel 2008 le segnalazioni totali di sospette ADR sono pervenute da 25 strutture
sanitarie comprendenti ASL, Aziende Ospedaliere, IRCCS; le segnalazioni di
ADR oncologiche sono pervenute da 14 strutture e per la maggior parte (82%)
raccolte in ambito ospedaliero. Nel 2009 le segnalazioni totali di sospette ADR
sono pervenute da 27 strutture, mentre le oncologiche da 12 strutture (per l’83 %
ospedaliere); nel 2010 le strutture che hanno inserito reazioni avverse oncologiche
sono state 16, la maggior parte delle segnalazioni sono state raccolte in ambito
ospedaliero 66%. Nel triennio 2008-2010 si assiste così a un progressivo
maggiore coinvolgimento delle diverse strutture siciliane (ASL, Aziende
Ospedaliere, IRCCS) nella segnalazione delle ADR.
Il maggior numero di segnalazioni in oncologia (circa il 76 % del totale) è stato
raccolto in ambito ospedaliero, in particolare dalle seguenti strutture: Policlinico
di Palermo, Policlinico di Messina, A.R.N.A.S Civico-Di Cristina-M. Ascoli e
ASP di Catania.
La provenienza delle segnalazioni non riflette la numerosità e la distribuzione
delle strutture assistenziali oncologiche nell’Isola; per esempio, nel territorio
insistono diverse case di cura ad alta specialità oncologica, ma il numero di
segnalazioni provenienti da esse è molto limitato.
In Sicilia, la patologia iatrogena risulta rilevante in ambito ospedaliero soprattutto
per ciò che concerne le reazioni gravi; ciò non sorprende, poiché come riportato
ampiamente in letteratura, le reazioni avverse rappresentano una causa frequente
di ricovero ospedaliero o di prolungamento dell’ospedalizzazione (15).
47
Di seguito viene descritta in dettaglio anche la distribuzione delle segnalazioni in
oncologia in rapporto alle provincie siciliane 2008-2010 (Tabella 6), riflettendo
solo in parte l’eterogenea organizzazione della rete di assistenza oncologica in
ambito regionale.
Tabella 6. Numero di segnalazioni pervenute negli anni 2008 - 2010 suddivise
per provincia
Provincia
Agrigento
Palermo
Messina
Catania
Ragusa
Enna
Trapani
Caltanissetta
Non definito
Siracusa
Totale
N report N report
2008
2009
3
6
19
96
2
5
6
5
14
2
0
2
2
1
4
7
50
123
N report
2010
6
48
51
33
8
3
1
3
154
La qualità delle segnalazioni
Come già esposto, un parametro per valutare la qualità delle segnalazioni è la
gravità. L’OMS indica infatti che per un efficiente sistema di farmacovigilanza
almeno il 30% delle segnalazioni totali riguardi ADR gravi.
Quindi per quanto riguarda il valore percentuale delle reazioni gravi, in Sicilia, si
è superato il valore di riferimento nei tre anni in esame. Nel 2008, la percentuale
di segnalazioni nella Regione con ADR gravi è stata pari al 33,4% (n=203) delle
totali, mentre nello stesso anno le segnalazioni in oncologia sono risultate per il
48
32% (n=17) gravi. Nel 2009, la percentuale di segnalazioni totali con ADR gravi è
stata pari al 35,4% (n=225), mentre quelle oncologiche sono state per il 62% gravi
(n=76); nel 2010 il 33,4% delle ADR totali (n= 270) ed il 28% (n= 42) di quelle
oncologiche sono risultate gravi. Solo nel 2010, a fronte di un aumento del
numero di segnalazioni in oncologia, si ha una diminuzione della gravità.
L’aumento delle segnalazioni non gravi nel 2010 rispetto al 2009 può essere
legato al fatto che gli operatori sanitari hanno recepito le linee-guida della
legislazione vigente che obbliga gli operatori sanitari a segnalare tutte le sospette
ADR, gravi e non gravi attese e inattese, imputate a farmaci sottoposti a
monitoraggio intensivo; infatti gli antitumorali di recente immissione in
commercio sono inseriti nel RFOM dell’AIFA (12).
Descrizione delle segnalazioni in oncologia siciliane nel triennio 2008-2010
Come indicato precedentemente, le segnalazioni spontanee di sospette ADR in
oncologia dalla regione Sicilia, disponibili presso il “Centro di consulenza ed
informazione sugli effetti tossici da farmaci antitumorali e sulle ADR in pazienti
neoplastici” e utilizzando come fonte la RNF dell’AIFA, dall’1 gennaio 2008 al
31 gennaio 2010, sono state 327. Nello stesso periodo il numero totale di
segnalazioni inserite nella RNF provenienti dalla regione Sicilia è stato di 2050.
49
Caratteristiche dei pazienti
Le segnalazioni di sospette reazioni avverse occorse in pazienti oncologici segnalate
dagli operatori sanitari della regione Sicilia pervenute all’AIFA nel triennio in esame
(2008-2010) hanno coinvolto in leggera maggior misura pazienti di sesso maschile
(181/327, 56,0%) piuttosto che di sesso femminile.
Questo dato, pur tenendo conto del numero relativamente esiguo delle schede,
contrasterebbe con quanto riportato in letteratura relativamente alla maggiore
suscettibilità delle donne a sviluppare ADR. Da uno studio internazionale è risultato che
il sesso femminile ha un rischio di insorgenza di ADR 1,5-1,7 volte superiore rispetto a
quello maschile, probabilmente a causa dell’influenza degli estrogeni sul metabolismo
dei farmaci e della particolare predisposizione delle donne ad eventi avversi di natura
immunologica, a causa della differente attivazione e proliferazione delle cellule T (16).
D’altra parte, le segnalazioni totali di ADR della regione Sicilia pervenute all’AIFA nel
biennio 2008-2009 avevano coinvolto in lieve maggioranza pazienti di sesso
femminile, (675/1243, 54,3%). Il rapporto F/M (overall sex ratio) nei dati regionali era
risultato così pari a 1,2. I dati regionali complessivi relativi alla distribuzione per genere
delle segnalazioni totali del 2010 non sono stati ancora presi in esame.
L’età media dei pazienti coinvolti nelle reazioni avverse oncologiche è stata di 66,0
anni (range di età 15-91), con una frequenza di segnalazioni più elevata nei soggetti di
fascia d’età di 60-69 anni con 100 segnalazioni (30,9%), e di 70-79 anni con 101
segnalazioni (31,2%). Il rapporto F/M è quasi sempre a favore del sesso maschile, ma
con una inversione a favore del sesso femminile nei soggetti di 30-39 anni (Rapporto
F/M: 2,6) e in quelli di età compresa tra i 40 ed i 49 anni (Rapporto F/M: 2,3) (Figura
3).
50
I maschi sono più rappresentati rispetto alle femmine, ma bisogna tenere conto della
differente diffusione della patologia oncologica nei due sessi; infatti, in 57 pazienti i
farmaci imputati nella sospetta ADR hanno avuto come indicazione il cancro della
prostata. L’incremento delle segnalazioni in età prevalentemente geriatrica potrebbe
essere attribuito alla particolare suscettibilità dei relativi pazienti all’insorgenza di
reazioni avverse.
Quest’analisi è naturalmente di valore limitato, poiché con la segnalazione spontanea
non è possibile la valutazione di dati d’incidenza per la mancanza di un denominatore
(es. consumo dei farmaci, incidenza della patologia nella popolazione, ecc.).
Figura 3. Numero di segnalazioni oncologiche (2008-2010) suddivise per sesso e
fascia d’età
120
100
80
M
F
60
40
20
0
15-29
30-39
40-49
50-59
anni
51
60-69
70-79
> 80
La tipologia delle reazioni avverse
Le segnalazioni di sospette ADR sono state classificate secondo il sistema di
codifica WHO-ART dell’OMS. Poiché in ogni segnalazione possono essere
presenti più reazioni avverse, le ADR totali sono state 540 (media: 1,6 eventi per
scheda).
Le reazioni gravi
La normativa vigente stabilisce che gli operatori sanitari hanno l’obbligo di
segnalare tutte le sospette reazioni avverse gravi (per la loro definizione vedi Box
2) o inattese di cui vengano a conoscenza nell’ambito della propria attività e tutte
le sospette reazioni avverse osservate (gravi, non gravi, attese, inattese) relative ai
vaccini ed ai farmaci posti sotto monitoraggio intensivo ed inclusi negli elenchi
pubblicati periodicamente dall’AIFA.
Box 2: Definizione di gravità di una reazione avversa
Le Agenzie Regolatorie internazionali (FDA, EMA) definiscono una reazione
avversa come “grave” se:
- mette in pericolo la vita del paziente;
- richiede l’ospedalizzazione del paziente o prolunga una ospedalizzazione già
avvenuta;
- determina una persistente o significativa disabilità o incapacità;
- provoca anomalie/deficit congeniti nel neonato;
- provoca la morte del paziente.
Le segnalazioni di sospette ADR gravi oncologiche ricevute dal Centro nel
triennio 2008-2010 sono state in totale 135, pari al 41,1% delle schede in ambito
52
oncologico raccolte complessivamente. L’OMS ha stabilito che, in un sistema di
farmacovigilanza efficace, il 30% delle segnalazioni deve riguardare reazioni
avverse gravi. Sotto questo profilo, il Centro risponderebbe quindi a questi
requisiti.
Queste segnalazioni gravi, secondo i criteri esposti nella scheda di segnalazione,
sono state così suddivise: 4 casi letali, 41 casi di ADR che hanno provocato o
prolungato l’ospedalizzazione dei pazienti, 13 che hanno messo in pericolo di vita
il paziente e 70 che hanno causato invalidità grave o permanente. Sette schede
rimanenti hanno riportato reazioni avverse che sono state comunque considerate
potenzialmente gravi o clinicamente rilevanti a giudizio del segnalatore.
I casi fatali, riportati sono stati 5:
bevacizumab
brivudin
addome acuto
agranulocitosi, anemia,
dermatite esfoliativa, diarrea,
stomatite, trombocitopenia
neutropenia febbrile
progressione di malattia
infarto del miocardio
oxaliplatino
lenalidomide
sorafenib
Per brevità, vengono riportate in dettaglio soltanto le ADR oncologiche (triennio
2008-2010) definite come gravi secondo la Critical Term List dell’OMS.
(Tabella 7)
53
Tabella 7. Farmaci maggiormente causa di ADR gravi in oncologia (numero di
segnalazioni ≥ 2) 2008-20010
Farmaci sospetti
ADR gravi
(N. Report TOT)
(N. Report)
Acido zoledronico (53)
Acido pamidronico (5)
Acido ibandronico (3)
Sorafenib (17)
Acido pamidronico (8)
Docetaxel (3)
Bevacizumab (2)
Oxaliplatino (2)
Cetuximab (2)
Gemcitabina (2)
Metotrexato (2)
Lenalidomide (2)
Bicalutamide (2)
Dasatinib (3)
Sunitinib (3)
Erlotinib (3)
osteonecrosi dei mascellari (53)
(in 1 caso il farmaco era associato a sunitinib)
osteonecrosi della mandibola (5)
osteonecrosi della mandibola (2, in un caso il farmaco era
associato ad ac. zoledronico); aftosi orale, emorragia di varici
esofagee e rettorragia (1)
astenia e diarrea (2); infarto miocardico (2); colecistite acuta;
leucopenia e piastrinopenia (1); anemia ipocromica, creatininemia
aumentata, esofagite, vertigine e vomito (1); disturbo dell'equilibrio
idroelettrolitico, febbre e fistola perianale (1); sindrome da
eritrodisestesia palmo-plantare (1); cefalea e eruzione (1);
dermatite, febbre e mucosite orale (1); Astenia aggravata (1);
astenia, ipertensione arteriosa e parestesia (1); sindrome
coronarica acuta (1) ; Colica biliare e disturbo dell'equilibrio
idroelettrolitico NAS (1); disturbo dell'equilibrio idroelettrolitico
NAS (2)
osteonecrosi dei mascellari (8, di cui sei in associazione ad ac.
zoledronico)
fibrillazione atriale e scompenso cardiaco (1); astenia, sensazione
di soffocamento e gonfiore della mucosa (1); dolore lombare,
brividi, incoscienza e tremori (1)
epistassi (1); crisi ipertensiva (1)
neutropenia febbrile (1); brividi, dispnea, ipotensione, dolore e
eruzione cutanea generalizzata (1)
eritema, edema generalizzato e prurito (1); aspergillosi
broncopolmonare invasiva (1)
insufficienza renale acuta (1); collasso cardiovascolare (1)
pancitopenia (2)
Anemia (1); immunoglobulina monoclonale presente (1)
broncospasmo, dispnea e dolori generalizzati (1) ; effetto
farmacologico incompleto (1); dispnea e lesione orale (1)
Dispnea e versamento pleurico (1); ictus ischemico (1); fibrosi
polmonare e insufficienza respiratoria (1)
anemia secondaria e emorragia NAS (1); anemia (1); trombosi
venosa profonda della gamba (1); crisi ipertensiva e sindrome
coronarica acuta (1)
ulcerazione della cute (1); epidermolisi (1); eruzione cutanea (1)
54
Tra le classi di farmaci più frequentemente implicate nelle reazioni avverse
oncologiche segnalate dagli operatori sanitari della regione Sicilia nel periodo in
esame (2008-2010) troviamo i bifosfonati ed alcuni antitumorali a meccanismo
molecolare orientato. In particolare, tra i singoli principi attivi, fra i più
frequentemente imputati vi sono l’acido zoledronico e il sorafenib (acido
zoledronico 53 ADR gravi; sorafenib 17 ADR gravi).
Va detto che questo è stato dovuto anche alla implementazione ed alla
stimolazione attiva della FV in particolari settori (ONJ , osteonecrosi dei
mascellari e attività relative alla RFOM dell’AIFA).
Si evidenziano delle associazioni farmaco-evento di notevole interesse (per la
novità, la frequenza o gravità, ecc.) .
Osteonecrosi dei mascellari da bifosfonati
Uno degli scopi principali di un sistema basato sulla segnalazione
spontanea è quello di generare “segnali”, cioè identificare reazioni avverse
non note o rilevare un aumento della frequenza di reazioni già note, e di
valutare le modifiche del profilo rischio-beneficio di un farmaco nelle reali
condizioni d'impiego, in modo da permettere che in un risk managment plan
possano essere attivate, ove necessarie, le opportune azioni correttive; un
caso esemplare è l’osteonecrosi dei mascellari da bifosfonati.
L’osteonecrosi dei mascellari (ONJ) è una grave reazione avversa, che
colpisce i pazienti esposti al trattamento con bisfosfonati (pregresso od in
atto), in assenza di altre cause riconoscibili.
Le principali società scientifiche internazionali (American Association for
Oral & Maxillofacial Surgery - AAOMS, American Society of Bone and
55
Mineral Research - ASBMR,
Canadian Association for Maxillofacial
Surgery - CAOMS, Commissione CHMO dell’Agenzia Europea per il
framaco -EMA, Commissione Scientifica congiunta giapponese) sostengono
che per poter formulare una diagnosi corretta di ONJ da bifosfonati
(BRONJ) sia necessaria la presenza di osso necrotico esposto in cavo orale
per più di 8 settimane dalla sua identificazione da parte di uno specialista, in
un paziente in terapia con bisfosfonati (precedente o in atto), mai sottoposto
a radioterapia dei mascellari (testa-collo). E’ parere diffuso tra i ricercatori
ed i clinici che questa definizione di malattia abbia in sé una serie di criticità
che ne limitano l’efficacia. Infatti, la presenza di “osso necrotico esposto in
cavo orale” è solo una delle possibili manifestazioni cliniche della malattia;
pertanto, considerare come soggetti affetti da BRONJ solo i pazienti che
presentano osso esposto in cavo orale impedisce la diagnosi di BRONJ in un
numero imprecisato di pazienti con manifestazioni patologiche assimilabili
alla BRONJ, ma in assenza di esposizione ossea clinica (stadio 0) (17).
Nel 70-80% dei casi, l’osteonecrosi dei mascellari da bifosfonati si
manifesta inizialmente con una mancata guarigione o con un ritardo nel
processo di guarigione della mascella o della mandibola dopo un’estrazione
dentaria o in seguito ad un qualsiasi altro intervento di chirurgia orale. Gli
stadi precoci della patologia sono caratterizzati dalla mancanza di sintomi e
dall’assenza di alterazioni radiologiche; in questa fase il dolore può essere
dovuto ad infezioni della porzione di osso esposta. Nel 25-40% dei casi
l’osteonecrosi della mascella insorge spontaneamente senza alcuna
correlazione a particolari traumi. In questi casi il primo e più comune
56
sintomo è dato da una sensazione sgradevole alla bocca che si manifesta con
intorpidimento, parestesia e bruciore. Si verifica poi una graduale
alterazione della mucosa orale con formazione di ulcere persistenti. In
questa fase si può palesare un forte dolore dovuto ad infezioni della
porzione ossea necrotizzata indotta dalla flora batterica orale. I segni e
sintomi includono dolore, edema e infezione dei tessuti molli, caduta dei
denti, drenaggio e osso esposto, il quale si può verificare spontaneamente o
più frequentemente nel sito di una precedente estrazione dentaria. Una delle
peculiarità della BRONJ è la localizzazione quasi esclusiva alle ossa
mascellari. Le possibili cause di questo fenomeno non sono ancora del tutto
conosciute, ma sono state avanzate ad oggi una serie di ipotesi: elevato
turnover osseo dei mascellari rispetto al restante scheletro, per la presenza
degli elementi dentali e per le funzioni dell’apparato stomatognatico (vale
adire,
masticazione,
deglutizione,
fonazione);
elevata
e
peculiare
vascolarizzazione dei mascellari; presenza di un esile rivestimento mucoperiosteo a protezione del sottostante tessuto osseo, facilmente soggetto a
traumatismo; presenza di una flora batterica residente in cavo orale; la
caratteristica interfaccia dento-alveolare, che predisporrebbe in caso di
malattia
dento-parodontale
(carie,
lesioni
e
ascessi
periapicali,
parodontopatia) o chirurgia dentale all’esposizione del tessuto osseo
sottostante (18). Il coinvolgimento della mascella rappresenta una differenza
notevole tra l’osteonecrosi da bifosfonati e l’osteoradionecrosi, una forma di
osteonecrosi secondaria a radioterapia per il trattamento del carcinoma della
57
testa e del collo. Nel 95% dei casi tale forma di osteonecrosi coinvolge la
sola mandibola (19).
L’osteonecrosi dei mascellari (ONJ), nosologicamente inquadrata tra le
osteochemonecrosi, rappresenta la principale complicanza a medio-lungo
termine descritta nei pazienti trattati con bifosfonati (BF), analoghi
strutturali del pirofosfato inorganico, con una stretta affinità per la
componente minerale dell’osso. I BF sono analoghi strutturali del
pirofosfato inorganico, una sostanza presente nei liquidi biologici capace di
inibire l'aggregazione e la dissoluzione dei cristalli di fosfato di calcio in
vitro e la calcificazione ectopica in vivo. Il pirofosfato previene la
calcificazione dei tessuti molli e svolge un ruolo di regolazione nei processi
di mineralizzazione ossea. I BF si differenziano dal pirofosfato per la
sostituzione dell'atomo di ossigeno compreso tra i due gruppi fosfato (P-OP), con un atomo di carbonio (P-C-P) geminale che lega due gruppi
fosfonati e due catene R1 e R2, la prima responsabile dell’affinità del
farmaco per l’idrossiapatite, la seconda della potenza dello stesso; questa
modifica rende tutti i BF resistenti alla degradazione biologica operata dalle
pirofosfatasi endogene e, quindi, utilizzabili in clinica.
In base alla presenza/assenza nella catena R2 di un gruppo aminico, i bisfosfonati
vengono classificati in aminobisfosfonati e non aminobifosfonati. I non amino,
bifosfonati di prima generazione (etidronato, clodronato e tiludronato), hanno una
scarsa potenza, vengono metabolizzati in un analogo dell’ATP non idrolizzabile
che si accumula negli osteoclasti e induce apoptosi . Gli aminobifosfonati hanno
un’alta affinità per il tessuto osseo e agiscono inibendo la farnesil pirofosfato
58
sintasi (FPP), un enzima chiave nella via del mevalonato a colesterolo e dei lipidi
isoprenoidi, necessari per la prenilazione di proteine essenziali per gli osteoclasti.
L'inibizione di questo enzima provoca anche un accumulo di isopentenildifosfato
(IPP), che è incorporato in un analogo di ATP che può indurre apoptosi degli
osteoclasti. Gli aminobifosfonati possono essere classificati in: bifosfonati di
seconda generazione che contengono un atomo di azotato nella catena laterale
(pamidronato, alendronato, ibandronato), da 10 a 100 volte più potenti dei
composti di prima generazione; bifosfonati di terza generazione (risedronato e
zoledronato), che contengono un gruppo amminico all’interno di un anello
eterociclico, e sono 10.000 volte più potenti rispetto a quelli di prima generazione
(20).
Per la loro capacità di inibire l’attività osteoclastica e impedire, quindi, il
riassorbimento osseo, i bifosfonati sono stati inizialmente impiegati nel
trattamento delle patologie ossee e principalmente nella cura dell’osteoporosi.
Tuttavia, nel tempo, il loro impiego in patologie oncologiche come il mieloma
multiplo e l’ipercalcemia neoplastica è divenuto sempre più frequente fino ad farli
attualmente inserire in diversi protocolli terapeutici di pazienti con metastasi
ossee. Il tessuto osseo è spesso sede di metastasi di neoplasie che hanno origine in
altre sedi come la mammella, la prostata o il polmone. In questi casi, i valori della
calcemia si elevano e il tessuto osseo presenta alterazioni metaboliche che
possono condurre a processi di osteolisi e conseguente fragilità della struttura
scheletrica e a rischio di fratture spontanee. Gli aminobifosfonati, in particolare,
più potenti e maggiormente selettivi rispetto agli altri BF, sarebbero anche in
grado di inibire l’angiogenesi neoplastica e la proliferazione delle cellule tumorali
59
e sono utilizzati correntemente con grande efficacia nel trattamento e/o nella
prevenzione delle fratture patologiche in pazienti con mieloma multiplo, delle
metastasi ossee e dell’ipercalcemia maligna (tumor-induced), associata ad alcuni
tumori solidi (come Ca prostatico, Ca mammario, Ca polmonare), nonché indicati
nel trattamento dell’osteoporosi e di alcuni disordini ossei quali il morbo di Paget.
Nonostante
i
riconosciuti
benefici,
per
ragioni
intrinseche
alla
loro
farmacodinamica, la loro somministrazione può associarsi a gravi quadri di
osteonecrosi dei mascellari sine restitutio ad integrum, che generalmente si
sviluppano in seguito a traumi o procedure chirurgiche invasive come estrazioni
dentarie.
A partire dal 2002 sono stati pubblicati in letteratura diversi report sulla possibile
correlazione tra l’uso di bifosfonati e la comparsa di necrosi avascolare della
mandibola. Wang e collaboratori, per primi, hanno descritto 3 casi di osteonecrosi
in donne sottoposte a chemioterapia per cancro metastatico della mammella in
trattamento anche con pamidronato; in due casi l’evento è insorto dopo estrazione
dentaria, mentre nel terzo caso si è sviluppato spontaneamente. Gli autori hanno
attribuito lo sviluppo di osteonecrosi all’utilizzo dei bifosfonati.
Contemporaneamente, Marx e collaboratori hanno segnalato 36 casi di
osteonecrosi avascolare in pazienti in trattamento con acido pamidronico o
zoledronico per cancro metastatico, mieloma multiplo ed osteoporosi, nel 78% dei
casi conseguenti ad estrazione dentaria e nel rimanente 22% dei casi insorti
spontaneamente. Ulteriori 63 casi sono stati descritti da Ruggiero e collaboratori
nel 2004, 56 dei quali relativi a pazienti in terapia con bifosfonati endovena nel
corso di chemioterapia antitumorale e 7 relativi a soggetti in trattamento con
60
bifosfonati per via orale per osteoporosi. Le lesioni si sono manifestate più
frequentemente a seguito di estrazione dentale (21-24).
Poiché per il pamidronato e per lo zoledronato tale complicanza non era stata
osservata durante i trial clinici pre-marketing, nel 2004 l’azienda produttrice di
entrambi i farmaci, ha emesso delle linee guida post-marketing sull’osteonecrosi
della mascella (25).
Da allora sono stati descritti in letteratura numerosi casi di osteonecrosi
soprattutto nei pazienti oncologici sottoposti alla somministrazione endovenosa di
pamidronato e/o zoledronato; un numero sempre crescente di casi viene riportato
tra i pazienti che assumono bifosfonati per via orale (alendronato o risedronato)
per il trattamento dell’osteoporosi o del morbo di Paget .
Sono da ritenersi a potenziale rischio di BRONJ: pazienti oncologici ed
ematologici trattati con somministrazioni mensili di bifosfonati ev (pamidronato,
acido zoledronico, ibandronato) per lesioni scheletriche (è questa la categoria cui
appartiene il maggior numero di casi di ONJ riportati); pazienti oncologici trattati
con BF per os (segnalati casi sporadici); pazienti non oncologici trattati con BF
per os (prevalentemente per osteopenia/osteoporosi), in genere sottoposti a
trattamenti prolungati (in genere > 2-3 anni di trattamento) e con possibili fattori
di rischio concomitanti. Al momento non sono disponibili stime di incidenza della
BRONJ. Nei diversi report pubblicati (studi di coorte; serie di casi) è stata stimata
una frequenza di BRONJ che varia da meno dell’ 1% a più del 12% tra i pazienti
con tumore o mieloma trattati con amino-BF per via endovenosa. Sono pochissimi
i dati di incidenza basati su dati raccolti sistematicamente in popolazioni più
ampie (26).
61
Alla luce dei dati in letteratura (stime di frequenza in popolazioni osservate
e rischio cumulativo, quando riportato), si può valutare che il rischio
mediano di BRONJ dopo trattamento prolungato con aminobifosfonati ev in
pazienti onco-ematologici possa oscillare tra 1% e 10% a 2 anni dall’inizio
del trattamento, con le seguenti precisazioni:
a) il rischio risulta più elevato quanto più alta è la dose totale di
farmaco somministrato (ma vi sono casi ad esordio precoce, dopo
poche somministrazioni);
b) sono al momento da considerare categoria a rischio anche i soggetti
che sospendono gli amino BF, non essendo stato ancora dimostrato
se il rischio di BRONJ diminuisca con la sospensione del
trattamento;
c) il rischio sembra più alto, pur in assenza di studi randomizzati di
confronto, per lo zolaedronato rispetto al pamidronato, mentre sono
insufficienti i dati per l’ibandronato;
d) il rischio sembra più elevato per i pazienti affetti da mieloma rispetto
a quelli trattati per metastasi ossee da carcinoma prostatico e
carcinoma mammario; sono sporadici invece i casi segnalati in
pazienti affetti da altri tumori (polmone, rene, pancreas, ecc.)
Il meccanismo mediante il quale si sviluppa l’ONJ durante trattamento con i
bifosfonati non è ancora stato chiarito. Una spiegazione potrebbe essere data dalla
potente inibizione mediata dai bifosfonati sugli osteoclasti, con diminuzione del
riassorbimento e inibizione del rimodellamento osseo, meccanismi essenziali nel
62
mantenere la normale omeostasi ossea. Con l’attivazione degli osteoclasti,
vengono inoltre rilasciate numerose citochine e fattori di crescita nella matrice
circostante, essenziali per la modulazione dello sviluppo di nuovo tessuto osseo.
L’inibizione della formazione di nuovo tessuto potrebbe interferire sulla qualità
dell’osso durante la sua crescita e durante la guarigione delle fratture. In uno
studio recente, i bifosfonati hanno evidenziato la capacità di inibire in vivo e in
vitro le cellule endoteliali con diminuzione della loro proliferazione, un aumento
del tasso di apoptosi e una diminuzione della formazione dei capillari. Si
dimostrava infatti una marcata riduzione del numero dei vasi sanguigni nel
midollo osseo dopo trattamento con bifosfonati rispetto al dato bioptico pretrattamento. I bifosfonati hanno dimostrato di indurre una significativa
diminuzione dei livelli di VEGF nei pazienti con tumore della mammella e
metastasi ossee. Le proprietà anti-angiogenetiche dei bifosfonati possono spiegare
le apparenti variazioni ischemiche notate in mandibole e mascelle dei pazienti
trattati (26- 28).
I fattori di rischio che possono favorire l’insorgenza e/o la progressione
dell’osteonecrosi dei mascellari legata all’assunzione di bifosfonati sono in parte
sconosciuti: il CHMP (Comitato scientifico dell’Agenzia per i medicinali per uso
umano) dell’EMA ha affermato nel 2009 che ulteriori ricerche sui fattori di
rischio sono necessarie e che a tal fine potrebbe essere utile istituire un registro
europeo di raccolta delle informazioni sui casi documentati di tale evento avverso.
Sono stati individuati come possibili fattori di rischio associati allo sviluppo
di osteonecrosi fattori farmaco-correlati, demografici, locali e sistemici (2931):
63
FATTORI FARMACO-CORRELATI:
dose cumulativa del bifosfonato;
potenza del bifosfonato; lo zoledronato è più potente rispetto
al pamidronato, più potente a sua volta dei bifosfonati orali;
in un recente studio, l’ibandronato assunto per via
endovenosa è risultato essere un determinante meno potente
del pamidronato ai fini dell’insorgenza di ONJ;
modalità di somministrazione: rischio maggiore di ONJ per
i soggetti che assumono BP per via endovenosa;
durata della terapia: una durata maggiore è associata ad un
incrementato rischio di insorgenza dell’evento avverso;
recenti evidenze suggeriscono che presentano maggiore
rischio di ONJ soggetti che hanno assunto BF per via
endovenosa per almeno 12 mesi e BF per via orale per
almeno 36 mesi (sebbene un ridotto numero di pazienti
abbiano
assunto
il
farmaco
nelle
due
modalità
di
somministrazione per una minore durata di quella citata);
FATTORI SISTEMICI:
malattia di base per assunzione dei BF (neoplasia
vs osteoporosi), patologie associate, terapie concomitanti (per es..
uso cronico di steroidi), livelli di metabolismo osseo, immunodeficit,
coagulopatie.
64
FATTORI
LOCALI:
Chirurgia dento-alveolare (e.g. avulsioni
dentarie, implantologia, chirurgia periapicale, chirurgia parodontale),
fattori anatomici (tori mandibolari o mascellari, cresta milojoidea
molto rappresentata, esostosi ossee), traumi alle ossa mascellari,
parodontopatia
cronica,
infezioni
odontogene
(ascesso
parodontale, ascesso endodontico), lesioni endo-perio, protesi
incongrue, scarsa igiene orale, tabagismo e consumo di alcool,
precedenti episodi di osteonecrosi/osteomielite delle ossa mascellari.
I dati della Rete nazionale di Farmacovigilanza
Negli ultimi anni anche nel nostro Paese si sono moltiplicate le segnalazioni
spontanee di osteonecrosi da bifosfonati, anche se si stima che il numero di
segnalazioni presenti nella Rete Nazionale di Farmacovigilanza sia ancora
notevolmente inferiore ai casi realmente occorsi. Nella Rete Nazionale di
Farmacovigilanza, prendendo in considerazione le segnalazioni con ADR insorte
dal 2001 fino a giugno 2010, sono state individuate 1176 segnalazioni di ADR da
bifosfonati, somministrati sia per via endovenosa sia per via orale. Poiché
l’osteonecrosi da bifosfonati è una complicanza relativamente recente di cui non
esiste ancora una definizione accurata e concorde sulla diagnosi, sono state prese
in esame tutte le segnalazioni da bifosfonati le cui ADR riguardavano l’apparato
dentale e i cui sintomi potevano essere correlati alla patologia in questione;
quindi, oltre alle osteonecrosi specificamente descritte, sono state considerate
anche l’osteomielite, l’ascesso dentale, il gonfiore gengivale, la necrosi asettica,
65
patologie non specificate ai denti o perdita dei denti, ecc. Sono state individuate,
nel periodo in esame, 639 segnalazioni riferibili ad osteonecrosi della mandibola
da bifosfonati, pari al 54% del totale delle segnalazioni di ADR da bifosfonati.
Bisogna ancora ribadire che in Italia esiste una sottostima delle segnalazioni di
ADR da farmaci in quanto esse provengono da pochi centri e il loro numero
risulta inferiore agli standard europei. E’ interessante analizzare l’andamento
temporale delle segnalazioni di osteonecrosi da bifosfonati presenti nella rete
nazionale di farmacovigilanza (Tabella 8): nel 2002 la comunità scientifica fu
allertata per la prima volta sulla possibile associazione tra l’impiego di acido
zoledronico e pamidronico somministrati per via endovenosa e l’insorgenza di
osteonecrosi della mandibola (Report Novartis), in seguito nel 2003 furono
pubblicati diversi casi inerenti la reazione avversa tanto da spingere l'azienda
produttrice a pubblicare nel 2004 una dear doctor letter concordata con la FDA
(32); nonostante questa allerta nella RNF italiana erano presenti nel 2002 solo 3
segnalazioni di ONJ da bifosfonati, 2 nel 2003 e 19 nel 2004, dati poco
significativi considerando che i farmaci imputati, i bifosfonati, nel 2003 erano
stati inseriti nell’elenco dei farmaci sottoposti a monitoraggio intensivo per i quali
si richiede di segnalare tutte le sospette reazioni avverse, anche le non gravi e
attese. L’ EMA in seguito ha adottato alcuni provvedimenti regolatori consistenti
nella modifica del Riassunto delle Caratteristiche del Prodotto dei farmaci (RCP)
a base di bifosfonati (acido zoledronico; acido pamidronico; acido ibandronico;
acido alendronico e vitamina D3; acido alendronico) somministrati per via
parenterale e per via orale con l’inserimento di informazioni sul rischio di
osteonecrosi e l’Agenzia Italiana del Farmaco (AIFA) ha emanato una
66
determinazione di modifica degli stampati dei bifosfonati (Gazzetta Ufficiale n.
267 del 16 novembre 2006) che riportano come l’osteonecrosi dei mascellari sia
possibile anche in caso di terapia per osteoporosi; infine nel settembre 2009 il
Ministero del Lavoro, della Salute e delle Politiche Sociali ha emesso la
“Raccomandazione
(n.10)
per
la
prevenzione
dell’osteonecrosi
della
mascella/mandibola da bifosfonati”. Nella Rete Nazionale di Farmacovigilanza,
nel 2006 si è osservato un incremento del numero delle segnalazioni, indice di un
maggiore recepimento delle indicazioni di sicurezza da parte degli operatori
sanitari e una maggiore consapevolezza di questa patologia iatrogena. Tuttavia, il
numero di segnalazioni è rimasto sempre basso. Infine nel 2009 in occasione di un
Congresso, tenutosi ad Alessandria, è emerso che le segnalazioni di Osteonecrosi
dei mascellari inserite nella Rete Nazionale di Farmacovigilanza (RNF)
rappresentavano solo una minima parte dei casi italiani; di conseguenza l’AIFA
ha invitato tutti i responsabili di farmacovigilanza delle strutture pubbliche (ASL,
AO, IRCS, Regioni, Centri Regionali) a sensibilizzare gli operatori sanitari al fine
di recuperare nel più breve tempo possibile i casi di ONJ mancanti e inserirli nella
RNF. Nel 2009 si è avuto il numero più alto di segnalazioni di ONJ da bifosfonati,
vale a dire 231 segnalazioni, di cui il 35% provenivano da operatori sanitari della
regione Sicilia.
67
Tabella 8. Andamento temporale delle segnalazioni di ONJ da BF nella RNF
Anno
inserimento in
RNF
N Report
ONJ da BF
in RNF
N Report
ONJ da BF
SICILIA
2001
2002
2003
2004
2005
2006
2007
2008
2009
2010
Totale
0
3
2
19
69
116
79
76
231
0
0
0
0
2 (1,8%)
15 (13,6%)
0
2 (1,8%)
81 (74%)
10 (9%)
110
N Report ONJ
SICILIA /
N Report ONJ in
RNF
1,4%
12,9%
2,6%
35%
Nella rete nazionale di farmacovigilanza dal 2001 al 31 gennaio 2010 sono state
inserite 136 segnalazioni di ADR da bifosfonati provenienti dagli operatori
sanitari della regione Sicilia, di cui 110 (80,9%) segnalazioni di osteonecrosi da
bifosfonati.
L'andamento delle segnalazioni di ONJ in Sicilia è stato di n. 2 nel 2005, n. 15 nel
2006 , 0 nel 2007, n.81 nel 2009 e n.10 nel 2010. Il Progetto Regionale di FV, che
aveva già in precedenza contribuito significativamente al riconoscimento della
ONJ da bifosfonati, nel 2009, in risposta alle richieste dell’ AIFA, ha provveduto
mediante il Centro sulle ADR in oncologia ad individuare le strutture di
riferimento per la prevenzione, diagnosi e terapia dell’ONJ presenti in Sicilia ed a
sensibilizzarle sulla necessità di segnalare i casi di ONJ da
bifosfonati. Il
riscontro è stato positivo sia in termini di numerosità che di qualità delle
segnalazioni raccolte. Si è rilevata inoltre una latenza di tempo tra la data di
insorgenza dell'evento avverso e la comunicazione dello stesso: le prime
68
segnalazioni di ONJ presenti in RNF provenienti dalla regione Sicilia sono state
inserite nel 2005, mentre se consideriamo la data di insorgenza dell’evento i primi
casi si sono verificati nel 2003. Questo può indicare che gli operatori sanitari non
erano ancora in grado di associare l’evento ONJ all’assunzione di bifosfonati. La
maggior parte delle ADR sono state segnalate dopo anni dalla data di insorgenza:
degli 81 casi del 2009 solo 9 erano insorti nello stesso anno. Tuttavia, nel 2010,
tutti i casi segnalati sono insorti nell’anno, indicando che gli operatori sanitari, in
particolare gli odontoiatri, sono ormai in grado di diagnosticare precocemente
l’evento e inseriscono la segnalazione spontanea nella loro pratica clinica
(Tabella 9).
Tabella 9. Andamento temporale delle segnalazioni di ONJ da Bifosfonati
siciliane
Anno
ONJ - Anno
insorgenza ADRs
ONJ - Anno
inserimento in RNF
Tutti i reports da PB Anno inserimento in
RNF
2001
2002
2003
2004
2005
2006
2007
2008
2009
2010
Totale
0
0
6
9
23
15
19
21
5
10
110
0
0
0
0
2
15
0
2
81
10
110
3
2
3
4
4
16
1
9
84
11
136
69
La RNF ha raccolto svariate segnalazioni (110) di osteonecrosi da bifosfonati per
uso endovenoso e anche alcune da bifosfonati per via orale. Ad oggi l’acido
zoledronico è stato imputato nel 72% delle segnalazioni, l’acido pamidronico nel
11,2% dei casi, l’acido alendronico nel 22,4% , l’acido clodronico nel 4,7%,
l’acido risedronico nell’1,9% e l’acido ibandronico nel 5,4%; nelle schede sono
talvolta presenti più bifosfonati, quindi sommando tali percentuali si ottiene un
numero maggiore di 100. I pazienti coinvolti sono stati 81 femmine e 21 maschi
(rapporto femmine/maschi 4,2) in accordo a quanto riportato in letteratura dove il
sesso femminile è fattore di rischio per l’evento (Tabella 10). In relazione alla
gravità, il 94% delle 110 segnalazioni riguarda ADR gravi (99 con invalidità
grave o permanente) e non gravi solo per il 5%. Il 68% delle segnalazioni ha
riportato come esito “non ancora guarito”, quindi la sospetta ADR è stata
invalidante e non si è risolta nella maggior parte dei casi, anche dopo la
sospensione del farmaco.
70
Tabella 10 . Le segnalazioni caratteristiche
N. Segnalazioni
Sesso
Età
Acido Zoledronico ev
PATOLOGIA
NEOPLASTICA
79
OSTEOPOROSI
58 F-21 M
29 F
41-91 (media 67)
54-83 (media 69)
60
1
29
Acido Risedronico os
2
Acido Pamidronico ev
1
1
Acido Ibandronico os
2
Acido Clodronico im
3
Acido Alendronico os
16
Acido Alendronico + Colecalciferolo os
2
Acido Alendronico+ Colecalciferolo os,
Acido Alendronico os
1
Acido Alendronico+ Acido Clodronico os
1
Acido Pamidronico ev + Acido Zoledronico ev
10
Acido Zoledronico ev+
Acido Alendronico os
1
Acido Zoledronico ev+
Acido Ibandromico os
2
Acido Zoledronico ev+
Sunitinib os
1
Acido Zoledronico,
Acido Alendronico + Colecalciferolo
1
SENZA INDICAZIONE
3
71
Le indicazioni d’uso per i bifosfonati sono state rappresentate da osteoporosi (29),
metastasi ossee (24), cancro della mammella (22), mieloma multiplo (19), cancro
della prostata (6), carcinoma a cellule renali (2), plasmocitosi (1), tumore maligno
(1), tumore maligno al fegato (1), cancro del retto (1), adenocarcinoma polmonare
metastatico (1), mentre in tre segnalazioni non erano riportate. Nel 70% delle
segnalazioni di ONJ l’indicazione terapeutica d’uso dei bifosfonati era
oncologica, nel 26% il trattamento dell’osteoporosi. La provenienza delle
segnalazioni era nel 90% dei casi da medici ospedalieri e si concentravano in tre
Aziende dell’isola; è interessante notare che i segnalatori nella quasi totalità dei
casi sono stati i clinici (odontoiatri) preposti alla diagnosi e cura della ADR e non
i prescrittori dei bifosfonati. Gli oncologi e ematologi sono stati scarsamente
rappresentati.
E’ interessante notare come in una segnalazione di ONJ sia stato imputato come
sospetto, in associazione all’acido zoledronico, anche il sunitinib, in 4 sia stato
riportato come farmaco concomitante la talidomide ed in una il bevacizumab.
A questo proposito, recentemente l’AIFA ha pubblicato 2 note informative
importanti su informazioni di sicurezza relative il sunitinib ed il bevacizumab (3334):
Casi di osteonecrosi della mascella sono stati segnalati in pazienti con
tumore trattati con bevacizumab o sunitinib; nella maggior parte dei casi
segnalati
i
pazienti
avevano
ricevuto
precedentemente
contemporaneamente un trattamento con bifosfonati per via endovenosa.
72
o
Il trattamento con sunitinib o bevacizumab può essere un fattore di rischio
aggiuntivo per lo sviluppo dell’osteonecrosi della mascella.
Il rischio potenziale deve essere considerato in particolar modo quando
sunitinib
o
bevacizumab
e
i
bifosfonati
sono
somministrati
contemporaneamente o in sequenza. Prima del trattamento con questi
farmaci si deve considerare l’opportunità di una visita odontoiatrica e di
appropriate cure odontoiatriche preventive. Nei pazienti che hanno
ricevuto precedentemente o che sono in trattamento con bifosfonati e.v.
dovrebbero essere evitate, se possibile, procedure dentistiche invasive.
Di fatto, in letteratura è stato riportato il possibile aumento del rischio di ONJ da
BF con l’uso combinato di farmaci anti-angiogenetici, come il bevacizumab ed il
sunitinib, indicando che esso potrebbe risultare più o meno rilevante e
significativo a seconda del tipo di tumore (35-37). In più, alcuni “case report”
hanno indicato che anche l’uso isolato di farmaci oncologici anti-angiogenetici,
come lo stesso bevacizumab ed il sunitinib, potrebbe essere causa di ONJ,
spingendo a mettere sotto osservazione sotto questo profilo altre molecole dotate
di attività biologica potenzialmente anti-angiogenetica, come il sorafenib, la
talidomide, gli inibitori di mTOR, il cetuximab, il panitumumab ed altri agenti
attualmente sottoposti a sperimentazione clinica (38-40). L’esistenza di un rischio
per l’ONJ associato agli anti-angiogenetici (da soli ed in associazione a BF) e
l’entità di questo devono però essere definitivamente stabiliti, anche se questo non
risulta facile per l’esistenza di una serie di fattori (per esempio, data la sostanziale
irreversibilità della ONJ, gli effetti del “dechallenge” non rappresentano spesso un
73
elemento sicuro per stabilire la responsabilità di un trattamento nell’insorgenza
della stessa).
Nonostante il limitato numero di segnalazioni di osteonecrosi, comunque in media
superiore a quello nazionale, si possono riscontare nelle caratteristiche
demografiche dei pazienti e nei farmaci imputati i fattori di rischio riportati nella
letteratura internazionale per l’osteonecrosi dei mascellari da bifosfonati. Per
quanto riportato sull’esperienza siciliana in termini di segnalazioni di ONJ, ormai
in media superiore a quello nazionale, si può chiaramente evincere come
l’implementazione della FV possa decisamente contribuire a:
definire
l’importanza di una patologia iatrogena emergente e le sue caratteristiche in
termini di presentazione clinica e di fattori di rischio, con indubbie possibili
positive ricadute in termini di prevenzione e contenimento della stessa.
Sorafenib e infarto del miocardio/sindrome coronarica acuta
L'introduzione degli agenti antineoplastici a bersaglio molecolare orientato (con
un target singolo o con target multipli) ha reso più complesso lo scenario della
terapia antitumorale per svariate ragioni. A differenza della maggior parte dei
farmaci convenzionali, che agiscono con meccanismi scarsamente selettivi, tali
agenti dovrebbero interferire con alterazioni genetiche specifiche delle cellule
cancerogene. Tuttavia, contrariamente alle attese iniziali, la loro tossicità può
coinvolgere alcuni tessuti normali in quanto, per esempio, questi esprimono gli
stessi target contro cui i nuovi agenti sono diretti (si veda per esempio la tossicità
cutanea dei farmaci diretti verso l’EGFR). Sono state documentate anche forme di
74
tossicità cardiovascolare, tra cui si annoverano aritmie cardiache, malattia
ischemica, ipertensione e eventi tromboembolici (41).
La reale spiegazione del verificarsi di questa tossicità cardiovascolare non è stata
completamente definita, ma può essere causata da molteplici motivi. Tuttavia, per
quanto concerne gli inibitori multichinasici sunitinib e sorafenib, i meccanismi
della
loro
tossicità
cardiaca
potrebbero
riflettere
effetti
"off-target"
(coinvolgimento di bersagli non rilevanti ai fini dell’attività antitumorale),
essendo dei composti ad attività pleiotropiche (42).
Nella RNF, in base alla distribuzione delle reazioni per classe sistemico-organica
(SOC), sono presenti 24 segnalazioni di sospetti di patologie cardiache da
sorafenib, tra cui sette di infarto del miocardio; le schede provenienti dalla regione
Sicilia riguardano 2 segnalazioni di infarto del miocardio e una di sindrome
coronarica acuta. Nonostante il numero limitato dei dati, si evidenzia che il
sistema di segnalazione spontanea in Sicilia sia in grado di identificare reazioni
avverse gravi e poco rappresentate in termini numerici nella banca dati nazionale.
In Sicilia, le segnalazioni di patologia cardiache da agenti antitumorali
(convenzionali e non) sono complessivamente 10 e includono anche una
segnalazione riguardante una crisi ipertensiva e sindrome coronarica acuta causata
da sunitinib, un altro inibitore multichinasico. Di seguito vengono presentati casi
nel dettaglio i 4 casi di tossicità cardiaca associati al sorafenib ed al sunitinib.
75
Segnalazione di infarto del miocardio dopo uso di sorafenib
E’ stato segnalato il caso di una paziente di 74 anni di età, di origine mediterranea,
andata incontro a infarto del miocardio dopo uso di sorafenib (Nexavar), alla dose
di 800 mg/die per via orale (durata dell’uso dal 18, 11, 2008 al 10, 01, 2009) per il
trattamento di epatocarcinoma non resecabile. La reazione ha portato al decesso
della paziente in data 16, 01, 2009. La paziente assumeva come farmaci
concomitanti Cardioaspirina 100 mg per os e Lobivon 5 mg (Nebivololo
cloridrato) mezza compressa per os al giorno.
Il farmaco sospetto, sorafenib, era stato sospeso senza miglioramento della
reazione e non era stato ripreso. In base all’algoritmo di Naranjio l’imputabilità
del sorafenib nella reazione avversa è risultata “possibile”.
Segnalazione di infarto miocardico acuto anteriore dopo uso di sorafenib
E’ stato segnalato il caso di un paziente di 74 anni di età andato incontro in data
18, 10, 2009 a infarto miocardico acuto anteriore dopo uso di Sorafenib
(Nexavar), alla dose di 400 mg/die per via orale (durata dell’uso dal 10, 07, 2009
al 18, 10, 2009) per il trattamento di epatocarcinoma. La reazione, giudicata
grave, con ospedalizzazione o prolungamento dell’ospedalizzazione, è stata
trattata con eparina a basso peso molecolare e si è risolta con postumi.
Il farmaco sospetto, sorafenib, sospeso con miglioramento della reazione, non è
stato ripreso. In base all’algoritmo di Naranjio l’imputabilità del sorafenib nella
reazione avversa è risultata “probabile”.
76
Segnalazione di sindrome coronarica acuta dopo uso di sorafenib
E’ stato segnalato il caso di un paziente di 53 anni di età, caucasico, andato
incontro in data 03, 01, 2010 a sindrome coronarica acuta dopo uso di sorafenib
(Nexavar), alla dose di 800 mg/die per via orale (durata dell’uso dal 14, 12, 2009
al 03, 01, 2010) per il trattamento di epatocarcinoma. La reazione, giudicata
grave, con ospedalizzazione o prolungamento dell’ospedalizzazione, è stata
trattata con infusione di nitrati e terapia con eparina a basso peso molecolare. Il
paziente assumeva come farmaco concomitante Bisoprololo (Congescor) 1,25 mg
per os.
Il farmaco sospetto, sorafenib, sospeso con miglioramento della reazione, non è
stato ripreso. In base all’algoritmo di Naranjio l’imputabilità del sorafenib nella
reazione avversa è risultata “probabile”.
Segnalazione di sindrome coronarica acuta in corso di crisi ipertensiva
dopo uso di sunitinib
E’ stato segnalato il caso di un paziente di 72 anni di età, andato incontro in data
05, 12, 2010 a sindrome coronarica acuta in corso di crisi ipertensiva dopo uso di
sunitinib (Sutent), alla dose di 50 mg/die per via orale (durata dell’uso dal 12, 11,
2009 al 06, 012, 2010) per il trattamento di carcinoma del rene. La reazione,
giudicata grave, con ospedalizzazione o prolungamento dell’ospedalizzazione, è
stata gestita con infusione di nitrati e terapia antipertensiva. Sono stati riportati
come esami strumentali e di laboratorio rilevanti per l’ADR: creatinfosfochinasi
ematica aumentata; ecocardiogramma: spessori del SIV aumentati, non alterazioni
della cinetica segmentaria; elettrocardiogramma: ritmo sinusale con ST
sottolivellato in sede infero-laterale; FE 60%. Il paziente assumeva come farmaco
77
concomitante Bisoprololo (Eutirox) 25 mcg per e tamsulosina cloridrato (Omnic).
Il farmaco sospetto, sunitinib, sospeso con miglioramento della reazione, è stato
ripreso senza ricomparsa dei sintomi. In base all’algoritmo di Naranjio
l’imputabilità del sunitinib nella reazione avversa è risultata “possibile”.
Commento
Il sorafenib, attualmente approvato per il trattamento dell’epatocarcinoma e di
pazienti con carcinoma a cellule renali avanzato (stadio IV), nei trial clinici, è
risultato associato con sindromi coronariche acute nel 2,9% dei pazienti trattati
con il farmaco verso lo 0,4% dei pazienti trattati con placebo (41). In uno studio
su 74 pazienti con carcinoma a cellule renali metastatico trattati con sunitinib (un
altro inibitore multichinasico indicato nel carcinoma renale) o sorafenib, 14 con
sorafenib e 11 trattati con sunitinib e andarono incontro ad un evento cardiaco; 13
di questi 25 pazienti mostrarono tipici sintomi clinici, includendo angina tipica,
dispnea da sforzo e capogiri.
Di questi ultimi, sette risultarono gravemente compromessi e richiesero il
trattamento in unità di terapia intermedia o intensiva. In 12 dei 25 pazienti andati
incontro ad eventi cardiaci furono riscontrate modificazioni ECG. Tutti i pazienti
si rimisero dopo la terapia cardiovascolare e furono considerati in grado di
riprendere il trattamento per il tumore (42). Oltre che ipertensione (un effetto
molto probabilmente dovuto al blocco degli effetti fisiologici del VEGF a livello
della parete vascolare; si è già discusso come l’effetto anti-angiogenetico di
sorafenib e sunitinib possa favorire l’insorgenza di ONJ da BF) gli inibitori
multichinasici possono causare anche ipotiroidismo, che può aggravare la loro
78
cardiotossicità (43-44). Il sorafenib, oltre che VEGFR, PDGFR, KIT e FLT-3,
inibisce le kinasi Raf che innescano la via di proliferazione e di sopravvivenza
cellulare MEK/ERK e hanno un ruolo protettivo nel cuore. E’ interessante come
mutazioni “gain of function” di Raf-1 e di altri componenti della via di Raf siano
responsabili di certi casi di cardiomiopatia ipertrofica (sindromi di Noonan e
LEOPARD) (45). Tuttavia, il coinvolgimento di Raf-1 e di BRAF nella tossicità
per i miociti del sorafenib è stato recentemente messo in discussione (44).
E’ richiesto un attento monitoraggio fino a che studi di larghe dimensioni e la
sorveglianza post-marketing non definiranno chiaramente la natura degli eventi
cardiovascolari associati al sorafenib o al sunitinib, specialmente in pazienti con
fattori di rischio cardiovascolare, come età avanzata o una storia pregressa di
malattia coronarica (43).
I casi che ho riportato illustrano chiaramente come l’applicazione capillare della
segnalazione delle ADR possa contribuire a questo obiettivo specifico, come del
resto al chiarimento della situazione rispetto a tante altre ADR in cui sono
imputati farmaci di tipo oncologico o meno. Non verrà mai sottolineata
abbastanza l’importanza che il segnalatore fornisca dato quanto più completi
possibile, in maniera da facilitare l’interpretazione sull’imputabilità, sui fattori di
rischio, etc.
79
Conclusioni
La segnalazione delle reazioni avverse da farmaci (ADR) in ambito postmarketing è fondamentale per la tempestiva identificazione di nuove, in
particolare gravi, tossicità, che, per vari limiti, non emergono facilmente nei trial
pre-registrativi. La farmacovigilanza (FV) è necessaria per una valutazione più
completa della sicurezza e dell’impatto sulla qualità di vita di un nuovo farmaco
nella pratica clinica reale, dove i pazienti, per differenti ragioni (patologie
multiple, corredo genetico, usi off-label, etc.) sono a maggior rischio di ADR e di
interazioni tra farmaci.
In passato i farmaci antineoplastici non sono stati oggetto di attenzione prioritaria
nei programmi nazionali o internazionali di FV e, in aggiunta, è stata assente la
cultura della segnalazione delle ADR tra gli oncologi medici. Solo recentemente è
stato sottolineata la chiara, preminente, importanza delle attività di FV in ambito
oncologico; si assiste ad un rapido ed intenso sviluppo di nuovi agenti, tra cui
quelli a meccanismo non tradizionale (inibitori chinasici, anticorpi monoclonali),
e tutta una serie di significativi problemi inaspettati ha indicato come ci sia ancora
molto da imparare sul loro profilo di tossicità.
La presente tesi ha fatto riferimento alla mia esperienza nel “Centro di consulenza
ed informazione sugli effetti tossici da farmaci antitumorali e sulle ADR in
pazienti neoplastici” della Regione Sicilia. L’andamento della segnalazione
spontanea in ambito oncologico a livello regionale può essere un indice
dell’attività del Centro e dell’eventuale raggiungimento dei suoi obbiettivi: il
numero di segnalazioni di sospette reazioni avverse occorse in pazienti oncologici
segnalate dagli operatori sanitari della Regione Sicilia è cresciuto nel tempo.
80
Confrontando il numero di segnalazioni relative a pazienti oncologici per anno di
inserimento, si osserva un incremento che si è passati da quattro segnalazioni nel
2003 (data di inizio delle attività del Centro) a 154 nel 2010. Il coinvolgimento
delle strutture sanitarie è stato buono e nel 2010 le segnalazioni di ADR
oncologiche hanno raggiunto la provenienza da 16 strutture dell’isola. Si è
confermato come un feedback educazionale permanente produca notevoli effetti
in termini quantitativi della segnalazione di reazioni avverse da farmaci. D’altra
parte, in genere le segnalazioni sono state di notevole interesse e di buona qualità
e hanno significativamente contribuito a caratterizzare una patologia iatrogena
emergente come l’ONJ da BP o acquisire informazioni sulla sicurezza di farmaci
di recente immissione in commercio come quelli sottoposti a RFOM (tra cui
sorafenib e sunitinib).
Si auspica un ulteriore futuro sviluppo della cultura della segnalazione delle ADR
in ambito oncologico fra gli operatori sanitari della regione. Solo attraverso questo
sistema di farmacovigilanza le segnalazioni di sospetta reazione avversa possono
essere esaminate in maniera cumulativa e, eventualmente, generare segnali
d’allarme o confermare il rapporto beneficio/rischio di un medicinale. Senza il
contributo degli operatori sanitari non sarebbe possibile svolgere questo lavoro a
garanzia della salute pubblica; questo vale soprattutto per alcune branche della
medicina come l’oncologia, un’area in continua evoluzione.
81
Bibliografia
1. Edwards IR. Who cares about pharmacovigilance? Eur J Clin Pharmacol.
1997; 53: 83-88.
2. Abraham J, Davis C. Testing times: the emergence of the practolol disaster
and its challenge to British drug regulation in the modern period. Soc Hist
Med. 2006 ;19:127-47.
3. McBride W.G.Thalidomide and congenital abnormalities. Lancet 1961;II,
1358.
4. Olsson S. The role of the WHO programme on international drug monitoring
in coordinating worldwide drug safety efforts. Drug safety 1998; 19: 1-10.
5. Edwards
IR,
Olsson
S.
WHO
Programme-Global
Monitoring.
In
Pharmacovigilance (2002); Mann RD, Andrews EB, editors. Wiley,
Chichester.
6. Alvarez-Requeio A, Carvajal A, Begaud B, Moride Y, Vega T, Arias LH.
Under-reporting of adverse drug reactions. Estimate based on a spontaneous
reporting scheme and a sentinel system. Eur J Clin Pharmacol. 1998; 54: 483488.
7. Meyboom R, Olsson S. Teaching Pharmacovigilance. In Pharmacovigilance
(2002); Mann RD, Andrews EB, editors. Wiley, Chichester.
8. Edwards IR, Aronson JK. Adverse drug reactions: definitions, diagnosis and
management. Lancet 2000; 356: 1255-9.
9.
Naranjo CA, Busto U, Sellers EM, et al. "A method for estimating the
probability of adverse drug reactions". Clin Pharmacol Ther 1981; 30: 239–
45.
10. Meyboom RHB, Egberts ACG, Edwards IR, Hekster YA, De Koning FHP,
Gribnau FWJ. Principles of signal detection in pharmacovigilance. Drug
Safety 1997;16:355-365.
11. Biriell C, Edwards RI. Reasons for reporting adverse drug reactions--some
thoughts based on an international review. Pharmacoepidemiol Drug Saf
1997; 6: 21-26.
82
12. Decreto Legislativo 24 aprile 2006 n. 219, di attuazione della Direttiva
2001/83/CE (e successive direttive di modifica) relativa ad un codice
comunitario concernente i medicinali per uso umano, nonché della direttiva
2003/94/CE (pubblicato nella Gazzetta Ufficiale n. 142 del 21 giugno 2006 Supplemento Ordinario n. 153.)
13. D’Alessandro N. I farmaci antineoplastici, cenerentole in farmacovigilanza: è
necessario segnalare le ADR in oncologia? http://www.farmacovigilanza.org/
corsi/050731-04.asp
14. - Ladewski LA, Belknap SM, Nebeker JR, Sartor O, Lyons EA, Kuzel TC,
Tallman MS, Raisch DW, Auerbach AR, Schumock GT, Kwaan HC, Bennett
CL. Dissemination of information on potentially fatal adverse drug reactions
for cancer drugs from 2000 to 2002: first results from the research on adverse
drug events and reports projects. J. Clin. Oncol. 2003; 21: 3859-66.
15. Beijer HJ, de Blaey CJ. Hospitalisations caused by adverse drug reactions
(ADR): a meta-analysis of observational studies. PharmWorld Sci. 2002; 24:
46-54.
16. Rademaker M. Do women have more adverse drug reactions? Am J. Clin.
Dermatol. 2001; 2: 349-351.
17. Colella G., Campisi G. & Fusco V. American Association of Oral and
Maxillofacial
Surgeons
Position
Paper:
Bisphosphonate-Related
Osteonecrosis of the Jaws-2009 Update: The Need to refine the BRONJ
definition. Oral Maxillofac Surg. 2009; 67:2698-9.
18. Marx RE, et al. Bisphosphonateinduced exposed bone (osteonecrosis/
osteopetrosis) of the jaws: risk factors, recognition, prevention, and treatment.
J Oral Maxillofac Surg. 2005; 63:1567-75.
19. Reuther T, et al. Osteoradionecrosis of the jaws as a side effect of
radiotherapy of head and neck tumour patients a report of a thirty year
retrospective review. Int J Oral Maxillofac Surg 2003;32:289-295.
20. Drake MT, et al. Bisphosphonates: Mechanism of Action and Role in Clinical
Practice Mayo Clin Proc 2008; 83: 1032-1045.
21. Wang J, Goodger NM, Pogrel MA. Osteonecrosis of the jaws associated with
cancer chemotherapy. J Oral Maxillofac Surg 2003; 61: 1104-7.
83
22. Marx RE. Pamidronate (Aredia) and zoledronate (Zometa) induced avascular
necrosis of the jaws: a growing epidemic. J Oral Maxillofac Surg 2003; 61:
1115-7.
23. Ruggiero SL, Merotra B, Rosemberg TJ, Engroff SL. Osteonecrosis of the
jaws associated with the use of biphosphonates: A review of 63 cases. J Oral
Maxillofac Surg 2004; 62: 527-34.
24. Changes to the precautions and post-marketing experience sections of Aredia
(pamidronate disodium) injection and Zometa (zoledronic acid) injection
prescribing information related to osteonecrosis of the jaw. September 24,
2004 (package inserts) [http://www.novartis.com]
25. Mavrokokki T, Cheng A, Stein B, Goss A. Nature and frequency of
bisphosphonate-associated osteonecrosis of the jaws in Australia. J Oral
Maxillofac Surg. 2007;65:415-23.
26. Whyte MP, Wenkert D, Clements KL, McAlister WH, Mumm S.
Bisphosphonate-induced osteopetrosis. N Engl J Med. 2003; 349:457-63.
27. Fournier P, Boissier S, Filleur S, Guglielmi J, Cabon F, Colombel M,
Clezardin P.Bisphosphonates inhibit angiogenesis in vitro and testosteronestimulated vascular regrowth in the ventral prostate in castrated rats. Cancer
Res.2002; 62:6538-44.
28. Santini D, Vincenzi B, Avvisati G, Dicuonzo G, Battistoni F, Gavasci M,
Salerno A, Denaro V, Tonini G. Pamidronate induces modifications of
circulating angiogenetic factors in cancer patients. Clin Cancer Res.
2002;8:1080-4.
29. American Association of Oral and Maxillofacial Surgeons Position Paper on
Bisphosphonate-Related Osteonecrosis of the Jaw—2009 Update.
30. Vahtsevanos K, Kyrgidis A, Verrou E, Katodritou E, Triaridis S, Andreadis
CG, Boukovinas I, Koloutsos GE, Teleioudis Z, Kitikidou K, Paraskevopoulos
P, Zervas K, Antoniades K. Longitudinal cohort study of risk factors in cancer
patients of bisphosphonate-related osteonecrosis of the jaw. J Clin Oncol.
2009;27:5356-62.
31. Coleman RE. Risk and benefits of bisphosphonates. Br J Cancer, 2008;
98:1736-40.
84
32. Edwards BJ et al. Pharmacovigilance and reporting oversight in US
FDA fast-track process: bisphosphonates and necrosis of the jaw. Lancet
Oncol 2008; 9: 1166-72.
33. Nota informativa importante su Avastin (bevacizumab) del 30/11/2010
34. Nota informativa importante su Sutent (sunitinib) del 30/11/2010
35. Aragon-Ching JB et al. Higher incidence of osteonecrosis of the jaw in
patients with metastatic castration resistant prostate cancer treated with antiangiogenic agents. Cancer Invest. 2009; 27: 221-226.
36. Christodolou C et al. Combination of biphosphonates and antiangiogenic
factor induces osteonecrosis of the jaw more frequently than biphosphonates
alone. Oncology 2009;76:209-211.
37. Van Poznak C. Osteonecrosis of the jaw and bevacizumab therapy. Breast
Cancer Res Treat 2010; 122:189-191.
38. Estilo CL et al. Osteonecrosis of the jaw related to bevacizumab. J Clin Oncol
2008;26:4037-4038.
39. Greuter S et al. Bevacizumab-associated osteonecrosis of the jaw. Ann Oncol
2008;19:2091-2092.
40. Brunello A et al. Worsening of osteonecrosis of the jaw during treatment with
sunitinib in a patient with metastatic renal cell carcinoma. Bone 2009;44:173175.
41. Chen M.H., Kerkelä R, Force T. Mechanisms of cardiac dysfunction
associated with tyrosine kinase inhibitor cancer therapeutics. Circulation
2008;117:84-95.
42. Schmidinger M., Zielinski C.C., Vogl U.M., Bojic A., Bojic M., Schukro C.,
Ruhsam M., Hejna M., Schmidinger H. Cardiac toxicity of sunitinib and
sorafenib in patients with metastatic renal cell carcinoma. J. Clin. Oncol.
2008;26:5204-12.
43. Di Lorenzo G., Autorino R., Bruni G., Cartenì G., Ricevuto E., Tudini M.,
Ficorella C., Romano C., Aieta M., Giordano A., Giuliano M., Gonnella A.,
De Nunzio C., Rizzo M., Montesarchio V., Ewer M., De Placido S.
Cardiovascular toxicity following sunitinib therapy in metastatic renal cell
carcinoma: a multicenter analysis. Ann. Oncol. 2009;20:1535-42.
85
44. Torino F, Torino F, Corsello SM, Longo R, Barnabei A, Gasparini G.
Hypothyroidism related to tyrosine kinase inhibitors: an emerging toxic effect
of targeted therapy. Nat. Rev. Clin. Oncol. 2009;6:219-29.
45. Pandit B., Sarkozy A., Pennacchio L.A. et al. Gain-of-function RAF1
mutations cause Noonan and LEOPARD syndromes with hypertrophic
cardiomyopathy. Nat. Genet. 2007; 39:1007-12.
46. Hasinoff N.B., Patel D. Mechanisms of myocyte cytotoxicity induced by the
multikinase inhibitor sorafenib. Cardiovasc. Toxicol. 2010;10:1-8.
86
Indice
Argomenti
Pagine
Introduzione
3
La segnalazione spontanea: generalità
5
Il significato della segnalazione
8
La validazione delle segnalazioni
10
Organizzazione della segnalazione spontanea a livello
internazionale
14
Il sistema di segnalazione spontanea in Italia
16
Scopo della tesi
28
Progetto per l’organizzazione della farmacovigilanza in Sicilia
34
Metodi
39
Risultati
42
Distribuzione delle segnalazioni in oncologia siciliane
44
La qualità delle segnalazioni
48
Descrizione delle segnalazioni in oncologia siciliane nel triennio
49
2008-2010
Conclusioni
80
Bibliografia
82
87