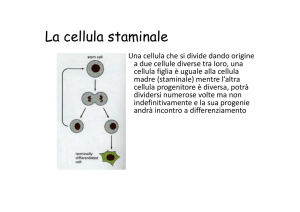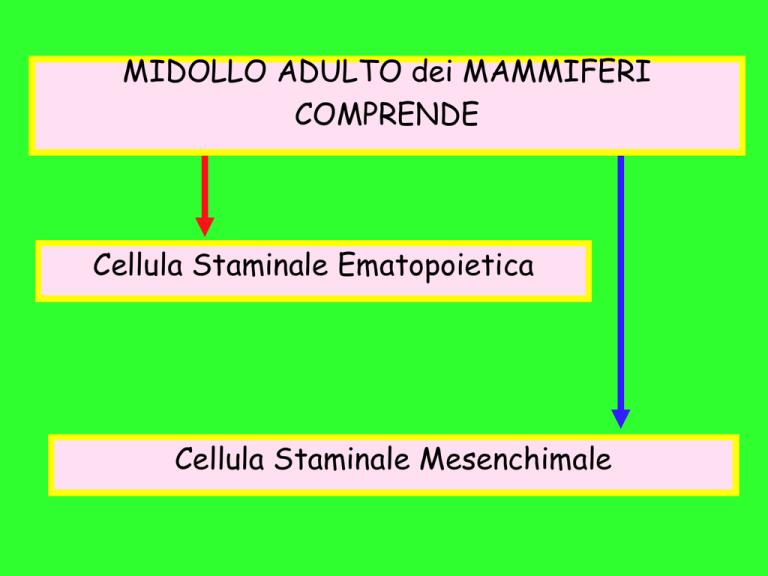
MIDOLLO ADULTO dei MAMMIFERI
COMPRENDE
Cellula Staminale Ematopoietica
Cellula Staminale Mesenchimale
IL MIDOLLO OSSEO
Ematopoiesi
Ininterotta formazione di elementi giovani
del sangue a partire da cellule staminali
totipotenti: origine a tutte le linee
emopoietiche
Organi
emopoietici:
forniscono
il
microambiente necessario per la proliferazione
e il differenziamento verso le varie linee
cellulari
Organi emopoietici
Organi mieloidi: midollo osseo
Organi linfoidi: timo e midollo osseo
Organi linfoidi secondari o periferici:
linfonodi, tonsille palatine, placche di Peyer,
tessuto linfoide diffuso, milza
Principi che giustificano l’utilizzo dei saggi funzionali
su Cellule Ematopoietiche
•Il Sistema Ematopoietico rappresenta un continuum
di cellule che progressivamente manifestano
differenti caratteristiche biologiche: … da cellula
staminale a … vari tipi cellulari differenziati;
•Variazioni biologiche rilevate nei vari
compartimenti “maturanti” non riflettono quelle che
si attuano nel compartimento staminale;
•I vari compartimenti ematopoietici sono controllati
da differenti fattori che variano indipendentemente
l’uno dall’altro.
IDENTIFICATION OF HEMATOPOIETIC STEM/PROGENITOR
CELLS: STRENGTH AND DRAWBACKS OF FUNCTIONAL
ASSAYS. Oncogene, 2004, 23, 7210-7222
Wu et al, 1967; Iscove et al., 1971; Metcalf et al. 1975.
•Standardizzazione dei primi saggi funzionali;
•Rivelazione dei concetti che definiscono la biologia
della cellula staminale ematopoietica;
•Possibile estensione degli stessi concetti alla
comprensione dei meccanismi biologici che regolano la
sopravvivenza e proliferazione della cellula staminale
tumorale nonché delle cellule staminali nonematopoietiche.
Short-term in vitro Assays
•
I prototipi dei saggi funzionali a breve termine
sono rappresentati dai saggi a colonie;
•
La sospensione cellulare viene quindi piastrata
in terreno semisolido rappresentato da
metilcellulosa oppure da agar.
… la progenie che deriva da una singola cellula
costituisce
COLONIA
•
Diversa composizione;
•
Diversa grandezza;
•
Diverso colore.
Ogni colonia rappresenta un continuum di
progenitori “lineage committed”.
SAGGI A COLONIE
…dopo circa 3 Settimane cioè a 5-10 Divisioni
Nell’ambito di un data linea cellulare,
i progenitori con differenti livelli di maturità
possono essere riconosciuti in base a:
• Sensibilità di risposta ai fattori di
crescita;
• Tempo necessario per generare una
progenie di cellule differenziate;
• La grandezza e la particolare morfologia
delle colonie.
… Sensibilità, Tempo e Grandezza …
Questi tre parametri sono stati utilizzati per
l’ottenimento di
mature CFU-E Colony-forming Unit Erythroid
da
immature Burst-forming Unit Erythroid
Il progenitore T linfoide migra nell’abbozzo del timo, ed in questa
sede progressivamente si differenzia nei vari tipi di linfociti
attraverso un processo che è caratterizzato da eventi molecolari
specifici, e che è sotto controllo del microambiente timico.
Il progenitore mieloide invece differenzia progressivamente
nelle diverse linee ematopoietiche caratterizzate , da un punto
di vista sperimentale, in base alla capacità di formare colonie
(CFU, Colony Forming Units) o “burst” (Burst Forming Unit) in
mezzo semisolido sotto lo stimolo di fattori di crescita
ematopoietici specifici, denominati “Colony Stimulating
Factors” (CFS) e interleuchine, che sono rilasciati
fisiologicamente da vari tipi cellulari ( cellule staminali del
midollo, monociti-macrofagi, linfociti T e NK).
Cellule progenitrici della serie eritroide (BFU-E e
CFU-E) progenitori iniziali e più differenziati
rispettivamente
Cellule progenitrici della serie granulo-macrofagica
(CFU-GM, CFU-G e CFU-M)
Cellule progenitrici della serie megacariocitaria (BFUMK, CFU-MK)
L’interleuchina 3 (IL-3) ed il granulocyte/macrophage colony
stimulating factor (GM-CSF): inducono la differenziazione dei
progenitori iniziali (BFU-E e CFU-GM)
L’eritropoietina, l’interleuchina 5 (IL-5), il GM-CSF ed il
macrophage colony stimulating factor (M-CSF): agiscono
essenzialmente sulla proliferazione e\o differenziazione dei
progenitori più avanzati (CFU-E, CFU-G, CFU-M,
rispettivamente) e sull’attivazione delle cellule terminali
mature.
1. LA PROLIFERAZIONE CELLULARE
La proliferazione cellulare è misurata
attraverso il numero di cellule prodotte.
2. POTENZIALE DIFFERENZIATIVO.
Il potenziale differenziativo è stimato
attraverso il numero di differenti linee
cellulari rappresentate nella progenie
prodotta.
Tutti i Saggi Funzionali misurano
2 Parametri:
1. LA PROLIFERAZIONE CELLULARE;
2. POTENZIALE DIFFERENZIATIVO.
Limite dei Saggi a Colonie a Breve Termine
Non risultano adeguati nel rilevamento di
progenitori più immaturi
•Inadeguatezza dei mezzi semisolidi utilizzati;
•L’efficacia di un mezzo semisolido non supera le tre
settimane e tutto questo conduce
All’impossibilità di identificare una
Stem Cell molto immatura.
… Una Stem Cell molto immatura necessita
di un periodo superiore a 3 - 5 settimane
affinchè possa garantire una progenie di
cellule differenziate.
Michael Dexter, 1977
Long - Term Culture
Presenza di un feeder layer costituito da cellule che da un
lato fungono da substrato e dall’altro provvedono a
secernere fattori di crescita nel tentativo di ricostituire il
microambiente ematopoietico
Feeder Layer
•Cellule normali aderenti midollari allogeniche, espanse per
4 settimane e successivamente irradiate;
•Linee cellulari continue murine derivate dallo stroma
midollare.
Linee Cellulari Continue Murine
•Le più note sono MS5, S17, AFT024 ed M210B4;
•Esse hanno il pregio di essere più facilmente gestibili
rispetto alle cellule stromali fresche allogeniche;
•L’ottenimento del loro numero è ILLIMITATO;
• Supportano egualmente bene sia la differenziazione
mieloide che quella linfoide a partire da progenitori
lineage-committed.
UNITA’ EMATONE
STROMA
+
CELLULE EMATOPOIETICHE
+
CELLULE NON-EMATOPOIETICHE (Cellule Mesenchimali)
L’Unità Ematone è quindi una delle strutture funzionali
elementari rappresentata da un aspirato midollare che è
indispensabile per la comprensione dei meccanismi biologici
che regolano in vivo la Cavità della Cellula Staminale
ovvero Stem Cell Niche.
STROMA
Le cellule stromali nel loro insieme sono costituite da
adipociti, cellule endoteliali, macrofagi e fibroblasti.
Trends in Biotechnology, 2003
VEGF2R
P-selectin
•IL6
•G-CSF
E-selectin
•GM-CSF
CD105
endoglin
•M-CSF
•SCF
VLA-4
•Flk-2
VCAM-1
ICAM-1
Molecole di Adesione,
Fattori di crescita e…
•VEGF2-R = Recettore per Vascular Endothelial Growth
Factor 2;
•CD105 = Recettore per il Transforming Growth Factor;
•VCAM-1= Vascular Cell Adhesion Molecule-1;
•ICAM-1= Intercellular Adhesion Molecule-1;
•SCF= Stem Cell Factor;
•VLA-4= Very Late Antigen di tipo IV.
•GM-CSF
•G-CSF
•M-CSF
Macrofago
•IL6
•IL1
•TNF-a
•TGF-b
Concetto di Nicchia
•Stabile Microambiente per la cellula staminale;
•La nicchia è costituita da cellule e componente
extracellulare che può ospitare una o più cellule
staminali e controllarne l’autorinnovamento nonchè
la produzione di progenie;
•La matrice extracellulare insieme alle molecole di
adesione definiscono i confini spaziali della nicchia
e modulano l’espressione di molecole di adesione
nonchè quelle deputate al signalling.
Concetto di Nicchia
La scelta di una cellula staminale se rimanere nel suo stato
di quiescenza o dividersi guidata dal microambiente.
-Angiopoietin-1 (Ang-1): il fattore secreto dagli osteoblasti e il suo
recettore (Tie2) hanno grande importanza per il contatto delle HSC alle
cellule della nicchia mantenendole in uno stato di quiescenza
-p21: controlla il numero delle cellule staminali, mantenendo la
popolazione staminale in uno stato di quiescenza
-p27: controlla la proliferazione dei precursori ematopoietici e il loro
pool all’interno dell’organismo
-Growth factor independent 1 (Gfi-1): regola la proliferazione delle
cellule T
Stem cells find their niche
ALLAN SPRADLING, DANIELA DRUMMOND-BARBOSA &
TOSHIE KAI
Nature, 2001
Figure 1 Niche structure. Niche cells (green) underlying a basement membrane
signal to stem cells (red) to block differentiation and regulate division. When a
lineage mechanism prevails (lower mitotic cell), the stem cell divides such that one
daughter retains its connections to the niche, while the other (yellow) becomes
untethered and begins to differentiate. When a population mechanism prevails (upper
mitotic cell), stem cell division may be either symmetric (shown) or asymmetric (not
shown), as determined by local factors. ECM, extracellular matrix.
Figure 1 Birth control for stem
cells. The niche that regulates
the birth and differentiation of
blood-forming (haematopoietic)
stem cells is formed of
osteoblasts (a type of bonemarrow cell) that line the inner
surface of bone. Zhang et al.7
showed that depleting
osteoblasts of a receptor for
bone morphogenetic protein
(BMP) caused a doubling in
both the osteoblast population
and the stem-cell population.
Calvi et al.8 found a parallel
expansion of the stem-cell
population when they increased
the numbers of osteoblasts by
using parathyroid hormone
(PTH).
Lemischka et al. Nature 425: 778, 2003
Colture a Lungo Termine
Identificano:
•LTC-IC;
•CAFC;
•Extended LTC-IC ovvero
ELTC-IC.
LTC-IC
La “Long-Term Culture Initiating Cell” identifica
un tipo cellulare che è in grado, quando coltivata su
un supporto costituito dallo stroma, di dare origine
a cellule figlie identificabili mediante l’applicazione
di saggi a colonie.
La LTC-IC rappresenta, quindi, la primitiva cellula
ematopoietica che è in grado di sostenere la
produzione di tutte le linee cellulari
ematopoietiche per l’intera vita di un individuo.
CAFC
La “cobblestone area-forming cell”
identifica un tipo cellulare che si integra
nello strato aderente stromale.
La colonia cellulare è costituita, pertanto,
da cellule appiattite, otticamente dense e
strettamente associate alle cellule aderenti.
Cobblestone Area. La CA è composta da cellule scure,
angolari, associate ad una cellula adiposa (F). Si osservano
cellule in sospensione (S), brillanti, ed un macrofago (M).
Patricia Denning-Kendall et al, Stem Cells, 2003
Extended LTC-IC ovvero ELTC-IC
L’Extended LTC-IC probabilmente identifica
un tipo cellulare la cui longevità è
strettamente associata a quella attesa per
una vera e propria cellula staminale.
ELTC-IC si ottiene estendendo il saggio
LTC-IC ad un periodo superiore a 12
settimane.
Identificazione di Precursori Linfoidi B
I precursori ad habitus B sono stati
necessariamente assegnati in coltura
liquida su feeder stromale murino
utilizzando
“Murine Dexter-type long-term bone
marrow cultures”.
Linee cellulari continue stromali murine
utilizzate: Sys-1, S17, MS-5 ed AFT024.
… Perché è stato necessario utilizzare
questa tecnica?
• La discriminazione morfologica di colonie B da colonie
non-B non è accurata;
• La caratterizzazione immunofenotipica su colonie
direttamente prelevate da metilcellulosa non è indicata;
• E’ essenziale l’utilizzo di basse concentrazioni di siero;
• Le citochine prodotte da granulociti e macrofagi
inibiscono la differenziazione di progenitori B
(Interferon-a ed IL-6).
Identificazione e Quantizzazione di
Precursori Linfoidi T
SISTEMI UTILIZZATI
•Coltura di timo fetale (FTOC, fetal thymus organ culture);
•Coltura di riaggregati e monolayer di cellule stromali
timiche;
•Coltura della linea cellulare continua murina stromale, OP9
che esprime il ligando Notch Delta-1.
Da notare che:
•La trasduzione del segnale via Notch-ligand è
determinante per il differenziamento T;
•In questi tipi di sistemi è stato ottenuto il
differenziamento CD4 a partire da 100 staminali
cordonali CD34+.
H. Spits. Development of ab T cell in the human thymus. Nature Reviews Immunology, 2002.
Immunofenotipo delle HSCs
CD34: HSCs e precursori ematopoietici
Cellule in divisione: CD34+ CD38Cellule quiescenti: CD34- CD38+
CD201: espresso anche nelle endoteliali, coinvolto
nella coagulazione del sangue e nei processi
infiammatori
CD133: HSCs e precursori ematopoietici
CD45, CD43, Flt3….
SIMPLIFIED SCHEME OF STEM CELL DIFFERENTIATION
hematopoietic stem cell
CD34
CD117
CD133
CD90
VEGFR
CD105
ALDH
ABCG2
ABCB1
CDCP1
CD318
myeloid blast
erythroid
Homing delle Cellule Staminali Ematopoietiche
Con il termine Homing si definisce quel processo
biologico che conduce le cellule staminali
ematopoietiche trapiantate a raggiungere la loro
cavità, ovvero “nicchia” nel midollo osseo.
Fasi di Homing
Le varie fasi di Homing di una cellula staminale
ematopoietica prevedono:
1.Rolling sulle cellule endoteliali attraverso il legame con
E e P-Selectine;
2.Adesione attraverso VCAM-1 espresso dalle stesse
cellule endoteliali;
3.Migrazione trans-endoteliale via VLA-4/VCAM-1 come
anche via VLA-4 e VLA-5/Fibronectina.
Perché è importante aumentare l’efficienza di
Homing?
• Perché soltanto il circa 5% di progenitori umani
CD34+ raggiunge la nicchia midollare dell’ospite!
• La percentuale è leggermente variabile e correla
con lo stato del ciclo cellulare delle cellule
primitive trapiantate;
Christopherson et al, Science 2004
Modulation of Hematopoietic Stem cells Homing
and Engrafment by CD26
Uno dei protagonisti che limita fortemente
l’Homing e quindi l’attecchimento dei progenitori
primitivi ematopoietici è la molecola CD26.
CD26 è una DPPIV/Dipeptidilpeptidasi IV che ha
la funzione di rimuovere dipeptidi dalla estremità
aminoterminale delle proteine.
CXCR4
:-)
Le cellule stromali producono
SDF-1 che attrae le cellule
positive per CXCR4.
CXCR4
1
NH2
2
3
4
Struttura generale dei
recettori per
chemochine
5
Sette domini transmembrana
HOOC
6
7
CXCR4
:-(
CD26
CD26 cliva SDF-1 bloccando il
meccanismo chemiotattico
AMD3100
:-)
CXCR4
“Mobilizzatore”
CD26
Diprotin-A
“Esaltatore di Homing”