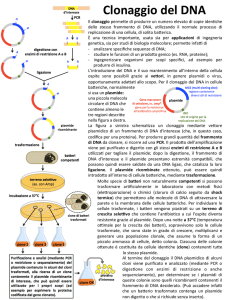
Esercitazione 3 e 4 Metod di Genetica
annuncio pubblicitario
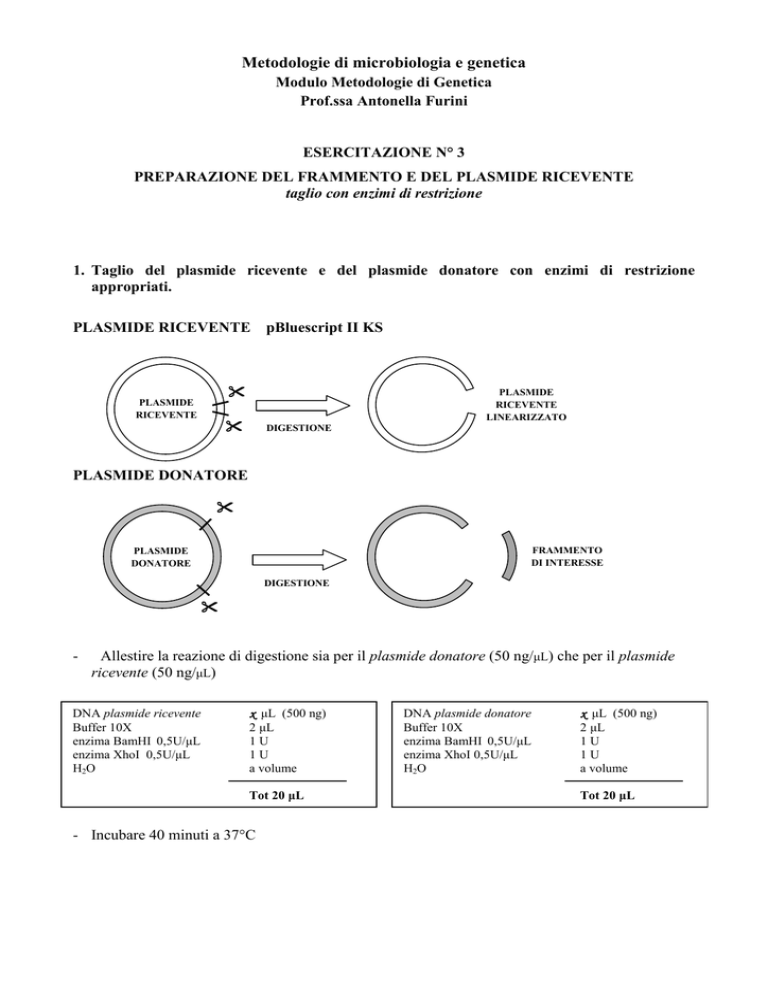
Metodologie di microbiologia e genetica Modulo Metodologie di Genetica Prof.ssa Antonella Furini ESERCITAZIONE N° 3 PREPARAZIONE DEL FRAMMENTO E DEL PLASMIDE RICEVENTE taglio con enzimi di restrizione 1. Taglio del plasmide ricevente e del plasmide donatore con enzimi di restrizione appropriati. PLASMIDE RICEVENTE pBluescript II KS PLASMIDE RICEVENTE PLASMIDE RICEVENTE LINEARIZZATO DIGESTIONE PLASMIDE DONATORE FRAMMENTO DI INTERESSE PLASMIDE DONATORE DIGESTIONE - Allestire la reazione di digestione sia per il plasmide donatore (50 ng/µL) che per il plasmide ricevente (50 ng/µL) DNA plasmide ricevente Buffer 10X enzima BamHI 0,5U/µL enzima XhoI 0,5U/µL H 2O x µL (500 ng) 2 µL 1U 1U a volume Tot 20 µL - Incubare 40 minuti a 37°C DNA plasmide donatore Buffer 10X enzima BamHI 0,5U/µL enzima XhoI 0,5U/µL H 2O x µL (500 ng) 2 µL 1U 1U a volume Tot 20 µL - Verificare il successo della reazione di restrizione su gel di agarosio all’1% caricando: a. il marker (5 µL di marcatore di peso molecolare chiamato 1Kb); b. il plasmide donatore non tagliato; Solo 1 gruppo per bancone!!! c. il plasmide ricevente non tagliato; d. il plasmide donatore tagliato; e. il plasmide ricevente tagliato. Preparazione dei campioni b. e c. per il caricamento su gel: 1 µL di plasmide non tagliato; 4 µL di Loading Buffer 6X (blu); 19 µL di H2O. Preparazione dei campioni d. e e. per il caricamento su gel: 20 µL di campione; 4 µL di Loading Buffer 6X (blu); Schema di caricamento del gel (1 gel ogni due gruppi): a b c d e Gruppo A d e Gruppo B - Far correre a 90 V fino a quando il fronte colorato supera i 4 cm dal margine superiore del gel (± 30min). - Con un bisturi pulito tagliare al transilluminatore (→ attenzione, UV) le bande corrispondenti al frammento (exciso dal plasmide donatore) ed al plasmide ricevente tagliato (lanes d ed e) e porle in due tubi da 1.5 mL (scrivere sul tubo il contenuto ed il numero del gruppo). - Conservare le bande a -20°C. Metodologie di microbiologia e genetica Modulo Metodologie di Genetica Prof.ssa Antonella Furini ESERCITAZIONE N° 4 PREPARAZIONE DEL FRAMMENTO E DEL PLASMIDE RICEVENTE (purificazione da gel) E LIGAZIONE 2. Purificazione del frammento e del plasmide donatore da gel di Agarosio - aggiungere 500 µL di DF Buffer e mescolare brevemente vortexando; - incubare a 50–55 °C fino a quando il gel è completamente sciolto (10-15 min) vortexando ogni 2 min; - inserire la colonnina DF nell’apposito tubo e applicare 800 µL della soluzione gel-DF buffer dentro alla colonna; - centrifugare a 10000g per 30 secondi; - eliminare l’eluato e reinserire la colonnina nell’apposito tubo; - aggiungere 500 µL di Wash Buffer; - centrifugare a 10000 g per 30 secondi; - eliminare l’eluato e reinserire la colonnina nell’apposito tubo; - centrifugare a 10000 g per 1 minuto per asciugare la resina contenuta nella colonnina; - trasferire la colonnina in un tubo da 1.5 mL pulito; - aggiungere 50 µL di Elution Buffer; - incubare 1 minuti a temperatura ambiente; - centrifugare a 16000 g per 1 minuti, eliminare la colonnina e marcare il tubo (numero del gruppo e contenuto); - conservare in ghiaccio o a -20 °C; 3. Quantificazione del plasmide ricevente e del frammento - Corsa elettroforetica su gel di Agarosio 1% di: a. una aliquota (2 µL) di plasmide ricevente purificato; b. una aliquota (2 µL) di frammento purificato; c. una quantità nota di DNA (DNA del fago λ) corrispondente a 50 ng; Preparazione dei campioni a. e b. per il caricamento su gel: 2 µL di campione; 4 µL di Loading Buffer 6X; 18 µL di H2O; - Far correre (a 90 V) fino a quando il fronte colorato supera i 4 cm dal margine superiore del gel (± 30min). - Quantificare, al transilluminatore, il frammento e il plasmide ricevente tramite confronto della fluorescenza emessa dai due campioni e quella emessa dallo standard a quantità nota (λDNA, 50 ng). [considerando che sono stati caricati 2 µL per ognuno dei due campioni, qual è la loro concentrazione, espressa in ng/µL?] 2. LIGAZIONE - Si vogliono utilizzare 50 ng di plasmide ricevente (chiamato anche vettore). A quanti microlitri (yy µL) corrispondono 50 ng, in base alla concentrazione determinata al punto precedente? - Determinare la quantità (in ng) di frammento da utilizzare per la ligazione, secondo un rapporto di ligazione frammento:vettore = 3:1 (si applichi la formula indicata nel riquadro sotto riportato). - Determinare il volume (xx µL) di frammento da utilizzarsi, conoscendone la concentrazione e la quantità necessaria (in ng). - Allestire la reazione di ligazione come descritto sotto: frammento pl. ricevente T4 ligasi (0.5U/µL) buffer Ligasi 10X H2O x µL y µL (corrispondenti a 50ng) 2 µL 2 µL a volume 20 µL - Incubare a 4°C overnight PLASMIDE RICEVENTE LINEARIZZATO FRAMMENTO LIGAZIONE Materiali: TAE (Tris/acetate/EDTA) electrophoresis buffer 50X 242 g Tris base 57.1 mL acido acetico glaciale 100 mL 0.5 M EDTA pH8.0 Portare a 1 L con H2O Loading buffer (6X) 0.25% Blu di bromofenolo 30% (w/v) glicerolo Gel di agarosio 1% guanti!! - pesare 1 g di agarosio in una beuta; - aggiungere 100 mL di tampone di corsa TAE 1X - sciogliere in forno a microonde - aggiungere 5 µL di etidio bromuro (stock 10 mg/mL) - colare il gel