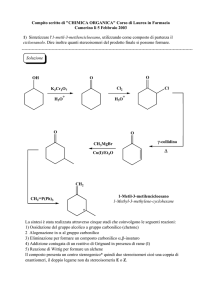
Reazioni Acido - Base
Alcune di queste slides riportano materiale gentilmente concesso
dal Dr. Valerio Di Marco- Dip. Scienze Chimiche – Univ. Padova
La definizione secondo Brønsted e Lawry di acido e base è:
ACIDO: Sostanza in grado di DONARE UN PROTONE (H+) in acqua
BASE: Sostanza in grado di ACETTARE UN PROTONE in acqua
HCl(g) = H + (aq) + Cl − (aq)
acido
base
NaOH(s) + H 2 O = Na + (aq) + OH − (solv) + H 2 O
base
acido
Le Reazioni acido-base sono reazioni all’equilibrio in cui un protone
viene ceduto o acquistato
(aq) = acquoso, (solv) = sovente, (s)= solido, (g) = gas
1
In acqua la specie H+ isolata non esiste, ma è sempre associata ad
altre molecole di acqua per cui la descriviamo come ione H3O+ .
HCl (g) + H2O (l) = Cl‒ (aq) + H3O+ (aq)
CH3COOH (aq) + H2O(solv) = CH3COO‒ (aq) + H3O+ (aq)
Acido acetico
La concentrazione di ioni H3O+ presenti in soluzione influenza fortemente le
proprietà della soluzione acquosa ed è di estrema importanza negli equilibri
anche di altre specie chimiche in soluzione.
Poiché può assumere valori in una vasta scala di concentrazioni che va da
1x10-14 M a 0.1 M è difficile riportare tali valori i un grafico lineare (noteremmo
solo quelli più alti), per cui la si esprime in genere in scala logaritmica ed è
stata definita una quantità derivata: pH
pH = −log10 [H 3O + ]
2
Scala del pH
pH = 1 corrisponde a [H3O+] = 10(-pH) = 1.0x10-1 M = 0.1 M
pH = 5.24 corrisponde a [H3O+] = 10(-pH) = 5.7 x10-6 M
pH = 12.47 corrisponde a [H3O+] = 10(-pH) = 3.9 x10-13 M
Se pH < 7 la soluzione si dice ACIDA
Se pH = 7 la soluzione si dice NEUTRA
Se pH > 7 la soluzione si dice BASICA
3
Scala del pH
http://www.easychem.com.
au/the-acidicenvironment/acids/ph-scale
http://www.eniscuola.net/it/acqua/contenuti
/inquinamento-dell-acqua/grafici-e-tabelle
4
AUTOPROTOLISI DELL’ACQUA
L’acqua pura in condizioni di equilibrio è parzialmente dissociata in ioni H3O+ e
Ioni OH-.
2H2O (solv) = H3O+ (aq) + OH‒ (aq)
Per calcolare la concentrazione a cui sono presenti tali ioni si ricorre a delle
equazioni che siano funzione delle varibili stesse e che pongano dei vincoli tra
loro come:
[H 3O + ] = [OH − ]
[H 3O + ][OH − ]
+
−
KW =
=
[H
O
][OH
]
3
2
[H 2 O]
[H 2 O] = 1
Bilancio di carica (*)
Costante di equilibrio
solvente
Per l’acqua a T=25º C = 298.15 K e pressione standard la costante di
equilibrio è:
KW = 1 x 10-14
e viene chiamata COSTANTE DI AUTOPROTOLISI DELL’ACQUA
(*) Deriva dalla condizione di elettroneutralità della soluzione macroscopica
5
Dipendenza della costante Kw dalla temperatura
T (°
°C)
Kw (mol2 dm-6)
pH
0
0.114 x 10-14
7.47
10
0.293 x 10-14
7.27
20
0.681 x 10-14
7.08
25
1.008 x 10-14
7.00
30
1.471 x 10-14
6.92
40
2.916 x 10-14
6.77
50
5.476 x 10-14
6.63
100
51.3 x 10-14
6.14
http://www.chemguide.co.uk/physical/acidbaseeqia/kw.html
6
La relazione imposta da Kw alle concentrazioni degli ioni H3O+ e OH‒ vale in
qualsiasi soluzione acquosa, anche in presenza di altre sostanze.
Anche per la concentrazione di OH‒ si può definire una grandezza logaritmica:
−
pOH = −log10 [OH ]
Esiste una relazione tra pH e pOH che deriva da Kw:
pH + pOH = pKW=-log10(Kw)=14
Dimostrazione:
K W = [H 3O + ][OH − ]
(
)
([H O ]) − log ([OH ])
- log10 (K W ) = − log10 [H 3O + ][OH − ]
- log10 (K W ) = − log10
+
3
−
10
pK W = pH + pOH
7
COSTANTE DI ACIDITA’
Quando una sostanza acida viene posta in soluzione acquosa si instaura il
seguente equilibrio generico di dissociazione:
HA (aq) + H2O (solv) = H3O+ (aq) + A‒ (aq)
La cui costante di equilibrio, detta costante di acidità è espressa da:
[A − ][H 3O + ]
Ka =
[HA]
Esempi:
HCl acido cloridrico Ka >> 1
CH3COOH acido acetico Ka = 1.75 x 10-5
HNO3 acido nitrico Ka >> 1
Ione ammonio (NH4+) Ka = 5.7 x 10-10
H2CO3 Ka1= 4.45 x 10-7 Ka2 = 4.69 x 10-11
8
COSTANTE DI BASICITA’
Quando una sostanza basica viene posta in soluzione acquosa si instaura il
seguente equilibrio generico di dissociazione:
B (aq) + H2O (solv) = BH+ (aq) + OH‒ (aq)
La cui costante di equilibrio, detta costante basicità è espressa da:
[BH + ][OH + ]
Kb =
[B]
Esempi:
NaOH idrossido di sodio Kb >> 1
NH3 ammoniaca Kb = 1.75 x 10-5
KOH idrossido di sodio Kb >> 1
HCO3‒ bicarbonato Kb = 2.24 x 10-8
CH3NH2 metilammina Kb = 4.4 x 10-4
9
COPPIE ACIDO-BASE CONIUGATE
Se si considera l’equilibrio di dissociazione acida :
HA (aq) + H2O (solv) = H3O+ (aq) + A‒ (aq)
HA ed A‒ sono rispettivamente un acido e una base, infatti se facciamo
reagire A− con l’acqua si ha:
A ‒ (aq) + H2O (solv) = HA (aq) + OH‒ (aq)
Le costanti di equilibrio per i due processi sono uguali a:
[A − ][H 3O + ]
Ka =
[HA]
[HA][OH − ]
Kb =
[A - ]
Queste costanti di equilibrio non sono indipendenti ma sono correlate
attraverso la costante di equilibrio di autoprotolisi dell’acqua:
Ka ⋅ Kb = Kw
10