Dispense CHIMICA GENERALE E ORGANICA (STAL)
2010/11
Prof. P. Carloni
LA CLASSIFICAZIONE PERIODICA DEGLI ELEMENTI
La tavola periodica e le proprietà degli elementi, dimensioni atomiche, energia di
ionizzazione, affinità elettronica, elettronegatività, carattere metallico.
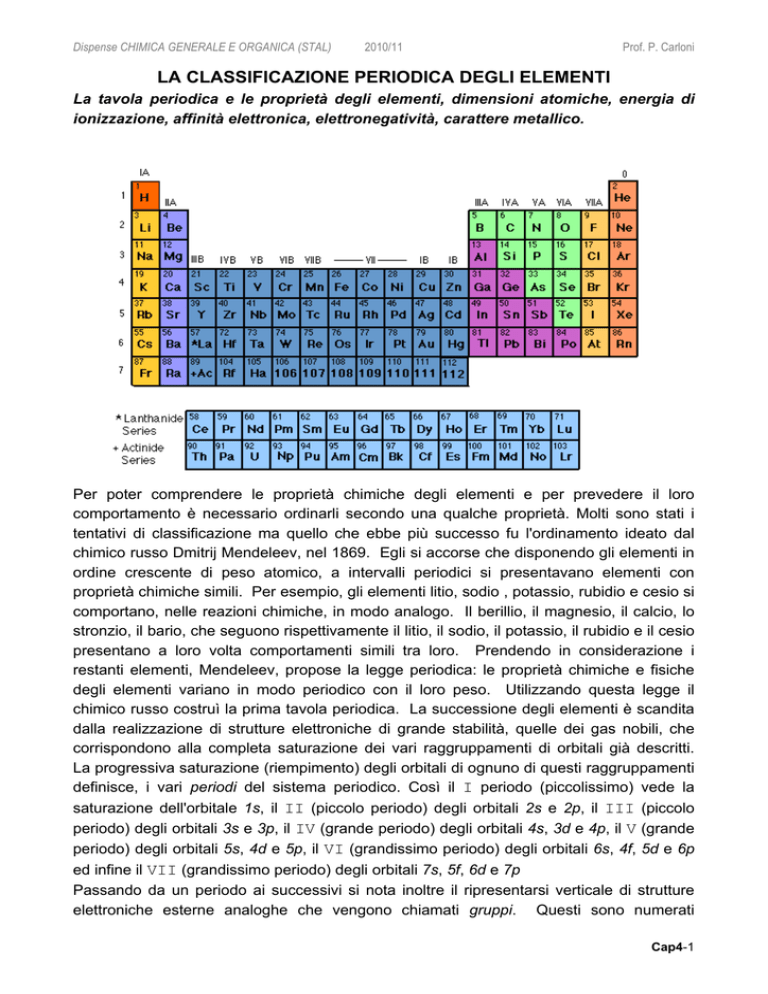
Per poter comprendere le proprietà chimiche degli elementi e per prevedere il loro
comportamento è necessario ordinarli secondo una qualche proprietà. Molti sono stati i
tentativi di classificazione ma quello che ebbe più successo fu l'ordinamento ideato dal
chimico russo Dmitrij Mendeleev, nel 1869. Egli si accorse che disponendo gli elementi in
ordine crescente di peso atomico, a intervalli periodici si presentavano elementi con
proprietà chimiche simili. Per esempio, gli elementi litio, sodio , potassio, rubidio e cesio si
comportano, nelle reazioni chimiche, in modo analogo. Il berillio, il magnesio, il calcio, lo
stronzio, il bario, che seguono rispettivamente il litio, il sodio, il potassio, il rubidio e il cesio
presentano a loro volta comportamenti simili tra loro. Prendendo in considerazione i
restanti elementi, Mendeleev, propose la legge periodica: le proprietà chimiche e fisiche
degli elementi variano in modo periodico con il loro peso. Utilizzando questa legge il
chimico russo costruì la prima tavola periodica. La successione degli elementi è scandita
dalla realizzazione di strutture elettroniche di grande stabilità, quelle dei gas nobili, che
corrispondono alla completa saturazione dei vari raggruppamenti di orbitali già descritti.
La progressiva saturazione (riempimento) degli orbitali di ognuno di questi raggruppamenti
definisce, i vari periodi del sistema periodico. Così il I periodo (piccolissimo) vede la
saturazione dell'orbitale 1s, il II (piccolo periodo) degli orbitali 2s e 2p, il III (piccolo
periodo) degli orbitali 3s e 3p, il IV (grande periodo) degli orbitali 4s, 3d e 4p, il V (grande
periodo) degli orbitali 5s, 4d e 5p, il VI (grandissimo periodo) degli orbitali 6s, 4f, 5d e 6p
ed infine il VII (grandissimo periodo) degli orbitali 7s, 5f, 6d e 7p
Passando da un periodo ai successivi si nota inoltre il ripresentarsi verticale di strutture
elettroniche esterne analoghe che vengono chiamati gruppi. Questi sono numerati
Cap4-1
Dispense CHIMICA GENERALE E ORGANICA (STAL)
2010/11
Prof. P. Carloni
progressivamente con le designazioni da I a VII, prescindendo dagli elementi della serie
di transizione (riempimento degli orbitali d) che intervallano, nei grandi periodi, il II dal
III gruppo e che sono distinti dagli altri. Ad ogni gruppo corrisponde una famiglia
naturale di elementi che descriveremo meglio in seguito. Il gruppo dei gas nobili, che
rappresentano i termini di chiusura di ogni periodo, è chiamato gruppo 0. Il numero
d'ordine dei vari gruppi indica il numero di elettroni di valenza presenti nell'atomo cioè il
numero di elettroni situati sugli orbitali di valenza (gli orbitali del livello elettronico più
esterno). Tale numero ci dà indicazioni sulla cosiddetta valenza cioè la capacità di un
atomo di combinarsi con altri atomi: resta così giustificata anche la designazione di gruppo
zero che si dà al gruppo dei gas nobili, tipici per la loro inerzia chimica dovuta al fatto che
hanno gli orbitali di valenza completamente saturi.
La rappresentazione periodica degli elementi permette di individuare quattro classi
fondamentali di elementi:
a)
Gas nobili
b)
Elementi tipici o rappresentativi
c)
Elementi delle serie normali di transizione
d)
Elementi delle serie interne di transizione
a) Gas nobili. Tutti i membri di questa classe, appartenenti al gruppo zero, hanno gli
orbitali di valenza saturi, con una configurazione esterna generalizzabile in ns2np6
(escluso l'elio che ha configurazione 1s2); tale configurazione dona loro una caratteristica
inerzia chimica in quanto l'aggiunta o la perdita di un elettrone ne aumenterebbe a
dismisura l'energia.
b) Elementi tipici o rappresentativi. I membri di questa classe corrispondono al progressivo
riempimento degli orbitali di valenza; tutti gli orbitali a più bassa energia sono saturi.
Appartengono a questa classe gli elementi i cui atomi hanno una configurazione
elettronica esterna variabile da ns1 a ns2np5 e precisamente:
I gruppo
ns1
metalli alcalini
II gruppo ns2
metalli alcalino-terrosi
III gruppo ns2np1
IV gruppo ns2np2
V gruppo
ns2np3
VI gruppo ns2np4
VII gruppo ns2np5
alogeni
Il loro comportamento chimico è determinato dalla tendenza più o meno marcata ad
acquistare o a perdere un certo numero di elettroni o a metterne in comune con altri atomi,
così da realizzare una configurazione elettronica analoga a quella del più vicino gas
nobile.
Metalli alcalini: essi hanno soltanto un elettrone sull’orbitale più esterno: esso può essere
quindi allontanato facilmente portando alla formazione di uno ione positivo avente una
configurazione elettronica uguale a quella del gas nobile che lo precede.
Metalli alcalino terrosi: hanno un doppietto elettronico (una coppia di elettroni) sull’orbitale
Cap4-2
Dispense CHIMICA GENERALE E ORGANICA (STAL)
2010/11
Prof. P. Carloni
più esterno, che può essere quindi allontanato facilmente portando alla formazione di uno
ione doppiamente positivo avente una configurazione elettronica uguale a quella del gas
nobile che lo precede.
Alogeni: ad essi manca un solo elettrone sugli orbitali più esterni, che può essere quindi
acquistato facilmente, portando alla formazione di uno ione negativo avente una
configurazione elettronica uguale a quella del gas nobile che lo segue.
Altri: per questi composti è difficile sia perdere che acquistare elettroni: essi tendono
dunque a mettere gli elettroni in comune con gli altri atomi.
c) Elementi delle serie normali di transizione. Li contraddistingue il progressivo
riempimento degli orbitali dei sottogruppi (n-1)d (essendo n il numero quantico che
corrisponde al periodo). Essi hanno tutti caratteristiche metalliche e possiedono tutti delle
caratteristiche fisiche simili. La loro chimica ha aspetti comuni molto evidenti come la gran
varietà di stati di ossidazione e la spiccata tendenza a dare numerosissimi composti di
coordinazione.
d) Elementi delle serie interne di transizione. Li contraddistingue il progressivo
riempimento degli orbitali dei sottogruppi (n-2)f (essendo n il numero quantico che
corrisponde al periodo).
Le proprietà degli elementi.
Abbiamo appena visto che sia la struttura elettronica che le proprietà fisiche e chimiche
degli elementi sono una funzione periodica del numero atomico: questa conclusione è di
solito chiamata legge periodica. Vediamo ora come alcune proprietà, quali le dimensioni
atomiche, l'energia di ionizzazione, l'affinità elettronica, l'elettronegatività ed il carattere
metallico variano lungo i gruppi e i periodi della tavola periodica.
Dimensioni atomiche.
Si definisce raggio atomico la metà della distanza minima di avvicinamento fra due atomi
della stessa specie in una molecola o in un cristallo. Lungo ogni periodo il raggio atomico
diminuisce gradualmente con l'aumento del numero atomico mentre scendendo lungo ogni
gruppo si ha un sensibile aumento del raggio medesimo. Questo può essere spiegato
ricordando che gli orbitali che si trovano su uno stesso livello energetico (stessa n) sono
caratterizzati da energia poco diversa, mentre fra orbitali di due raggruppamenti successivi
la differenza di energia è grande.
Quindi a mano a mano che si procede lungo un
periodo, gli elettroni che si aggiungono passando da un elemento ai successivi vanno ad
occupare orbitali pressappoco della stessa energia. Contemporaneamente però cresce la
carica nucleare e questo determina
una contrazione degli orbitali occupati,
e quindi della nuvola elettronica
avvolgente il nucleo e cioè del raggio
atomico. Passando invece da un
periodo al successivo, i nuovi elettroni
vanno
ad
occupare
orbitali
corrispondenti a livelli energetici
sempre più alti e perciò molto più
Cap4-3
Dispense CHIMICA GENERALE E ORGANICA (STAL)
2010/11
Prof. P. Carloni
espansi, così che si ha un aumento
del raggio atomico. Nelle serie di
transizione le variazioni del raggio
atomico sono minori e non regolari:
questo in quanto gli elettroni vanno ad
occupare
orbitali
interni,
del
sottogruppo (n-1)d per cui l'estensione
dell'orbitale esterno resta pressoché
costante e le variazioni del raggio
atomico risultano di piccola entità.
Energia di ionizzazione.
Si definisce energia di ionizzazione di
un atomo la quantità di energia necessaria per allontanare a distanza infinita dal nucleo
l'elettrone ad esso meno fortemente legato, cioè quello più esterno, trasformando l'atomo
considerato X in ione positivo X+. Esiste anche una energia di seconda ionizzazione che si
riferisce all'allontanamento di un secondo elettrone dallo ione positivo X+: questa è sempre
più alta di quella di prima ionizzazione.
Le variazioni dell'energia di prima ionizzazione sono riportate in grafico: i minimi assoluti
corrispondono agli elementi del I gruppo e i massimi assoluti agli elementi del gruppo 0;
lungo ogni periodo si ha un graduale incremento dovuto al fatto che gli elettroni più esterni
si trovano sempre più vicini al nucleo (vedi raggio atomico) e quindi su livelli energetici
sempre inferiori.
Nell'ambito di ogni gruppo un aumento del
numero atomico determina una diminuzione
dell'energia di ionizzazione: ciò deriva dal
fatto che entro ogni gruppo le dimensioni
atomiche aumentano procedendo dall'alto
verso il basso e l'elettrone più esterno si
muove a distanza sempre più grande dal
nucleo, con una energia corrispondente a
livelli sempre più alti.
Tanto più bassa è l'energia di ionizzazione,
e tanto più facilmente da un atomo neutro può originarsi uno ione positivo, ossia tanto più
elettropositivo è il carattere dell'elemento considerato.
Affinità elettronica.
Si definisce affinità elettronica di un atomo l'energia liberata quando ad un atomo neutro,
supposto isolato ed allo stato fondamentale, viene addizionato un elettrone, e rappresenta
l'energia di legame tra l'elettrone aggiunto e l'atomo X: essa ha quindi segno negativo
(cessione di energia) come tutte le energie di legame.
Dai dati disponibili si rivela, come andamento generale, la tendenza dell'affinità elettronica
ad aumentare in valore assoluto (diventa più negativa) procedendo da sinistra a destra
Cap4-4
Dispense CHIMICA GENERALE E ORGANICA (STAL)
2010/11
Prof. P. Carloni
lungo un periodo: questo perché andando in questa direzione aumenta la tendenza degli
atomi ad acquistare elettroni. Riguardo alla variazione della affinità elettronica nell'ambito
di uno stesso gruppo, c'è da osservare che essa decresce, in valore assoluto, con
l'aumentare del numero atomico, cioè dall'alto al basso: ciò è naturale, perché negli atomi
di piccole dimensioni l'attrazione di un elettrone da parte del nucleo è più energica per il
più alto valore del campo elettrico.
Si possono definire le affinità elettroniche del secondo ordine o di ordine superiore, relative
all'addizione non di uno ma di due o più elettroni agli atomi neutri: esse risultano di solito di
segno opposto.
Elettronegatività.
Come gli elementi che hanno bassa energia di ionizzazione sono spiccatamente
elettropositivi, così quelli che hanno una elevata affinità elettronica (in valore assoluto),
tendendo a dare ioni negativi, sono tipicamente elettronegativi.
Il concetto di elettronegatività è di grande importanza nella chimica: l'elettronegatività è
una misura della capacità di un atomo di attrarre elettroni quando prende parte ad un
legame covalente. Il concetto di elettronegatività fu introdotto nel 1932 da Linus Pauling
che propose la scala di elettronegatività che ne porta il nome. Sono state proposte varie
scale di elettronegatività, le più utilizzate sono quella di Pauling e quella di Mulliken.
L'elettronegatività comunque, in tutte le scale che sono state proposte, varia spostandosi
sulla Tavola Periodica in modo analogo, indipendentemente dai valori assoluti dati nelle
varie scale: aumenta andando da sinistra a destra lungo i periodi della tavola periodica
(perché diminuiscono le dimensioni degli atomi ed aumenta la loro carica nucleare) e
diminuisce scendendo dall'alto in basso lungo i gruppi (perché aumentano le dimensioni
degli atomi pur aumentando la carica nucleare).
Carattere metallico.
Gli elementi chimici si possono classificare nei due grandi gruppi dei metalli e dei non
metalli: alla base di questa classificazione vi è l'entità delle forze attrattive che legano nei
loro atomi gli elettroni più esterni al nucleo. Gli elementi i cui atomi sono caratterizzati da
deboli forze attrattive fra elettroni esterni e nucleo, tali da conferire agli elettroni stessi una
notevole mobilità, costituiscono la classe dei metalli. Quelli che hanno caratteristiche
opposte e cioè i cui elettroni sono saldamente legati al nucleo costituiscono la classe dei
non metalli.
A questo punto possiamo raccogliere in un
unico quadro di insieme l'andamento generale
delle proprietà degli elementi fino a qui
esaminate,
che
sono
particolarmente
significative per la caratterizzazione del loro
comportamento chimico, del tipo di legami con
cui sono sostituiti i loro composti e delle
proprietà fondamentali di questi.
Cap4-5
Dispense CHIMICA GENERALE E ORGANICA (STAL)
×
2010/11
Ö
Õ
Cap4-6
Prof. P. Carloni
Ø












