15
Onde elettromagnetiche e materia
Questo capitolo si ricollega idealmente alle introduzioni
a elettromagnetismo e relatività sviluppate nel Capitolo
11. Dalle leggi di Maxwell si ricava, in modo intuitivo,
l’espressione del campo elettrico dell’onda elettromagnetica prodotta da un dipolo oscillante; si mostra così
che l’energia elettromagnetica presente nello spazio privo di cariche è dovuta quasi esclusivamente a onde elettromagnetiche. I risultati fondamentali della teoria della
relatività servono per introdurre il dualismo onda-particella che è alla base della descrizione quantistica di materia e radiazione.
Dal punto di vista concettuale, lo scopo del capitolo è
di illustrare la potenza esplicativa del principio di conservazione dell’energia, il quale fissa le regole delle interazioni tra radiazione e materia. Il capitolo vuole anche fornire in modo sintetico informazioni che sono fondamentali in altre discipline (quali chimica e scienze sanitarie) o di enorme importanza tecnologica e culturale
(come la fisica nucleare).
come nulla si crede essere la carica elettrica complessiva
dell’Universo.
Consideriamo un dipolo elettrico D costituito da una
carica positiva q fissa in O e una uguale, e di segno opposto, che si può muovere tra z0 e −z0. A una distanza
r >> z0 il campo elettrostatico prodotto dal dipolo è proporzionale a 1/r3, sia nel caso di un punto sulla normale
all’asse del dipolo Estat⊥(r) sia in quello di un punto
sull’asse del dipolo, Estat||(r):
z
z
E stat⊥ (r ) ≈ | E − | 0 ∝ 0
r
r3
15.1
1
1
≈
E stat|| (r ) ∝ 2 −
(r + z 0 ) 2
r
1
≈ 2
r
2z0
1
1 −
≈
1 + 2z0 / r r 3
E+
15.1 Il dipolo elettrico oscillante
Un’onda elettromagnetica è prodotta da una carica accelerata: questa genera campi magnetici variabili a cui sono
associati campi elettrici variabili secondo relazioni spazio-temporali descritte dalle equazioni di Maxwell. Mostriamo innanzitutto che il meccanismo dell’onda elettromagnetica è in grado di trasmettere campi elettromagnetici a grandi distanze, dove i corrispondenti campi
coulombiani “statici” sono trascurabili. Trattiamo il caso
del generatore di onde elettromagnetiche più comune e
più facile per noi da realizzare: un dipolo elettrico oscillante. Il dipolo elettrico ha una importante proprietà: ha
carica complessiva nulla, come nulla è, nella maggior
parte dei casi, la carica della materia che ci circonda e
Estat||(r)
z
E−
O
−z0
Estat⊥ (r
_
z0
D
+
r
E−
E+
Eonda = cost
Se la carica negativa oscilla come indicato in figura, anche il campo elettrostatico prodotto a una distanza r dal
332 Capitolo 15
dipolo oscillerà, assumendo il valore che si avrebbe per
un dipolo statico con un ritardo di tempo di circa r/c.
Oltre a tale campo elettrostatico ritardato occorre
prendere in considerazione il campo elettrico Eonda associato alla propagazione dell’onda elettromagnetica che
può avvenire solo lungo direzioni normali a quella di oscillazione di Estat. L’energia trasportata da tale onda
nell’unità di tempo attraverso l’unità di superficie normale alla direzione di propagazione è l’intensità della radiazione, ed è proporzionale a E2onda. Poiché l’energia
irradiata dal dipolo si distribuisce su superfici sempre più
ampie, l’intensità della radiazione deve diminuire con la
stessa legge del quadrato della distanza secondo cui aumentano tali superfici:
1
1
2
E onda
∝ 2 ⇒ E onda ∝
r
r
d 2 r'
4πε0 c 2 dt 2 r '
q
q
4πε0 c 2 r '
a ⊥ (t − r '/ c)
15.4
ossia il campo dell’onda è proporzionale alla proiezione
dell’accelerazione della carica, a⊥, in un piano normale a
r'. Secondo la 15.3, gli spostamenti della carica nella direzione di r' non cambiano il versore r'/|r'| e non producono perciò alcun campo radiante
d 2D
dt
Bonda
2
r´
_
D
a
r
16.2
P
Eonda
_
z
Dal confronto con la 16.1 si ha che il campo elettrico trasmesso mediante un’onda elettromagnetica diminuisce
molto meno rapidamente con la distanza del campo elettrostatico di tipo coulombiano del dipolo: da una certa distanza in poi quest’ultimo sarà del tutto trascurabile rispetto al campo elettrico dovuto all’onda che si propaga.
Anche per dipoli oscillanti lentamente, a distanze sufficientemente grandi dagli stessi, solo il campo elettromagnetico radiante esiste!
L’energia irraggiata non si distribuisce uniformemente in tutte le direzioni: l’onda elettromagnetica, essendo
trasversale, non si può propagare lungo l’asse del dipolo
perché il campo elettrico è qui sempre parallelo all’asse.
La curva continua della figura precedente unisce i punti
del piano del disegno nei quali il campo elettrico
dell’onda prodotta dal dipolo oscillante ha la stessa ampiezza: Eonda = costante.
Purtroppo le equazioni di Maxwell portano a formule
complicate quando si vuole descrivere esattamente il
campo elettromagnetico di una carica in moto. Si potrebbe mostrare che l’onda prodotta dalla carica oscillante −q
in un generico punto P è data da
E onda ( P, t ) =
( )
E onda P, t =
15.3
dove r' è il vettore congiungente P alla posizione occupata dalla carica al tempo t − r'/c. La radiazione che raggiunge un osservatore dipende dall’ampiezza dell’angolo
sotto cui vede oscillare la carica. Per grandi distanze dal
dipolo r' >> z0 e per velocità della carica molto minori
della velocità c della luce la 15.3 diventa, in modulo,
y
x
L’Equazione 15.4 conferma il ragionamento intuitivo secondo cui l’energia irraggiata non è uniformemente distribuita su una superficie sferica attorno al dipolo. Infatti
il campo elettrico prodotto dal dipolo è prevalentemente
diretto come l’asse di questo e un’onda elettromagnetica
si propaga solo perpendicolarmente alla direzione di vibrazione del campo elettrico.
15.1.1
La generazione delle onde
elettromagnetiche
La frequenza dell’onda elettromagnetica generata da un
dipolo oscillante è, ovviamente, pari a quella di oscillazione del dipolo. Nei primi esperimenti di Hertz sulle onde elettromagnetiche il dipolo elettrico variabile era costituito dai due piatti di un condensatore elettrico a facce
piane e parallele: scaricando il condensatore attraverso
una induttanza (vedi Capitolo 14) Hertz otteneva che la
carica di un piatto passasse in breve tempo da positiva a
negativa, ossia che il dipolo elettrico oscillasse. Nei circuiti elettrici le frequenze di oscillazione delle correnti
che caricano/scaricano i condensatori (ossia i dipoli elettrici) dipendono principalmente dai valori di induttanze,
resistenze e capacità; possono essere influenzate anche
dalle dimensioni fisiche dei vari componenti e raggiungono oggi valori sino a circa 1011 Hz. Per ottenere frequenze più elevate si può ricorrere a sistemi atomici: più
Onde elettromagnetiche e materia 333
leggera è la carica elettrica e più intensa è la forza elastica che la riporta alla posizione di equilibrio, maggiore è
la frequenza propria dell’oscillazione attorno alla posizione di equilibrio, e quindi maggiore è la frequenza
dell’onda elettromagnetica. Le onde elettromagnetiche
prodotte spontaneamente dal moto di elettroni di valenza
in atomi e molecole coprono l’intervallo di frequenze che
va da 1010 Hz a 1018 Hz, regno delle varie spettroscopie
“ottiche”, come la spettroscopia dell’infrarosso (IR), la
spettroscopia Raman(*), quella del visibile e quella
dell’ultravioletto (UV).
È abbastanza facile fornire a elettroni sotto vuoto energie cinetiche molto maggiori di quelle possedute nella
materia condensata ordinaria e poi modificarne la velocità mediante urti con atomi o mediante campi magnetici
deflettenti, come nel ciclotrone e nel sincrotrone, due tipi
di acceleratori di particelle. Le Equazioni 15.3 e 15.4 collegano l’accelerazione della carica con intensità e direzione del campo elettrico prodotto. Con tecniche di questo tipo si producono per esempio i raggi X, aventi frequenze comprese tra 1017 e 1020 Hz circa.
Per ottenere frequenze ancora più elevate si possono
utilizzare le forze nucleari (o interazioni forti) che, vincendo la repulsione elettrostatica, mantengono unite le
cariche positive nei nuclei atomici; i raggi γ sono prodotti naturalmente durante reazioni che portano a rompere
(reazione di fissione) o a unire tra loro (reazioni di fusione) nuclei atomici o loro frammenti.
energia E proporzionale alla frequenza ν:
E = hν
dove h = 6.63(10−34) J⋅s è la costante di Planck(**). Le
equazioni di Maxwell sono una approssimazione “continua” di un fenomeno che, se osservato con strumenti
sufficientemente sensibili, si rivela invece sempre nel suo
aspetto “quantistico”, ossia discreto.
È da circa due secoli che siamo certi del fatto che la
materia sia costituita da “atomi”, ossia da entità discrete.
Tuttavia la fisica classica, oltre che trattare il “punto materiale”, aveva via via raffinato gli strumenti matematici
capaci di descrivere entità infinitamente divisibili, o
“continue”, quali ci appaiono, per esempio, gli oggetti
materiali. Non si pensava vi fosse alcunché di errato in
questa idealizzazione, fino a quando un secolo fa esperimenti diversi hanno indicato con chiarezza che non solo
la materia, ma anche la radiazione elettromagnetica è, per
sua natura, discreta. Ne è nata la necessità di un formalismo, la meccanica quantistica, capace di descrivere oggetti che hanno allo stesso tempo caratteristiche di particelle e di onde.
Secondo la relatività di Einstein (vedi Capitolo 11) la
massa è una forma di energia; perciò al fotone, in base alla 15.5, può essere assegnata sia una massa (m) sia una
quantità di moto (q)
m=
*
( ) La spettroscopia Raman analizza la luce diffusa da una
sostanza in funzione della differenza di frequenza tra luce incidente e luce diffusa stessa. Le spettroscopie dell’infrarosso, visibile e dell’ultravioletto solitamente determinano, in funzione
della lunghezza d’onda, quale sia la riduzione di intensità di
un’onda che attraversa un campione.
E
c
15.2 Onde e particelle
Il dipolo oscillante risolto con le equazioni di Maxwell
getta luce su alcune delle regole che governano la produzione di onde elettromagnetiche. A cavallo tra Ottocento
e Novecento una serie di osservazioni sperimentali sembrano però mettere in crisi l’intera teoria di Maxwell: in
certi esperimenti l’onda elettromagnetica pare comportarsi più come particella che come onda. Ritorna in una
nuova veste la teoria corpuscolare della luce grazie a un
fatto che i fisici fecero una grande fatica ad accettare:
un’onda elettromagnetica consiste sempre di unità elementari indivisibili, dette fotoni, caratterizzate da una
15.5
2
=
hν
c
2
q = mc =
hν
c
15.6
Si può perciò pensare al fotone come a una particella con
una lunghezza d’onda (λ) inversamente proporzionale al
suo impulso q:
λ=
c
ν
=
h
h
⇒λ =
hν
q
c
15.7
Come accennato nel Capitolo 11, se un’onda è pensabile
come una particella con massa, così una particella materiale dotata di un impulso q potrebbe essere pensata come
(**) Sul finire del secolo scorso Planck introdusse la “quan-
tizzazione” delle onde elettromagnetiche come ipotesi ad hoc
per interpretare lo spettro del corpo nero; nel 1905 Einstein postulò l’equazione 15.5 per spiegare l’effetto fotoelettrico (vedi
seguito), ma ricevette per questo il premio Nobel solo una ventina d’anni più tardi, quando cessarono le controversie sulla
quantizzazione del campo elettromagnetico. Inoltre Einstein
considerò per tutta la vita l’ipotesi di quantizzazione un ripiego
in attesa di una teoria più soddisfacente (vedi Capitoli 11 e 16).
334 Capitolo 15
un’onda con lunghezza d’onda data dalla 15.7. Questa
idea fu per la prima volta esposta nella tesi di laurea in fisica di Louis de Broglie (Parigi, 1924). Con questa ipotesi si può giustificare intuitivamente la regola di quantizzazione di Bohr introdotta a proposito del momento magnetico dell’elettrone (Capitolo 13). Infatti, secondo la
meccanica di Newton, un elettrone (massa me, carica −e)
può occupare un’orbita di raggio qualunque attorno al
nucleo di idrogeno (1H). Ma se l’elettrone è anche
un’onda, saranno speciali le orbite per le quali la circonferenza dell’orbita è pari a un numero intero n di lunghezze d’onda date dalla 15.7:
2πr = nλ = n
h
h
⇒ me vr = n
= nh
me v
2π
15.8
Per analogia con il trattamento di corde vibranti e strumenti musicali (Capitolo 7) si diranno stazionarie queste
orbite atomiche. L’ultima espressione nella 15.8 si legge:
il momento della quantità di moto dell’elettrone in
un’orbita stazionaria attorno a un nucleo è un multiplo intero di “acca-tagliato”, h .
15.2.1
Emissione e assorbimento
di radiazione
Il fatto che un’onda elettromagnetica consista di entità discrete semplifica il problema della sua interazione con un
sistema materiale, problema che tanto aveva preoccupato
Lorentz. Si può pensare al fotone come a una particella e
all’interazione come all’urto meccanico tra due oggetti;
l’energia complessiva prima dell’urto deve essere uguale
a quella dopo l’urto(☯). Se un fotone è assorbito (ha cioè
energia nulla dopo l’urto) l’energia del sistema materiale
deve aumentare di hν. Perché questo accada la differenza
tra energia iniziale e finale del sistema materiale deve essere pari a hν:
Efin − Ein = hν
15.9
(☯) Anche la quantità di moto di (fotone + sistema materia-
le) si conserva durante l’interazione. Tuttavia con la 15.6 si può
dimostrare che la quantità di moto del fotone è solitamente una
frazione trascurabile di quella di una particella materiale. Fanno
eccezione i fotoni più ricchi di energia (raggi γ). Gli effetti legati alla conservazione della quantità di moto complessiva
quando fotoni ad alta energia interagiscono con nuclei nella
materia condensata sono alla base della spettroscopia Mössbauer.
Come consuetudine, rappresentiamo i livelli energetici
del sistema (E1, E2, ...) con barre normali a un asse verticale delle energie e i processi di assorbimento ed emissione di un fotone come spostamenti di una pallina (che
indica l’energia del sistema) tra i livelli energetici.
assorbimento
E2
hν=E2−E1
E1
emissione
spontanea
hν=E2−E1
L’Equazione 15.9 afferma che affinché un sistema possa
assorbire o emettere un fotone a frequenza ν è necessaria
la presenza di stati, o “livelli”, del sistema le cui energie
differiscano di hν.
Ci aspettiamo che un sistema materiale su un livello
energeticamente ricco tenda naturalmente a portarsi al livello di energia minimo. Tuttavia, il tempo richiesto perché questo processo spontaneo avvenga, con la conseguente emissione di un fotone, può essere anche molto
lungo. Il processo di emissione viene grandemente accelerato quando il sistema è investito da un fotone di frequenza pari a quella del fotone che verrebbe emesso per
processo spontaneo.
E2
hν=E2−E1
E1
emissione
stimolata
hν=E2−E1
Il fotone incidente non viene assorbito e il sistema emette
un fotone avente la stessa fase della radiazione incidente,
la quale viene perciò amplificata (emissione coerente).
Questo processo di emissione stimolata è alla base del
funzionamento dei laser, nei quali occorre fornire (per
via elettrica, chimica o elettromagnetica) l’energia necessaria per mantenere il sistema prevalentemente nello stato
a energia superiore E2.
Sperimentalmente e teoricamente si trova che la probabilità che due fotoni con frequenza ν/2 riescano a modificare di hν l’energia del sistema (processo consentito
in linea di principio dalla conservazione dell’energia) è
quasi sempre trascurabile. Questo implica che ogni fotone agisce in modo praticamente indipendente dai suoi si-
Onde elettromagnetiche e materia 335
mili, ossia il principio di sovrapposizione si applica anche all’interazione radiazione-materia. Una importantissima conseguenza è che gli effetti di una radiazione elettromagnetica a frequenza ν si devono analizzare considerando in primo luogo il ruolo che l’energia specifica della radiazione hν riveste per il sistema. Per esempio, se un
fotone a frequenza 2ν ha a stento l’energia sufficiente
per estrarre un elettrone da un metallo, non vi è praticamente alcuna possibilità che due fotoni a frequenza ν riescano a fare altrettanto.
L’effetto fotoelettrico consiste nell’emissione di un
elettrone da parte della materia a seguito di assorbimento
di radiazione elettromagnetica: l’elettrone passa da uno
stato “legato” allo stato “libero”. L’elettrone non viene
emesso quando l’energia hν è al di sotto di una soglia caratteristica del sistema, che è detta energia di ionizzazione, pari all’energia di legame dell’elettrone nella materia(☯). Si trova inoltre che l’energia cinetica massima
dell’elettrone emesso è circa pari alla differenza tra hν ed
energia di ionizzazione.
L’effetto Compton consiste nella diffusione della radiazione elettromagnetica da parte di una particella carica
libera, ossia nella generazione di un’onda elettromagnetica che si propaga in direzione diversa da quella originale.
Tale effetto può essere descritto mediante il formalismo
degli urti elastici (vedi Esercizio R15.4). La quantità di
moto del fotone assorbito da una carica inizialmente ferma deve essere uguale alla somma di quantità di moto del
fotone diffuso e quantità di moto finale della carica;
l’energia iniziale, hν, deve essere pari all’energia del fotone diffuso, hν', più l’energia cinetica finale “di rinculo”
della carica. Dal punto di vista del fotone emesso il processo è anelastico (l’energia fotonica non si conserva) e
incoerente (non vi è relazione di fase tra onda incidente e
onda emessa).
Il principio di conservazione dell’energia si applica a
ogni caso di interazione radiazione-materia, anche quando la radiazione è costituita da onde di particelle anziché
da onde elettromagnetiche. Il parametro più importante
della radiazione è la sua energia specifica: hν per un fotone, mv2/2 per una particella classica, non relativistica e
libera. Per il sistema materiale è importante lo spettro
energetico, ossia la distribuzione delle energie caratte(☯) In un atomo o molecola si intende come energia di io-
nizzazione l’energia minima richiesta per liberare un elettrone.
In un metallo una parte degli elettroni non è legata a un atomo
in particolare, ma va pensata come costituente un gas che riempie uniformemente l’intero conduttore. L’energia di ionizzazione in questo caso è spesso chiamata lavoro di estrazione.
rizzanti i possibili stati del sistema. Conoscendo lo spettro energetico si può predire come il sistema risponde alla
radiazione. Viceversa, studiando la radiazione emessa o
assorbita si hanno informazioni sullo spettro energetico
del sistema. Per questo i metodi basati sull’analisi della
radiazione si dicono spettroscopie.
15.3 I livelli energetici degli atomi
Per la meccanica classica la forza coulombiana di attrazione tra elettrone e nucleo di idrogeno (carica e) è proporzionale all’accelerazione centripeta dell’elettrone in
orbita intorno al nucleo:
e2
4πε 0 r
2
=
me v 2
r
15.10
dove r è il raggio dell’orbita, supposta circolare, e v è la
velocità dell’elettrone; l’elettrone possiede un’energia Ee
che è somma di un termine cinetico e uno potenziale (negativo):
m v2
m v2
e2
1 e2
−
=−
=− e
Ee= e
2
4πε 0 r
2 4πε 0 r
2
15.11
dove si è sfruttata la relazione 15.10 (moltiplicata per r/2)
e l’energia potenziale è stata assunta nulla a distanza infinita. Essendo l’elettrone in moto circolare, quindi accelerato, per la fisica classica dovrebbe produrre onde elettromagnetiche alla sua frequenza di rotazione. Secondo la
15.4 dovrebbe emettere perciò energia assumendo energie potenziali sempre più negative (e quindi minori) e
muovendosi su orbite sempre più piccole e non stazionarie (vedi 15.8). Per la meccanica quantistica invece
l’elettrone occupa solo orbite stazionarie e può emettere
o assorbire un fotone solo passando da un’orbita stazionaria a un altra. Calcoliamo ora raggio r(n) ed energia
Ee(n) di un’orbita stazionaria generica introducendo la
15.8 nella 15.10:
4πε0 n 2 h 2
e2
n2h2
= me v 2 =
⇒
r
(
n
)
=
4πε0r (n)
me r 2 (n)
me e 2
Sostituendo r(n) nell’espressione dell’energia 15.11 si ha:
E e (n) = −
m e4 1
1
e2
= − e2 2 2
2 4πε 0 r ( n)
8ε 0 h n
15.12
La lunghezza d’onda λ del fotone emesso quando l’elet-
336 Capitolo 15
trone passa dall’orbita stazionaria n1 alla n2 (n1 > n2) è
1
λ
=
ν
c
=
1
me e 4 1
1
1
= RH
15.13
−
2 − 2
2 3 2
2
8ε0 h c n2 n1
n2 n1
1s, 2s, ... dove il primo numero indica il numero quantico
principale, n, e il simbolo s significa orbita sferica, ossia
con momento angolare totale nullo.
−
dove si è introdotta la costante di Rydberg
RH =
me e 4
8ε02 h 3c
7
≈ 1097
. (10 ) m
−1
+
+
15.14
che fu determinata sperimentalmente molto prima che potesse essere interpretata in termini di altre costanti fondamentali: velocità della luce, massa e carica dell’elettrone, costante di Planck.
Quando si tratta dell’interazione tra fotoni ed elettroni
legati a un atomo, un’unità conveniente di energia è
l’elettronvolt, eV:
1 eV =1.6(10−19) C V = 1.6(10−19) J
a cui corrisponde una frequenza di circa 2.4 × 1014 Hz, di
poco inferiore a quella della luce rossa (∼ 4 × 1014 Hz).
Infatti dalla 15.12 si ottiene per l’energia del primo livello (n = 1) dell’atomo di idrogeno (uguale, in modulo,
all’energia di ionizzazione dell’idrogeno atomico):
Ee(1) = −2.18(10−18) J = −13.6 eV
a cui corrisponde una frequenza nell’ultravioletto (vedi
seguito) di circa cinque volte superiore alla frequenza
della luce blu (νblu ∼ 6(1014) Hz). L’elettronvolt e i suoi
multipli (keV, MeV, GeV, TeV) sono usati anche per descrivere le energie di cariche libere accelerate da grandi
differenze di potenziale e le energie dei fotoni che queste
cariche producono interagendo con altre particelle.
Il parallelo tra onde stazionarie in un sistema elastico
monodimensionale e orbite stazionarie dell’elettrone di
un atomo d’idrogeno permette di descrivere solo le “orbite” dell’elettrone aventi simmetria sferica, caratterizzate dal solo numero quantico principale n, con n − 1 nodi. Si può visualizzare lo stato a energia minima
dell’elettrone dell’idrogeno (n = 1) all’incirca come una
sfera attorno a 1H dove la funzione d’onda dell’elettrone
è apprezzabilmente diversa da zero. Lo stato con n = 2 e
momento angolare nullo è una sfera dove la funzione
d’onda è “positiva”, circondata, dopo una zona “proibita”
(il nodo), da uno spesso “guscio” dove tale funzione ha
segno “negativo”.
Gli stati a simmetria sferica vengono indicati con ns:
−
1s
2s
Per completare la descrizione degli stati, o funzioni
d’onda, dell’elettrone nell’atomo di idrogeno occorrerebbe introdurre a un livello meno empirico il formalismo
quantistico, cosa che qui non faremo. Citeremo solo i risultati che si ottengono analizzando separatamente le diverse parti nelle quali può essere fattorizzata la funzione
d’onda. Come per il numero quantico principale, si trovano soluzioni che sono descritte da un insieme discreto
di numeri interi detti numeri quantici.
Quando n > 1 sono possibili distribuzioni non sferiche
per l’elettrone nelle quali il momento angolare totale
dell’elettrone è pari a un multiplo intero di acca-tagliato,
l⋅ h , dove l è un intero, sempre minore di n, chiamato
numero quantico angolare. Vi sono 3 stati con l = 1,
indicati con “p”, per i quali il momento angolare totale
vale h . Questi tre stati corrispondono a tre differenti
numeri quantici magnetici m, con |m| ≤ l , ossia m = 1,
m = 0, m = −1 i quali descrivono l’orientazione
dell’orbita nello spazio. Quando n ≥ 3 sono possibili stati
“d” con momento angolare totale l = 2, identificati dai
cinque numeri quantici magnetici m da −2 a +2.
L’insieme delle orbite con lo stesso numero quantico
principale n formano un “guscio” (shell) e, nel caso
dell’atomo di idrogeno, hanno un’energia determinata
dalla 15.2. Le funzioni d’onda orbitali dell’atomo di
idrogeno, il loro numero totale in ciascun guscio e la loro
energia di ionizzazione −Ee(n) (espresse in elettronvolt)
sono
n
l −Ee(n)[eV] simbolo
1
2
0
0
1
0
1
3
13.60
3.40
3.40
1.51
1.51
1s
2s
2p
3s
3p
m
totale
0
0
+1, 0, −1
0
+1, 0, −1
1
4
Onde elettromagnetiche e materia 337
2
1.51
+2, +1, 0, −1, −2
3d
9
15.3.1 La tabella periodica degli elementi
Molto prima della scoperta delle regole dei quanti, Mendeleev (1869) aveva trovato regolarità nelle proprietà degli elementi tabulati sulla base del loro peso atomico. Di
seguito presentiamo i primi 30 elementi e forniamo
l’interpretazione delle loro proprietà chimiche fornita
dalla teoria quantistica.
−Ee
[eV]
Z
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
H
He
Li
Be
B
C
N
O
F
Ne
Na
Mg
Al
Si
P
S
Cl
A
K
Ca
Sc
Ti
V
Cr
Mo
Fe
Co
Ni
Cu
Zn
13.6
24.6
5.4
9.3
8.3
11.3
14.5
13.6
17.4
21.6
5.1
7.6
6.0
8.1
10.5
10.4
13.0
15.8
4.3
6.1
6.5
6.8
6.7
6.8
7.4
7.9
7.9
7.6
7.7
9.4
occupazione dello stato
1s
1
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2s
2p
3s
3p
1
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
1
2
3
4
5
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
1
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
1
2
3
4
5
6
6
6
6
6
6
6
6
6
6
6
6
6
3d
4s
può essere svolto solo in modo approssimato. Si trova
che ogni “orbita” o funzione d’onda spaziale può essere
condivisa al più da due elettroni che si possono visualizzare come rotanti su se stessi in versi opposti, uno con
momento angolare intrinseco (o di spin Sz) pari a + h /2 e
l’altro con Sz = − h /2. Inoltre, in genere, l’energia aumenta all’aumentare sia di n sia del numero quantico angolare l e dipende ovviamente dal numero totale di elettroni presenti. Il criterio secondo cui gli Z elettroni di un
atomo neutro occupano via via le orbite a energia minore
disponibili è riassunto dal principio di esclusione di
Pauli: un atomo non può contenere due elettroni aventi
gli stessi numeri quantici orbitali (n, l, m) e di spin
(sz = ±1/2). Vi sono perciò al più due elettroni nel primo
guscio, otto nel secondo, diciotto nel terzo, e così via. La
tabella precedente fornisce, per i primi trenta elementi
della tavola periodica, il numero atomico (Z), l’energia di
ionizzazione −Ee, e il numero di elettroni nei vari stati o
gusci. Gli elettroni in un guscio completo o semicompleto
(livelli s e p occupati) hanno una energia di ionizzazione
particolarmente elevata: tale configurazione, particolarmente stabile, corrisponde a quella dei gas nobili che non
si combinano con gli altri elementi. Nella tabella si sono
rappresentati in grigio gli elettroni dei gusci completi o
semicompleti, o elettroni del nocciolo (core electrons).
Le proprietà chimiche dipendono in larga misura dall’energia di ionizzazione e sono determinate in buona parte
dagli elettroni esterni al nocciolo, detti anche elettroni di
valenza, rappresentati nelle caselle in bianco.
15.4 La radiazione elettromagnetica
1
2
3
5
5
6
7
8
10
10
1
2
2
2
2
1
2
2
2
2
1
2
In presenza di più elettroni, e di nuclei con numero atomico Z > 1, il calcolo delle funzioni d’onda elettroniche
15.4.1 Scale di energia e frequenza
Un’onda elettromagnetica a frequenza ν ha una energia
specifica hν e una lunghezza d’onda λ = c/ν nel vuoto.
Anche se è equivalente parlare di frequenza, energia specifica o lunghezza d’onda nel vuoto, gli spettroscopisti
preferiscono parlare di lunghezza d’onda, in quanto usano spesso reticoli di diffrazione che separano le varie
componenti della radiazione in base alle differenti lunghezze d’onda. D’altro canto, i fisici teorici preferiscono
parlare dell’energia del fotone.
Discutendo il principio di equipartizione dell’energia
(Capitolo 9) si è trovato che una particella descritta da tre
coordinate (o gradi di libertà) ha un’energia cinetica di
3
k BT ( K )
2
338 Capitolo 15
Inoltre un corpo nero a temperatura T (espressa in kelvin)
emette di preferenza onde elettromagnetiche alla frequenza
ν ≈5
kB
T
h
15.15
Secondo questa relazione, alle temperature prossime a
quella “ambiente” (300 K) corrispondono frequenze
nell’infrarosso, mentre al colore rosso corrisponde una
temperatura di circa 4000 K. Esprimere una frequenza in
una scala di temperatura ha significato in astrofisica, dove si parla di temperatura delle stelle e temperatura della
radiazione primordiale (background radiation) e in fisica dello stato solido, dove si deve spesso confrontare
l’energia termica con l’energia specifica della radiazione.
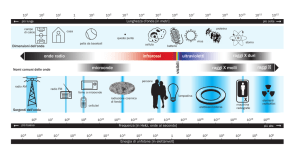
I nomi della radiazione elettromagnetica cambiano al
variare della frequenza. La tabella seguente esprime nelle
varie unità i confini approssimativi tra le regioni dello
spettro elettromagnetico.
onde radio
microonde
infrarosso
visibile
ultravioletto
raggi X
ν(Hz)
λ(m)
E(eV)
T(K)
105
3×103
4×10−10
10−6
109
3×10−1
4×10−6
10−2
1012
3×10−4
4×10−3
10
4×1014
7×10−7
2
4×103
7×1014
4×10−7
3
7×103
3×1017
10−9
103
3×106
1020
3×10−12
4×105
109
...
...
...
...
raggi γ
15.4.2 Onde radio
Le onde radio vengono prodotte con circuiti elettrici basati su induttanze, condensatori e resistenze (circuiti risonanti) collegati a strutture metalliche (antenne) che al
passaggio delle cariche elettriche diventano dipoli elettrici oscillanti. Sono di enorme importanza nelle telecomunicazioni: le comuni antenne televisive sono costituite da
asticelle metalliche la cui spaziatura e lunghezza sono
dell’ordine del metro, comparabili con le lunghezze d’onda che si vogliono ricevere.
Le onde radio interagiscono con la materia biologica
principalmente tramite il meccanismo delle correnti parassite. Tuttavia, la conducibilità dei “fluidi biologici” è
di natura ionica e abbastanza piccola: un’onda di 10 MHz
deve percorrere una distanza dell’ordine del metro in una
soluzione fisiologica perché la sua intensità venga ridotta
alla metà a causa dell’energia dissipata dalle correnti parassite (eddy currents).
I campi elettrici dell’onda radio variano troppo rapidamente rispetto ai tempi di risposta delle membrane biologiche eccitabili elettricamente e non sono in grado di
produrre blocchi neuromuscolari. La loro energia specifica è una piccola frazione dell’energia termica, e una ancor più piccola frazione dell’energia di legame chimico
(∼1 eV); non si vede come possano essere direttamente
responsabili di una reazione biochimica.
L’unico effetto fisiologico diretto delle onde radio è
legato al riscaldamento dei tessuti prodotto dalle eddy
currents, riscaldamento che ci si aspetta essere proporzionale alla dose assorbita e quindi all’intensità della radiazione. Anche per lavoratori esposti a dosi insolite di
radiofrequenze (operatori di stazioni trasmittenti e forni a
radiofrequenza, di centraline di commutazione di potenza) l’effetto di riscaldamento dovuto alla radiofrequenza
è per lo più dell’ordine di 1 °C. Purtroppo, tale riscaldamento raggiunge organi interni, come il sistema linfatico,
liquidi sinoviali e parti del sistema nervoso, che non sono
in grado di scambiare rapidamente calore con il sangue.
Dopo anni di esposizione a massicce dosi giornaliere di
onde radio si può sviluppare una patologia che si manifesta in emicranie, disturbi della vista, caratteri sessuali
primari (libido) e secondari (barba per gli uomini) attenuati. Non vi sono accettati standard internazionali che
regolino l’esposizione a radiofrequenze e microonde:
molti stati considerano tollerabile una esposizione di
qualche µW/cm2 per otto ore al giorno, anche se fino ad
alcuni anni fa il limite era di 1 mW/cm2 per otto ore al
giorno in tutti gli Stati Uniti.
Sul versante terapeutico, le onde radio sono alla base
di trattamenti che si prefiggono di accelerare o ritardare
un processo biologico di un tessuto interno mediante variazioni di temperatura .
15.4.3 Microonde
Le microonde vengono spesso generate con cavità riso-
Onde elettromagnetiche e materia 339
nanti che producono onde elettromagnetiche stazionarie
alla frequenza desiderata. La loro importanza nelle trasmissioni cresce di giorno in giorno, con il raffinamento
delle tecniche di generazione e trattamento dei segnali a
frequenze maggiori di 109 Hz (gigahertz). Poiché la
quantità di informazione trasmessa dipende dalla frequenza della portante, si possono mettere molti più canali
televisivi nella regione delle microonde che in quella delle onde radio. Uno svantaggio delle microonde è che sono assorbite dall’atmosfera e dalle nubi molto più delle
onde radio.
Nella materia condensata, hanno frequenze nell’intervallo delle microonde i moti relativi di complessi molecolari, alcuni moti collettivi di gruppi di atomi, i salti
diffusivi di ioni e altre particelle di massa elevata.
Per gli effetti biologici si può ripetere quanto detto
per le onde radio: le microonde penetrano distanze di
centimetri nei tessuti biologici, e possono disturbare il
delicato bilancio termico di organi interni. A parità di intensità, sono in genere più pericolose delle onde radio in
quanto vengono assorbite in percentuali maggiori. Tuttavia, il forno a microonde, che racchiude le radiazioni in
modo ermetico e si spegne automaticamente appena si
apre lo sportello, non dovrebbe presentare pericoli di radiazioni. State solo attenti al vapore e alle gocce d’acqua
che si raccolgono sul coperchio del recipiente. Infatti il
fornetto utilizza radiazioni che vengono preferenzialmente assorbite dall’acqua la quale, particolarmente se isolata
in goccioline, raggiunge molto velocemente una temperatura prossima, o anche superiore, ai 100°C. Non ci aspettiamo di scottarci aprendo un coperchio che si è a stento
intiepidito.
15.4.4 Infrarosso
La radiazione infrarossa è generata naturalmente dai moti
vibrazionali di atomi e molecole nella materia condensata. Questi moti sono detti anche moti termici in quanto la
loro ampiezza dipende dalla temperatura. Spesso l’andamento del calore specifico di un solido può essere predetto accuratamente sulla base del suo spettro infrarosso in
quanto le vibrazioni nell’infrarosso sono il principale
serbatoio di energia termica.
La radiazione infrarossa è completamente assorbita
dalla nostra pelle; noi l’avvertiamo provenire da fiamme
o altri corpi caldi grazie a sensori che ci avvertono
dell’aumento di temperatura dell’epidermide. La radiazione infrarossa può essere molto pericolosa: ma questo è
noto, anche grazie alle leggende riguardanti Muzio Sce-
vola e San Lorenzo.
15.4.5 Visibile
Si può approssimativamente dire che lo spettro visibile è
una regione di confine tra le più elevate energie vibrazionali e le energie di ionizzazione. Conformazioni molecolari e legami chimici sono spesso modificati dalla luce visibile. I fenomeni microscopici di interazione della materia con la luce visibile sono una enorme e ben studiata
varietà. La radiazione visibile è un elemento del nostro
ambiente che notiamo immediatamente e che spesso regoliamo per nostra comodità. Siamo portati a pensare che
la luce visibile sia un bene, più che una minaccia per la
nostra salute, ma la luce intensa è dannosa. Al crescere
dell’intensità di un raggio luminoso, la parte superficiale
del tessuto colpito aumenta via via la sua temperatura: oltre i 50 °C si hanno danni irreversibili per la maggior parte dei tessuti; a 100 °C si ha rapida perdita di acqua; a
temperature ancora superiori si ha carbonizzazione e sublimazione del residuo secco. La luce del laser può essere
focalizzata in fasci minuscoli e intensissimi capaci di
produrre tali effetti in regioni ben definite. I laser trovano
impiego in chirurgia in quanto possono tagliare e cauterizzare allo stesso tempo.
15.4.6 Ultravioletto
La radiazione ultravioletta è in grado di rimuovere elettroni di valenza da atomi e molecole creando per breve
tempo specie chimiche instabili e altamente reattive. Infatti le energie specifiche dei raggi ultravioletti sono quasi sempre maggiori delle energie di ionizzazione. I raggi
ultravioletti sono in grado di estrarre elettroni dalla superficie di metalli, di portare elettroni nella banda di conduzione di semiconduttori e di attivare molte reazioni
chimiche.
La nostra epidermide ferma la maggior parte dei raggi ultravioletti con frequenze prossime al visibile. L’abbronzatura è una reazione naturale di difesa ai raggi ultravioletti: l’epidermide produce un sostanza pigmentata
(melanina) che ha un elevato potere assorbente per questi
raggi. La melanina scherma dai raggi ultravioletti le parti
profonde e vitali dell’epidermide. I raggi ultravioletti
possono essere utilizzati per sterilizzare le superfici di
oggetti in quanto capaci di uccidere microbi e batteri che
non hanno come protezione una epidermide specializzata
come la nostra.
I raggi nella parte ad alta energia dello spettro ultravioletto trovano relativamente pochi elettroni capaci di
340 Capitolo 15
assorbirne l’energia e non sono arrestati dagli strati superficiali dell’epidermide; per questo causano danni, particolarmente ai nuclei cellulari (cromosomi) e altro materiale cromatico (iride, retina) che li assorbono a un ritmo
maggiore del resto dei tessuto. Le fasce di ozono dell’atmosfera e il vapor d’acqua assorbono una buona parte di
questa radiazione pericolosa proveniente dal Sole. Per evitare rischi di cecità e di tumori alla pelle è bene portare
costantemente occhiali da sole e limitare l’esposizione
della pelle nuda ai raggi del sole, particolarmente al mattino, in località desertiche (ossia “secche”), in alta montagna e nelle zone dove, recentemente, si sono formati
“buchi” nello schermo d’ozono.
15.4.7 Raggi X
I raggi X vengono solitamente prodotti sparando contro
uno schermo metallico elettroni accelerati da differenze
di potenziale dell’ordine di 103 V. I raggi X provengono
sia dalla decelerazione dell’elettrone nel metallo, sia da
processi di ionizzazione coinvolgenti elettroni di nocciolo. I raggi X hanno lunghezze d’onda comparabili o minori delle tipiche dimensioni atomiche e penetrano distanze tanto maggiori quanto più elevata è la loro energia
e quanto minore è la densità di elettroni del materiale
colpito; i raggi X vengono diffusi dagli elettroni degli atomi e danno preziose informazioni sulle posizioni relative degli atomi nella materia condensata.
Anche se la materia biologica è relativamente trasparente ai raggi X, questi costituiscono un pericolo per la
capacità di ogni fotone assorbito di ionizzare, e rendere
chimicamente instabili, molti atomi. Il tema della radiazione ionizzante in biologia verrà ripreso più avanti in
questo capitolo.
15.4.8 I raggi γ
I raggi γ vengono prodotti da reazioni coinvolgenti nuclei
atomici e particelle subnucleari secondo regole simili a
quelle che governano l’emissione di radiazione da parte
degli elettroni atomici. Oltre che nelle reazioni nucleari, i
raggi γ si generano nello scontro tra una particella e la
sua antiparticella: per esempio, protone con antiprotone.
In tale caso, la conservazione della quantità di richiede
che si generino due raggi γ opposti. Penetrano facilmente
grossi spessori di materia perché sono fermati solo dai
minuscoli nuclei atomici. Vanno considerati come una
radiazione ionizzante perché dallo scontro con un nucleo
si generano sciami secondari di radiazioni ionizzanti.
15.5 Cenni di fisica nucleare
All’inizio di questo secolo Ernest Rutherford provò che
la carica positiva di un atomo (e quasi tutta la sua massa)
è concentrata in un nucleo con dimensioni decine di migliaia di volte inferiori a quelle atomiche, ossia del femtometri (fm = 10−15 m). Questo piccolissimo oggetto è a
sua volta costituito da protoni (p, con carica +e) e neutroni (n, con carica nulla), particelle pesanti circa duemila
volte un elettrone, chiamate collettivamente nucleoni. Il
raggio nucleare cresce abbastanza regolarmente con la
radice cubica del numero di nucleoni, e i nuclei hanno
all’incirca una densità di
1 uma
(fm)
3
= 1661
. (1018 )
kg
m3
dove un nucleone corrisponde all’incirca a una unità di
massa atomica (uma). Se il sole si riducesse a una stella
neutronica (avente cioè la stessa densità di un nucleo atomico) diventerebbe una sfera di soli 6.6 km di raggio.
Ogni nucleo è caratterizzato dal numero di protoni Z,
detto numero atomico, e dal numero di nucleoni A (protoni + neutroni), detto numero di massa. Il simbolo chimico della specie atomica individua in modo univoco il
numero atomico: il numero di massa viene scritto in alto
a sinistra del simbolo chimico e individua il particolare
isotopo dell’elemento. Per esempio, l’idrogeno (H) ha tre
isotopi: 1H = idrogeno, 2H = deuterio, 3H = tritio. In fisica nucleare su usa anche indicare esplicitamente il numero atomico al disotto del numero di massa:
218
84 Po
indica l’isotopo del polonio con A = 218 e ricorda che il
numero atomico di questa specie chimica è Z = 84. Per
esempio, il neutrone si può anche indicare come
1
0n
Mentre vi sono poco più di cento specie chimiche, sono
oggi noti oltre 1500 isotopi, la maggior parte dei quali
caratterizzati da brevi tempi di vita, che vengono studiati
dopo essere stati prodotti con reazioni nucleari controllate dall’uomo.
Le reazioni nucleari avvengono anche naturalmente,
sia nelle stelle sia sulla superficie terrestre. È stato pro-
Onde elettromagnetiche e materia 341
prio il fenomeno della radioattività naturale, ossia la capacità di alcune specie chimiche di emettere vari tipi di
radiazione ionizzante a seguito di reazioni nucleari, che
ha avviato l’esplorazione delle proprietà dei nuclei e delle particelle che li costituiscono. Questa ricerca ha preso
le mosse dalla scoperta fortuita (1896) della radioattività
dell’uranio da parte di Henry Becquerel; è proseguita con
lo sviluppo di una vera e propria chimica nucleare, per
molti versi parallela all’ordinaria chimica degli elementi,
in cui l’interazione più importante è quella dovuta a quella forza a corto raggio che tiene i nucleoni assieme nel
nucleo (interazione forte) vincendo la repulsione elettrostatica. La chimica nucleare ha avuto esiti clamorosi, quali la bomba atomica, quella “all’idrogeno” (bomba H) e
le centrali nucleari. Non meno importanti sono stati gli
sviluppi concettuali: la possibilità di studiare in laboratorio i processi che avvengono nel cuore delle stelle ha dato
nuove prospettive all’astrofisica. Negli ultimi anni la ricerca sui costituenti primi della materia ha caratterizzato i
componenti dei nucleoni (quark) e ha ipotizzato
l’esistenza di una entità ancor più fondamentale a cui è
stato dato il nome di bosone di Higgs.
15.5.1 Le reazioni nucleari
Le regole principali delle reazioni nucleari sono le seguenti:
1. Conservazione del numero di massa. La somma dei
numeri di massa dei reagenti è uguale a quella dei prodotti; per esempio:
238
234
92 U → 90 Be
4
2 He
4
2H
+
+
4
2 He
14
17
7N → 8O
+ 94 Be →
12
6C
+ 11 H
+ 01 n
15.16
15.17
15.18
La reazione 15.16 avviene naturalmente e produce nuclei
di elio (4He) che sono detti anche raggi α. Queste particelle, prodotte nella disintegrazione spontanea di molti
elementi, sono state usate da Rutherford nel 1921 per isolare il protone (p ossia nucleo di 1H, reazione 15.17) e
nel 1932 da James Chadwick per identificare il neutrone
(reazione 15.18).
2. Conservazione della carica. La carica elettrica com-
plessiva dei prodotti è uguale a quella dei reagenti. Per le
reazioni 15.15-18 questo equivale alla conservazione del
numero atomico totale. In altre reazioni vengono emessi
degli elettroni ordinari o degli elettroni con carica positiva e+ (detti antielettroni o positroni) ciascuno dei quali
fa aumentare (o diminuire) di una unità il numero atomico complessivo.
1
1
0 n→1 H
+ e-
12
12
+
7 N→ 6 C + e
15.19
15.20
La 15.19 è la reazione di decadimento del neutrone isolato in un protone e un elettrone, reazione che avviene in
circa 15'. Per ragioni storiche, gli elettroni a elevata energia cinetica liberati nelle reazioni nucleari vengono chiamati raggi β. La 15.20 è la reazione di decadimento di un
nuclide instabile che libera un positrone. Quanto un positrone incontra un elettrone, la sua “antiparticella”, si annichila con questo producendo una coppia di raggi γ diretti in direzioni opposte. In medicina nucleare si utilizzano isotopi di azoto, carbonio e ossigeno prodotti artificialmente che decadono in pochi minuti producendo positroni. Una soluzione con questi nuclidi viene iniettata
nel paziente che è posto tra rivelatori di raggi γ per il breve periodo nel quale i nuclidi decadono. I rivelatori sono
in grado di identificare le parti di tessuti o organi da cui i
raggi provengono, permettendo di ricostruire una mappa
della distribuzione della sostanza iniettata (esame PET =
Positron Emission Tomography).
3. Conservazione dell’energia. Nel bilancio energetico
vanno tenute in considerazione le energie cinetiche, le
energie di legame e, soprattutto, le energie associate alle
masse a riposo di reagenti e prodotti (m0c2). All’unità di
massa atomica
1 uma =
massa (12 C)
= 1.661×10−27 kg
12
corrisponde una energia di
1 uma × c2 = 1.493(10−10) J = 932 MeV
mentre alla massa dell’elettrone (9.109 × 10−31 kg) corrispondono 0.51 MeV. La reazione di cattura di un neutrone da parte del protone si può scrivere trascurando le energie cinetiche di reagenti e prodotti:
342 Capitolo 15
1
1
2
1 H + 0 n→ 1 H +
Elegame ↑
15.21
dove si indica che la reazione libera una quantità di energia pari a quella che tiene uniti protone e neutrone nel
nucleo di deuterio (questa energia di legame è pari
all’energia potenziale dell’interazione forte cambiata di
segno, che è nulla per nucleoni dissociati). Dalla 15.21
segue
Elegame = [m( 11 H ) + m(n) − m( 21 H )]c2 =
= [(1.00783 + 1.00867 − 2.0141) uma]c2 =
15.22
= (0.0024 uma)c2 = 2.24 MeV
Si può perciò dire che ognuno dei due nucleoni che costituiscono l’atomo di idrogeno ha una energia di legame di
1.12 MeV. Sommando la massa di neutroni, protoni ed
elettroni che compongono un atomo si ottiene sempre una
massa maggiore di quella dell’atomo; si ha cioè un difetto di massa che corrisponde all’energia di legame che
tiene unito il nucleo ed è quasi interamente dovuto
all’interazione forte tra nucleoni. Per esempio, un nucleo
di 12C (massa di 12 uma) consiste di 6 neutroni, 6 protoni
e 6 elettroni, per una massa complessiva di
6(1.00867 + 1.00728 + 0.00055) uma =
= 12.099 uma = 12 × (1 + 0.00825) uma
Perciò ogni nucleone del 12C ha perso in media
0.00825 uma, corrispondenti a una energia di legame per
nucleone di circa 7.6 MeV. La maggior parte dei nuclidi
ha un’energia di legame di circa 8 MeV per nucleone.
Fanno eccezione gli atomi leggeri: l’energia di legame
per nucleone vale 1.12 MeV per 2H ed è in genere minore di 8 MeV per A < 20. L’energia di legame per nucleone decresce, lentamente ma regolarmente, per A > 60 e
raggiunge 7.6 MeV per 238U.
Il principio di conservazione dell’energia si applica,
in particolare, alle transizioni tra stati nucleari. Come nel
caso delle transizioni tra livelli elettronici dell’atomo,
queste transizioni sono accompagnate dall’emissione o
assorbimento di fotoni ad alta energia (raggi γ). Per esempio
60
27 Co
→
60 **
−
28 Ni + e
*
→ 60
28 Ni + γ (1174 keV)
→ 60
28 Ni + γ (1332 keV)
15.23
Il 60Co decade naturalmente dando un elettrone e un nucleo eccitato di 60Ni (segnato con uno o due asterischi), il
quale raggiunge lo stato a energia minima emettendo in
sequenza due raggi γ di energia circa uguale. Questa radiazione, altamente penetrante, è utilizzata in medicina
nella radioterapia dei tumori.
4. Conservazione della quantità di moto e del momento della quantità di moto. In molte reazioni nucleari, in
particolare nelle 15.19-15.20, non torna né il bilancio energetico né la conservazione della quantità di moto e del
momento della quantità di moto. Prima Wolfgang Pauli
(1930) e poco dopo Enrico Fermi interpretarono
l’anomalia sviluppando la teoria di una nuova classe di
particelle, i neutrini (simbolo generico ν) capaci di attraversare l’intera Terra praticamente senza interagire con la
materia.
15.5.2 Fissione e fusione nucleare
I neutroni possono entrare in contatto e reagire con un
nucleo senza possedere l’elevata energia cinetica che una
carica positiva dovrebbe avere per superare la repulsione
elettrostatica. Una tipica reazione nucleare indotta dai
neutroni è quella di rottura di un nucleo in frammenti più
piccoli (reazione di fissione):
1
0n
+
235
92 U
→
102
42 Mo
+
131
50 Sn
+ 301 n
15.24
In queste reazioni si libera energia di legame che, per i
nuclidi di molibdeno e stronzio, è maggiore rispetto a
quelli di uranio di circa 1 MeV per nucleone.
La capacità di un nucleo di reagire con un neutrone è
descritta dalla sua sezione d’urto, una grandezza con le
dimensioni di un’area, misurata in barn:
1 barn = (1 fm)2 = 10−28 m2
Più lento è il neutrone, più grande è la sua lunghezza
d’onda e maggiore è la probabilità di “toccare” un nucleo
con cui può avvenire una reazione. La scoperta principale
di Fermi è legata proprio al fatto che, rallentando i neutroni prodotti dalla reazione 15.24 mediante urti con nu-
Onde elettromagnetiche e materia 343
clei leggeri, si aumenta la probabilità che i neutroni reagiscano con altri nuclei di 235U: ognuno dei tre neutroni
prodotti nella 15.23 può in teoria produrre altre tre reazioni, e così via in una reazione a catena che libera quantità sempre crescenti di energia fino a quando la maggior
parte dei nuclei “fissionabili” non vengono “bruciati”.
Basta che sia in media catturato poco più di uno dei neutroni prodotti nella 15.24 (e analoghe) perché la velocità
della reazione aumenti in brevissimo tempo e porti
all’esplosione atomica. Una importante reazione di cattura neutronica che avviene nei reattori nucleari trasforma
l’isotopo più abbondante dell’uranio (238U, non fissionabile) in plutonio
1
238
239
−
0 n + 92 U→ 94 Pu + 2e
+ν +γ
15.25
che successivamente si “fissiona” con reazioni simili a
quelle di 235U.
Si hanno reazioni altamente esotermiche anche quando due nuclidi leggeri (a bassa energia di legame) si uniscono per formare un nucleo più pesante (reazione di fusione):
3
2
1 H + 1H
→ 42 He + 01n + 17.6 MeV
15.26
Reazioni di questo tipo richiedono elevatissime temperature, o energie cinetiche, per consentire a nuclidi carichi
positivamente di avvicinarsi a distanze dell’ordine delle
dimensioni nucleari. Nelle bombe H il detonatore è formato da un bomba a fissione che fornisce queste energie
(o temperature).
−
Solo una piccola parte dei nuclidi conosciuti è stabile: la
maggior parte decade spontaneamente liberando energia
e trasformandosi in un’altra specie nucleare. Un corpo
che contiene una specie nucleare instabile emette una radiazione nucleare (raggi α, β e γ) e si dice radioattivo. Si
chiama attività di una sorgente radioattiva il numero di
decadimenti nucleari che avvengono al secondo. Questo
numero è proporzionale ai nuclei radioattivi presenti N(t)
e alla costante del decadimento 1/τ:
attività = −
dN (t )
N (t )
× 1s =
× 1s
dt
τ
15.27
Se all’istante iniziale si hanno N(0) nuclei presenti, al
tempo t ve ne saranno
15.28
Dalla 16.26 si ottiene l’espressione del tempo di dimezzamento τ1/2, necessario perché il numero di nuclei N(t)
si riduca alla metà di quelli presenti inizialmente, N(0):
τ
1/ 2
−
N (τ 1/ 2 ) 1
= = e τ ⇒ τ 1/ 2 = τ ln 2
N (0)
2
15.29
L’attività nel sistema SI si misura in becquerel (simbolo
Bq) pari a 1 decadimento al secondo. Una unità comunemente usata è ancora oggi il curie (in onore di Pierre e
Marie Curie, simbolo Ci) che corrisponde all’attività di
un grammo di radio, e si converte in becquerel mediante
l’equivalenza
1 Ci = 3.7(1010) Bq
15.30
Per mezzo della legge del decadimento radioattivo è possibile datare campioni biologici e geologici. La datazione
di campioni biologici con 14C è basata sul fatto che il
questo isotopo si forma nell’atmosfera per effetto della
radiazione cosmica e decade, con un tempo di dimezzamento di circa 5700 anni, secondo la reazione
14
14
6 C →7
N + e− + ν + γ
Negli organismi viventi vi è un rapporto
[ C] ≈ 13. (10
[ C]
14
12
15.5.3 La radioattività
t
N (t ) = N (0) e τ
− 12
)
15.31
pari al rapporto tra le concentrazioni dei due isotopi sulla
crosta terrestre. Dopo la morte dell’organismo non si ha
più scambio di carbonio con l’esterno e il 14C presente
decade facendo progressivamente diminuire il rapporto
15.31. Si ottengono datazioni abbastanza accurate misurando la frazione di 14C presente in un campione biologico (per esempio del legno, un dente) di età compresa tra
circa 1000 e 10 000 anni.
Per la datazione delle rocce si utilizzano nuclidi con
tempi di dimezzamento geologici. Per esempio, 238U decade in 234Th in quattro miliardi e mezzo di anni, un
tempo dell’ordine dell’età della Terra: una serie di reazioni con tempi molto più brevi trasforma successivamente il torio in 206Pb. Assumendo che il Pb non fosse inizialmente presente al momento della formazione del minerale d’uranio, il rapporto
344 Capitolo 15
[
[
206
]
U]
Pb
238
permette di risalire all’età della roccia.
15.5.4
Effetti biologici delle radiazioni
nucleari
Le radiazioni nucleari con effetti biologici consistono di
ioni (per esempio, un raggio α è uno sciame di He++), di
neutroni, di elettroni e positroni (raggi β), e di raggi γ. I
raggi α interagiscono molto fortemente con atomi e molecole e vengono fermati dopo un percorso quasi rettilineo di pochi micron in un tessuto. Una particella α viene
emessa con energie cinetiche dell’ordine del MeV e dissipa questa energia attraverso numerosi urti con le molecole del tessuto che per lo più causano processi di ionizzazione. Poiché la particella α percorre una distanza
dell’ordine delle dimensioni della cellula causando centinaia di migliaia di rotture di legami, essa di solito porta
alla morte della cellula colpita. Effetti molto simili hanno
i protoni (1H+) prodotti in alcune reazioni nucleari.
Le particelle β penetrano un tessuto molle per distanze dell’ordine di qualche millimetro seguendo un percorso contorto: anch’esse provocano ionizzazione. I raggi γ
da 1 MeV penetrano un tessuto per distanze dell’ordine
di 10 cm strappando elettroni interni e di valenza dalle
loro orbite. Per energie superiori al MeV, il raggio γ può
produrre, per collisione con un nucleo, una coppia elettrone-positrone, ossia radiazione β. La penetrazione dei
raggi γ cresce con la loro energia specifica.
Mancando di carica elettrica, i neutroni interagiscono
poco con la materia. A una energia di 1 Mev penetrano
circa 1 m di tessuto. A elevate energie cinetiche sono
probabili gli urti elastici con i nuclei, particolarmente
quelli leggeri, ma si verificano anche urti anelastici con
produzione di raggi γ e/o particelle cariche. La reazione
di cattura del neutrone da parte di un nucleo diviene un
processo importante per i neutroni termici, che hanno energie dell’ordine del decimo di eV, ossia dell’ordine di
kBT (con T = temperatura ambiente). Tale reazione è seguita quasi sempre dall’emissione di raggi α, β ,γ o dalla
generazione di neutroni o ioni ad alta energia.
Gli effetti biologici della radiazione dipendono innanzitutto dall’energia assorbita per unità di massa, o dose
assorbita, che, nel sistema SI, è misurata in gray (Gy, in
onore di Harold Gray). Un’unità spesso usata di dose è
il rad, pari a un centesimo di Gy:
1 Gy =
1J
= 100 rad
1 kg
15.32
Dal punto di vista biologico, più che il valore assoluto
della dose assorbita è importante l’efficacia biologica relativa della radiazione, misurata in sievert (simbolo Sv, in
onore di Rolf Sievert) e così definita: una radiazione di
un sievert produce lo stesso effetto biologico di un gray
di raggi X con una energia specifica di 200 keV. Spesso
usato è anche il rem (röntgen equivalent man), dove il
röntgen è la quantità di raggi X che produce ioni positivi
con una carica complessiva di 2.58(10−4) C in un kg di
aria. La relazione di conversione tra sievert e rem è
1 Sv = 100 rem
15.33
La dose efficace di radiazione assorbita mediamente dalla
popolazione occidentale è di circa 4 mSv/anno, un decimo circa dei quali dovuti all’impiego dei raggi X per
scopi medici. Per lavoratori la cui professione comporta
esposizione a radiazioni ionizzanti il limite di esposizione
consentito è di 50 mSv/anno. Un altro parametro di una
radiazione spesso usato a fini protezionistici è il LET (linear energy transfer), l’energia ceduta per unità di percorso dalle radiazioni nel sistema biologico.
La radiazione ionizzante in piccole dosi produce a
lungo andare effetti solo su una parte degli individui esposti. Tali effetti si rivelano mediante analisi statistiche
relative a popolazioni numerose. Per esempio, l’esposizione alla radiazione del radon (un gas nobile instabile
prodotto nella sequenza di reazioni di decadimenti a partire dallo 238U) per chi vive in case poco aerate, costruite
su terreni debolmente radioattivi, comporta dosi efficaci
tipiche di 2 mSv/anno. A tale dose efficace si assegna una
riduzione di vita media di 40 giorni. Con simili metodi
statistici si stima che un pacchetto di sigarette al giorno
dall’adolescenza in poi diminuisca la vita di circa sei anni. I militari americani che parteciparono alle numerose
prove con bombe atomiche tattiche all’inizio degli anni
Cinquanta svilupparono negli anni Settanta alcune patologie (leucemia, in particolare) con probabilità molto
maggiore relativamente al resto della popolazione. Una
spiegazione è che i soldati assorbirono minuscole quantità di sostanze radioattive con tempi di vita dell’ordine di
anni e furono per decenni esposti a una radiazione di basso livello (low level radiation) la cui pericolosità era stata
precedentemente sottostimata.
Riassunto
Onde elettromagnetiche e materia 345
Questo capitolo raccoglie in modo sintetico i più importanti risultati della fisica moderna riguardanti le interazioni tra radiazione e materia. Si è cercato di mettere in
luce gli aspetti fondamentali dei fenomeni, in particolare
quelli collegati ai principi di conservazione. Il concetto
fondamentale è che la radiazione, come la materia, è
quantizzata; esiste cioè una quantità di energia “indivisibile”, caratteristica di un tipo di radiazione, che ne de-
termina le proprietà fondamentali.
Abbiamo stabilito una corrispondenza tra classi di
“reazioni” che avvengono nella materia e la scala delle
energie specifiche della radiazione elettromagnetica. È
importante avere presente questo quadro per interpretare
fenomeni quali cambi di temperatura, reazioni chimiche,
reazioni nucleari e farsi una idea dei modi in cui il nostro
benessere fisico può essere insidiato dalle radiazioni.
ESERCIZI RISOLTI ______________________________________________________________
Esercizio R15.1 Un raggio luminoso con lunghezza d’onda λ = 500 nm (luce verde) è caratterizzato da un
campo elettrico di ampiezza E0 = 20 V/m. L’intensità del raggio espressa in numero di fotoni/(m2⋅s) è di (ε0 = 8.85 × 10−12 F/m, h = 6.63 × 10−34 J⋅s)
(A) 2.67 × 1018 (B) 3140 (C) 1.66 × 1016 (D) 5.34 × 1015 (E) 1.33 × 1018
Soluzione Le densità di energia associate al campo elettrico oscillante di ampiezza E0 e al campo magnetico di ampiezza B0 = E0/c sono
1
1
ε 0 < E 2 > = ε 0 E 02
2
4
1
1
1
< B2 > =
B02 = ε 0 E 02 ⇒
2µ 0
2µ0
4
⇒ < densità di energia totale > =
1
ε 0 E 02
2
L’intensità luminosa I è pari alla densità di energia totale per la velocità della luce e anche al
numero N di fotoni per m2·s moltiplicato per hν:
I = Nhν = Nh
c
λ
=
ε 0 E 02 c
2
⇒N=
λε 0 E 02
2h
( )
≈ 133
. 1018 fotoni/(m2⋅s)
Esercizio R15.2 L’intensità della radiazione solare sulla Terra è pari a I ≈ 1 kW/m2 e il raggio medio della
Terra è rT ≈ 6350 km. Assumendo che tutta la radiazione solare sia assorbita dalla Terra, la
forza con la quale la radiazione solare respinge la Terra è pari a circa
(A) 1.7 × 109 N (B) 8.4 × 108 N (C) 4.2 × 108 N (D) 3.14 GN (E) 9.8 GN
Soluzione Ogni fotone solare di energia hν trasferisce alla Terra la quantità di moto hν/c. Se in un tempo ∆t e su una superficie ∆S vengono assorbiti n fotoni di questo tipo la pressione esercitata
dalla radiazione è pari alla quantità di moto trasferita divisa per il tempo e la superficie:
p radiazione =
nhν
I
=
c∆S∆t c
Da questa relazione si vede che la pressione di radiazione per un’onda elettromagnetica assorbita è pari all’intensità divisa per la velocità della luce ed è indipendente dalla frequenza
dell’onda. La risposta si trova moltiplicando la pressione di radiazione per l’area di una sezione massima della Terra
346 Capitolo 15
F = p radiazione πrT2 =
IπrT2
≈ 4.2 10 8 N
c
( )
Esercizio R15.3 A un sottile perno verticale sono attaccati due schermi quadrati complanari, ciascuno di 25
cm2, uno perfettamente riflettente e l’altro perfettamente assorbente.
Quando vengono investiti da una luce rossa (λ = 663 nm) il momento delle forze di pressione
di radiazione rispetto al perno è ∆M = 10−9 N·m. Il numero di fotoni che raggiunge al secondo i due schermi è di circa
(A) 6.0 × 1023 (B) 3.1 × 1012 (C) 8.9 × 1021 (D) 6.6 × 1014 (E) 8.0 × 1019
Soluzione Indicata con I l’intensità luminosa, la pressione di radiazione sullo schermo assorbente è I/c
mentre su quello riflettente è il doppio in quanto la quantità di moto trasferita da un fotone è
2hν/c. Per lo schermo riflettente forza e momento della forza sono
Fr =
2I 2
l
c
Mr =
2I 2 l
l ×
c
2
Il momento dovuto alla pressione di radiazione sullo schermo assorbente è Ma = Mr/2 e diretto in senso opposto. Indicato con N il numero di fotoni per m2⋅s, la risposta cercata è 2Nl2
Nhc
I = λ
3
3
∆M = M − M = I l = Nh l
r
a
2c
2λ
4λ
⇒ 2N l2 =
∆M ≈ 8.0 1019 / s
hl
(
)
La potenza luminosa che complessivamente raggiunge gli schermi è tale numero moltiplicato
per hc/λ, pari a circa 24 W.
Esercizio R15.4 Un raggio γ con λ = 2.1 × 10−15 m colpisce un protone, mp = 1.67 × 10−27 kg, quasi immobile; viene emesso un fotone secondario che forma un angolo α = 30° con la direzione del fotone originale e ha una lunghezza d’onda λ' pari a circa (in m)
(A) 2.1 × 10−15 (B) 2.3 × 10−15 (C) 2.8 × 10−15 (D) 3.4 × 10−15 (E) 7.8 × 10−15
Soluzione Lo schema della reazione è il seguente:
y
x
h/λ'
h/λ
α
x
P
Si indicano con Px e Py le componenti della quantità di moto P del protone dopo l’urto, con
E0 ed E l’energia complessiva del protone prima e dopo l’urto e con v la sua velocità dopo
Onde elettromagnetiche e materia 347
l’urto. Le espressioni relativistiche di queste quantità sono
E 0 = mp c 2
mp
E = mc 2 P = mv con m =
2
1− v2 / c2
2
E 02 = m 2p c 4 = m 2 c 4 − ( mvc) = E 2 − ( Pc) ⇒ E 2 = E 02 + ( Pc)
2
L’urto è elastico e conserva la quantità di moto:
h h
λ − λ ' cos α = Px
h
sin α = Py
λ'
1
1
2 cos α
+
−
P 2 = Px2 + Py2 = h 2
2
2
λλ '
λ
λ'
⇒
e l’energia complessiva:
hc
λ
+ E0 =
hc
1 1
+ E ⇒ E = E 0 + hc −
λ λ'
λ'
Si inseriscono ora queste espressioni nella relazione tra E, E0 e P:
2
1
1
2 cos α
1 1
E 2 = E 0 + hc − = E 02 + c 2 h 2
+
−
2
2
λ
λ
'
λλ '
λ
λ'
da cui con pochi passaggi si ricava l’equazione dell’effetto Compton per il protone
λ '− λ =
h
(1 − cos α )
mp c
Inserendo i valori numerici: λ' − λ = 1.77 × 10−16 m ⇒λ' ≈ 2.3 × 10−15 m
Esercizio R15.5 Una radiazione ultravioletta con λ = 200 nm colpisce la superficie coperta di nichel metallico
di un elettrodo sotto vuoto posto nel circuito della figura.
hν
+
V
Quando il potenziale V raggiunge il valore di 1.22 V la corrente nel circuito si estingue completamente. Il potenziale di estrazione V0 di un elettrone dal nichel metallico è pari a circa
(A) 6.22 V (B) 3.14 V (C) 1.22 (D) 6.62 V (E) 5.00 V
Soluzione Indicato con E0 = eV0 (e = 1.6 × 10−19 C) il lavoro di estrazione dell’elettrone dal nichel
metallico si ha
hν =
hc
λ
= E 0 + eV = e(V0 + V ) ⇒ V0 =
hc
− V ≈ 6.22 − 1.22 = 5.00 V
eλ
Esercizio R15.6 Nella transizione, detta di Lyman, dal livello n = 2 al livello n = 1 dell’atomo di idrogeno
348 Capitolo 15
viene emesso un fotone con lunghezza d’onda λL mentre nella transizione, detta di Balmer,
dal livello n = 3 al livello n = 2 viene emesso un fotone con lunghezza d’onda λB. Ci si aspetta che il rapporto λL/ λB valga
(A) 2/3 (B) 5/27 (C) 1/3 (D) 4/9 (E) 7/17
Soluzione Le differenze di energie tra i livelli di transizione e il reciproco della relativa lunghezza
d’onda sono proporzionali tra loro (vedi Equazione 15.13), per cui
1
1
1
1
1
2 − 2
λB
1
5 4
5
2
3
=
=
2 − 2 ∝λ ⇒ 1 =
1
36 3 27
n1 n 2
1− 2
λL
2
Esercizio R15.7 Nel circuito della figura un fotodiodo con una superficie sensibile Sd = π(0.2 mm)2 è posto a
d = 33 cm di distanza da una lampada al sodio con λ = 589 nm.
d = 33 cm
A
Assumendo che ogni fotone ricevuto dal fotodiodo permetta il passaggio di un elettrone nel
circuito, se si misura una corrente I(A) = 2.7 µA, la potenza luminosa W della lampada al sodio è di circa
(A) 560 W (B) 1.78 kW (C) 18 W (D) 62 W (E) 0.62 W
Soluzione L’intensità luminosa a distanza d, Il(d), e il numero N di fotoni che raggiungono il fotodiodo
in un secondo sono
I l (d ) =
W
4πd 2
N=
I ( A ) I l (d ) S d
I (A ) hc
4πd 2
=
⇒W =
≈ 62 W
hc
e
e λ π ( 0.2 mm) 2
λ
Esercizio R15.8 La fissione di un atomo di 235U libera circa 200 MeV di energia. Se una centrale nucleare
produce 500 MW con una efficienza del 25% la massa dell’uranio consumata in un’ora è pari
a circa
(A) 27 kg (B) 2.3 kg (C) 0.31 kg (D) 88 g (E) 0.66 g
Soluzione Per produrre 500 MW con una efficienza del 25% sono richiesti 2 GW e un numero di atomi
al secondo pari
2 GW
1.6 × 10
−19
× 200 MeV
= 6.25 × 10−19 s−1 ≈ 1.04 × 10−4 mol/s ≈ 0.374 mol/h
Poiché una mole pesa circa 235 g, si consumano circa 88 g/h.
Esercizio R15.9 Il tempo di dimezzamento di 226Ra è di 1620 anni. Il numero di decadimenti al secondo in un
grammo di radio è pari a circa
(A) 2.7 × 1021 (B) 6.02 × 1023 (C) 5.1 × 1010 (D) 3.6 × 1010 (E) 2.5 × 1010
Onde elettromagnetiche e materia 349
Soluzione Il numero atomi presenti in un grammo è N = NA/226 ≈ 2.665 × 1021. La costante di tempo
del decadimento è τ = 1620/ln(2) anni ≈ 7.37 × 1010 s e il numero di decadimenti al secondo
è N/τ ≈ 3.6 × 1010.
Esercizio R15.10 Un fascio di raggi γ con energia specifica di 1.25 MeV e una sezione di 3.14 cm2 porta
2 ×108 fotoni al secondo; viene applicato per 5 s a un tessuto tumorale di densità 950 kg/m3
spesso 1 cm, nel quale il fascio si attenua del 7%. La dose in gray assorbita dal tessuto è di
circa
(A) 0.875 Gy (B) 3.14 mGy (C) 95.0 Gy (D) 4.7 mGy (E) 0.11 mGy
Soluzione L’energia assorbita è
5 × 2(108) × 1.25(106) × 1.6(10−19) × 0.07 ≈1.4 (10−5) J
e la massa del tessuto irradiato è
3.14(10−6) × 950 = 2.983(10−3) kg
La dose è
energia/massa = 4.7(10−3) J/kg = 4.7 mGy = 0.47 rad
ESERCIZI PROPOSTI____________________________________________________________
Esercizio 15.1 La temperatura della corona solare è pari a circa T = 6000 K. L’intensità della radiazione
solare è massima alla frequenza di
(A) 3.8(1014) Hz (B) 4.4(1014) Hz (C) 5.9(1014) Hz (D) 6.2(1014) Hz (E) 7.7(1014) Hz
Esercizio 15.2 Una lampada emette 1000 W luminosi. Il campo elettrico a una distanza d = 10 m dalla lampada ha una ampiezza di circa
(A) 1.7 V/m (B) 12.8 V/m (C) 24.5 V/m (D) 34.6 V/m (E) indeterminata
Esercizio 15.3 L’energia di un fotone con λ = 100 nm espressa in elettronvolt (eV) vale
(A) 0.63 eV (B) 8.83 eV (C) 12.43 eV (D) 31.4 eV (E) 62.6 eV
Esercizio 15.4 Un elettrone (me = 9.1 × 10−31 kg) che si muove inizialmente nella direzione positiva
dell’asse x verso una lampada al sodio con λ = 589 nm. Dopo un urto con un fotone emesso
dalla lampada si muove con velocità pari a quella iniziale ma nel verso opposto. Il modulo di
tale velocità, v, vale circa
(A) 1.24 km/s (B) 2.3(109) m/s (C) 197 m/s (D) 630 km/s (E) 7700 m/s
Esercizio 15.5 Un fotone con λ = 2 nm urta un elettrone fermo (me = 9.1 × 10−31 kg). Se il fotone emesso
forma un angolo di 90° con quello incidente l’energia dell’elettrone a seguito dell’urto aumenta di
(A) 0.11 eV (B) 3.14 eV (C) 9.9×10−17 J (D) 62 eV (E) 0.74 eV
350 Capitolo 15
Esercizio 15.6 Il potenziale di estrazione del sodio metallico è di 2.3 V. Se l’energia cinetica massima
dell’elettrone estratto è pari a 1 eV e se è lecito trascurare l’energia termica (kBT ≈ 36 meV a
temperatura ambiente) la frequenza del fotone incidente, espressa in Hz, è di circa
(A) 2.4 × 1014 (B) 5.6 × 1014 (C) 8.0 × 1014 (D) 1.0 × 1015 (E) 5.6 × 1015
Esercizio 15.7 Un elettrone (me = 9.1 × 10−31 kg) con una velocità di 3600 km/h ha la stessa quantità di
moto di un fotone con lunghezza d’onda pari a circa
(A) 2600 nm (B) 730 nm (C) 314 nm (D) 910 nm (E) 250 nm
Esercizio 15.8 Un neutrone (mn = 1.67 × 10−27 kg) alla temperatura di 300 K (neutrone termico) ha una
lunghezza d’onda di
(A) 1.0 nm (B) 1.7 nm (C) 0.62 nm (D) 0.15 nm (E) 2.3 × 10−12 m
Esercizio 15.9 Un positrone (e+) e un elettrone (me = 9.1 × 10−31 kg), ambedue a bassa velocità si annichilano creando due fotoni con una frequenza di circa
(A) 248 GHz (B) 1.24 × 1020 Hz (C) 6.63 THz (D) 3.14 × 1018 Hz (E) 9.1 Hz
Esercizio 15.10 Un fascio di particelle α con una efficacia biologica relativa di 12 sievert per gray ha depositato 0.08 J di energia in un fegato di 1.3 kg. La dose efficace depositata è di
(A) 0.74 Sv (B) 9.6 Sv (C) 9.2 Sv (D) 0.32 Sv (E) indeterminata