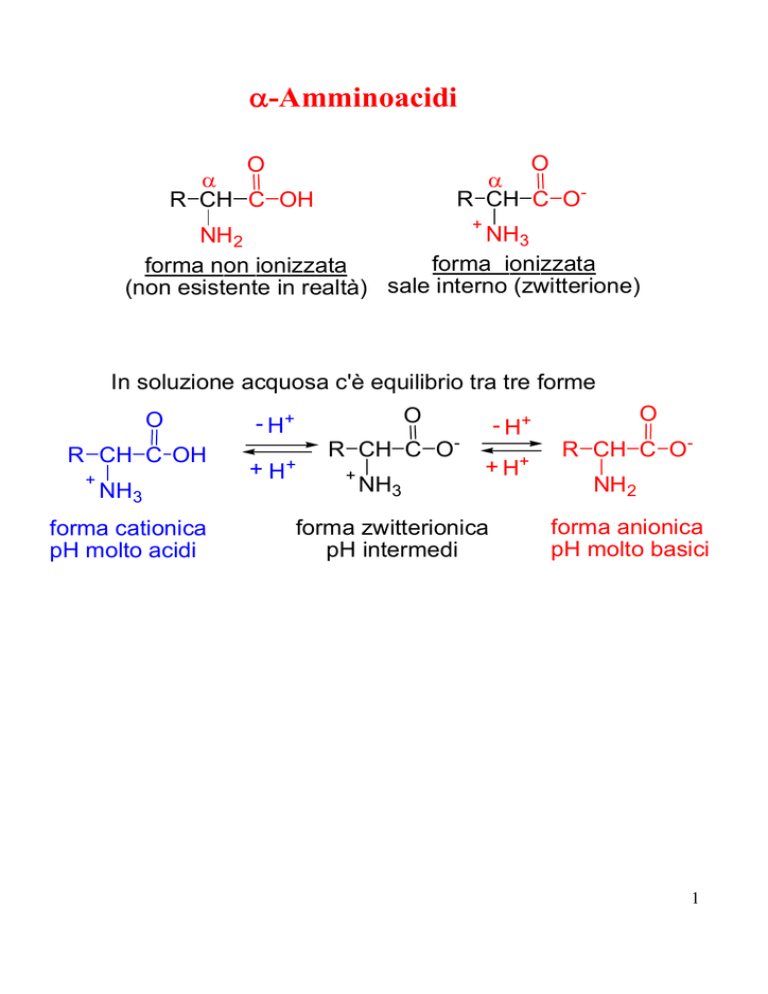
α-Amminoacidi
O
α
R CH C O-
O
α
R CH C OH
+
NH3
NH2
forma ionizzata
forma non ionizzata
(non esistente in realtà) sale interno (zwitterione)
In soluzione acquosa c'è equilibrio tra tre forme
O
R CH C OH
+
NH3
forma cationica
pH molto acidi
O
- H+
+ H+
R CH C O+
NH3
- H+
+
+H
forma zwitterionica
pH intermedi
O
R CH C ONH2
forma anionica
pH molto basici
1
In tutti gli amminoacidi naturali (tranne nella glicina)
il carbonio α è un centro chirale
O
α
H CH C O
+
NH3
O
α
H3C CH
+ NH
C O
-
3
alanina
glicina
La nomenclatura dei centri chirali degli amminoacidi (e dei
carboidrati) fa uso dei descrittori D,L
(configurazione relativa alla gliceraldeide)
O
O
H
O
C
C
H
OH
H
α
D-gliceraldeide
H
C
HO
H
CH2OH
L-gliceraldeide
+
NH3
CH2OH
CH2OH
O
-
D-amminoacido
O
O
C
+ α
H3N
H
CH2OH
L-amminoacido
La quasi totalità delle proteine di tutti gli organismi viventi sono
costituite da solo 20 α-amminoacidi,
di cui i 19 chirali sono tutti della serie L.
19 α-amminoacidi hanno il gruppo amminico primario
e solo uno secondario (la prolina).
2
I 20 α-amminoacidi proteinogenici
α O R CH C O
+
R = catena laterale
NH3
Catena laterale non polare
Catena laterale polare
R=
H
glicina, Gly, G
R=
CH2OH
serina, Ser, S
R=
CH3 alanina, Ala, A
R=
CH OH
treonina, Thr, T
R=
CH CH3
CH3
valina, Val, V
CH3
R=
O
CH2 C
NH2
asparagina, Asn, N
CH2 CH CH3
R=
CH3
leucina, Leu, L
R=
CH CH2 CH3
O
R=
CH2 CH2 C
NH2
glutammina, Gln, Q
CH3
isoleucina, Ile, I
R=
CH2
fenilalanina, Phe, F
R=
CH2
NH
triptofano, Trp, W
R=
CH2 CH2 S CH3
metionina, Met, M
3
I 20 α-amminoacidi proteinogenici
α O R CH C O
+
R = catena laterale
NH3
Catena laterale acida
Catena laterale basica
+
O
R=
NH2
CH2 C
R=
OH
acido aspartico, Asp, D
CH2 CH2 CH2 C
NH2
arginina, Arg, R
O
R=
CH2 CH2 C
R=
+
CH2 CH2 CH2 CH2 NH3
OH
lisina, Lys, K
acido glutammico, Gln, E
R=
H
N
CH2SH
R=
cisteina, Cys, C
R=
CH2
CH2
N
istidina, His, H
OH
tirosina, Tyr, Y
L'unico α-amminoacido col gruppo amminico
non primario ma secondario
α
+
C
N
H
H
O
O-
prolina, Pro, P
4
Titolazione della glicina con NaOH
A
H3NCH2COOH
forma cationica
-OH
Ka1
B
-OH
C
Ka2
H2NCH2COO
H3NCH2COO
forma zwitterionica
H2O
forma anionica
H2O
Partendo da 1 mole di glicina a pH=0, A, si aggiunge una soluzione 1M
di NaOH. Quando si sono aggiunte 0,5 moli di NaOH si ha che il 50% di
A ha reagito e il pH=pKa1=2,35
[H NCH COOH]= [H NCH COO-]
3
2
3
2
aggiungendo ancora NaOH fino ad 1 mole, tutto A ha reagito per dare B
a
ad un pH=6,06
[H NCH COO-]
3
2
aggiungendo ancora NaOH fino ad 1,50 mole, il 50% di B ha reagito per
ad un pH=pK
dare C
a pH=pK
a2=9.78
a2=9,78
[H NCH COO-]= [H NCH COO-]
3
2
3
2
5
aggiungendo ancora NaOH fino ad 2 mole, tutto B ha reagito per dare C
Punto isoelettrico
Il punto isoelettrico, pI, di un amminoacido, di un peptide o
di una proteina è il pH al quale la specie non ha una carica
netta, cioè la maggior parte delle molecole si trovano come
zwitterione e le specie cariche positivamente sono in
uguale concentrazione di quelle cariche negativamente
pI = 1/2(pKa COOH + pKa NH3+)
per la glicina
pI=1/2(2,35+9,78)=6,06
Ogni aminoacido, peptide o proteina ha il suo punto isoelettrico
caratteristico e conoscendolo è possibile valutare la carica
posseduta dalla specie ad un dato pH
ad esempio, la tirosina ha un pI= 5,63, il che significa che a
pH=5,63 la tirosina ha carica 0, a un pH=5 avremo una piccola
frazione di tirosina carica positivamente e a un pH ancora
inferiore avremo che tutto la tirosina sarà sotto forma di ione
positivo
Se si introducono due elettrodi, aventi tra loro una differenza di
potenziale, in una soluzione di un amminoacido che si trova ad
un pH uguale al punto isoelettrico, l'amminoacido non migrerà
nè all'anodo nè al catodo
Scegliendo un opportuno pH è possibile fare migrare in un
campo elettrico selettivamente i vari amminoacidi. Su tale
principio si basa la elettroforesi, tecnica di separazione di specie
differentemente cariche
6
Oligopeptidi, polipeptidi e proteine
Gli oligopeptidi sono molecole contenenti da 2 a 9 unità di
amminoacidi legate tramite un legame peptidico.
I polipeptidi si hanno quando gli amminoacidi sono da 10 a 100.
Le proteine si hanno quando gli amminoacidi sono più di 100.
Il legame peptidico è un legame ammidico
HOH2C H
H
O
HOH2C H
O
- H N+
O
3
C
C
N
+ H2O
C
+
C
C +
C
+
O
H3N
C
C
O
H
N
3
CH3
O
H
O H CH3
alanina
legame peptidico
serina
amminoacido
C-terminale a destra
amminoacido
N-terminale a sinistra
seril-alanina
Il legame ammidico ha un parziale carattere di doppio legame
che determina una impedita rotazione intorno ad esso causa di
diastereoisomeria cis-trans
C
N
H
Cα
..
..
Cα
..
N
H
+
cis-oide
-
O
C
H
N
..
Cα
C
O
..
..
..
O
..
Cα
H
-
..
C
+
Cα
..
Cα
..
..
C
.. Cα
N
..
..
O
O
+
Cα
Cα
N
H
Cα
trans-oide
7
Lipidi
Classe eterogenea di sostanze organiche caratterizzate dal fatto di
non essere solubili in acqua ma in solventi non polari (liposolubili)
1) trigliceridi, 2) fosfolipidi, 3) steroidi, 4) prostaglandine
Trigliceridi (o triacil-gliceroli)
O
C
Esempio:
CH2O
R
O
C
CHO
R'
O
CH2O C R''
olio di oliva, olio di arachide,
olio di mais, olio di soia, burro, lardo
O
C
CH2O
(CH2)14CH3
O
C
CHO
(CH2)16CH3
O
CH2O C (CH2)7CH=CH(CH2)7CH3
Gli acidi grassi sono acidi carbossilici
a lunga catena (6-20 carboni) non ramificata
12:0 CH3(CH2)10COOH acido laurico
14:0 CH3(CH2)12COOH acido miristico
16:0 CH3(CH2)14COOH acido palmitico
18:0 CH3(CH2)16COOH acido stearico
20:0 CH3(CH2)18COOH acido arachidico
18:1
18:2
18:3
20:4
acidi grassi
saturi
acidi grassi
insaturi
CH3(CH2)7 CH CH (CH2)7COOH acido oleico
CH3(CH2)4 (CH CH CH2)2 (CH2)6COOH acido linoleico
CH3(CH2)4 (CH CH CH2)3 (CH2)6COOH acido linolenico
CH3(CH2)4 (CH CH CH2)4 (CH2)2COOH acido arachidonico
8
Saponificazione dei trigliceridi
O
C
CH2O
R
O
C
CHO
R'
O
CH2O C R''
trigliceride
O
CH2OH
H2O
NaOH
CHOH
CH2OH
glicerolo
+
+
+
Na-O
O
Na-O
R
+
Na-O
R''
O
R'
sali di carbossilato
degli acidi grassi
9