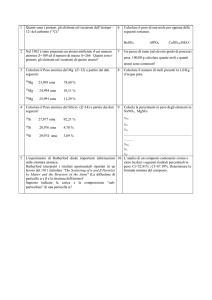
Massa assoluta e relativa e
mole
Massa atomica assoluta
.
.
• Massa di un atomo di un dato elemento. In
questo caso si parla spesso di peso atomico
assoluto, che viene espresso in grammi: l'ordine
dei valori oscilla tra i 10-22g e i 10-24g.
• Per ovviare al difficile uso di numeri così piccoli
nei calcoli, si è convenuto di esprimere la massa
atomica in rapporto al peso atomico assoluto di
1/12 dell'atomo 12C, il cui valore è adottato quale
unità di massa atomica (u.m.a.).
• La massa assoluta del 126C è 1,9926 x 1023g
• Una unità di massa atomica (UMA) è pari
a 1/12 della massa dell’isotopo 126C,
ovvero è pari a 1,6605 x 10-24g
• Per MASSA ATOMICA RELATIVA di un
ATOMO si intende la massa di un atomo
di quell’atomo espressa in UMA
• Risulta dal rapporto tra la massa atomica
ASSOLUTA dell’atomo e 1/12 della massa
del 126C
Esempio
• La massa assoluta del nuclide 2311Na è
38,103 x 10-24g. Calcolare la sua massa in
UMA.
• M(2311Na)=38,103 x 10-24g/1,6605 x 10-24g
x UMA-1=22,98 UMA
• La massa dell’isotopo 2311Na è 23 volte più
grande di quella del 126C/12
Massa atomica relativa
Il riferimento è arbitrario: l’atomo (isotopo) 12C a cui è assegnata
convenzionalmente massa 12,0000 è il riferimento attualmente scelto.
La massa atomica relativa è un numero puro: rappresenta il rapporto tra la
massa di un atomo (in g) e 1/12 della massa di un atomo di 12C (in g)
E’ come se si fosse scelto di usare
come unità di riferimento una fetta di
torta che è divisa in 12 fette.
Per calcolare la massa relativa di
un’altra torta, prendo la sua massa
assoluta e la divido per la massa
della singola fetta utilizzata come
riferimento: otterrò un numero
PURO, ADIMENSIONALE
Massa atomica relativa
• Media ponderata della massa relativa di
ciascun isotopo (sommatoria del prodotto tra
la massa relativa di ciascun isotopo e la
relativa abbondanza isotopica fratto cento)
• Esempio: in natura il carbonio è costituito da
due isotopi stabili: per il 98,89% è costituito
dall’isotopo 12C di peso atomico 12 (per
convenzione) e per l’ 1,11% dall’isotopo 13C
di peso atomico 13,0033 (per determinazione
sperimentale).
• Il peso atomico del C è:
(98.89 / 100) x 12 + (1.11 / 100) x13.0033 = 12.0111
Peso molecolare
• somma dei pesi atomici degli elementi che
compongono la sostanza
• Esempio: note le masse di idrogeno
(1.0079 u.m.a.) e ossigeno (15.9994
u.m.a.) la massa molecolare dell'acqua
(H2O) si calcola come segue:
2 × 1.0079 u.m.a. + 15.9994 u.m.a. =
18.0152 u.m.a.
Peso formula
• È l'equivalente del peso molecolare per i
composti ionici, che non hanno una molecola
esattamente definita. È definito come la somma
delle masse atomiche degli atomi che
costituiscono la FORMULA MINIMA del
composto
• Esempio: la formula minima del solfato di sodio
è Na2SO4 ; il suo peso formula è:
(2 × 22.98977) + 32.06 + (4 × 15.9994) = 142.04
Peso molecolare
• E’ il rapporto tra la massa della molecola
considerata e l’unità di massa (1/1212C)
• Nota la formula di una sostanza, il peso
molecolare (PM) è la SOMMA DEI PESI
DEGLI ATOMI CHE LA COSTITUISCONO
• Si chiama molecola la più piccola parte di
sostanza (semplice o composta) capace di
esistenza indipendente
La mole
• Una mole è una determinata quantità fissa
di specie chimiche (molecole, ioni, unità
formula, atomi)
• Corrisponde a un insieme N di unità, dove
N è il numero di Avogadro
• N=6,023 x 1023
• E’ pari tante unità elementari quanti sono
gli atomi contenuti in 0,012 kg (12 g)di 12C
• Quindi una mole di un elemento ha un
peso pari al peso atomico di
quell’elemento
• Una mole di ossigeno pesa 16 g
• Una mole di ferro pesa 55,85 g
• Il volume in litri occupato da una mole di
un qualsiasi gas a condizioni normali (c.n.)
ovvero T=0°C e P=1 atm è pari a 22,414 l
• Per conoscere il numero di moli presenti in
una quantità in grammi di una sostanza di
cui si conosca il peso atomico (o il peso
molecolare, o il peso formula) è sufficiente
dividere questa quantità per il peso
atomico (o il peso molecolare, o il peso
formula)
• Una mole di gas contiene N molecole e,
per la legge di Avogadro, occupa, in
condizioni normali un volume ben
determinato
• Tale volume corrisponde a 22,414 l ed è
detto volume molare
Schema riassuntivo del concetto di
mole
Una MOLE di
sostanza
corrisponde a:
Una MASSA in g
pari al P.A., P.M.,
P.F. di una
sostanza
Un VOLUME in l
pari a 22,414 a c.n.
di sostanza
gassosa
Un NUMERO di
entità elementari di
sostanza pari a
6,022 . 10 23
Di conseguenza i rapporti:
m (g) sostanza
V(l) sostanza a c.n.
X (unità formula)
M (g/mol)
Volume molare Vm
(l/mol) a c.n.
N° (unità formula/mol)
Corrispondono a n
moli di sostanza
ESEMPIO
• Calcolare le moli corrispondenti a 180,0 g di
carbonio, sapendo che la massa atomica
relativa di C è 12,011.
• moli (C) = 180,0 g /12,011 g mol-1 = 14,99 mol
E’ possibile calcolare la massa corrispondente ad
un certo numero di moli moltiplicando la massa
in g per il peso molecolare (massa molare):
massa (in g) = mol x massa molare (g mol-1)
Esercizi
• Qual è la massa in grammi di una
molecola di azoto?
• Determina la massa molecolare di H2SO4.
Esercizio
• Calcolare la massa in grammi
corrispondente a 2,00 moli di NaOH
Esercizio
• Calcolare quante molecole sono presenti
in
• 0,50 moli di NaOH
• 5,00 g di NaOH
Esercizi
• A quante moli di H2O corrispondono 3,48 g
di H2O?
• Calcolare la massa in grammi di 1,00 mol
di atomi di cloro e di 1,00 mol di molecole
di cloro.
Esercizio
• Quaranta chicchi di riso occupano un volume di
1,0 cm3 e pesano 1,0g. Calcolare: a) l’altezza di
un silos cilindrico di raggio 1,0 km necessario
per immagazzinare una mole di riso b) la massa
in tonnellate di una mole di riso c) se ciascun
abitante della Terra consumasse 365 kg di riso
l’anno, in quanto tempo verrebbe esaurita la
scorta? (si consideri la popolazione mondiale
pari a 5 miliardi di individui)
Esercizio
• In una soluzione acquosa sono contenuti
30,0 g/l di HNO3. Calcolare il volume di
soluzione contenente 3,0 moli di HNO3
ESEMPIO
• Il cloro è presente in natura come miscela degli
isotopi 35Cl (34,9689 uma, 75,770 %) e 37Cl (36,9659
uma, 24,230 %). Calcolare la massa atomica del cloro
naturale.
• Consideriamo un campione di cloro costituito, ad
esempio, da 100000 atomi. Di questi, 75,770 x
100000/100 = 75770 sono atomi di 35Cl e 24,230 x
100000/100 = 24230 sono atomi di 37Cl.
• La massa totale del campione è data dalla somma delle
masse dei due tipi di atomi, cioè: 75770 x 34,9689 uma
+ 24230 x 36,9659 uma = 3,5453.106 uma.atomi
• La massa atomica media si ottiene dividendo questo
valore per il numero di atomi contenuti nel campione:
• 3,5453.106 uma.atomi / 100000 atomi = 35,453 uma