CARBOSSITERAPIA
di Vincenzo Varlaro
Docente nel Master Internazionale Biennale di II livello di Medicina
Estetica e Terapia Estetica dell'Università Degli Studi di Camerino
[email protected]
Per carbossiterapia si intende l'utilizzo dell’anidride carbonica allo
stato gassoso a scopo terapeutico. L’anidride carbonica è costituita
da un atomo di carbonio legato a due atomi di ossigeno (CO2) (Fig.
1).
Figura 1
Per la sua formula di struttura l’anidride carbonica può essere
denominata anche biossido di carbonio.
Il termine carbossiterapia è stato introdotto da Luigi Parassoni nel
1995, in occasione del XVI Congresso Nazionale di Medicina
Estetica di Roma della Società Italiana di Medicina Estetica.
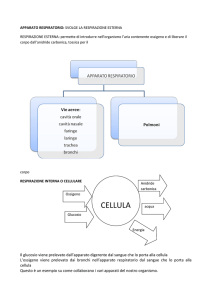
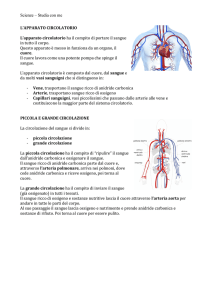
ELEMENTI DI EMODINAMICA
La funzione della circolazione sanguigna è quella di provvedere alle esigenze dei
tessuti fornendo le sostanze nutritive, rimuovendo i prodotti di rifiuto,
trasportando gli ormoni da una parte all’altra del corpo e, consentendo, in
generale, il mantenimento di un ambiente interno ottimale alla sopravvivenza e al
funzionamento cellulare in tutti i liquidi dei tessuti. La circolazione sanguigna è
distinta in sistemica e polmonare.
Poiché la circolazione sanguigna sistemica provvede all’irrorazione di tutti i
tessuti del corpo ad eccezione dei polmoni, essa è chiamata anche grande
circolazione o circolazione periferica.
Le componenti funzionali della circolazione sanguigna sono le arterie, le
arteriole, le metarteriole, i capillari, le venule, le vene (Fig. 2).
Figura 2 Microcircolazione
La funzione delle arterie è di trasportare ad alti regimi pressori il sangue ai
tessuti, quelle delle arteriole e delle metarteriole di esplicare le funzioni di
valvole di controllo attraverso cui il sangue viene immesso nei capillari e, quella
di fornire, con la loro sfigmicità, la vis a tergo che favorisce il flusso a livello di
microcircolazione, quella dei capillari di favorire lo scambio di acqua, nutrienti,
elettroliti, ormoni e altre sostanze tra il sangue e il liquido interstiziale, quella
delle venule di raccogliere il sangue dai capillari, quella delle vene di fungere da
condotti per il trasporto del sangue al cuore e quella di serbatoio di grosse
quantità di sangue: le loro pareti sono molto sottili ma possiedono ugualmente
una tunica muscolare che consente, con il suo rilassarsi e contrarsi, di accogliere
e di immettere nella circolazione sanguigna, a seconda del fabbisogno, quantità
più o meno grandi di sangue.
Una caratteristica comune a tutti i vasi è la distensibilità. Il fatto che le arterie
siano distensibili permette loro di accogliere la gittata pulsatoria del cuore e di
smorzare le pulsazioni pressorie trasformando il flusso ematico da pulsatile a
continuo nei vasi molto piccoli.
Il sistema più distensibile è, comunque, quello venoso. Per la sua distensibilità il
sistema venoso esplica le funzioni di riserva temporanea di grandi quantità di
sangue da poter utilizzare nel momento del bisogno da altri settori del sistema
circolatorio.
Il sangue circola nei vasi arteriosi spinto dalla contrazione del cuore. Il cuore
riceve il sangue a bassa pressione dal sistema capacitativo venoso e lo immette
ritmicamente (a ogni sistole), a pressione elevata, nelle grandi arterie, che
fungono da camere di compressione. Da qui, spinto dalla “retrazione elastica”
delle pareti delle arterie, il sangue defluisce nella microcircolazione e, quindi, nel
sistema venoso.
Il cuore si comporta come una sorta di <<servitore>> dei tessuti che deve
soddisfare con il suo lavoro.
La regolazione nervosa della circolazione sanguigna interessa principalmente le
funzioni generali come la ridistribuzione del flusso ematico nelle diverse aree del
corpo, il potenziamento dell’attività della pompa del cuore e in particolare la
regolazione rapida della pressione arteriosa.
La sezione più importante del sistema nervoso autonomo che controlla la
circolazione sanguigna è quella del sistema nervoso simpatico. La sezione
parasimpatica del sistema nervoso autonomo ha significati importanti soprattutto
nella regolazione della funzione cardiaca. Le fibre nervose vasomotrici del
sistema nervoso simpatico partono dal midollo spinale con tutti i nervi del tratto
toracico e con i primi uno - due nervi del tratto lombare, passano nei gangli della
catena simpatica e, da qui, raggiungono i vasi sanguigni attraverso due strade: i
nervi simpatici specifici che innervano il sistema vascolare degli organi interni e
il cuore e i nervi spinali che innervano principalmente i territori periferici.
L’innervazione simpatica vale per tutto il sistema arterioso e venoso con
l’esclusione degli sfinteri precapillari, dei capillari, della maggior parte delle
metarteriole che subiscono la regolazione da parte di fattori locali (Fig. 3)
Figura 3
Il centro vasomotore (un’area situata nella sostanza reticolare del bulbo e nel
terzo inferiore del ponte) trasmette di continuo segnali alle fibre nervose
vasocostrittrici del simpatico in tutto l’organismo mantenendo un’attività di
scarica a bassa frequenza di circa 0.5-2 impulsi al secondo. Questa attività
continua è chiamata tono vasocostrittore del simpatico che mantiene in uno stato
di parziale contrazione le pareti dei vasi sanguigni (tono vasomotore).
Il sistema nervoso autonomo simpatico, poiché innerva quasi la totalità dei vasi,
se stimolato, può fare incrementare la resistenza vascolare sistemica con
riduzione del volume dell’intero sistema vascolare sistemico. Con tale
meccanismo il sistema nervoso autonomo simpatico è in grado di variare il
ritorno del sangue al cuore svolgendo, così, un ruolo importante nella
regolazione della funzione cardiovascolare. La regolazione nervosa della
circolazione del sistema nervoso autonomo simpatico è poco implicata nella
regolazione del flusso ematico tessutale locale.
La regolazione del flusso ematico tessutale locale, nei singoli distretti tessutali, è
effettuata principalmente da fattori locali.
Uno dei principi fondamentali della funzione circolatoria è la capacità di ciascun
distretto tessutale di regolare il proprio flusso ematico tessutale locale in
relazione alle esigenze metaboliche tessutali stesse. Così, come i bisogni tessutali
mutano, anche il flusso ematico tessutale locale si modifica.
Le necessità specifiche dei tessuti alle quali il flusso ematico tessutale locale si
deve adeguare sono molteplici:
• l’apporto di ossigeno;
• l’apporto di nutrienti (glucosio, aminoacidi, acidi grassi,…);
• la rimozione di CO2 dai tessuti;
• il mantenimento di un’appropriata concentrazione di svariati ioni nei tessuti;
• il trasporto di diversi ormoni e di altre specifiche sostanze ai tessuti.
Inoltre, alcuni organi hanno esigenze specifiche. A livello cutaneo, il flusso
ematico tessutale locale, determina dispersione di calore per cui contribuisce alla
regolazione della temperatura corporea. A livello renale il flusso ematico
tessutale locale permette di allontanare i prodotti di scarto del metabolismo
contribuendo alla funzione dell’emuntorio renale.
In generale quanto più è elevato il metabolismo di un organo tanto maggiore è il
suo flusso ematico tessutale locale. A riposo l’attività metabolica dei muscoli è
molto bassa per cui anche il flusso ematico tessutale locale è molto basso (4
ml/minuto/100 grammi). Al contrario, in condizioni di attività fisica intensa,
l’attività metabolica muscolare può aumentare più di sessanta volte e il flusso
ematico tessutale locale può aumentare più di venti volte, salendo fino a valori di
80 ml/minuto/100 grammi.
Il flusso ematico tessutale locale è regolato principalmente da fattori locali:
anidride carbonica, adenosina, acido lattico, composti di adenosina, fosfati,
istamina, ioni potassio, ioni idrogeno, fattori di crescita delle cellule endoteliali,
fattori di crescita dei fibroblasti, angiogenina (Fig. 4).
ANIDRIDE
CARBONICA
ADENOSINA
COMPOSTI
ADENOSINA
ACIDO LATTICO
FOSFATI
ISTAMINA
IONI IDROGENO
IONI POTASSIO
Figura 4
Tali fattori locali regolano il flusso ematico tessutale locale a breve termine e a
lungo termine.
I fattori locali che regolano il flusso ematico tessutale locale a breve termine
sono l’anidride carbonica, l’adenosina, l’acido lattico, i composti di adenosina, i
fosfati, l’istamina, gli ioni potassio, gli ioni idrogeno.
I fattori locali che regolano il flusso ematico tessutale locale a lungo termine
sono i fattori di crescita delle cellule endoteliali, i fattori di crescita dei
fibroblasti, l’angiogenina.
La regolazione a breve termine del flusso ematico tessutale locale operata
dall’anidride carbonica, dall’adenosina, si realizza con una vasodilatazione
arteriolare e metarteriolare ed una conseguente retrazione delle pareti arteriose
stesse con, quindi, un aumento della sfigmicità arteriolare e metarteriolare.
Queste variazioni del flusso ematico tessutale locale avvengono nel giro di pochi
secondi o minuti al fine di garantire e mantenere un flusso ematico tessutale
locale appropriato alle esigenze tessutali locali: si tratta di variazioni repentine
del flusso ematico tessutale locale conseguenti a cambiamenti del grado di
costrizione locale delle arteriole, delle metarteriole, degli sfinteri precapillari.
La regolazione a lungo termine del flusso ematico tessutale locale operata dai
fattori di crescita delle cellule endoteliali, dai fattori di crescita dei fibroblasti,
dall’angiogenina si realizza con un aumento della entità del letto vascolare della
microcircolazione tessutale (angiogenesi vera e angiogenesi falsa). L’incremento
della entità del letto vascolare della microcircolazione tessutale si può verificare
nel giro di alcuni giorni, di alcune settimane, di alcuni mesi.
Una unità tessutale è costituita da una metarteriola, un singolo capillare e dal
tessuto circostante. All’origine del capillare c’è lo sfintere precapillare e intorno
alla metarteriola parecchie fibre muscolari lisce.
Se si osserva al microscopio un tessuto sottile come quello dell’ala di un
pipistrello si nota che gli sfinteri precapillari sono o completamente aperti o
completamente chiusi e che il grado di costrizione della metarteriola varia con il
tempo. Il numero degli sfinteri precapillari che sono aperti in un dato periodo è
all’incirca proporzionale alla richiesta di ossigeno (e di altri nutrienti) dei tessuti.
Inoltre gli sfinteri precapillari e le metarteriole si aprono spesso in modo ciclico
per parecchie volte al minuto e la fase di apertura è anch’essa proporzionale alle
necessità metaboliche dei tessuti. Questo aprirsi e chiudersi ciclico delle
metarteriole e degli sfinteri precapillari è detto vasomotion.
Poiché i muscoli lisci richiedono ossigeno per rimanere in contrazione si può
ritenere che la forza di contrazione degli sfinteri aumenta con l’incremento della
concentrazione dell’ossigeno.
Di conseguenza quando la concentrazione dell’ossigeno sale nel tessuto oltre un
certo livello, gli sfinteri precapillari e le metarteriole si chiudono e si riduce la
velocità del flusso ematico tessutale locale fino a che le cellule tessutali non
hanno consumato l’ossigeno in eccesso mentre quando la concentrazione
dell’ossigeno scende a livelli sufficientemente bassi, gli sfinteri precapillari e le
metarteriole si aprono e aumenta la velocità del flusso ematico tessutale locale.
La regolazione a breve termine del flusso ematico tessutale locale viene
realizzata principalmente da fattori locali: l’anidride carbonica, l’adenosina,
l’acido lattico, i composti di adenosina, i fosfati, l’istamina, gli ioni potassio, gli
ioni idrogeno.
La regolazione a breve termine del flusso ematico tessutale locale operata
dall’anidride carbonica, dall’adenosina, si realizza con una vasodilatazione
arteriolare e metarteriolare ed una conseguente retrazione delle pareti arteriolari e
metarteriolari con, quindi, un aumento della sfigmicità arteriolare e
metarteriolare.
Queste variazioni del flusso ematico tessutale locale avvengono nel giro di pochi
secondi o minuti al fine di garantire e mantenere un flusso ematico tessutale
locale appropriato alle esigenze tessutali locali: si tratta di variazioni repentine
del flusso ematico tessutale locale conseguenti a cambiamenti del grado di
costrizione locale delle arteriole, delle metarteriole, degli sfinteri precapillari.
La regolazione a breve termine del flusso ematico tessutale locale prevede
l’entrata in gioco di diversi elementi come il metabolismo tessutale, la
disponibilità di ossigeno, la disponibilità di alcuni nutrienti. In genere un
aumento del metabolismo tessutale di otto volte determina un incremento del
flusso ematico tessutale locale di quattro volte. Tutte le volte che la disponibilità
dell’ossigeno nei tessuti diminuisce come avviene alle alte quote, nella
polmonite, nell’avvelenamento da monossido di carbonio (che annulla la
capacità dell’emoglobina di trasportare ossigeno), nell’avvelenamento da cianuro
(viene meno la capacità dei tessuti di utilizzare ossigeno) il flusso ematico
tessutale locale aumenta marcatamente.
Esistono due teorie fondamentali sulla regolazione del flusso ematico tessutale
locale in risposta alle variazioni del metabolismo del tessuto o alla disponibilità
dell’ossigeno:
• la teoria della vasodilatazione;
• la teoria della richiesta di ossigeno.
Teoria della vasodilatazione
Secondo la teoria della vasodilatazione maggiore è il grado del metabolismo o
minore è la disponibilità di ossigeno per il tessuto più grande è la liberazione di
una sostanza vasodilatatrice che agisce a livello degli sfinteri precapillari, delle
metarteriole causandone la vasodilatazione. Insomma verrebbe liberata una
sostanza che esplicherebbe una vasodilatazione arteriolare e metarteriolare. Tra
le svariate sostanze coinvolte in tale regolazione quelle ritenute capaci di
determinare una vasodilatazione arteriolare e metarteriolare sono l’adenosina,
l’anidride carbonica, l’acido lattico, i composti di adenosina, i fosfati, l’istamina,
gli ioni potassio, gli ioni idrogeno.
Alcuni fisiologi hanno ipotizzato che l’adenosina sia, tra i vasodilatatori
arteriolari e metarteriolari che regolano il flusso ematico tessutale locale, una
delle sostanze più importanti.
È stato osservato che l’adenosina viene rilasciata in piccole quantità dalle cellule
del muscolo cardiaco tutte le volte che il flusso coronarico si riduce troppo. Si
ritiene che la liberazione dell’adenosina provochi la vasodilatazione dell’arteria
coronaria riportando il flusso ematico tessutale locale ai valori normali. Inoltre,
quando il cuore diventa iperattivo e aumenta il suo metabolismo, si verifica una
eccessiva utilizzazione dell’ossigeno per cui cala la sua concentrazione nei
tessuti e tutto ciò porta alla degradazione dell’ATP con aumento della
formazione di adenosina. Si ritiene che l’adenosina fuoriesca, in parte, dalle
cellule muscolari e provochi una vasodilatazione dell’arteria coronaria,
aumentando, così, il flusso coronarico per soddisfare le maggiori richieste di
ossigeno da parte del cuore in attività.
La generalità dei fisiologi ritengono che la CO2 esplichi la sua azione di
vasodilatazione arteriolare e metarteriolare con un meccanismo analogo a quello
dell’adenosina. L’anidride carbonica prodotta dal tessuto miocardico
provocherebbe una vasodilatazione delle arterie coronarie per fare aumentare il
flusso ematico coronarico e potere, quindi, soddisfare le maggiori richieste di
ossigeno del cuore in attività. Insomma quello dell’adenosina e della CO2
sarebbero due meccanismi fisiologici con cui l’organismo autoregola il flusso
ematico locale per soddisfare le esigenze dei propri tessuti, dei propri organi.
Teoria della richiesta di ossigeno
La teoria della vasodilatazione è accettata dalla gran parte dei fisiologi. Tuttavia
altri sostengono un’altra teoria: quella della richiesta di ossigeno, oppure, quella
definita più specificatamente: la teoria della richiesta dei nutrienti (perché
probabilmente, oltre all’ossigeno, molti altri fattori nutrizionali sono coinvolti
nella regolazione del flusso ematico tessutale locale).
L’ossigeno (così come altre sostanze nutrizionali) è richiesto per mantenere la
muscolatura liscia dei vasi arteriosi in stato di contrattura. Pertanto, in assenza di
un adeguato apporto di ossigeno (e di altre sostanze nutrizionali) è ragionevole
pensare che i vasi arteriosi tendano spontaneamente a dilatarsi. Inoltre, un
aumento della utilizzazione dell’ossigeno nei tessuti, come si verifica nei casi di
un aumento del metabolismo, potrebbe, teoricamente, fare diminuire la
disponibilità di ossigeno per le fibrocellule muscolari lisce dei vasi sanguigni
arteriosi locali causando una vasodilatazione arteriosa locale.
La regolazione a lungo termine del flusso ematico tessutale locale prevede un
aumento della entità del letto vascolare della microcircolazione tessutale.
Nell’aumento della entità del letto vascolare della microcircolazione tessutale
sembrerebbero coinvolti contemporaneamente una angiogenesi vera e una
angiogenesi falsa.
Angiogenesi vera
Il termine angiogenesi significa sviluppo di nuovi vasi sanguigni. L’angiogenesi
si verifica principalmente in risposta alla presenza di fattori angiogenetici
rilasciati da:
• tessuti ischemici;
• tessuti in crescita rapida;
• tessuti con livelli metabolici eccessivamente alti.
Sono stati scoperti una dozzina e più di fattori angiogenetici. In generale questi
fattori angiogenetici sono dei piccoli peptidi. Tre di questi piccoli peptidi sono
stati meglio caratterizzati:
• i fattori di crescita delle cellule endoteliali;
• i fattori di crescita dei fibroblasti;
• l’angiogenina.
Questi fattori di crescita sono stati isolati da tessuti tumorali o da tessuti
ischemici. Presumibilmente è proprio la mancanza di ossigeno nei tessuti che
porta alla formazione dei fattori angiogenetici. Questi tre diversi fattori di
crescita promuovono la crescita di nuovi vasi allo stesso modo: per gemmazione
dalle piccole venule e, occasionalmente, dai capillari.
Con questo meccanismo si possono neoformare piccole arteriole e, forse, anche
arterie più grandi. La biodisponibilità dell’ossigeno assume significati importanti
nella regolazione a lungo termine del flusso ematico tessutale locale e, quindi,
nel processo angiogenetico. Un esempio pratico che avvalora questa
affermazione è dato dal fatto che si ha un incremento del letto vascolare della
microcircolazione dei tessuti in molti animali che vivono a grandi altezze, dove
la concentrazione dell’ossigeno atmosferico è bassa. Un altro effetto è quello che
si può osservare negli embrioni di pollo: se vengono incubati in un’atmosfera
povera di ossigeno sviluppano una rete vascolare doppia del normale.
L’effetto dell’angiogenesi è dimostrato in modo drammatico in quei casi in cui i
neonati prematuri vengono posti sotto la tenda ad ossigeno per scopi terapeutici.
L’eccesso di ossigeno causa quasi immediatamente un arresto della
neoformazione dei vasi della retina e induce, addirittura, la degenerazione di
alcuni capillari già formati. Poi, quando il neonato è portato fuori dalla tenda ad
ossigeno, si verifica una crescita esplosiva di nuovi vasi per compensare la
rapida riduzione dell’ossigeno disponibile. In tali casi si può avere una crescita
così tumultuosa dei vasi sanguigni che gli stessi possono invadere l’umor vitreo
e causare cecità: condizione nota come fibroplasia retrolenticolare. Il processo
angiogenetico viene, quindi, stimolato da una ridotta biodisponibilità
dell’ossigeno e, di conseguenza, da un eccesso di CO2.
La CO2 favorirebbe la liberazione di fattori di crescita che stimolerebbero,
appunto, il processo angiogenetico. Il grado di vascolarizzazione di un tessuto
può aumentare o diminuire in virtù delle necessità metaboliche del tessuto stesso.
Se il metabolismo tessutale aumenta (e aumenta la produzione di CO2) si verifica
un incremento della vascolarizzazione tessutale mentre se il metabolismo
tessutale diminuisce (e diminuisce la produzione di CO2) si verifica una
riduzione della vascolarizzazione tessutale. Insomma, si verifica una
ristrutturazione della vascolarizzazione microcircolatoria tessutale secondo le
necessità metaboliche del tessuto. Si parla di angiogenesi vera per distinguerla
dalla angiogenesi falsa.
Angiogenesi falsa
Quella della angiogenesi falsa è una teoria di Curri. Secondo tale studioso della
microcircolazione la CO2 favorirebbe l’aumento del letto vascolare della
microcircolazione tessutale promovendo la ricanalizzazione di capillari virtuali.
La angiogenesi falsa non verrebbe indotta direttamente dalla CO2 ma sarebbe la
conseguenza dell’aumento del flusso ematico tessutale locale. Si parla di
angiogenesi falsa perché aumenterebbe l’entità del letto vascolare della
microcircolazione tessutale non per una angiogenesi vera indotta dai fattori di
crescita delle cellule endoteliali, dai fattori di crescita dei fibroblasti,
dall’angiogenina, bensì, per una canalizzazione di capillari virtuali.
L’angiogenesi vera e la angiogenesi falsa potrebbero essere coinvolte entrambe
nel determinare un aumento della entità del letto vascolare della
microcircolazione tessutale. L’aumento della entità del letto vascolare della
microcircolazione tessutale potrebbe essere la conseguenza:
• sia di una angiogenesi vera indotta dai fattori di crescita delle cellule
endoteliali, dai fattori di crescita dei fibroblasti, dall’angiogenina;
• sia di una angiogenesi falsa indotta dall’aumento della velocità del flusso
ematico tessutale locale e, di conseguenza, dall’aumento della entità del flusso
ematico tessutale locale che determinerebbe una canalizzazione di capillari
virtuali.
Le arterie hanno pareti robuste. L’organizzazione di base della parete di tutte le
arterie è simile: una tonaca intima di natura endoteliale, una tonaca media
composta soprattutto da fibrocellule muscolari lisce orientate trasversalmente,
una tonaca avventizia che costituisce il rivestimento esterno e che è costituita da
fibroblasti e fibre collagene orientate per la maggior parte in senso longitudinale.
Il confine fra la tonaca intima e la tonaca media è segnato dalla lamina elastica
interna, mentre il confine fra la tonaca media e la tonaca avventizia è segnato
dalla lamina elastica esterna.
Le arterie vengono classificate in elastiche (di conduzione) e muscolari (di
distribuzione). Le arterie elastiche sono caratterizzate, a livello di tonaca media,
da numerose lamine fenestrate di elastina. Sono arterie elastiche le grandi arterie
come l’aorta, la polmonare, la brachiocefalica, la succlavia, la carotide comune,
l’iliaca comune.
Le arterie muscolari sono caratterizzate, a livello di tonaca media, da un numero
variabile di strati di fibrocellule muscolari lisce: si va dai tre-quattro strati delle
piccole arterie fino ai trenta-quaranta strati delle grandi arterie. Sono arterie
muscolari la brachiale, la femorale, la radiale, la poplitea e le loro diverse
diramazioni. Le arterie muscolari costituiscono la maggioranza dei vasi del
sistema arterioso. La funzione delle arterie è di trasportare il sangue ad alti
regimi pressori e al tempo stesso, in virtù della loro elasticità, di fare viaggiare il
sangue verso gli ultimi <<prati vascolari>>: la microcircolazione. Le arterie
fungono da camera di compressione.
La retrazione elastica delle arterie è essenziale affinché il sangue possa essere
sospinto nella microcircolazione. Se non ci fosse l’effetto della retrazione
elastica delle arterie il sangue potrebbe pervenire nella microcircolazione
soltanto nelle fasi di sistole cardiaca.
Le arteriole e le metarteriole, a livello di microcircolazione, esplicano delle
funzioni importanti perché rappresentano quella che è la vis a tergo della
microcircolazione.
La vasodilatazione e la retrazione elastica della parete delle arteriole e delle
metarteriole, costituiscono la sfigmicità delle arteriole e delle metarteriole, la vis
a tergo della microcircolazione che spinge il flusso ematico a viaggiare nel letto
vascolare della microcircolazione.
La carbossiterapia serve a riequilibrare la microcircolazione
quando la stessa è alterata. Con la carbossiterapia si effettua un
trattamento riabilitativo della microcircolazione.
La carbossiterapia esplica i suoi effetti interferendo principalmente
con i fattori che regolano a breve termine il flusso ematico tessutale
locale determinando, così, un aumento della velocità del flusso
ematico tessutale locale:
• agendo sulla vis a tergo della microcircolazione, cioè a livello
arteriolare e metarteriolare dove determina un incremento della
sfigmicità arteriolare e metarteriolare;
• agendo sugli sfinteri precapillari della microcircolazione dove
determina un rilassamento delle fibrocellule muscolari lisce che
caratterizzano strutturalmente gli sfinteri precapillari;
• determinando un aumento della deformabilità eritrocitaria.
La CO2 somministrata determina un aumento della velocità del
flusso ematico tessutale locale e, di conseguenza, un aumento della
entità del flusso ematico tessutale locale.
L’aumento della sfigmicità arteriolare e metarteriolare è un aspetto
che gioca un ruolo importante nell’aumento della entità e della
velocità del flusso ematico tessutale locale.
La sfigmicità arteriolare rappresenta la vis a tergo della
microcircolazione che favorisce il viaggio del flusso ematico nel
letto capillare che non è da relazionare solo all’apertura e alla
chiusura delle metarteriole, degli sfinteri precapillari, ma anche alla
sfigmicità arteriolare e metarteriolare che realizza, così, un’azione
propulsiva importante.
L’aumento della velocità, della entità del flusso ematico tessutale
locale, della sfigmicità arteriolare e metarteriolare è stato osservato
mediante videocapillaroscopia a sonda ottica (VCSO) da Parassoni
e altri autori e rilevato mediante Laser Doppler Flow da Curri,
Albergati, Lattarulo, Parassoni, Varlaro.
Nel 2006 Manzo, Villeggia, Varlaro hanno dimostrato mediante
linfoscintigrafia radioisotopica gli effetti della carbossiterapia sul
flusso linfatico degli arti inferiori in situazioni cliniche di grave
linfostasi (Figg. 5, 6, 7, 8).
Figura 5 Linfoscintigrafia gambe viste anteriormente pretrattamento
Figura 6 Linfoscintigrafia gambe viste anteriormente posttrattamento
Figura 7 Linfoscintigrafia cosce viste posteriormente pretrattamento
Figura 8 Linfoscintigrafia cosce viste posteriormente posttrattamento
Con la carbossiterapia effettuata in situazioni di grave linfostasi si è
osservato, in tutti i casi trattati, un miglioramento delle situazioni di
stasi linfatica con una ottima ripresa del flusso linfatico nel sistema
linfatico degli arti inferiori.
Oltre che con gli effetti sulla tonaca media delle arteriole e delle
metarteriole che determinano un aumento della sfigmicità
arteriolare e metarteriolare e che con gli effetti sugli eritrociti che
determinano un aumento della deformabilità eritrocitaria, la
carbossiterapia, probabilmente, agisce anche mediante altri
meccanismi molecolari: l’attivazione recettoriale e l’amplificazione
dell’effetto Bohr e dell’effetto Haldane.
Attivazione recettoriale
L’attivazione recettoriale è legata all’iperdistensione dei tessuti
sottocutanei operata dall’anidride carbonica iniettata. Tale effetto
non è, chiaramente, CO2-dipendente; infatti vale per qualsiasi altro
gas che viene iniettato nel sottocutaneo e che ha la capacità di
distendere i tessuti. Nel sottocutaneo si trovano degli esterocettori
specifici:
• i piccoli corpuscoli di Golgi (a forma rotondeggiante) che
raccolgono le pressioni leggere;
• i grossi corpuscoli di Pacini (a forma di pallone di rugby) che
sono rivestiti da lamelle concentriche (nelle sezioni traverse hanno
un aspetto simile a quello di una cipolla) e che raccolgono le
pressioni elevate.
L’iperdistensione dei tessuti sottocutanei causata dalla CO2
determina l’attivazione di esterocettori specifici che favoriscono la
liberazione di sostanze algogene come le catecolamine, la
bradichinina, la serotonina. Sembra che la bradichinina esplichi
anche un effetto vasodilatatorio sulle arteriole e le metarteriole e
che, quindi, possa contribuire, agendo sul cuore della
microcircolazione, a fare aumentare il flusso ematico tessutale
locale.
Tali sostanze algogene, agendo su recettori specifici β-adrenergici,
attivano l'adenilciclasi, quindi, determinano un aumento del cAMP.
Il cAMP attiva la preteinchinasi inattiva che, a sua volta, stimola la
lipasi intradipocitaria che idrolizza i trigliceridi intradipocitari
dando luogo alla formazione di acidi grassi e glicerolo.
Amplificazione dell’effetto Bohr e dell’effetto Haldane
L’emoglobina oltre a trasportare l’ossigeno dai polmoni ai tessuti,
trasporta anche due prodotti terminali della respirazione tessutale:
l’H+ e la CO2 dai tessuti ai polmoni e ai reni: i due organi deputati
all’escrezione di questi prodotti. Nelle cellule dei tessuti periferici
gli alimenti organici vengono ossidati dai mitocondri (utilizzando
l’ossigeno portato dall’emoglobina dai polmoni) con la formazione
di anidride carbonica, acqua e altri prodotti. La formazione di CO2
provoca un aumento nella concentrazione di H+ (e quindi, una
diminuzione del pH) nei tessuti poiché l’idratazione della CO2
forma H2CO3 (acido carbonico), un acido debole che si dissocia
formando H+ e bicarbonato: H2CO3 H++HCO3-.
Oltre a trasportare dai polmoni ai tessuti praticamente tutto
l’ossigeno richiesto, l’emoglobina trasporta una discreta quantità
(circa il 20%) della CO2 e dell’H+ formati nei tessuti, ai polmoni e
ai reni. Il legame dell’emoglobina con l’O2 viene influenzato dal
pH e dalla concentrazione di CO2 ed il legame dell’emoglobina con
la CO2 è inversamente correlato al legame con l’O2. A pH basso e
ad alta concentrazione di CO2 nei tessuti periferici l’affinità
dell’emoglobina per l’ossigeno diminuisce mentre vengono legati
H+ e CO2. Viceversa nei capillari polmonari, come la CO2 è escreta
e aumenta il pH del sangue, aumenta l’affinità dell’emoglobina per
l’O2. Questo effetto del pH e della concentrazione di CO2 sul
legame e sul rilascio dell’O2 dall’emoglobina è detto effetto Bohr,
da Christian Bohr, un fisiologo danese, che lo scoprì.
L’effetto Bohr è il risultato di un equilibrio che coinvolge non solo
l’ossigeno ligante ma anche altri due liganti che possono essere
legati dall’emoglobina: l’H+ e la CO2. La reazione è: Hb+O2 HbO2. Questa reazione è, però, incompleta.
Considerando l’effetto delle concentrazioni di H+ sul legame
dell’ossigeno da parte dell’emoglobina possiamo, così, riscrivere la
reazione: HHb++O2 HbO2+H+ dove HHb+ denota una forma
protonata di emoglobina.
Questa reazione ci dice che la curva di saturazione in ossigeno
dell’emoglobina è influenzata dalla concentrazione degli
idrogenioni H+. Sia l’O2 che l’H+ sono legati dall’emoglobina ma in
modo inverso. Quando la concentrazione di ossigeno è alta, come
nei polmoni, esso sarà legato dall’emoglobina e gli idrogenioni H+
saranno rilasciati.
Quando la concentrazione di ossigeno è bassa, come nei tessuti,
l'emoglobina legherà l’idrogenione H+. L’O2 e l’H+ non sono legati
nell’emoglobina agli stessi siti.
L’ossigeno è legato agli atomi di ferro dell’eme mentre l’H+ è
legato ai gruppi R dei residui di istidina 146 nelle catene beta e ad
altri due residui nelle catene alfa. La CO2 si lega all’estremità
aminoterminale di ciascuna delle quattro catene polipeptidiche
dell’emoglobina formando carbaminoemoglobina.
Ad alte concentrazioni di CO2, come avviene nei tessuti, alcune
molecole di CO2 sono legate all’emoglobina e l’affinità per l’O2
diminuisce per cui si verifica il suo rilascio.
Viceversa, quando l’O2 viene legato nei polmoni l’affinità
dell’emoglobina per la CO2 diminuisce, per cui si verifica la sua
eliminazione.
L’effetto Bohr è un effetto essenziale per la vita. Maggiore è la
pressione parziale dell'ossigeno maggiore è la percentuale di
saturazione dell'emoglobina in ossigeno.
Maggiore è la pressione parziale dell'anidride carbonica maggiore è
la percentuale di saturazione dell'emoglobina in anidride carbonica.
Maggiore è la pressione parziale dell'ossigeno maggiore è l’affinità
dell’emoglobina per l’ossigeno.
Maggiore è la pressione parziale dell'anidride carbonica maggiore è
l’affinità dell’emoglobina per l’anidride carbonica. Nei tessuti, il
pH basso e la concentrazione alta di CO2 tendono a provocare il
rilascio di O2 dall’emoglobina e nei polmoni, la concentrazione
alta di O2 tende a promuovere il rilascio di H+ e CO2.
Somministrando CO2 nei tessuti vengono amplificati, a livello
distrettuale, l’effetto Bohr e l’effetto Haldane.
La somministrazione di CO2 nel sottocutaneo determina un
abbassamento del pH ed un innalzamento della concentrazione
della CO2 con, quindi, aumentato rilascio di O2 da parte
dell’emoglobina. Aumentato rilascio di O2 da parte
dell’emoglobina che significa aumentata biodisponibilità di O2 per i
tessuti e, quindi, aumentata biodisponibilità di O2 per i processi
catabolici ossidativi degli acidi grassi. Il legame dell’ossigeno con
l’emoglobina tende ad eliminare la CO2 dal sangue. Questo è noto
come effetto Haldane.
L’effetto Haldane è dovuto al fatto che il legame dell’ossigeno con
l’emoglobina nei polmoni rende l’emoglobina più acida, e ciò, fa
spostare l’anidride carbonica dal sangue e ne facilita l’eliminazione
alveolare con due meccanismi:
• l’emoglobina più acida ha una minore tendenza a combinarsi con
l’anidride carbonica per formare carbaminoemoglobina, liberando,
così, molta dell’anidride carbonica presente sotto tale forma;
• l’aumentata acidità dell’emoglobina provoca il rilascio da parte
dell’emoglobina stessa di un maggiore numero di ioni idrogeno
(H+) che si combinano con gli ioni bicarbonato (HCO3-) presenti
nel plasma a formare acido carbonico; in seguito, l’acido carbonico
si dissocia in acqua e anidride carbonica, liberando quest’ultima dal
sangue.
Nei capillari dei tessuti l’effetto Haldane causa una maggiore
assunzione di anidride carbonica da parte dell’emoglobina in
seguito allo spiazzamento dell’ossigeno dall’emoglobina. Nei
capillari dei polmoni l’effetto Haldane determina una maggiore
liberazione di anidride carbonica dall’emoglobina per il legame
dell’ossigeno con l’emoglobina.
VIE DI ELIMINAZIONE DELL’ANIDRIDE CARBONICA
L’anidride carbonica (CO2) prodotta dal metabolismo cellulare, per
essere eliminata, diffonde dall’interno all’esterno delle cellule in
forma gassosa e sempre in forma gassosa, passa dallo spazio
interstiziale nei capillari (Fig.9).
CO2
CELLULA
G
A
S
CO2
INTERSTIZIO
G
A
S
CO2
Figura 9
Solo una piccola parte di CO2 può diffondere come bicarbonato in
quanto la membrana cellulare è quasi del tutto impermeabile allo
ione bicarbonato. Al suo ingresso nel capillare la CO2 va incontro a
tutta una serie di reazioni chimiche e fisiche che sono essenziali per
il trasporto dell’anidride carbonica (Fig. 10).
SANGUE
7% FORMA GASSOSA
73% IONE BICARBONATO
20% LEGATA A PROTEINE
Figura 10 Trasporto dell’anidride carbonica nel sangue
Una piccola frazione di CO2 presente nel plasma (il 7% di tutta
l’anidride carbonica trasportata) è trasportata ai polmoni sotto
forma di gas disciolto in soluzione. Una parte della CO2 disciolta
nel sangue reagisce con l’acqua per formare acido carbonico:
CO2+H2O H2CO3 (Fig. 11).
PLASMA
CO2 + H2O
H2CO3
REAZIONE LENTA
Figura 11
Questa reazione sarebbe molto lenta, quindi sarebbe trascurabile se
non ci fosse una particolare specializzazione enzimatica all’interno
dei globuli rossi dove si è presente un enzima denominato anidrasi
carbonica che catalizza la reazione tra l’anidride carbonica e
l’acqua aumentando la velocità di tale reazione di 5000 volte (Fig.
12).
ERITROCITA
ANIDRASI CARBONICA
CO2 + H2O
H2CO3
REAZIONE VELOCE
Figura 12
Invece di richiedere molti secondi o addirittura alcuni minuti, come
accade nel plasma, nei globuli rossi la reazione avviene così
rapidamente da raggiungere lo stato di equilibrio in una frazione di
secondo. Ciò permette a grandi quantità di anidride carbonica di
reagire con l’acqua contenuta nei globuli rossi ancor prima che il
sangue abbia lasciato il capillare. In un’altra frazione di secondo,
l’acido carbonico formatosi nei globuli rossi, si dissocia in ioni
idrogeno e ioni bicarbonato: H2CO3 H++HCO3- (Fig. 13).
ERITROCITA
ANIDRASI CARBONICA
CO2 + H2O
H2CO3
H+ HCO3PRINCIPALE
BASE TAMPONE
DEL PLASMA
Figura 13
HCO3-
CL-
Molti degli ioni idrogeno (H+), poi, si combinano con l’emoglobina
nei globuli rossi poiché l’emoglobina stessa si combina con un
potente tampone acido-base.
Molti ioni bicarbonato (HCO3-) diffondono dai globuli rossi nel
plasma, mentre ioni cloro (Cl-) vi si sostituiscono spostandosi nei
globuli rossi. Ciò è reso possibile dalla presenza, nella membrana
cellulare dell’eritrocita, di una speciale proteina di trasporto degli
ioni cloro e bicarbonato che promuove il rapido scambio tra i due
ioni che si muovono in direzioni opposte. Pertanto il contenuto di
ioni cloro negli eritrociti del sangue venoso è maggiore di quello
presente nei globuli rossi del sangue arterioso: questo fenomeno
prende il nome di scambio dei cloruri.
Il legame reversibile dell’anidride carbonica con l’acqua negli
eritrociti, in seguito all’intervento dell’anidrasi carbonica, è
responsabile di circa il 70% del trasporto dell’anidride carbonica
dai tessuti ai polmoni. E’ questo il meccanismo di trasporto della
CO2 più importante tra quelli utilizzati dall’organismo.
Se si somministra ad un animale da esperimento un inibitore
dell’anidrasi carbonica, quale per esempio l’acetazolamide, allo
scopo di bloccare negli eritrociti l’azione dell’anidrasi carbonica, il
trasporto dell’anidride carbonica dai tessuti si riduce tanto che la
PCO2 tessutale può aumentare fino a raggiungere il valore di 80
mmHg, invece dei normali 45 mmHg.
Oltre che combinarsi con l’acqua, l’anidride carbonica reagisce con
i radicali amminici delle molecole dell’emoglobina formando
carbaminoemoglobina (CO2Hgb). Si tratta di un legame reversibile
e di debole intensità che permette all’anidride carbonica di essere
facilmente rilasciata negli alveoli polmonari, dove la PCO2 è più
bassa che nei capillari tessutali. Una piccola quantità di anidride
carbonica reagisce con le proteine plasmatiche con le stesse
modalità con cui reagisce con l’emoglobina. La quantità teorica di
anidride carbonica che può essere trasportata dai tessuti ai polmoni
in combinazione con l’emoglobina e con le proteine plasmatiche è
pari a circa il 30%. Tuttavia il legame dell’anidride carbonica con
le proteine plasmatiche si verifica più lentamente della reazione tra
l’anidride carbonica e l’acqua catalizzata dall’anidrasi carbonica
negli eritrociti per cui è dubbio che questo meccanismo possa
concorrere al trasporto dell’anidride carbonica per più del 20% del
totale. L’acido carbonico che si forma quando l’anidride carbonica
entra nei capillari dei tessuti fa diminuire il pH del sangue. La
reazione di questo acido con i sistemi tampone impedisce che la
concentrazione degli idrogenioni aumenti in modo eccessivo
facendo diminuire troppo il pH del sangue.
INDICAZIONI CLINICHE
Le indicazioni cliniche della carbossiterapia interessano diverse
branche della patologia medica: la cellulite, l'invecchiamento
cutaneo, la psoriasi.
La cellulite può essere di tipo puro (adiposità localizzata) o misto
(adiposità localizzata e pannicolopatia edemato-fibro-sclerotica).
Il trattamento terapeutico della cellulite, pertanto, per essere
adeguato deve essere sia di tipo riabilitativo della
microcircolazione, sia di tipo lipolitico.
La carbossiterapia realizza:
• un’azione riabilitativa della microcircolazione;
• un’azione lipolitica.
L’azione riabilitativa della microcircolazione torna vantaggiosa nel
trattamento della cellulite perché agisce sulla componente
vascolare
alterata
che
caratterizza
la
fisiopatologia
microcircolatoria della PEFS.
Intervenendo sulla vis a tergo della microcircolazione,
correggendo, cioè, l’iposfigmia delle metarteriole e delle arteriole
si risolve quella situazione di stasi veno-linfatica che caratterizza,
appunto, la PEFS.
Se immaginiamo la cellulite come una spugna imbevuta di acqua,
l’eseguire la carbossiterapia è come realizzare una strizzata
energica della spugna stessa.
Con la carbossiterapia risolviamo le problematiche di stasi venolinfatica che determinano l’edema del tessuto adiposo che innesca
quei processi abiotrofico-regressivi-riparativi del tessuto adiposo
identificati da Curri come PEFS.
L’azione lipolitica della carbossiterapia torna vantaggiosa nel
trattamento della cellulite perché agisce sulla componente adiposa,
cioè sulla adiposità localizzata ipertrofica-iperplasica in eccesso
determinando la lipolisi dei trigliceridi intradipocitari ipertrofici in
acidi grassi e glicerolo. L’azione lipolitica della carbossiterapia è
legata principalmente a tre meccanismi:
• aumento del flusso ematico tessutale locale;
• attivazione recettoriale;
• amplificazione dell’effetto Bohr e dell’effetto Haldane.
L’aumento del flusso ematico tessutale locale favorisce la lipolisi
perché aumenta la quantità di ossigeno che è trasportato dal sangue
dagli alveoli polmonari ai tessuti e che è rilasciato dall’emoglobina
a livello dei tessuti trattati.
Con un maggiore apporto e rilascio di ossigeno vengono favoriti i
processi ossidativi degli acidi grassi. Inoltre, un aumento del flusso
ematico tessutale locale si traduce in un aumento del metabolismo
tessutale locale con, quindi, una maggiore richiesta energetica da
parte del tessuto adiposo coinvolto e, quindi, con una maggiore
stimolazione della lipolisi.
L’attivazione recettoriale stimola la liberazione di sostanze
algogene che stimolano la lipolisi distrettuale.
L’amplificazione dell’effetto Bohr e dell’effetto Haldane significa
un più facile rilascio da parte dell’emoglobina dell’ossigeno che si
rende biodisponibile per i processi ossidativi degli acidi grassi.
Le controindicazioni alla carbossiterapia sono diverse: alcune
assolute, altre relative (Fig. 14).
Insufficienza respiratoria cronica
Insufficienza renale cronica
Insufficienza cardiaca cronica
Insufficienza epatica cronica
Terapia con acetazolamide, diclofenamide
o altri inibitori dell'anidrasi carbonica
Terapia con metformina o altre biguanidi
Diabete mellito
Anemia grave
Gangrena gassosa
Gravidanza
Figura14 Controindicazioni alla carbossiterapia
Per ipercapnia si intende un eccesso di anidride carbonica nei
liquidi corporei (acidosi).
Gli organi che provvedono alla eliminazione della CO2 e degli
idrogenioni (H+) dall’organismo sono i polmoni e i reni. Una
compromissione grave di tali organi (una insufficienza respiratoria
cronica grave, una insufficienza renale cronica grave) può
determinare la comparsa di una situazione di ipercapnia.
Nella insufficienza cardiaca cronica si ha un rallentamento
importante del flusso ematico che determina una diminuzione della
quantità di anidride carbonica che può essere rimossa dai tessuti.
L’insufficienza cardiaca cronica rappresenta una condizione
fisiopatologica che può indurre una possibile situazione di
ipercapnia.
Si comprende facilmente perché è bene non eseguire la
carbossiterapia a soggetti interessati da una situazione di
insufficienza respiratoria cronica grave, di insufficienza renale
cronica grave, di insufficienza cardiaca cronica grave.
Una terapia con acetazolamide, diclofenamide o con altri inibitori
dell’anidrasi carbonica potrebbe indurre, nei trattamenti prolungati,
la comparsa di una situazione di ipercapnia (acidosi) perché
verrebbe meno, a livello eritrocitario, la coniugazione rapida
dell’anidride carbonica con l’acqua per formare acido carbonico,
coniugazione catalizzata dall’enzima anidrasi carbonica. Con una
inibizione dell’anidrasi carbonica si interferisce con uno dei
meccanismi principali attraverso cui la CO2 è trasportata nel sangue
per potere, poi, essere eliminata a livello degli alveoli polmonari e
a livello renale. Si comprende facilmente perché è bene non
associare la carbossiterapia ad una terapia con acetazolamide,
diclofenamide o con altri inibitori dell’anidrasi carbonica.
Altra controindicazione è la terapia con metformina. La
metformina, specie negli anziani e nei soggetti affetti da
insufficienza renale cronica, può causare un’acidosi lattica
sistemica. Somministrare CO2 in tali casi potrebbe aggravare una
eventuale situazione di acidosi sistemica; quindi, è bene evitare di
somministrare CO2 a pazienti diabetici che assumono metformina o
altre biguanidi.
Il diabete mellito è una controindicazione per le possibili situazioni
di chetoacidosi che si possono verificare nel corso di tale patologia.
Somministrare CO2 a pazienti diabetici di cui non si conosce lo
stato metabolico potrebbe aggravare una eventuale situazione di
acidosi sistemica e fare abbassare ulteriormente il pH del sangue; è
bene evitare di somministrare CO2 a pazienti diabetici di cui non si
conosce l’equilibrio metabolico.
Altra controindicazione è l’anemia grave. Nel caso di un’anemia
grave si avrebbero due situazioni deficitarie nel meccanismo di
eliminazione della CO2: quella relativa alla coniugazione della CO2
con l’acqua a formare acido carbonico operata dall’anidrasi
carbonica eritrocitaria e quella relativa all’emoglobina. Una
situazione di anemia grave significa un deficit eritrocitario grave e,
di conseguenza, un deficit importante del meccanismo principale
attraverso cui la CO2 è trasportata nel sangue per potere, poi, essere
eliminata a livello degli alveoli polmonari e a livello renale. Una
situazione di anemia grave significa, inoltre, un deficit importante
in emoglobina. Un deficit grave in emoglobina comporta quote
ridotte di proteincarbaminati per cui viene meno anche l’altro
meccanismo eritrocitario che permette il legame e, quindi, il
trasporto della CO2 nel sangue e la sua conseguente eliminazione
polmonare e renale. Se alla difficoltà di eliminare la CO2 tessutale
intrinseca in una situazione di anemia grave sommiamo un
intervento terapeutico mediante carbossiterapia diventa facile
prevedere che si possa verificare una situazione di ipercapnia
(acidosi).
L’insufficienza
epatica
cronica
rappresenta
un’altra
controindicazione. Nella insufficienza epatica cronica grave si
verifica una deficitaria produzione delle proteine plasmatiche con
possibili deficit dei proteincarbaminati. Altra controindicazione è
la gangrena gassosa. La gangrena gassosa è una malattia causata da
germi anaerobi del suolo introdottisi nell’organismo attraverso
ferite. Si tratta di un processo infettivo acuto caratterizzato da
necrosi dei tessuti, edema, enfisema, grave compromissione delle
condizioni generali. Trattandosi di una situazione infettiva acuta
sostenuta da germi anaerobi (Welchia perfringens, Clostridium
septicum, Clostridium novyi, Clostridium sporogenes, Clostridium
hystoliticum) si comprende facilmente quanto la somministrazione
di CO2 potrebbe favorire una situazione patologica di tale tipo.
Se una situazione di ipercapnia lieve iniziasse a instaurarsi in
seguito ad un intervento terapeutico di carbossiterapia la stessa
sarebbe immediatamente risolta dall’organismo con un aumento
della ventilazione polmonare. L’ipercapnia grave è una situazione
clinica che non può essere indotta da una somministrazione, anche
eccessiva, di CO2.
In condizioni di normalità, eseguendo la carbossiterapia, non esiste
alcuna possibilità che possa verificarsi una situazione di ipercapnia
grave.
Una situazione di ipercapnia grave si può instaurare solo per valori
elevati di PCO2 a livello degli alveoli polmonari. Quando la PCO2
raggiunge, a livello degli alveoli polmonari, valori di 60-75 mm Hg
il soggetto ventila con la massima frequenza e profondità di cui è
capace e la fame d’aria o dispnea diventa molto intensa. Quando la
CO2 raggiunge, a livello degli alveoli polmonari, valori di 80-100
mm Hg il soggetto va incontro ad uno stato letargico o
semicomatoso (coma ipercapnico).
Quando la CO2 raggiunge, a livello degli alveoli polmonari, valori
di 120-150 mm Hg, l’eccesso di anidride carbonica deprime il
centro del respiro (piccole quantità di CO2 stimolano il centro del
respiro) determinando la morte.
Già negli anni venti fu dimostrato che la somministrazione
sottocutanea di CO2 era priva di tossicità. In medicina, in
particolare nella chirurgia ginecologica per via laparoscopica, la
CO2, è utilizzata per distendere il cavo endoaddominale. In tali casi
si introducono nel cavo endoaddominale 2-4 litri di anidride
carbonica senza alcun problema di tossicità.
In condizioni di riposo (6 litri ventilazione polmonare/minuto) circa
250 ml di ossigeno vengono trasportati dai polmoni ai tessuti e 200
ml di anidride carbonica vengono rimossi dai tessuti e trasportati ai
polmoni. In situazioni di iperventilazione la quantità massima di O2
consumato è pari a 4000-5000 ml/minuto e la quantità massima di
CO2 prodotta è pari a 4000-4500 ml/minuto. Il nostro organismo in
condizioni di riposo elimina 200 ml/minuto di CO2 mentre in
condizioni di iperventilazione elimina 4500 ml/minuto di CO2.
Quando si esegue una seduta di carbossiterapia si somministrano,
per via sottocutanea, in media, 30-50 ml/minuto.
È facilmente comprensibile come una lieve iperventilazione
durante il trattamento di carbossiterapia possa eliminare del tutto il
rischio di una qualsiasi situazione di lieve ipercapnia (acidosi).
Le tecniche di somministrazione della CO2 sono principalmente
due: percutanea, iniettiva.
La somministrazione percutanea
I bagni
I bagni possono essere di due tipi: di gas secco, di acqua carbonica.
I bagni di gas secco possono essere generali o parziali. I bagni di
gas secco generali prevedono che il paziente stia seduto o disteso
su un lettino e che venga inserito in un sacco di plastica stretto al
torace o alla vita con una chiusura ermetica. In tale sacco viene
immessa CO2. Insomma gli arti inferiori e la parte inferiore del
corpo si trovano immersi in una atmosfera satura in CO2. Un
bagno di gas secco generale ha la durata, in media, di 20-30 minuti.
Si eseguono trattamenti quotidiani per 20-30 giorni. I bagni di gas
secco parziali prevedono che sia solo l’estremo di un arto o un arto
intero ad essere inseriti in una sacca di plastica che viene, poi,
chiusa in modo ermetico a livello della regione prossimale dell’arto
o del segmento dell’arto interessato da problemi arteriosi organici o
funzionali. Quindi, si immette la CO2 nel sacco. Una metodica
ambulatoriale di bagni di gas secco è quella della
idrocarbossiterapia. I bagni di acqua carbonica si eseguono facendo
immergere il paziente in vasche contenenti acqua alla temperatura
di 34° in cui viene fatta gorgogliare CO2. I bagni di acqua
carbonica hanno la durata, in media, di 20-30 minuti. Si eseguono
cicli curativi di 20-30 giorni.
Le docce di gas secco
Le docce di gas secco possono essere di due tipi:
• docce di gas secco puntiforme: si utilizza un tubicino con un
foro piccolissimo attraverso il quale passa la CO2. Tale metodica si
adotta per le piccole ulcere isolate.
• docce di gas secco loco-regionale: si utilizza una sorta di rampa
multiforata in cui si mette l'arto da trattare che viene, poi, coperto
con un telo e da un sacco di plastica.
Le docce di gas secco si utilizzano per il trattamento delle ulcere
distrofiche degli arti inferiori. La durata di tale trattamento è, in
media, di 20-30 minuti. Si eseguono cicli curativi di 20-30 giorni.
La somministrazione iniettiva
Mentre i bagni di gas secco, i bagni in acqua carbonica, le docce di
gas secco, le docce di acqua carbonica sono metodiche curative
termali, quella iniettiva è una metodica curativa che può essere
eseguita in un ambulatorio medico.
Inizialmente, per le somministrazioni sottocutanee, veniva
utilizzato uno strumentario spartano: una bombola di CO2 e una
siringa. Oggi si possono utilizzare apparecchiature sofisticate, degli
erogatori con una tecnologia assolutamente avanzata (Fig. 15).
Tali apparecchiature sofisticate permettono non solo di poter dosare
l’anidride carbonica, ma anche di poter assicurare al gas un certo
grado di purezza: una serie di filtri purificano la CO2 da possibili
contaminanti come, ad esempio, dalle spore di Clostridium
sporogenes. Il gas dosato da un apparecchio centrale e purificato da
una serie di filtri, arriva in un deflussore che termina con un ago 30
G da 13 mm.
Una volta iniziata l’erogazione dell’anidride carbonica si lascia che
il gas fuoriesca per pochi secondi dall’ago in modo da avere la
certezza che il condotto del deflussore sia saturo in CO2 e, poi, si
infigge l’ago stesso nel sottocutaneo provocando un graduale
enfisema sottocutaneo. Una volta che la CO2 inizia a diffondere nel
sottocutaneo si fissa l’ago sulla pelle con un cerotto e si lascia che
la diffusione sottocutanea, attraverso percorsi virtuali, si realizzi
fino alle quantità stabilite.
La facilità di diffusione dell’anidride carbonica nel sottocutaneo
dipende dal grado di lassità del tessuto sottocutaneo stesso per cui è
variabile da soggetto a soggetto.
Figura 15 C.D.T. Evolution (Carbossiterapia Italiana)
DOSAGGIO
Si somministrano 600 ml per emilato di CO2 per seduta. Si eroga la
CO2 adottando un flusso medio pari a 30 ml/minuto. Nei primi 1-2
minuti, quando il gas cerca di farsi strada attraverso percorsi
sottocutanei virtuali, si avverte un certo fastidio o dolore vero e
proprio che risulta, comunque, ben tollerato nel 98% dei casi.
Superata la prima fase, la somministrazione avviene senza grossi
disagi per il paziente.
SEDI DELLE INIEZIONI
Nella cellulite le iniezioni vengono eseguite a livello
sottotrocanterico o a livello peritrocanterico o a livello dei fianchi
(Fig. 16).
Figura 16
Solitamente si esegue una sola infissione per emilato. Si fissa l’ago
nel sottocutaneo con un cerotto e si lascia che il gas diffonda fino a
600 ml per emilato con un flusso medio di 30 ml/ minuto. In tal
modo il gas si distribuisce in tutto l’arto inferiore e fino ai fianchi e
al torace.
Nei casi di insufficienza venosa cronica si può adottare la stessa
strategia terapeutica utilizzata per il trattamento della cellulite:
stessa tecnica di somministrazione e stesso dosaggio del gas.
BIBLIOGRAFIA
ALBERGATI F., PARASSONI L., LATTARULO P., VARLARO V.,
CURRI S.B.: Carbossiterapia e vasomotion: comparazione tra immagini
videocapillaroscopiche e referti laser doppler flow dopo
somministrazione di anidride carbonica. Riv. "La Medicina Estetica",
anno 21, n.1, gennaio-marzo 1997. Editrice Salus Internazionale, Roma.
GUYTON & HALL: Fisiologia Medica, 2003, EdiSES, Napoli.
MANZO G., VILLEGGIA P., VARLARO V.: La carbossiterapia utilizzata
in situazioni cliniche di linfostasi a carico degli arti inferiori: valutazione
degli effetti mendiante linfoscintigrafia – Abstract Book- XXVII
Congresso Nazionale della Società Italiana di Medicina Estetica – Riv. "La
Medicina Estetica", anno 30, n.1, gennaio-marzo 2006. Editrice Salus
Internazionale, Roma.
PARASSONI L., ALBERGATI F., VARLARO V., CURRI S.B.: la
carbossiterapia in tema di meccanismi d’azione. Riv. "La Medicina
Estetica", anni 21, n.1, gennaio-marzo 1997. Editrice Salus Internazionale,
Roma.
PARASSONI L., VARLARO V.: la carbossiterapia: una metodica in
evoluzione. Riv. "La Medicina Estetica", anno 21, n.1, gennaio-marzo
1997. Editrice Salus Internazionale, Roma.
PARASSONI L., LATTARULO P., ALBERGATI F., VARLARO V.,
GUIDI F.: Carbossiterapia. Da Bartoletti C.A: Medicina Estetica, 1998.
Editrice Salus Internazionale, Roma.
VARLARO V., BARTOLETTI C. A.: La carbossiterapia. Rivista "La
medicina Estetica", anno 9, numero 3, luglio-settembre 2005, Editrice
Salus Internazionale, Roma.
VARLARO V., BARTOLETTI C.A.:La carbossiterapia. Riv. "La Medicina
Estetica", anno 29, n.3, luglio-settembre 2005. Editrice Salus
Internazionale, Roma. Pagg. 417-438.
VARLARO V., MANZO G., MUGNAINI F., BISACCI C, FIORUCCI P.,
DE RANGO P., BISACCI R.: Carboxytherapy: effects on microcirculation
and its use in the treatment of severe lymphedema. A review. Riv.: "Acta
Phlebologica", Vol. 8, n. 2 - August 2007, Edizioni Minerva Medica,
Torino.
VARLARO V., PARASSONI L., BARTOLETTI C.A.: La carbossiterapia
nella PEFS e nell’adiposità localizzata. Riv. "La Medicina Estetica", anno
19, n.1, gennaio-marzo 1995. Editrice Salus Internazionale, Roma.