Regolazione
Neuroendocrina
del Comportamento
Alimentare
La capacità
capacità degli organismi di mantenere
stabile il peso corporeo, anche per lunghi
periodi, nonostante le variazioni quotidiane
dell’
dell’introito calorico e della spesa energetica,
rivela l’
l’esistenza di un controllo fisiologico del
bilancio energetico.
1
La regolazione del peso corporeo è in realtà
realtà
determinata da un equilibrio dinamico
caratterizzato dal tentativo di bilanciare
l’introito calorico ed il dispendio energetico
tramite una complessa regolazione del
comportamento alimentare sia nel breve che nel
lungo termine.
2
Interrelazione
ridondanti.
di
diversi
segnali,
spesso
Provenienti sia dal cervello sia dagli organi
periferici.
Doppio circuito retroattivo che mantiene sotto
controllo il bilancio energetico attraverso la sua
influenza sul comportamento alimentare.
Introito di
cibo
Controllo a
Breve Termine
Controllo a
Lungo Termine
Fegato
Stomaco
Intestino
Pancreas
Tessuto Adiposo
3
Due sistemi distinti che controllano quasi
indipendentemente la fame e la sazietà
sazietà.
I segnali fisiologici che innescano l’
l’assunzione
di cibo, ovvero l’
l’appetito, la ricerca e la scelta,
sono infatti qualitativamente differenti rispetto a
quelli che la fanno cessare.
Sin dalla metà
metà del secolo scorso è noto che le
aree implicate nel controllo di questi due
sistemi risiedono nell’
nell’ipotalamo.
Sistema di controllo = Ipotalamo
Feedback = Asse Ipotalamo-Enterico
Vago e [Nutrienti]
Sistemi Integrativi = Aree Emotive e Associative
4
IPOTALAMO
Il centro di controllo
Struttura del sistema nervoso centrale situata
nella zona centrale interna ai due emisferi
cerebrali ai lati del III ventricolo.
5
Costituisce la parte ventrale del diencefalo e
comprende numerosi nuclei che controllano e
integrano
le funzioni vegetative
l'attività
l'attività endocrina
la termoregolazione
il sonno
il bilancio idroidro-salino
l'assunzione del cibo
Inoltre, l’
l’ipotalamo, è anche coinvolto nel
controllo di emozioni, stati d’
d’animo e umore.
posteriormente dai corpi mammillari,
anteriormente dal chiasma ottico,
superiormente dal solco ipotalamico e dal talamo
inferiormente dall'ipofisi
Eminenza mediana
Infundibolo
6
A
B
Regione Anterore:
Anterore: Area Preottica (PA), Nucleo Anteriore (AN), Nucleo
Soprachiasmatico (SCN), Nucleo Sopraottico (SON), Nucleo
Paraventricolare (PVN). Regione mediale del Tuber Cinereum (gruppo
medio): Nucleo Periventricolare (PeVN),
PeVN), Nucleo Dorsomediale (DMN),
Nucleo Ventromediale (VMN) e Nucleo Arcuato (ARC), Nucleo
Perifornicale (PFA), Area Laterale (LHA). Regione Posteriore: Nucleo
posteriore (PN) e Corpo Mammillare.
L’ipotalamo è attraversato da una fitta rete di
vasi sanguigni ed è collegato da fasci di fibre
nervose ad altre aree cerebrali:
corteccia cerebrale
talamo
corpo striato
mesencefalo
bulbo
7
L'ipotalamo svolge una duplice funzione:
il controllo del sistema nervoso autonomo
il controllo del sistema endocrino
I segnali fisiologici che innescano l’assunzione di
cibo
(appetito,
ricerca,
scelta),
sono
qualitativamente differenti rispetto a quelli che la
fanno cessare.
In particolare nel secolo scorso fu sviluppato un
modello a due centri:
Ipotalamo Laterale = Fame
Ipotalamo Ventromediale = Sazietà.
8
PVH
N. Paraventricolari
LHA
Area Laterale
DMH Area DorsoMediale
VMH Area VentroMediale
ARC
N. Arcuato
3V III Ventricolo
PVN N. Paraventricolari LH Area Laterale
DMH Area DorsoMediale ARC N. Arcuato
VMH Area VentroMediale OC Chiasma Ottico
9
Hetherington e Ramson 1940
Lesione dell’Ipotalamo Ventromediale
induce:
Iperfagia
Obesità
A
Iperfagia in ratti con lesioni VMH
45
Cibo ingerito in gr
40
35
30
25
VMH-X
20
Sham
15
10
5
0
1
5
9
13
17
21
25
29
33
37
Giorni
B
Aumento di Peso in ratti con lesioni VMH
Peso Corporeo in gr
450
400
350
VMH-X
300
Sham
250
200
150
1
5
9
13
17
21
25
29
33
37
Giorni
10
Anand e Brobeck 1951
Lesione dell’Ipotalamo Laterale
determina:
inibizione nell’assunzione di cibo
anomalie comportamentali:
motilità incongrua rispetto alla ricerca del cibo
ridotta attenzione verso stimoli esterni.
Tale afagia era seguita da progressivo
deperimento che poi conduceva alla morte. Gli
autori conclusero che nell’
nell’area ipotalamica
laterale risiede un “centro della fame”
fame”.
11
Stimolazione dell’Ipotalamo Ventromediale
induce:
Soppressione del comportamento alimentare
Stimolazione dell’Ipotalamo Laterale
induce:
Comportamento di ricerca del cibo
Iperfagia
12
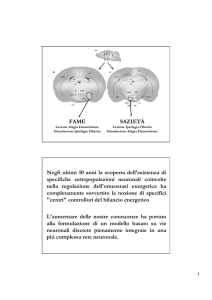
FAME
SAZIETÀ
SAZIETÀ
Lesione Afagia Denutrizione
Stimolazione Iperfagia Obesita
Lesione Iperfagia Obesita
Stimolazione Afagia Denutrizione
Miller e col 1950, Teitelbaum 1957
I ratti con lesioni al VMH, pur essendo
iperfagici,
iperfagici, lo sono solo in presenza di cibo
gustoso ed inoltre sono meno motivati ad
ottenerlo.
13
Weigarten e col 1983
Il comportamento “schizzinoso”
schizzinoso” dei ratti VMHVMHX è conseguenza dello stato di obesità
obesità dei ratti,
e non è provocato direttamente dalle lesioni.
Nonostante il modello a due centri discreti,
anatomicamente separati, sia ormai stato
smentito, le interconnessioni della rete
neuronale che controllano gli stimoli della fame
e della sazietà
sazietà danno vita a due sistemi di
controllo, o centri funzionali, interagenti tra di
loro ma funzionalmente distinti, che possono
essere tuttora definiti come centro della fame e
della sazietà
sazietà.
14
L’azione dei neuroni ipotalamici è indirizzata
più
più al controllo del bilancio energetico, che non
del comportamento alimentare direttamente, il
quale, come già
già descritto è la risultante di un
integrazione a più
più livelli di controllo.
Nucleo Arcuato dell’
dell’ipotalamo due popolazioni
di neuroni:
NPY/AgRP
NPY/AgRP
POMC/CART
Fame
Sazietà
Sazietà
entrambe proiettano ad altre aree ipotalamiche
coinvolte nel controllo del bilancio energetico.
15
Le
nuove
evidenze
sperimentali,
pur
mantenendo una chiara distinzione nel controllo
dei due stimoli, mostrano, quindi, una struttura
molto simile ad una rete neuronale complessa
che controlla fame e sazietà
sazietà.
PVN
Neuroni
Anoressigeni
LHA
DMN
PFA
Neuroni
Oressigeni
Interconnessioni tra i neuroni
NPY/AgRP
NPY/AgRP e POMC/CART del
nucleo arcuato con gli altri nuclei
della
regione
mediana
dell’
dell’ipotalamo.
Nucleo Paraventricolare (PVN)
Nucleo Dorsomediale (DMN)
VMN
Nucleo Ventromediale (VMN)
Nucleo Arcuato (ARC)
III
POMC
CART
NPY
AgRP
ARC
Nucleo Perifornicale (PFA)
Area Laterale (LHA).
16
Bilancio
Energetico
Comportamento
Alimentare
Sazietà
Sazietà
Fame
Nuclei
Paraventricolari
Ipotalamo
Laterale
MESENCEFA
LO
Ipotalamo
Mediale
NTS
Nucleo Arcuato
IPOTALAMO
POMC
CART
NPY
ArRP
Eminenza Mediana
Stimoli Periferici
Oressigeni
Stimoli Periferici
Anoressigeni
Area
Postrema
Nervo
Vago
I neuroni oressigeni dell’
dell’ipotalamo laterale sono
formati da due popolazioni di neuroni, che
producono due differenti neurosecreti:
Oressina A (OXA)
Ormone Concentrante la melanina (MCH)
17
Entrambi questi neuroni sono presenti in modo
uniforme all’
all’interno di LHA e inviano
terminazioni a diverse aree centrali coinvolte
negli stati motivazionali e nel movimento
Neocorteccia
Talamo
LHA
N. Accumbens
ATV
Substanzia Nigra
Midollo Spinale
Formazione Reticolare
Sostanza Grigia P.
Locus Coeruleus
18
In tutte queste strutture sono stati individuati i
recettori per OXA e MCH.
L’azione dei neuroni oressigeni OXA e MCH su
queste aree determina l’
l’attivazione del
comportamento di ricerca e ingestione del cibo.
I neuroni OXA e MCH ricevono terminazioni
dai neuroni del nucleo arcuato: eccitatorie da
NPY/AgRP
NPY/AgRP e inibitorie da POMC/CART.
Questi neuroni presentano inoltre una ricca
espressione di recettori CB1 per gli
endocannabinoidi,
endocannabinoidi, che come vedremo rivestirà
rivestirà
un ruolo importante nella mediazione della
modulazione degli effetti edonistici del cibo sul
bilancio energetico.
19
PVN
CRH Neuroni
Anoressigeni
LHA
OXA
Interconnessioni tra i neuroni
NPY/AgRP
NPY/AgRP e POMC/CART del
nucleo arcuato con gli altri nuclei
della
regione
mediana
dell’
’
ipotalamo.
dell
DMN
Nucleo Paraventricolare (PVN)
PFA
MCH
VMN
III
Nucleo Ventromediale (VMN)
SF1SF1-P
POMC
CART
NPY
AgRP
ARC
Nucleo Dorsomediale (DMN)
Nucleo Arcuato (ARC)
Nucleo Perifornicale (PFA)
Area Laterale (LHA).
Lo stimolo della sazietà
sazietà è invece regolato dai
neuroni POMC/CART dei nuclei arcuati che
inibiscono gli OXA e gli MCH dell’
dell’ipotalamo
laterale e stimolano i neuroni anoressigeni dei
PVN.
I neuroni POM/CART sono direttamente inibiti
dai NPY/AgRP
NPY/AgRP e da ghrelina,
ghrelina, mentre sono
stimolati dagli stimoli anoressigeni periferici, in
particolare da leptina,
leptina, insulina e stimolazioni
vagali.
20
Inoltre nei nuclei VentroVentro-Mediali sono stati
scoperti
neuroni,
denominati
SF1SF1-P
(Steroidogenic Factor 1 Positive Neurons),
Neurons), che
proiettano verso il nucleo arcuato ed eccitando i
neuroni
POMC/CART
agiscono
come
rafforzatori dello stimolo di sazietà
sazietà.
Tali neuroni vengono attivati direttamente da
leptina e insulina e sono fondamentali per un
corretto controllo del peso corporeo.
Il nucleo paraventricolare rappresenta un sito
cruciale per il rilascio di segnali anoressigeni.
Al suo interno sono presenti neuroni che
secernono una grande varietà
varietà di neuropeptidi,
neuropeptidi,
tra cui quelli che regolano l’
l’attività
attività dell’
dell’ipofisi
anteriore
Ormone rilasciante la corticotropina (CRH)
Ormone rilasciante la tireotropina (TRH)
con spiccata attività
attività anoressizzante.
21
I neuroni anoressigeni dei PVN quindi
proiettano alla sostanza grigia periacqueduttale
e alle aree del midollo spinale che controllano il
metabolismo.
Tuttavia il principale effetto di induzione della
sazietà
sazietà in realtà
realtà è mediato dall’
dall’inibizione da
parte dei neuroni POMC/CART sui neuroni
OXA e MCH.
PVN
CRH Neuroni
Anoressigeni
LHA
OXA
Interconnessioni tra i neuroni
NPY/AgRP
NPY/AgRP e POMC/CART del
nucleo arcuato con gli altri nuclei
della
regione
mediana
dell’
dell’ipotalamo.
DMN
Nucleo Paraventricolare (PVN)
PFA
MCH
VMN
III
Nucleo Ventromediale (VMN)
SF1SF1-P
POMC
CART
NPY
AgRP
ARC
Nucleo Dorsomediale (DMN)
Nucleo Arcuato (ARC)
Nucleo Perifornicale (PFA)
Area Laterale (LHA).
22
Neuropeptide Y NPY
La sintesi e le secrezione di NPY
dall'ipotalamo aumenta in risposta al digiuno,
all'esercizio fisico, al deficit di insulina o di
leptina.
leptina.
Il sistema neuronale NPYergico avverte e
risponde ad un'ampia serie di segnali
metabolici e ormonali che vengono modificati
dal decremento delle riserve energetiche.
Neuropeptide Y NPY
Nei ratti
Somministrazione i.c.v. acuta
Aumento dell’
dell’introito alimentare
Somministrazione i.c.v. cronica
Iperfagia
Incremento ponderale
Riduzione del dispendio energetico.
23
Neuropeptide Y NPY
La somministrazione i.c.v. di NPY induce un
aumento di:
Insulinemia
Liposintesi nel fegato e del tessuto adiposo
Aumento della sensibilità
sensibilità all'insulina
Attività
Attività della lipoprotein lipasi.
Neuropeptide Y NPY
La massima concentrazione di NPY nei
nei PVN è
stata osservata prima e durante i pasti,
confermando un suo ruolo nell’
ell’induzione
dell’
dell’assunzione alimentare.
alimentare.
Il digiuno si è dimostrato il principale
stimolatore dell’
dell’espressione di NPY negli
animali.
24
Neuropeptide Y NPY
I topi knockout per NPY risultano avere un
peso corporeo normale e mostrano variazioni
ponderali simili a quelle degli animali di
controllo sia in condizioni di iperiper-alimentazione
sia in condizioni di digiuno.
digiuno.
Neuropeptide Y NPY
Attivazione di vie oressigene alternative, al fine
di preservare l’
l’integrità
integrità allo stimolo della fame
Evolutivamente
sopravvivenza.
fondamentale
per
la
La sua produzione viene inibita da leptina e
insulina e sembra che il NPY provochi una
fame con spiccata predilezione per i
carboidrati.
25
Agouti Related Protein (AgRP)
I neuroni che secernono NPY coco-esprimono
anche la Agouti Related Protein (AgRP)
dotata di considerevoli azioni oressigene
oressigene
NPYNPY-indipendenti.
AgRP determina un aumento dell’
dell’introito
alimentare agendo come antagonista
endogeno dei recettori per melanocortina
MC3
MC3 e MC4, inibendo così
così l’azione
anoressizzante
anoressizzante di alphaalpha-MSH (ormone
stimolante i melanociti).
Agouti Related Protein (AgRP)
La somministrazione i.c.v. acuta di AgRP
nei roditori determina un incremento
dell’
dell’introito calorico per sei giorni
Il trattamento cronico determina
importante aumento di peso
un
Rispetto al NPY, l'effetto del AgRP è
minore, ma più
più prolungato
26
I neuroni NPY/AgRP rappresentano il
bersaglio più
più importante dei segnali
oressanti e anoressanti centrali e periferici.
In particolare, essi sono inibiti da leptina,
leptina,
peptide YY (PYY) e insulina e attivati dal
peptide oressante ghrelina
ghrelina.
Pro-opiomelanocortina (POMC)
Il gene della POMC è espresso in diversi
tessuti quali ipotalamo, ipofisi, sistema
immunitario e pelle.
Nell’
Nell’ipotalamo la POMC è espressa in
particolare nell
nell’ARC
27
Pro-opiomelanocortina (POMC)
Precursore di molecole biologicamente
attive:
, , e MSH (Melanocortina)
Melanocortina)
ACTH (Adrenocorticotropina)
Adrenocorticotropina)
endorfine
endorfine
Lipotrofine
ipotrofine
Schema che rappresenta le varie molecole
attive come neurotrasmettitori e/o neuro
ormoni derivate dalla Proopiomelanocortina.
Proopiomelanocortina.
POMC
-Lipoprotein
Pro-ACTH
Big -MSH
-MSH
ACTH
-Lipoprotein -Endorfina
-MSH CLIP -MSH
28
Pro-opiomelanocortina (POMC)
MSH è un potente inibitore dell’
dell’introito
calorico che agisce attraverso i recettori MC3
e MC4.
Negli animali, la somministrazione centrale
di MSH inibisce l’
l’assunzione di cibo e
riduce il peso corporeo.
Pro-opiomelanocortina (POMC)
I topi knockout per la POMC mostrano un
fenotipo obeso e iperfagico e presentano
un’
un’ipoplasia surrenalica e un’
un’alterazione
della pigmentazione cutanea.
Somministrazione cronica giornaliera di
alphaalpha-MSH inverte questi effetti e determina
un rapido calo ponderale.
29
Pro-opiomelanocortina (POMC)
Nell’
ell’uomo, la somministrazione cronica
intranasale di un frammento sintetico di
MSH (MSH/ACTH 44-10) determina una
lieve ma persistente riduzione del grasso
corporeo.
Cocaine and amphetamine-regulated
transcript (CART)
Somministrazione endogena di cannabinoidi e
oppioidi aumentano l’
l’appetito e l’
l’introito
calorico attraverso l’
l’attivazione del recettore
CB1.
CB1.
CB1 è coespress
o con CART e MSH nelle aree
coespresso
ipotalamiche centrali coinvolte nel controllo
del comportamento alimentare.
30
Cocaine and amphetamine-regulated
transcript (CART)
CART è coespresso in neuroni della POMC
nel ARC ed è direttamente modulato da
leptina.
leptina.
E’ anche espresso nel
PVN
LH
DMH
NTS
Cocaine and amphetamine-regulated
transcript (CART)
L’iniezione i.c.v. di CART è seguita da una
riduzione dell’
dell’introito alimentare perfino
quando coco-somministrato con NPY insieme a:
a:
diminuzione della
della [insulina]
insulina] plasmatica
plasmatica
diminuzione della
della [leptina]
leptina] plasmatica
plasmatica
incremento dell’
dell’ossidazione lipidica
31
Orexine
Orexina A (OXA) e B (OXB) sono due peptidi
espressi principalmente nel LH e dati recenti
mostrano la presenza di immunoreattività
immunoreattività per
OXA anche a livello viscerale.
Nell’
Nell’uomo, i livelli
aumentano durante
plasmatici
di
OXA
Digiuno
Ipoglicemia
Orexine
In condizioni di digiuno, la OXA:
OXA:
inibisce la motilità
motilità gastrointestinale
inibisce la risposta vagale alla colecistochinina
è coinvolta nella modulazione della secrezione
di insulina e glucagone.
I livelli plasmatici di OXA sono risultati essere
ridotti nell’
nell’obesità
obesità
32
Orexine
I topi knockout per le orexine sono narcolettici,
indicando che questi peptidi sembrerebbero
partecipare non solo al controllo dell’
dell’omeostasi
tra appetito e peso, ma anche al controllo del
sonno.
OXA sembra essere coinvolta anche nello
stimolare l’
l’attività
attività motoria spontanea e la
motilità
motilità.
La sua azione sull’
sull’assunzione del cibo
sembrerebbe essere dovuta alla stimolazione dei
neuroni MCH.
33
Alcuni recenti studi su modelli animali
suggeriscono anche un ruolo dell’
dell’ orexina
nell’
nell’assunzione delle sostanze d’
d’abuso.
Uno studio che riporta le variazioni cerebrali
riscontrate a livello dell’
dell’ipotalamo dopo
somministrazione di sostanze stupefacenti ha
dimostrato che ciascuna sostanza influisce in
modo specifico sul sistema dell’
dell’orexina
portando a diverse risposte fisiologiche e
comportamentali.
autoauto-somministrazione della sostanza
elaborazione degli stimoli associati
sistema di gratificazione
stress collegato all’
all’astinenza
possibile coinvolgimento di questo peptide nella
mediazione degli effetti incentivanti del cibo.
34
Ormone Concentrante la Melanina
(MCH)
Nei mammiferi l’
l’espressione di MCH è ristretta
ai neuroni dell’
dell’area ipotalamica laterale e della
zona incerta (ZI), ma le fibre dei neuroni che
producono MCH proiettano ad ampie regioni
del sistema nervoso centrale
Ruolo di neruromodulatore in un’
un’ampia varietà
varietà
di attività
attività fisiologiche, prima fra tutte la
regolazione del comportamento alimentare.
Al pari di OXA iniezioni di MCH nell’
nell’LHA e in
altre
regioni
cerebrali
stimolano
il
comportamento alimentare.
35
L’espressione di MCH è incrementata da:
Difetti nella produzione o nel meccanismo
d’azione della leptina in modelli animali di
obesità
obesità genetica
Digiuno
Trattamento con inibitori del metabolismo dei
carboidrati e dell’
dell’ossidazione degli acidi grassi.
I topi knockout per MCH consumano quantità
quantità
minori di cibo, rispetto ai topi normali, e sono
costantemente sottopeso.
I
topi
con
mutazione
che
induce
un’
un’iperproduzione di MCH sono iperfagici ed
ingrassano.
36
Corticotropin Releasig Hormon
(CRH)
ormone rilasciante la corticotropina
originariamente individuato come fattore di
rilascio (CRF), ed in seguito sono state
determinate le sue funzioni sia come ormone
polipeptidico
ipotalamico
che
come
neurotrasmettitore.
Corticotropin Releasig Hormon
(CRH)
Coinvolto sia nella risposta allo stress che nella
regolazione del comportamento alimentare,
mediando le risposte anoressigene e quindi
inducendo sazietà
sazietà.
37
IL CRH è prodotto dalle cellule neuroendocrine
del nucleo paraventricolare dell’
dell’ipotalamo.
Come fattore di rilascio ormonale è liberato
dalle terminazioni di tali neuroni nell’
nell’eminenza
mediana dell’
dell’adenoipofisi,
adenoipofisi, e attraverso il flusso
ematico (circolo portale dell’
dell’adenoipofisi)
adenoipofisi) arriva
alle cellule corticotrope dell’
dell’adenoipofisi.
adenoipofisi.
Induce rilascio di corticotropina (ACTH) e altre
sostanze biologiche (β
(β-endorfina).
Come neurotrasmettitore il CRH ha il compito
di inviare segnali anoressanti, inibendo il
comportamento alimentare e promuovendo il
senso di sazietà
sazietà.
I recettori per il CRH sono stati trovati in
numerosi siti cerebrali coinvolti nella
regolazione del comportamento alimentare
Neuroni del PVN
Nucleo centrale dell’
dell’amigdala
Striato
Locus ceruleus.
ceruleus.
38
La Galanina (GAL) è un neuropeptide di 29
aminoacidi ampiamente distribuito nel SNC.
Nei Mammiferi GAL e i suoi omologhi GALP
(Galanin Like Peptides)
Peptides) tra cui l’
l’Alarina sono
coinvolti nel controllo
della motilità
motilità gastrointestinale
del rilascio di insulina pancreatica
della stimolazione dell’
dell’appetito
Iniezioni di Alarina e altri GALP
iperfagia consistente in ratti alimentati ad
libidum,
libidum,
Topi knockout per GALP
Dieta normale no differenza di peso
Pasti Veloci Ridotto introito alimentare
Diete Iperlipidiche minor aumento di peso
39
La produzione di GALP è influenzata da
Leptina
ed è mediata da
NPY
OXA
Dopamina (DOPA)
GALP non è necessario per la regolazione dello
stimolo della fame in condizioni normali,
Interviene in risposta a situazioni metaboliche
ed ambientali particolari, come nel caso della
necessità
necessità di alimentarsi velocemente
Provoca una fame di grassi.
40
L’effetto oressizzante di GAL sembrerebbe
mediato da altre molecole coinvolte nei circuiti
neuronali responsabili dell’
dell’edonismo
da alcuni oppioidi endogeni, in particolare gli
antagonisti dei recettori k
dagli endocannabinoidi
Gli Endocannabinoidi (EC)
in particolare l’
l’anandamide,
anandamide,
aumentano l’
l’appetito e l’
l’introito calorico
attivazione di recettori specifici CB1
espressi nelle aree ipotalamiche coinvolte nel
controllo del comportamento alimentare.
41
Di Marzo e col 2001
Somministrazione centrale di leptina
riduzione dei livelli degli endocannabinoidi a
livello ipotalamico
Di Marzo e col 2001
Blocco del recettore CB1
inibisce nei roditori l’
l’iperfagia indotta dal
digiuno prolungato.
42
Cota e col 2003
nei topi
Delezione di CB1
Ipofagia
Riduzione del peso corporeo
Riduzione della massa grassa
Modelli knockout per NPY e per AgRP
non sono caratterizzati da un fenotipo magro
La dimostrazione sperimentale di una massa
corporea ridotta in topi knockout per il recettore
CB1 suggerisce fortemente che gli EC giochino
un ruolo cruciale nella regolazione dell’
dell’introito
alimentare e del bilancio energetico.
43
Digiuno
Concentrazione degli EC aumenta
Livello critico in grado di promuovere il
comportamento alimentare
Diminuisce in conseguenza del pasto
Tali variazioni delle concentrazioni degli EC in
rapporto alle condizioni di nutrizione si
riscontrano esclusivamente
Mesolimbico
Edonistica
Ipotalamo
Energetica
gli EC sono prodotti in situ e “al bisogno”
bisogno”
44
Gli endocannabinoidi ipotalamici sono espressi
prevalentemente dai neuroni dell’
dell’ipotalamo
laterale e sono coco-localizzati con OXA e MCH.
Nell’
Nell’ipotalamo di animali obesi i livelli di
endocannabinoidi sono aumentati.
Trattamento con leptina
riduce i livelli di EC
sia negli animali obesi che normopeso
il sistema cannabinoide ipotalamico sia
responsivo ai segnali di sazietà
sazietà provenienti dalla
periferia.
45
Attualmente, si ritiene, quindi, che il sistema
EC controlli l’
l’assunzione di cibo a due livelli.
Aumentano il desiderio e il consumo di cibo
tramite il circuito mesolimbico (Gratificazione)
Modulano
la
produzione
di
sostanze
oressigene/
oressigene/anoressigene a livello dell’
dell’ipotalamo
Nuclei Arcuati
stimolano la produzione di NPY
inibiscono i neuroni POMC/CART
PVN
inibiscono i neuroni anoressigeni CRH
46
Il controllo del bilancio energetico viene
modulato inoltre da altri neurotrasmettitori
gli oppioidi endogeni,
la dopammina
la serotonina
47