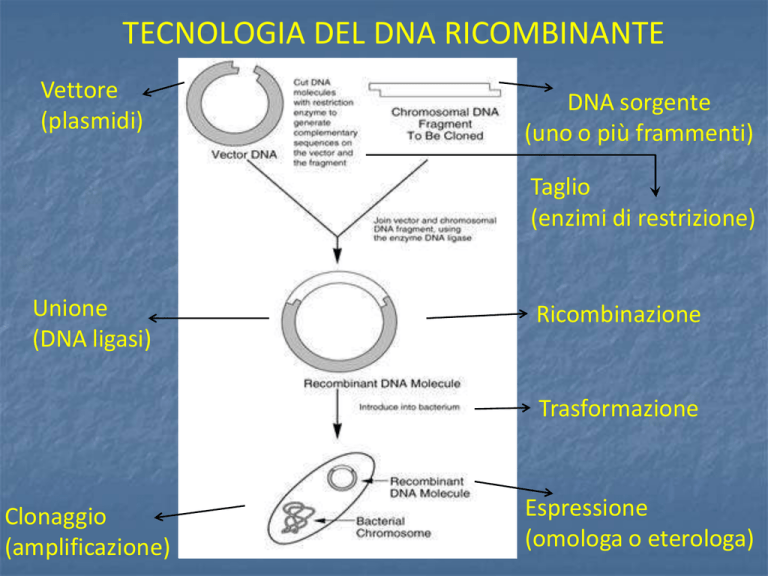
TECNOLOGIA DEL DNA RICOMBINANTE
Vettore
(plasmidi)
DNA sorgente
(uno o più frammenti)
Taglio
(enzimi di restrizione)
Unione
(DNA ligasi)
Ricombinazione
Trasformazione
Clonaggio
(amplificazione)
Espressione
(omologa o eterologa)
TECNOLOGIA DEL DNA RICOMBINANTE
Alcuni batteri hanno molecole di DNA circolari extracromosomico dette
plasmidi che si duplicano in maniera indipendente rispetto al cromosoma
batterico e producono proteine sfruttando i meccanismi biosintetici della
cellula.
E’ possibile usare i plasmidi come vettori per introdurre uno specifico gene che
codifica per la proteina desiderata.
Per questa operazione è necessario conoscere le sequenze nucleotidiche dei
segmenti da clonare, e manipolare il DNA plasmidico tale da renderlo idoneo
per l’acquisizione dell’inserto.
Il DNA viene quindi estratto, digerito e poi inserito nel vettore plasmidico.
Questo nuovo DNA, detto ricombinante perché ottenuto attraverso tecniche di
ricombinazione in vitro, può essere utilizzato per trasformare una cellula ospite,
batterio o un altro microrganismo capace di riprodursi rapidamente e generare
un gran numero di copie di DNA ricombinante.
DIGESTIONE DEL DNA - ENZIMI DI RESTRIZIONE
Vari tipi di enzimi sono in grado di idrolizzare i legami fosfoestere del DNA (nucleasi)
Endonucleasi : tagliano all’interno del filamento di DNA
Esonuclesi: tagliano a partire dalle estremità 5’ o 3’
ENDONUCLEASI DI RESTRIZIONE
Sono enzimi prodotti da batteri che tagliano le molecole di DNA a livello di sequenze
nucleotidiche specifiche dette siti di restrizione o di riconoscimento. Scindono
specificamente il legame estere tra l’ossigeno del C3’ dello zucchero di un nucleotide e il
gruppo fosfato in C5 ‘ dello zucchero del nucleotide successivo.
Varie classi
Classe I e III necessitano di energia e scindono il DNA in modo imprevedibile;
Classe II sono quelle più utili in quanto non richiedono energia e tagliano in siti specifici
riconoscendo delle sequenze di 4-8 bp dette palindromiche poiché risultano identiche se
lette su entrambi i filamenti.
Il loro taglio può produrre frammenti con estremità piatte o sfalsate (coesive), a seconda
del tipo di enzima utilizzato.
Esempi di tagli effettuati da diversi enzimi di
restrizione
DNA ligasi
Le estremità coesive prodotte
dallo stesso enzima su molecole
di DNA diverse sono
complementari e quindi in grado
di appaiarsi l’una con l’ altra.
Le catene associate sono tenute
insieme da legami idrogeno tra
basi complementari su filamenti
opposti ma necessitano di un
unione covalente tra il gruppo
fosfato 5’ di un’ estremità e il
gruppo ossidrilico 3’ della catena
adiacente.
Tale reazione è catalizzata
dall’enzima DNA ligasi.
DNA ligasi
formazione del legame covalente
tra due molecole di DNA.
Vettori di clonaggio
Gran parte degli straordinari progressi ottenuti dalla biotecnologia e dalla biologia
molecolare, dipendono dall'acquisizione della capacità di amplificare e propagare
indefinitivamente i geni.
Clonare un gene significa isolarlo da un genoma ed inserirlo in un vettore capace di
replicarsi in un certo ospite (di solito E.coli o lievito).
Esistono diversi tipi di vettori di clonaggio, ciascuno con vantaggi e svantaggi.
La principale considerazione da fare é relativa alle dimensioni dell'inserto di DNA che ogni
vettore può accettare.
PLASMIDI
da 0,1 a 10 Kb
FAGI
da 8 a 22 kb
COSMIDI
da 32 a 45 kb
BAC (CROMOSOMI ARTIFICIALI BATTERICI )
da 75 a 300 kb
YAC (CROMOSOMI ARTIFICIALI DI LIEVITO )
da 100 a 2000 kb
PLASMIDI
I plasmidi sono degli elementi genetici extracromosomali che si replicano
autonomamente. Variano da 1 a 200 kb e sono molto diffusi tra i procarioti.
Esempi di plasmidi batterici naturali sono i plasmidi ColE1 di E.coli, i plasmidi Sym
di rhizobium, I plasmidi Ti o Ri di Agrobacterium.
I plasmidi possono essere lineari o integrati nel cromosoma batterico ma, nella
maggior parte dei casi, sono molecole di DNA circolari (episomi)
Nell'ospite batterico i plasmidi si presentano come molecole circolari superavvolte,
che, durante le manipolazioni sperimentali, possono rilassarsi o linearizzarsi in
seguito a rotture a singolo o a doppio filamento. In un gel di agarosio e bromuro
di etidio le tre forme migrano a velocità diverse e possono essere distinte.
nick
Plasmide superavvolto
(supercoiled)
Plasmide circolare
rilassato
Plasmide linearizzato
Vettori plasmidici
Dai plasmidi batterici naturali sono derivati i vettori di clonaggio, le cui
caratteristiche essenziali sono
• Origine
di replicazione
• Marcatore
• Siti
selezionabile
di restrizione unici
VETTORI PLASMIDICI
Piccoli DNA circolari con capacità di replicazione autonoma (specie specifica)
contenenti geni che possono essere utili al batterio (es. resistenza ad antibiotici)
Utili se contengono siti unici per enzimi di restrizione
Ori: origine della replicazione
Amp: gene reistenza ampicillina
Tet: gene reistenza tetraciclina
VETTORI PLASMIDICI
Plasmidi artificiali: creati per soddisfare meglio le esigenze di clonaggio
MCS (multiple cloning sequence): breve tratto di DNA contenente diversi siti di
restrizione unici e posizionata in un punto specifico del vettore
LacZ: gene delle beta-galattosidasi
(enzima in grado di convertire X-gal in un composto colorato)
Vettori fagici
Vettori fagici
I COSMIDI
I cosmidi permettono di trasportare DNA fino a 45 Kb.
Un cosmide è un plasmide, di solito intorno alle 5 Kb, contenente, un
sito cos. Contiene una ori, un marcatore di resistenza e siti unici di
restrizione (sito di clonaggio) e si può utilizzare come un plasmide.
Per trasformare la cellula batterica, vista la
dimensione del cosmide, si può utilizzare un
packaging in vitro analogamente a un fago
Il cosmide infatti possiede un sito cos che
può essere considerato un buon substrato per
una reazione di packaging, purchè abbia
dimensione comprese tra 38 e 51 Kb.
Un cosmide si clona come un plasmide e si
propaga come un fago λ
I COSMIDI
BAC (Bacterial Artificial Chromosome)
Tipo di vettore che permette di inserire fino a 300Kb di inserto creato
usando come modello il plasmide F (fattore di fertilità responsivo della
coniugazione batterica)
I geni del fattore F conferiscono
al vettore una bassa percentuale
di co-clonazione e di
ricombinazione interna .
E’ presente solo in 1 o 2 copie per
cellula.
E' molto stabile nelle generazioni.
Per la trasformazione batterica
con questo vettore si usa
l'elettroporazione.
YAC (Yeast Artificial Chromosome)
Tra i vettori di lievito i vettori YAC
sono molto utilizzati perché possono
contenere inserti molto lunghi (fino
a 2 Mb), anche se l’efficienza di
trasformazione è molto bassa.
Vengono mantenuti e propagati in
E.coli
I componenti essenziali di un vettore
YAC sono:
Per la replicazione e il mantenimento
in lievito:
2.Separare i due bracci
1.Digerire parzialmente
il DNA bersaglio con
enzimi di restrizione
• Centromero(CEN), telomeri (TEL)
e sequenze a replicazione autonoma
(ARS)
• Marcatori di selezione auxotrofica
come TRP1 e URA3
Per la replicazione e il mantenimento
in E.coli:
• Marcatore di resistenza (Amp)
• Ori
Per la clonazione:
• Siti di restrizione unici
4.Trasformare le cellule di lievito,
selezionando per i 2 marcatori diversi
posizionati ciascuno su un braccio.
3.Ligare vettore
YAC e inserto
CLONAGGIO
DNA SORGENTE
- Genoma
frammentazione del DNA e inserimento in vettori
frammenti casuali (necessità di analizzare molti cloni)
presenza di sequenze non codificanti
- Trascrittoma (RNA)
necessità di covertire RNA in DNA (cDNA)
non tutti i geni sono espressi nella stessa cellula
Librerie geniche o genoteche
Quando un DNA genomico viene estratto dalle cellule di un organismo,
tagliato con uno o più enzimi di enzima di restrizione e la popolazione
dei frammenti di DNA ottenuti vengono clonati in un vettore, si ottiene
una collezione di cloni, contenente almeno una copia di tutte le
sequenze di DNA presenti nel genoma.
Tale collezione è definita LIBRERIA GENOMICA (o GENOTECA)
Imparentate alle genoteche genomiche sono le genoteche di DNA
complementare (cDNA), collezioni di cloni contenenti molecole di DNA
copiate dai mRNA isolati dalle cellule.
In tali genoteche è clonato il DNA privo delle regioni introniche e quindi
di solo la porzione codificante dei vari geni analizzati.
Sintesi del cDNA
Libreria di cDNA
La libreria di cDNA è cellula specifica
Trasformazione
Tipi di trasferimento genico
DNA
plasmidico
Elettroporazione
CaCl2
Coniugazione
Trasformazione
Cellula batterica
DNA
virus
Trasfezione
PEG
Elettroporazione
DEAE-destrano
Cellula animale Ca (PO )
3
4 2
Elettroporazione
cannoncino balistico
Agrobacterium
protoplasto
Elettroporazione
Cellula vegetale
fusione di protoplasti
Metodi di Trasformazione
CONIUGAZIONE
Trasferiento mediato da pili che congiungono 2 cellule
CaCl2 - Ca3(PO4)2
I Sali di Calcio creano dei pori nella membrana cellulare
attraverso la quale possono transitare le molecole di
DNA all’interno della cellula.
ELETTROPORAZIONE
Metodica che applica un impulso elettrico ad alto
voltaggio a una sospensione di cellule in presenza di
DNA al fine di far entrare quel DNA nelle cellule.
Elettroporazione
L’elettroporazione è una metodica efficiente e
praticamente universale.
31
Il trattamento provoca la formazione di pori sulla
membrana delle cellule e quindi la possibilità di entrata
del DNA.
32
Trasduzione (Vettori virali)
o Elevata efficienza
Si sfruttano le proprietà
naturali del virus
o Uso attento
Rischio di creare virus
patogeni per
ricombinazione
o Molti possibili vettori
diversi:
Oncoretrovirus, lentivirus,
adenovirus, HSV, virus ibridi
33
Ingegnerizzando il DNA contenuto nel capside del fago è possibile ottenere
trasformazione della cellula bersaglio. Il sistema è ad elevata efficienza
perché non si fa altro che sfruttare, manipolandolo, un processo naturale
(la naturale tendenza del virus all’infezione).
34
SELEZIONE DEI CLONI TRASFORMATI
SELEZIONE DEI CLONI TRASFORMATI
SELEZIONE DEI CLONI TRASFORMATI
Inattivazione inserzionale
SELEZIONE DEI CLONI SPECIFICI
- PCR
con primers specifici.
- Ibridazione con sonde a DNA specifiche.
- Tecniche immunologiche
SELEZIONE DEI CLONI TRASFORMATI
1) ligazione e trasformazione
3) trattamento della
membrana: denaturazione
in situ
2) replica della piastra
su filtro di
nitrocellulosa
Colony hybridization
4) Preparazione della sonda
generalmente si purifica
l’inserto clonato e si
marca per Nick translation
5) Ibridazione della sonda
6) Autoradiografia
Colony hybridization
Incubazione con
- anticorpo primario
- anticorpo secondario
Sviluppo di colore o segnale
- reazione catalizzata dall’enzima
coniugato all’anticorpo secondario
Uso di anticorpi specifici
ESPRESSIONE DI PROTEINE RICOMBINANTI
ESPRESSIONE DI PROTEINE RICOMBINANTI
Clonaggio di un gene o di un cDNA codificante una particolare
proteina
Scelta del tipo di cellula ospite in funzione della proteina da
produrre
Inserimento del gene nella cellula ospite ove si voglia farlo
esprimere. I sistemi di espressione più diffusi sono Escherichia coli,
Bacillus subtilitis, lievito e cellule di mammifero.
IL DNA CLONATO PUO’ ESSERE ESPRESSO
IN CELLULE BATTERICHE O EUCARIOTICHE
promotore ATG
DNA/cDNA Stop
Promotori forti
Promotori inducibli
Promotori tessuto specifici
Eucarioti
Promotore Lac, Trp ecc
Procarioti
Trascrizione
promotore
DNA
ATG
Promotore AOX (alcol ossidasi)
Virus animali (CMV, SV40, ecc)
Virus vegetali (TMV, CMV, ecc)
Stop
Trascrizione
maturazione
PROTEINA
Produzione e
purificazione
Caratterizzazione
funzionale
PA
CELLULE BATTERICHE
Vantaggi
Semplicità di manipolazione
Velocità di replicazione
Alta resa di prodotto a basso costo.
Svantaggi
A volte non assumono la conformazione corretta, formano dei corpi
inclusi generando proteine biologicamente inattive
E’necessario un promotore inducibile per attivare la trascrizione
del gene relativo alla proteina desiderata.
Mancano di enzimi che effettuano modificazioni postraduzionali
sulle proteine necessarie affinchè quest’ultime possano funzionare.
LIEVITO
Eucariote unicellulare ma cresce in modo rapido ed economico (batteri).
Realizza molte delle modificazioni postraduzionali osservate nelle
cellule di mammifero
Possiede proteasi attive che degradano le proteine estranee (desiderate)
riducendo il recupero quantitativo del prodotto.
MAMMIFERI
Sede di elezione dove produrre una proteina di mammifero.
I promotori, i vettori, i protocolli di trasformazione e i sistemi
di cellule ospiti sono stati notevolmente migliorati
determinando la produzione su ampia scala di proteine quali l’
attivatore del plasminogeno tissutale (tPA).
Vengono usate spesso per testare l’ attività di un gene appena
clonato o la funzionalità di una proteina modificata.
I vettori di espressione eucariotici
hanno le stesse caratteristiche dei
vettori procariotici
VETTORI di
Saccharomyces cerevisiae
Vettori episomiali o plasmidici
Molto diffusi
Possibile instabilità su larga scala
Vettori che si integrano
Limitazione del numero di copie del gene clonato (uno per
cromosoma) e quindi limitazione della resa in proteina
geni spesso instabili
Cromosomi artificiali di lievito ( YAC )
Lungo frammento di DNA (100Kb) mantenuto nella cellula come
cromosoma separato
Altamente stabile
Non ancora usato per produrre proteine eterologhe su scala industriale.
Il vettore YAC simula un cromosoma
Espressione in E.coli
INSULINA :
PRIMO FARMACO RICOMBINANTE
Ormone di natura proteica che regola il metabolismo degli zuccheri,
iene prodotta dalle cellule β delle isole Langerhans del pancreas
e successivamente secreta nel torrente circolatorio.
L’ impossibilità di produrre insulina determina l’insorgenza del diabete.
Nel tentativo di sopperire al deficit di tale molecola si è iniziato
dapprima ad estrarla dal maiale e poi a sintetizzarla tramite tecnologia
del DNA ricombinante in sistemi batterici.
L’insulina ricavata dal pancreas di maiali, anche se biologicamente attiva
nell’ uomo, possedeva delle sequenze amminoacidiche diverse tali che
alcuni pazienti trattati producevano anticorpi contro-insulina che
determinavano occasionalmente gravi reazioni immunitarie.
.
Nei mammiferi l’ insulina è espressa come un singolo
filamento di pre-prormone che viene secreto
attraverso la membrana plasmatica; esso contiene
degli amminoacidi aggiuntivi non presenti
nell’ormone maturo.
Durante la secrezione tali amminoacidi vengono
eliminati ad opera di proteasi cellulari per rilasciare
l’insulina matura che consta di due corte
catene polipeptidiche A e B unite da due legami
disolfuro.
CATENA A
30 aa
CATENA B
21 aa
peptide di collegamento C 35 aa
ESONE 1
Unite da 2 ponti S-S
ESONE 2
PREPROINSULINA
Peptide segnale
C
PROINSULINA (forma S-S)
Nel Golgi un enzima
rimuove il pepdide
di collegamento
A
INSULINA
B
INSULINA RICOMBINANTE
L’insulina ricombinante è stata ottenuta
inizialmente facendo esprimere
separatamente le catene A e B e poi
assemblandole nella configurazione della
molecola matura. I segmenti che codificano
per ciascuna catena sono stati sintetizzati
chimicamente e inseriti in un vettore
batterico tale che, dopo la traduzione,
l’insulina fosse fusa all’ estremità
carbossiterminale del gene β-gal di E.coli.
I batteri producono elevate quantità di
proteina di fusione e, dopo purificazione le
catene insuliniche possono essere separate
con BrCN il quale taglia tutti i legami
successivi ad ogni metionina.
A
β-galattosidasi
B
β-galattosidasi
Poiché la β- gal contiene anche altri
residui di metionina, il trattamento
con BrCN la frammenta in numerosi
polipeptidi di breve lunghezza,
mentre le catene insuliniche non
vengono tagliate ulteriormente
poichè non contengono metionine
interne. Le catene A e B sono
purificate e unite a formare un’
insulina ricombinante attiva.
A
β-galattosidasi
B
β-galattosidasi
BrCN
hGH UMANO RICOMBINANTE
E’ una proteina di 191 amminoacidi prodotta dall’ adenoipofisi
regola la crescita e lo sviluppo. Una carenza di hGH non consente,
nei bambini, di raggiungere una statura normale ma iniezioni
regolari di tale ormone ne stimolano lo sviluppo. A differenza di
quanto visto per l’ insulina, gli ormoni della crescita di origine
animale non sono efficaci: funziona solo la proteina di origine umana
Per molti anni la si è estratta dai cadaveri ma l’infezione da virus è
stata un’inevitabile conseguenza di tale trattamento.
La tecnologia ricombinante ha rappresentato una fonte sicura e
affidabile di tale ormone.
METODO A SECREZONE
INTRACELLULARE
La manipolazione è stata necessaria poiché il
sistema batterico non era in grado di
produrre una forma normale della proteina
umana matura.
La sintesi di hGH si è ottenuta mediante la
costruzione di un gene ibrido a partire da un
cDNA di hGH naturale (aa 24-191) e da un
oligonucleotide sintetico (aa 1-24) che
codificavano
la
porzione
aminoacidica
terminale della forma matura della proteina.
Tale sequenza codificante è stata ligata in un
plasmide in posizione adiacente ad un
promotore batterico e ad un gene che codifica
per una Met d’inizio. Dopo transfezione in E.
coli l’ormone inizia ad essere prodotto e ad
accumularsi nella cellula batterica e infine può
essere recuperato mediante opportune
tecniche di purificazione.
METODO A SECREZIONE ESTERNA
E’ possibile produrre nei batteri una proteina senza una Met
in più indirizzandola per la secrezione. A tale scopo è stato
costruito un pre-ormone unendo il segmento di DNA
codificante l’hGH ad una sequenza segnale ricavata da una
proteina batterica.
L’ ormone della crescita umano viene così prodotto in E. coli insieme
alla sequenza segnale che indirizza le proteine verso la secrezione.
Le proteine si accumulano nello spazio periplasmatico fra le
membrane batteriche interna ed esterna e possono essere
rilasciate all’esterno in seguito a rottura ipotonica della
membrana. Una proteasi batterica al momento della secrezione
rimuove il peptide segnale cosicchè le proteine prodotte
non contengono la Met d’inizio.
Espressione in lievito
ESPRESSIONE DIRETTA in S.cerevisiae
(accumulo di proteina nel citoplasma dell’ospite)
Cu/Zn - SOD ( superossido dismutasi )
catalasi
perossidasi
SOD, H +
O 2¯
anione
superossido
H 2O 2
H2O + O2
perossido di
idrogeno
La SOD trova un impiego terapeutico come agente antinfiammatorio
contro osteoartite, artrite reumatoide e spondilite anchilosante.
Il vettore della Cu/Zn-SOD umana-lievito
GAPD = gliceraldeide
3-fosfato deidrogenasi
IL VIRUS DELL’EPATITE B
( HBV )
Il virus HBV è costituito da un
piccolo genoma di 3,2 kb che è stato
clonato e sequenziato.
Nel sangue dei pazienti si trova sia
il virus intero che l’antigene di
superficie HBsAg.
I vaccini anti-epatite B attualmente
disponibili sono vaccini formati da
subunità virali non infettive
contenenti l’antigene di superficie
(HBsAg) in forma purificata.
Tale molecola viene prodotta in
cellule di lievito con la tecnica del
DNA ricombinante. Quindi, a
differenza dei primi vaccini, quello
attualmente disponibile non contiene
sangue umano né emoderivati.
Preparazione di HBsAg
espressione nel lievito
HBV è un virus difficile da propagare in coltura si è ricorso
pertanto ad un vettore d’espressione in S. cerevisiae per clonare
l’antigene di superficie.
La trascrizione è indotta da un promotore forte a valle del quale
viene inserito un terminatore di trascrizione.
Il vettore contiene, ora, le origini di duplicazione e i marcatori sia
per i batteri che per il lievito. Il lievito trasformato con tale
plasmide può crescere in incubatori sino a concentrazioni cospicue
tali da produrre un accumulo di quote elevate di HBsAg.
Dopo opportuna purificazione le particelle antigeniche si aggregano
a formare una strutture di circa 20 nm di diametro, le stesse che
ritroviamo nei pazienti infettati da HBV.
Pichia pastoris:
lievito metanoltrofico
Espressione in cellule di
mammifero
Vettori di espressione
per cellule di mammifero
Simili ai vettori eucariotici
Studio della funzione e
regolazione dei geni di
mammifero
Produzione di proteine
ricombinanti “autentiche”
utilizzabili in applicazioni
terapeutiche.
Sistemi marcatori selezionabili per vettori di
espressione in cellule di mammifero
Neo: gene che codifica per la neomicina transferasi
G-418: agente che blocca la traduzione e uccide la cellula
neomicina
fosfotransferasi
P
G-418
G-418
attiva
inattiva
Sistemi marcatori selezionabili per vettori di
espressione in cellule di mammifero
DHRF: gene che codifica la diidrofolato reduttasi
Utilizzabile con cellule DHFR-
MTX (metotrexato)
DHFR-
inibizione della
crescita
DHFR+
aumento di [ Mtx ] e selezione
di cellule contenenti più
copie del vettore
proliferazione
normale
Espressione coordinata di DHFR e di
una proteina ricombinante
COLTURE CELLULARI DI MAMMIFERO
Alcune proteine di interesse clinico sono caratterizzate da una
complessità strutturale e funzionele tale da non potere essere
prodotte in batteri o lieviti.
La moderna biotecnologia ha permesso il ricorso all’uso di colture
di cellule di mammifero che pur richiedendo trattamenti
dispendiosi consentono di produrre in modo corretto proteine
modificate pienamente attive.
tPA: attivatore del plasminogeno
E’ il primo farmaco ad essere stato prodotto per mezzo di una coltura di
cellule di mammifero. La proteina viene utilizzata come agente
trombolitico nell’infarto miocardico, nell’embolia polmonare o in casi di
trombosi venosa.
Il tPA è un enzima coinvolto nel processo di fibrinolisi che ha lo scopo di
mantenere l’integrità del coagulo solo per il tempo strettamente
necessario all’arresto dell’emorragia e di impedire altresì la formazione di
trombi intravascolari che possono verificarsi a seguito dell’attivazione
spontanea della coagulazione. La fibrinolisi inizia con la conversione del
plasminogeno, precursore inattivo, in plasmina per opera degli attivatori
del plasminogeno, i più noti fra i quali sono l’urochinasi e varie sostanze
di origine tissutale tra cui il tPA.
La plasmina è una potente proteasi capace di scindere la fibrina
responsabile della formazione dei coaguli ematici.
La rapida somministrazione di un attivatore del plasminogeno a seguito
di un attacco cardiaco scioglie i trombi che, altrimenti, produrrebbero
danni irreversibili al muscolo cardiaco.
Il cDNA del tPA umano è stato clonato e
inserito in un vettore di espressione
contenente un promotore forte e un
terminatore.
Con il vettore così costruito sono state
transfettate stabilmente cellule di
mammifero.
Le cellule trasformate secernono il tPA
nel mezzo di coltura ma con basse rese.
Per aumentare i livelli di produzione si è
ricorsi all’ uso di metotrexato che
permette di selezionare solo quelle
cellule in cui è avvenuta l’
amplificazione del vettore e quindi
quella del gene codificante il tPA.
Le linee cellulari ad alta capacità di
espressione sono poste in coltura in
grandi incubatori da cui il tPA
ricombinante può essere purificato.
ACTILYSE: nuovo farmaco rtPA per il
trattamento dell’ictus ischemico acuto
Farmaco "coagulo selettivo “
che attiva la cascata
fibrinolitica trasformando il
plasminogeno in plasmina la
quale scioglie la fibrina
presente nel trombo. I nuovi dati
clinici dimostrano che i pazienti
trattati con rt-PA possono vedere
aumentate la loro probabilità di
evitare qualsiasi forma di invalidità
a seguito di un ictus.
Il farmaco è risultato efficace in
una finestra temporale compresa
tra le 3 e le 4,5 ore dalla comparsa
dell’ictus.


![mutazioni genetiche [al DNA] effetti evolutivi [fetali] effetti tardivi](http://s1.studylibit.com/store/data/004205334_1-d8ada56ee9f5184276979f04a9a248a9-300x300.png)



![(Microsoft PowerPoint - PCR.ppt [modalit\340 compatibilit\340])](http://s1.studylibit.com/store/data/001402582_1-53c8daabdc15032b8943ee23f0a14a13-300x300.png)





