Università degli Studi di Enna “Kore”
Facoltà di Scienze dell’Uomo e della Società
Corso di Laurea magistrale in
“Scienze e tecniche dell’attività motoria e sportiva per la tutela della salute”
Insegnamento: “Biochimica metabolica e della nutrizione”, AA 2014-2015
Appunti dalle lezioni di
Biochimica metabolica e della nutrizione
PARTE II
METABOLISMO
METABOLISMO: insieme di reazioni (trasformazioni chimiche e fisiche) che avvengono nella
cellula e ne permettono l’esistenza.
ANABOLISMO: insieme dei processi di sintesi di biomolecole a partire da precursori semplici.
Tali processi richiedono energia (processi endoergonici).
CATABOLISMO: insieme dei processi di trasformazione e degradazione di solito ossidativi a
carico dei substrati energetici. Da composti complessi (substrati energetici) si attengono molecole
semplici e poco reattive quali CO2, H2O, NH2 con produzione di energia chimica (processi
esoergonici) sotto forma di adenosina 5’-trifosfato (ATP).
I processi anabolici e catabolici sono strettamente correlati e regolati vicendevolmente: l'energia
prodotta nei processi catabolici (esoergonici) viene utilizzata per rendere possibili i processi
anabolici (endoergonici).
ATP è un composto ad alta energia che viene utilizzata dalle cellule come riserva di energia. Infatti
la trasformazione di alcuni suoi gruppi funzionali (idrolisi del gruppo fosfo-anidridico) è
fortemente esoergonica (produce energia). E’ costituita da una base azotata adenina, uno zucchero
semplice, il ribosio e 3 gruppi fosfato (Pi). Il ribosio è fosforilato in posizione 5 mediante la
formazione di un legame fosfoestereo. Tale gruppo fosfato (alfa) è a sua volta legato ad altri due
gruppi fosfato (beta e gamma) tramite un legame fosfo-anidridico. Rispetto al gruppo fosfoestereo, i
due legami fosfoanidridici di ATP possono essere idrolizzati generando energia (processo
esoergonico).
Pi=ortofosfato (PO32-)
PPi=pirofosfato (P2O74-)
Biochimica-Lezione
ATP può essere sintetizzata per
Fosforilazione a livello del substrato: trasferimento di un gruppo fosfato da una molecola
ad alta energia all'adenosina 5'-difosfato (ADP);
Fosforilazione ossidativa: durante l’ossidazione di composti ridotti (coenzimi ridotti)
prodotti dal catabolismo ossidativo dei substrati energetici viene generato un potenziale
elettrochimico di membrana mitocondriale interna (forza proton-motrice). La
separazione di carica genera una differenza di potenziale proporzionale alla separazione di
carica stessa. La differenza di potenziale elettrochimico è una forma di energia utilizzabile
nella sintesi di ATP.
Altre molecole ad alto contenuto energetico sono l’acetil-CoA, in cui è presente un legame
tioestereo energeticamente confrontabile con un legame fosfo-anidridico o la fosfo-creatina che
può fosforilare ADP con produzione di ATP in un processo catalizzato dalla creatina chinasi. La
fosfocreatina può essere considerata una sorta di tampone per ATP intracellulare, ovvero si oppone
alle diminuzioni di ATP generandola da ADP.
Le molecole ad alta energia possono essere utilizzate nel cosiddetto accoppiamento di reazioni: la
cellula utilizza l’energia ottenuta dalla trasformazione di una molecola ad alta energia (G≥20 kJ
mol-1) per rendere termodinamicamente favorita una reazione endoergonica.
TRASPORTO
La membrana ha lo scopo di compartimentalizzare la cellula e regola l’ingresso e l’uscita di
nutrienti e prodotti catabolici di scarto. La membrana permette di stabilire un gradiente di
concentrazione, separando soluzioni a differente concentrazione ed un gradiente elettrico,
generato da concentrazioni intra ed extracellulari di cariche diverse. Gradiente chimico e gradiente
elettrico generano il cosiddetto potenziale elettrochimico di membrana.
TRASPORTO PASSIVO: non richiede consumo di energia e avviene quando il gradiente di
concentrazione è favorevole.
Il trasporto Passivo può avvenire per:
diffusione semplice;
trasporto attraverso canali (proteine) di membrana diffusione facilitata.
Le molecole che possono diffondere passivamente sfruttando il gradiente di concentrazione sono
piccole molecole apolari come benzene, O2 (ossigeno),CO2 (anidride carbonica) e N2 (azoto) o
molecole polari neutre come urea, glicerolo.
Molecole polari a peso molecolare elevato non possono diffondere nella membrana e richiedono
sempre trasportatori proteici nel processo di diffusione. Un esempio di diffusione passiva facilitata
è quello associato ai trasportatori del glucosio (glucose transporters, GluT) che mediano il
trasporto del glucosio sulla base del gradiente di concentrazione tra spazio extracellulare e
citoplasma.
TRASPORTO ATTIVO: associato prevalentemente al trasporto di specie cariche o contro
gradiente di concentrazione; l’ingresso di una specie molecolare o atomica ionica si ripercuote sul
potenziale elettrochimico di membrana che rimane inalterato nelle cellule non eccitabili o deve
essere ripristinato nelle cellule eccitabili. Un esempio di tale tipo di trasporto è quello condotto
dalle pompe sodio-potassio ATP dipendenti che permettono di mantenere concentrazioni
intracellulari di potassio ed extracellulari di sodio contro gradiente di concentrazione.
In alcuni casi il trasporto attivo utilizzato anche per molecole neutre. Un esempio è il trasporto
attivo del glucosio a livello enterocitario contro gradiente di concentrazione.
Trasporto attivo del glucosio: cotrasporto Glucosio-Na+ a livello intestinale.
Il trasporto intestinale del glucosio si basa sul cotrasporto di glucosio e sodio. Nel lume intestinale
la concentrazione di Na+ è elevata e maggiore rispetto alla concentrazione intracellulare
enterocitaria. Per questo motivo, Na+ tende a diffondere negli enterociti. Il trasporto avviene
attraverso una trasportatore proteico che media il cotrasporto di glucosio. Il legame tra Na+ e
trasportatore determina un cambiamento della struttura della proteina inducendone una maggiore
affinità per il glucosio, che viene quindi assorbito dalle pareti intestinali. L'aumento del sodio
intracellulare determina una diminuzione del gradiente elettrochimico che viene ristabilito
attraverso una pompa sodio potassio ATPasica localizzata a livello della parete basale. Tale
pompa, associata all'idrolisi di un legame fosfoanidridico di ATP, media l'efflusso di sodio nel
sangue e l'influsso di potassio dal sangue all’enterocita con ripristino del potenziale elettrochimico
di membrana enterocitario. Contemporaneamente, un trasportatore del glucosio di tipo 2 o 5
(GluT2/5), localizzato a livello basale, media il trasporto passivo facilitato del glucosio
dall’enterocita al flusso ematico.
DIGESTIONE E ASSORBIMENTO DEI CARBOIDRATI
La digestione dei carboidrati inizia in bocca ad opera della amilasi salivare, che rompe la catena
polisaccaridica idrolizzando i legami alfa1-4 glicosidici a pH neutro.
Nello stomaco il pH diminuisce rendendo inattivo l'enzima e inibendo l’idrolisi dei glucidici legami
glicosidici. A livello intestinale viene prodotta l’amilasi pancreatica, che permette la formazione
di monosaccaridi e disaccaridi per scissione dei legami alfa1-4 glicosidici dei residui polisaccaridici
prodotti mediante l'idrolisi catalizzata dall'amilasi salivare. I prodotti ottenuti sono glucosio,
maltosio, saccarosio, lattosio. L’idrolisi dei disaccaridi è mediata da disaccaridasi specifiche dimeri
per specifici disaccaridi. Un esempio è quello della lattasi che idrolizza selettivamente il legame
beta 1-4 del disaccaride lattosio con produzione di glucosio e galattosio. La maltasi agisce sul
maltosio e scinde il legame alfa1-4 glicosidici per ottenere 2 molecole di glucosio. La saccarasi
idrolizza il saccarosio scindendo il legami alfa1-2 glicosidico con produzione di fruttosio e
glucosio.
Nel lume intestinale, il glucosio è assorbito dai villi mediante il trasporto attivo descritto in
precedenza e viene immesso nel flusso ematico. Nei tessuti il glucosio viene assorbito mediante
diffusione passiva facilitata. L'assorbimento di glucosio è regolato dagli ormoni insulina e
glucagone. Infatti insulina e glucagone attivano o inibiscono, rispettivamente, l’espressione genica
e la sintesi proteica del trasportatore GLUT4 nei tessuti insulino-dipendenti (muscolare, epatico,
adiposo) modulando, quindi, la capacità delle cellule di assorbire glucosio in funzione del glucosio
disponibile. Nelle cellule il glucosio può essere degradato aerobicamente o anaerobicamente. La
degradazione ossidativa aerobica del glucosio viene definita respirazione cellulare mentre la
degradazione anerobica del glucosio viene denominata fermentazione omolattica.
PRIMA FASE DELLA RESPIRAZIONE CELLULARE
La glicolisi consiste in un serie di reazioni che avvengono nel citoplasma attraverso la quale il
glucosio è degradato ed ossidato ad acido piruvico.
Nella glicolisi si possono individuare due fasi: una di attivazione, in cui si richiede il consumo di
2 molecole di ATP ed una in cui si producono 4 molecole di ATP.
Nella fase di attivazione o investimento, il glucosio (esoso) viene scisso in due triosi (3 atomi di
carbonio): una molecola di gliceraldeide 3-fosfato ed una molecola di di-idrossiacetone fosfato.
Quest'ultimo può essere convertito in gliceraldeide 3-fosfato. La prima fase del processo determina
quindi la formazione di due molecole di gliceraldeide-3-fosfato. Il processo richiede il consumo di
2 molecole di ATP.
Le principali reazioni della fase d’investimento:
1.GLUCOSIO + ATP→GLUCOSIO-6Fosfato + ADP.
L’enzima che catalizza la reazione è una chinasi (esochinasi). In questa reazione la sintesi del
legame fosfoestereo richiede il consumo di una molecola di ATP (accoppiamento di reazioni) e la
reazione complessiva è irreversibile. La fosforilazione attiva il glucosio e lo trasforma in una
molecola carica negativamente cellula che non può diffondere passivamente dal citoplasma allo
spazio extracellulare.
2. FRUTTOSIO-6Fosfato + ATP→FRUTTOSIO 1,6-DIFOSFATO + ADP
L’enzima che catalizza la reazione è una fosfofruttochinasi I. In questa reazione viene consumata la
seconda molecola di ATP (accoppiamento di reazioni). Questo processo irreversibile attiva
ulteriormente, ovvero rende maggiormente reattivo il fruttosio ottenuto per isomerizzazione del
glucosio mediante la sintesi di un secondo legame fosfoestereo.
3.
FRUTTOSIO 1,6,DIFOSFATO→DI-IDROSSIACETONE FOSFATO + GLICERALDEIDE 3- FOSFATO
Il diidrossiacetonefosfato viene isomerizzato da trioso fosfato isomerasi (TIM) a gliceraledeide 3fosfato. La fase di investimento della glicolisi genera due triosi fosfato di precursori di due
molecole di piruvato.
Il piruvato viene ottenuto mediante una serie di reazioni a partire da gliceraldeide 3-fosfato di 2
molecole di ATP e riduzione di 1 molecola di nicotinammide adenina dinucleotide. Considerando il
processo per le 2 molecole di gliceraldeide 3-fosfato prodotte da una molecola di glucosio:
2GLICERALDEIDE 3-FOSFATO + 4ADP + 2NAD+ 2 PIRUVATO + 2NADH + 4ATP
L’ossidazione di GA3P è termodinamicamente favorita poiché E°1,3-DPG/GA3P<E°NAD+/NADH. Le
molecole di ATP sono ottenute per fosforilazione a livello del substrato dalla lisi del legame
anidridico misto di 1,3-DPG (reazione reversibile) e dal legame fosfoestereo di PEP (ricordare
l’effetto della tautomeria chetoeneolica reazione irreversibile). Entrambe le reazioni
rappresentano un esempio di accoppiamento di reazioni ( la trasformazione di un legame ad alta
energia viene utilizzata per la sintesi endoergonica di ATP da ADP).
Ricordare che esochinasi, fosfofruttochinasi I (PFK1) e piruvato chinasi (PK) catalizzano
reazioni fortemente esoergoniche ed irreversibili tappe regolatorie della prima fase.
I coenzimi ridotti prodotti nella reazione di ossidoriduzione costituiscono una fonte ulteriore di
energia chimica nella terza fase della respirazione cellulare. Le molecole di nicotinammide adenina
dinucleotide ridotto possono essere
a) ossidate nuovamente a livello citoplasmatico dalla lattato deidrogenasi (LDH) durante la
fermentazione omolattica, in modo da alimentare la prima fase della respirazione
(ricordare che alcuni lieviti in condizioni di anaerobiosi ripristinano i livelli di NAD+
attraverso la fermentazione alcolica e senza produzione di energia chimica;
b) trasferite nel mitocondrio mediante sistemi navetta come il sistema navetta del glicerolo 3fosfato o il sistema navetta malato-aspartato (un’eccellente trattazione dei sistemi di
trasporto
è
disponibile
ai
link:
http://www.chembio.uoguelph.ca/educmat/chm452/lectur10.htm
e
http://www.chembio.uoguelph.ca/educmat/chm452/lectur11.htm) e ossidate mediante
processi redox termodinamicamente favoriti (E°>0 G°<0) nella catena di trasporto
degli elettroni (electron transport chain, ETC) con successiva conversione di energia
elettrochimica in energia chimica durante la fosforilazione ossidativa (sintesi di ATP).
BILANCIO ENERGETICO della prima fase della respirazione cellulare
ATP
NADH
OTTENUTE
4
2
CONSUMATE
2
2
2
TOT
Il PIRUVATO prodotto nella prima fase della respirazione può seguire due vie:
a) la via anaerobica fermentazione;
b) la via aerobica seconda (ciclo di Krebs) e terza fase (catena di trasporto degli elettroni e
fosforilazione ossidativa) della respirazione cellulare.
FERMENTAZIONE OMOLATTICA
piruvato + NADH→Acido Lattico + NAD+
Lo scopo di tale processo è quello di produrre nuovamente coenzimi ossidati che possano essere
utilizzati nella fase precedente (ossidazione di gliceraldeide 3-fosfato a 1,3-difosfoglicerato). Il
bilancio energetico rimane invariato ed è di 2 molecole di ATP. Tale destino anaerobico del
piruvato si realizza quando sia richiesta energia rapidamente ed in condizioni di carenza di
ossigeno.
L’enzima che catalizza la reazione reversibile è la lattato deidrogenasi (LDH).
Alcuni batteri svolgono un metabolismo anaerobico omolattico, altri batteri o lieviti invece
fermentano il piruvato producendo l’alcol etilco (fermentazione alcolica).
SECONDA FASE DELLA RESPIRAZIONE CELLULARE
CICLO DI KREBS
Il PIRUVATO può superare la membrana mitocondriale interna attraverso un simporto piruvato/H+
e generare acetil-CoA, molecola chiave dell'intero metabolismo. Il piruvato subisce una
decarbossilazione ossidativa irreversibile con produzione di CO2 (massimo stato di ossidazione
del carbonio). L’ossidazione è associata alla riduzione del coenzima NAD+ ed è catalizzata
dall’enzima piruvato deidrogenasi
Nella matrice mitocondriale, l'acetil-CoA condensa con l'ossalacetato generando citrato, dando via
al ciclo di Krebs, seconda fase della respirazione cellulare.
Le principali reazioni sono:
Reazione 1: condensazione dell'acetil-CoA con l'ossalacetato (4C) e produzione di citrato (6C).
Reazioni 3-4 catalizzate rispettivamente da isocitrato deidrogenasi e alfa-chetoglutarato
deidrogenasi:
isocitrato (6C) + NAD+→alfa-chetoglutarato (5C) + NADH + CO2;
alfachetoglutarato (5C) + NAD+ → succinil-CoA + NADH + CO2
Le reazioni 3 e 4 sono decarbossilazioni irreversibili (produzione di CO2) associate alla riduzione
di NAD+ a NADH. Tutti gli atomi del glucosio sono stati a questo punto ossidati ad anidride
carbonica che viene trasformata rapidamente in bicarbonato dall'enzima anidrasi carbonica ed
immessa in tal forma nel flusso ematico (ricordare l’effetto Bohr e la regolazione dell’affinità di Hb
per O2).
Reazione 5: succinil CoA + GDP→succinato (4C) + GTP
Il succinil-CoA è una molecola ad elevata energia come tutti gli acil-CoA in virtù del gruppo
tioestere la cui idrolisi è esoergonica e viene utilizzata in un processo che richiede un
accoppiamento di reazioni. La molecola di guanosina 5’-trifosfato (GTP) è una molecola ad alta
energia ed è un nucleoside trifosfato come ATP. GTP sarà utilizzato nelle prime tappe della
gluconeogenesi o per la sintesi di ATP mediante la reazione: GTP + ADP GDP + ATP.
Reazione 6-8: ripristino dell’ossalacetato succinato (4C) + NAD+ + FAD ossalacetato
(4C) + NADH + FADH2
Il succinato viene convertito in ossalacetato, primo intermedio del ciclo mediante un processo di
ossidazione che perevede la formazione di NADH e riduzione del coenzima flavinadenina
dinucleotide (FAD).
BILANCIO ENERGETICO A PARTIRE DA UNA MOLECOLA DI GLUCOSIO
PRIMA FASE DELLA
RESPIRAZIONE
DECARBOSSILAZIONE
OSSIDATIVA DEL PIRUVATO
CICLO DI KREBS
TOT
ATP
2
NADH
2
FADH2
0
0
2
0
2 (GTP)
4
6
10
2
2
CATENA DI TRASPORTO DEGLI ELETTRONI E FOSFORILAZIONE OSSIDATIVA
I coenzimi ridotti NADH e FADH2 che sono stati generati dalla glicolisi e dal ciclo di Krebs
vengono nuovamente ossidati per alimentare la prima e la seconda fase della respirazione
(ricordare che NAD+ può essere nuovamente ottenuto anche mediante la fermentazione). Gli
elettroni, provenienti dall'ossidazione del glucosio avvenuta nelle fasi I e II ed immagazzinati nei
coenzimi ridotti (equivalenti riducenti), vengono ceduti da questi ultimi all'ossigeno con
formazione di acqua (prodotto di riduzione dell'ossigeno molecolare immesso nell'organismo
attraverso la respirazione) mediante una serie di molecole trasportatrici di elettroni (ubichinone e
citocromo c) che fanno parte della catena di trasporto degli elettroni (electron transport chain,
ETC). Il trasferimento di elettroni è catalizzato da quattro complessi proteici (complessi
mitocondriali).
Gli elettroni passano vengono trasferiti dai coenzimi ridotti NADH e FADH2 al coenzima Q, da
quest'ultimo al citocromo c ed infine dal citocromo c all'ossigeno mediante processi redox
termodinamicamente favoriti grazie a valori di potenziale normale di riduzione progressivamente
crescenti. Tanto più negativo è il potenziale di ossido-riduzione di una data specie tanto maggiore
sarà la sua tendenza a cedere elettroni. L’ossigeno ha un potenziale normale di riduzione positivo ed
accetta indirettamente gli elettroni dai coenzimi ridotti che, al contrario, presentano potenziali
normali di riduzione negativi. L’energia liberata da tali processi redox viene utilizzata dai complessi
I, III e IV che sono pompe protoniche, in grado di espellere gli ioni H+ nello spazio intermembrana
e generare un gradiente elettrochimico che verrà utilizzato nella sintesi di ATP mediante la
fosforilazione ossidativa (ipotesi chemio-osmotica).
Complesso I
Il complesso I è denominato NADH-CoQ (ubichinone) ossidoreduttasi,
1) trasferisce 2e- da NADH al coenzima Q;
NADH+H+ + CoQ →NAD+ + CoQH2
2) espelle 2H+ dalla matrice allo spazio intermembrana.
Complesso II
Il complesso II è chiamato succinato-CoQ(ubichinone) deidrogenasi e trasferisce gli elettroni da
FADH2 al CoQ. Il complesso 2 è un punto di integrazione tra ciclo di Krebs e catena di trasporto
degli elettroni. Infatti coincide con l'enzima succinato deidrogenasi che catalizza l’ossidazione
dell'acido succinico ad acido fumarico riducendo il FAD a FADH2 nel ciclo di Krebs. Tale reazione
è reversibile. Nella catena di trasporto degli elettroni viene condotto il processo inverso
all’ossidazione del succinato (riduzione del fumarato a succinato con ossidazione di FADH2). Il
complesso 2 non è una pompa protonica, cioè non è in grado di trasferire protoni dalla matrice
allo spazio intermembrana (proteina di membrana estrinseca).
Complesso III
Il complesso III è chiamato CoQ-citocromo c ossidoreduttasi, è la seconda delle tre pompe
protoniche della catena respiratoria e trasferisce gli elettroni dal CoQ al citocromo c;
CoQH2 + 2cit c(oss.) →CoQ + 2cit c(rid.)
Espelle 2H+ nello spazio intermembrana.
Il complesso 3 contiene il citocromo b e c che possiedono gruppi eme. A differenza dell’ubichinone
capace di trasportare 2 elettroni, i citocromi possono accettare solo 1 elettrone. Il citocromo c1 è
una proteina che diffonde liberamente nella membrana mitocondriale interna (lipofila), che accetta
un elettrone dall’ubichinone e lo cede mediante il complesso IV all’ossigeno.
Complesso IV
Il complesso IV è chiamato citocromo c ossidasi, è la terza ed ultima pompa di protoni della catena
di trasporto degli elettroni e trasferisce gli elettroni dal citocromo c a O2 che si riduce ad H2O.
Fosforilazione ossidativa
L’ossidazione di NADH e FADH2 è necessaria al ripristino di coenzimi in forma ossidata
indispensabili alla prima e alla seconda fase della respirazione cellulare. Il trasporto degli elettroni
attraverso i complessi I-IV è un processo termodinamicamente favorito (esoergonico).
L’energia liberata mediante il trasferimento esoergonico degli elettroni dai coenzimi ridotti
all'ossigeno viene utilizzata per trasferire idrogenioni (H+) dalla matrice mitocondriale allo
spazio intermembrana. Si crea, in tal modo, un gradiente elettrochimico a livello della
membrana mitocondriale interna: nella matrice la concentrazione di ioni H+ è minore (pH
maggiore) rispetto alla concentrazione di ioni H+ nello spazio intermembrana (pH minore). Gli ioni
H+ accumulati nello spazio intermembrana, non possono tornare liberamente nella matrice
nonostante il gradiente di concentrazione favorevole poichè la membrana interna è impermeabile a
questi ioni. Il trasporto di ioni H+ dallo spazio intermembrana alla matrice mitocondriale è mediato
dal complesso dell’ATPsintasi (complesso V). Il passaggio H+ all’interno della matrice
mitocondriale dissipa l’energia elettrica associata al potenziale elettrochimico di membrana che
viene convertita in energia chimica mediante produzione di ATP da ADP + Pi. Questo
meccanismo è alla base della cosiddetta teoria chemiosmotica.
L’ossidazione di NADH produce 3 molecole di ATP, mentre l’ossidazione di FADH2 ne
produce 2. Questa differenza dipende dalla produzione di un gradiente protonico inferiore
nell’ossidazione di FADH2 (trasporto di 4H+ anziché 6H+).
BILANCIO ENERGETICO DELLA RESPIRAZIONE CELLULARE:
a) la prima fase della respirazione cellulare porta alla produzione netta di 2 molecole di ATP.
Vengono inoltre prodotte 2 molecole di NADH che saranno riossidate nella catena di trasporto degli
elettroni con produzione di 3x2=6 molecole di ATP.
b) la decarbossilazione ossidativa delle due molecole di piruvato ottenute da una molecola del
glucosio porta alla formazione di due molecole di NADH. Tali molecole verranno ossidate con
produzione di 3x2=6 molecole di ATP
c) la seconda fase della respirazione determina la produzione di una molecola di GTP che può
essere convertita in ATP. Vengono inoltre prodotte 3 molecole di NADH e 1 di FADH2. Da una
molecola di glucosio si ottengono 2 molecole di acetil-CoA. Quindi mediante l'ossidazione dei due
gruppi acetilici (2 cicli di Krebs) vengono prodotte 2 molecole di GTP (2xATP), 3x2=6 molecole di
NADH e 2x1=2 molecole di FADH2.
d) la terza fase della respirazione (catena di trasporto degli elettroni e fosforilazione ossidativa)
porta alla produzione di 6x3=18 molecole di ATP dalla ossidazione di NADH e 2x2=4 molecole di
ATP dall'ossidazione di FADH2.
Complessivamente quindi vengono ottenute 2+6+6+2+18+4= 38 molecole di ATP
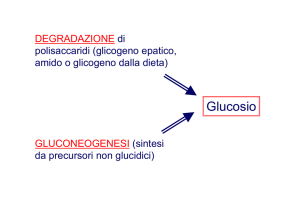
GLICOGENO
Il glicogeno è una riserva di glucosio che viene accumulato negli organismi animali principalmente
nel fegato e nel muscolo scheletrico.
Il glicogeno è un polisaccaride le cui unità monomeriche sono molecole di glucosio. Tali unità
sono unite tra di loro mediante un legame alfa-1,4-glucosidico. Sono inoltre presenti ramificazioni
generate mediante legami alfa-1,6-glucosidici.
La biosintesi del glicogeno prende il nome di GLICOGENOSINTESI e, come tutti i processi
anabolici, richiede energia.
La prima reazione prevede l'isomerizzazione del glucosio 6-fosfato:
GLUCOSIO 6-PGLUCOSIO 1-P
Enzima= fosfoglucomutasi (isomerasi)
Il glucosio 6P è un intermedio della glicolisi ed è ottenuto mediante fosforilazione catalizzata
dall'esochinasi del glucosio assorbito dalla cellula (ricordare il motivo dell’isomerizzazione).
La seconda reazione prevede l'attivazione del glucosio 1-P mediante uridina 5'-trifosfato (UTP)
molecola ad alta energia analoga a ATP:
GLUCOSIO1-P + UTP UDP-GLUCOSIO + (PPi) Enzima= UDP-GLUCOSIO pirofosforilasi
G1-P reagisce con l’uridina 5'-trifosfato (UTP) e si formano l’uridina 5'-difosfato (UDP)-glucosio
(UDP-glucosio) e pirofosfato (PPi) (ricordare il ruolo di PPi).
La terza reazione prevede la formazione del legame tra UDP-glucosio e la catena di glicogeno in
crescita:
UDP-GLUCOSIO + Glicogeno (n) Glicogeno (n+1) + UDP
Enzima= Glicogeno sintetasi
In tal modo, è stata aggiunta una molecola di glucosio all’estremità della catena di glicogeno (n+1),
con l’eliminazione di UDP. n=numero di unità monosaccaridiche costituenti il glicogeno in crescita.
Le ramificazioni vengono ottenute mediante la catalisi condotta da un enzima ramificante, la
Glicosiltransferasi.
5
Il processo di GLICOGENOLISI genera glucosio dal glicogeno mediante la scissione dei legami
glicosidici alfa-1,4 e alfa-1,6. Il glucosio ottenuto può essere immesso dal fegato ma non dal
muscolo nel flusso ematico ed alimentari i tessuti che richiedono costantemente glucosio.
Prima reazione:
GLIGOGENO (n) + Pi GLUCOSIO1-P + GLICOGENO (n-1) Enzima = Glicogeno fosforilasi
La glicogeno fosforilasi scinde il legame α-1,4 glicosidico del glicogeno (n) con l’intervento del
fosfato inorganico (Pi), producendo una molecola di glicogeno che presenta un residuo
monosaccaridico in meno (n-1) e glucosio 1-fosfato.
Seconda reazione:
GLUCOSIO1-P GLUCOSIO6-P
Enzima = Fosfoglucomutasi
Il glucosio 1 fosfato viene isomerizzato a glucosio 6-fosfato
Terza reazione:
GLUCOSIO6-P GLUCOSIO
Enzima = Glucosio 6-fosfato fosfatasi
Il glucosio 6-fosfato può essere defosforilato e immesso in circolo. Tale reazione può avvenire solo
nel fegato. Infatti solo gli epatociti esprimono la glucosio 6-fosfato fosfatasi.
Il fegato, quindi può rilasciare il glucosio nel sangue per rifornire gli altri tessuti in condizioni di
ipoglicemia.
Regolazione di glicogenolisi e glicogenosintesi
La regolazione di glicogenolisi e glicogenosintesi è fondamentale per il mantenimento di:
•OSMOLARITA’ CELLULARE (la concentrazione di glucosio e quindi la pressione osmotica nello
spazio extracellulare deve essere equivalente a quella del citoplasma).
•GLICEMIA (concentrazione ematica di glucosio).
La glicogeno sintasi e la glicogeno fosforilasi sono due enzimi che possono esistere in due forme:
la forma (a) attiva:
la forma (b) inattiva
La glicogeno sintasi è nella forma attiva (a) quando defosforilata, mentre la glicogeno fosforilasi
risulta attiva (a) quando viene fosforilata.
L’attività dei due enzimi è quindi regolata mediante fosforilazione reversibile di solito a carico di
residui di serina. Specifici residui di serina possono essere fosforilati ad opera di una fosforilasi
chinasi e defosforilati da una fosforilasi fosfatasi regolazione dell’attività enzimatica per
modificazione covalente.
Gli enzimi che catalizzano la fosforilazione sono le Chinasi (proteina chinasi A, fosforilasi b
chinasi e glicogeno sintasi chinasi attivano la glicogeno fosforilasi, inibiscono la glicogeno sintasi
ed attivano la glicogenolisi) mentre le Fosfatasi catalizzano la defosforilazione (la fosforilasi a
fosfatasi attiva la glicogeno sintasi ed inibisce la glicogeno fosforilasi, attivando quindi la sintesi
del glicogeno).
La regolazione delle attività dei due enzimi è ormonale e dipende da insulina e
glucagone/adrenalina:
Adrenalina e glucagone promuovono la fosforilazione inibendo la fosforilasi a fosfatasi
attivazione della glicogeno fosforilasi ed inibizione della glicogeno sintasi attivazione
della glicogeno lisi ed inibizione della glicogenosintesi.
L’insulina inibisce la fosforilazione inibendo le chinasi come glicogeno sintasi chinasi
attivazione della glicogeno sintasi e inibizione della glicogeno fosforilasi attivazione
della glicogenosintesi ed inibizione della glicogenolisi.
Il glucagone attiva la glicogenolisi epatica per ristabilire i livelli di glicemia, stimolando anche la
lipolisi nel tessuto adiposo e mobilizzando in tal modo substrati energetici alternativi al glucosio
(acidi grassi) in condizioni di digiuno o di elevato fabbisogno energetico. Il mantenimento di valori
costanti di glicemia durante il digiuno è di particolare importanza per il sistema nervoso, che in
condizioni normali, utilizza il glucosio come fonte energetica predominante.
L'insulina ha invece un effetto opposto e riduce i livelli di glicemia inibendo simultaneamente la
lipolisi.
GLUCONEOGENESI
La cellula può ottenere glucosio anche mediante il processo alternativo di GLUCONEOGENESI
ovvero mediante la biosintesi di glucosio da molecole non glucidiche come:
1) l’acido alfa-chetopropanoico (piruvato), ottenuto da amminoacidi come l’alanina o dall’acido
alfaidrossipropanoico (lattato), prodotto della fermentazione omolattica
2) il glicerolo, ottenuto dalla scissione dei trigliceridi a livello adipocitario
3) alcuni amminoacidi gluconeogenici come aspartato e glutammato che possono generare
intermedi del ciclo di Krebs come l’ossalacetato coinvolto nella via gluconeogenica.
E’ importante sottolineare che il piruvato e, di conseguenza, il glucosio non possono essere ottenuti
dall’acetil-CoA, prodotto ad esempio dalla beta-ossidazione dei grassi, a causa dell’irreversibilità
della decarbossilazione ossidativa del piruvato catalizzata dalla piruvato deidrogenasi.
La gluconeogenesi (processo anabolico) avviene nel fegato e nella corteccia surrenale quando le
scorte di glucosio o di glicogeno sono insufficienti al mantenimento di livelli normali di glicemia.
La gluconeogenesi non è il processo inverso della glicolisi, perché la prima fase della respirazione
cellulare prevede 3 reazioni irreversibili:
1. Glucosio + ATP → Glucosio 6-fosfato +ADP
Enzima: Esochinasi
3. Fruttosio 6-fosfato + ATP →Fruttosio-1,6-bisfosfato +ADP
Enzima: Fosfofruttochinasi
10. Fosfoenolpiruvato→produzione di Piruvato
Enzima: Piruvato chinasi
Tali reazioni sono fortemente esoergoniche ed il processo indiretto non avviene.
Nella gluconeogenesi vengono quindi realizzate le seguenti reazioni per aggirare la barriera
energetica corrispondente alle tappe irreversibili della prima fase della respirazione:
Piruvato+CO2+ATP+H2O → Ossalacetato+ADP+Pi+2H+
Enzima: Piruvato Carbossilasi
Ossalacetato+GTP→ Fosfoenolpiruvato+GDP+CO2 Enzima:Fosfoenolpiruvato carbossichinasi
La conversione del piruvato in fosfoenolpiruvato viene ottenuta mediante la sintesi intermedia di
ossalacetato a livello mitocondriale. Nella prima fase la reazione richiede energia, fornita da ATP;
nella seconda fase l’ossalacetato viene trasportato nel citoplasma attraverso il sistema navetta del
malato/aspartato e decarbossilato a fosfoenolpiruvato. Anche in questa seconda fase il processo
richiede energia fornita però da GTP.
Le altre due tappe irreversibili della prima fase della respirazione vengono realizzate mediante
l’azione di enzimi definiti fosfatasi:
Fruttosio -1,6-bisfosfato + H2O → Fruttosio 6-fosfato + Pi
1.Glucosio 6-fosfato + H2O → Glucosio + Pi
Enzima: Fruttosio 1,6-bisfosfatasi
Enzima: Glucosio 6-fosfatasi (epatica)
La gluconeogenesi è energeticamente dispendiosa. Infatti, per ogni
sintetizzata da piruvato vengono utilizzate 4 molecole di ATP e 2 di GTP.
molecola di glucosio
Regolazione concertata di glicolisi e gluconeogenesi
Come per glicogenolisi e glicogenosintesi, glicolisi e gluconeogenesi non possono avvenire
contemporaneamente e devono essere regolate simultaneamente. Gli enzimi che vengono regolati
allostericamente mediante un meccanismo spesso di retroinibizione sono quelli che catalizzano i
processi irreversibili descritti precedentemente. Ad esempio, ATP e AMP inibiscono e attivano,
rispettivamente, la glicolisi mentre hanno un effetto opposto sulla gluconeogenesi (ricordare la
reazione catalizzata da adenilato chinasi per interpretare il ruolo regolatori di AMP).
Un particolare meccanismo regolatorio delle due vie si basa sulla sintesi di un isomero del fruttosio
1,6-difosfato a partire dal fruttosio 6-fosfato. Il fruttosio 2,6-difosfato è un effettore allosterico
positivo della fosfofruttochinasi (PFK-1) che attiva la via glicolitica. Lo stesso composto
disattiva la fruttosio 1,6-bifosfatasi, inibendo la gluconeogenesi. La sintesi del fruttosio 2,6bisfosfato è promossa dalla fosfofruttochinasi-2 (PFK-2) anche denominata fruttosio bi fosfatasi
2 (FBPase2), enzima bi-funzionale (enzima dimerico contenente simultaneamente un dominio
chinasico e uno fosfatasico) regolato da glucagone e insulina (regolazione ormonale). Tali ormoni
quindi regolano in modo opposto entrambe le vie metaboliche.
Controllo ormonale
Insulina attivazione di PFK-2 aumento di fruttosio 2,6-difosfato citoplasmatico
attivazione di PFK-1 attivazione della GLICOLISI
Glucagone inibizione di PFK-2 riduzione dei livelli citoplasmatici di fruttosio 2,6-difosfato
attivazione di fruttosio 1,6-bifosfatasi attivazione della GLUCONEOGENESI
Ricordare anche il ruolo del citrato e del protone nella regolazione di PFK-1 e dell’alanina e di
Acetil-CoA nella regolazione di PK.
REGOLAZIONE DEL CICLO DI KREBS
1.
Non ormonale.
2.
Regolazione allosterica in base al fabbisogno energetico.
a) Un aumento di NADH inibisce le 3 reazioni irreversibili. Inoltre inibisce anche piruvato
deidrogenasi (inibita anche da aumenti di ATP e acetil-CoA).
b) Un aumento di ATP inibisce citrato sintasi e isocitrato deidrogenasi (IDH). Il citrato inibisce la
citrato sintasi.
c) Succinil CoA e citrato inibiscono alfa-chetoglutarato deidrogenasi (KGDH).
d) ADP attiva (ricordare che è prodotto di ATP nella contrazione) citrato sintasi e isocitrato
deidrogenasi.
e) Ca2+ attiva IDH e KGDH (la contrazione richiede influsso di calcio attivazione di Krebs).
3.
Disponibilità dei substrati (reazioni anaplerotiche possono accelerare/attivare il ciclo).
La gluconeogenesi epatica è parte integrante di due processi che integrano il metabolismo glucidico
di muscolo e fegato:
1) Il CICLO DI CORI
Il lattato, prodotto dal muscolo quando il fabbisogno energetico deve essere soddisfatto in tempi
brevi o in condizioni di carenza d'ossigeno, viene trasportato tramite il flusso ematico al fegato. Nel
fegato il lattato viene ossidato dalla lattato deidrogenasi (ricordare le diverse isoforme di LDH)
a piruvato (processo inverso della fermentazione) che, a sua volta, viene convertito, mediante
gluconeogenesi, in glucosio.
2) Il CICLO GLUCOSIO ALANINA
L'alanina, ottenuta per transaminazione dal piruvato nel muscolo in condizioni di elevato
fabbisogno energetico passa nel circolo sanguigno e raggiunge il fegato, nel quale subisce una
nuova transaminazione (reazione inversa della precedente) rigenerando piruvato. Il piruvato può,
quindi essere convertito in glucosio tramite la gluconeogenesi.
METABOLISMO DEI LIPIDI
DIGESTIONE
I lipidi alimentari sono un'importante fonte di energia. Essi sono rappresentati in prevalenza da
trigliceridi. La digestione dei lipidi avviene nell’intestino. I sali biliari emulsionano le molecole
lipidiche poco solubili in acqua in micelle facilitando l’azione della lipasi pancreatica, l’enzima
che scinde i trigliceridi in 2 molecole di acidi grassi liberi e una molecola di monoacilglicerolo
(molecola di glicerolo esterificata con una molecola di acido grasso di solito in posizione 2 fattori
sterici). Gli acidi grassi a catena corta (meno di 12 atomi di carbonio) diffondono liberamente
attraverso la parete intestinale nel flusso ematico. Al contrario, gli acidi grassi a catena lunga e i
monogliceridi vengono assorbiti dagli enterociti dove vengono nuovamente convertiti in
trigliceridi a livello del reticolo endoplasmatico liscio. I trigliceridi ottenuti in tal modo
interagiscono con particolari proteine lipofile definite lipoproteine generando dei complessi
lipoproteici a bassa densità definiti chilomicroni. I chilomicromni vengono immessi nel flusso
linfatico e poi nel flusso ematico per esocitosi e trasportati ai tessuti. A livello muscolare ed
adipocitario, i chilomicroni vengono deprivati di trigliceridi generando i cosiddetti chilomicroni
remnant che nel fegato vengono trasformati in lipoproteine a bassissima densità (VLDL), utilizzate
per trasportare lipidi ai tessuti capaci di utilizzarli (muscolo scheletrico e tessuto adiposo). Tali
lipidi possono essere utilizzati per produrre energia (muscolo) o per costituire delle scorte
energetiche (tessuto adiposo) da utilizzare in caso di necessità. Le VLDL vengono
progressivamente depauperate di trigliceridi trasformandosi in lipoproteine a densità bassa (LDL)
che tornano al fegato dove possono nuovamente arricchirsi di trigliceridi introdotti con la dieta. Un
caso particolare di lipoproteine è quello delle lipoproteine ad alta densità (HDL) sintetizzate a
livello epatico indipendentemente dai chilomicroni. Tali proteine hanno la capacità di interagire con
il colesterolo e di mediare il suo trasporto dai tessuti al fegato dove verrà utilizzato per la sintesi
degli acidi biliari. Tali lipoproteine hanno, quindi, una funzione protettiva. Infatti, un eccesso di
lipidi e colesterolo circolanti possono favorire la formazione di placche ateromasiche dando inizio
all’aterosclerosi, patologia favorita dall'elevata e progressiva assunzione di grassi animali e
correlata ad un aumento del rischio di sviluppare patologie cardiovascolari.
MOBILIZZAZIONE DEI TRIGLICERIDI NEL TESSUTO ADIPOSO
Seppur utilizzati direttamente come substrati energetici da alcuni tessuti come il muscolo, buona
parte dei trigliceridi viene conservata a livello del tessuto adipocitario. E' importante sottolineare
che sia il muscolo che il tessuto adiposo sono insulino sensibili.
L'accumulo di trigliceridi nel tessuto adiposo avviene in condizioni di limitato fabbisogno
energetico e di iperglicemia che stimola la secrezione pancreatica di insulina. Tale ormone attiva il
processo. I chilomicroni e le VLDL trasportate al tessuto adiposo subiscono l'azione della
lipoproteina lipasi che scinde i trigliceridi in acidi grassi e glicerolo. Gli acidi grassi possono
essere assorbiti dagli adipociti mediante un meccanismo indotto dall'insulina che stimola la
contemporanea espressione di GluT4, esaltando la capacità di assorbimento di glucosio di tali
cellule. Nell'adipocita, gli acidi grassi condensano con glicerolo proveniente dal di-idrossiacetone
fosfato, ottenuto dalla prima fase della respirazione e precursore del glicerolo grazie all’azione
dell’enzima glicerolo 3-fosfato deidrogenasi, per formare nuovamente trigliceridi.
In condizioni di elevato fabbisogno energetico e di ipoglicemia, il pancreas produce glucagone che
ha un'azione opposta all'insulina ed attiva la lipolisi. Infatti il glucagone attiva la cosiddetta lipasi
ormone sensibile, inibita al contrario dall’insulina, che catalizza l'idrolisi dei trigliceridi localizzati
nell'adipocita ad acidi grassi e glicerolo. Gli acidi grassi liberi possono essere veicolati ai tessuti
dall'albumina attraverso il flusso sanguigno. Il glicerolo può essere trasportato al fegato per entrare
nella gluconeogenesi, via attivata nelle stesse condizioni fisiologiche.
CATABOLISMO: BETA-OSSIDAZIONE
La degradazione degli acidi grassi avviene nei mitocondri e viene denominata beta-ossidazione.
Gli acidi grassi, assorbiti dalle cellule e trasportati nello spazio intermembrana mitocondriale,
vengono attivati mediante condensazione con CoA e formazione di acil-CoA, molecole analoghe
all'acetil-CoA e quindi ad alta energia (gruppo tioestereo). La reazione è fortemente endoergonica e
richiede consumo di 2 molecole di ATP. Gli acil-CoA non possono attraversare la membrana
mitocondriale interna e sono trasformati dalla carnitina acil transferasi I in acilcarnitine per
reazione con la carnitina. Le acilcarnitine attraversano la membrana tramite translocasi e giunte
nella matrice mitocondriale sono riconverite nuovamente in acil-CoA dalla carnitina
aciltransferasi II.
L’acil-CoA subisce nella matrice mitocondriale una serie di 4 reazioni che costituiscono un ciclo di
beta-ossidazione: una deidrogenazione FAD dipendente (sintesi di enoil-CoA), una idratazione
(sintesi di beta-idrossi acil-CoA), una ossidazione dell’ossidrile in posizione beta a chetone NAD+
dipendente (sintesi di beta-cheto Acil-CoA) e una reazione di tiolisi (sintesi di Acetil-CoA e di.una
molecola di Acil-CoA contenente 2 atomi di carbonio in meno rispetto all’Acetil-CoA originario). I
coenzimi FAD e NAD ridotti sono convogliati direttamente nella catena di trasporto degli elettroni.
Complessivamente, la degradazione ossidativa degli acidi grassi a catena diversamente lunga
converte le molecole di acido grasso in un numero variabile di molecole di acetil-CoA che possono
essere ossidate nel ciclo di Krebs con produzione di energia.
Ad esempio, da una molecola di acido palmitico (16 atomi di carbonio) si ottengono, mediante 7
cicli di beta ossidazione, 8 molecole di acetil-CoA. L'ossidazione di tali molecole mediante 8
ripetizioni del ciclo di Krebs produce 12x8=96 molecole di ATP. Inoltre, ogni ciclo di betaossidazione comporta la produzione di 1 molecola di FADH2 e 1 molecola di NADH. Mediante 7
cicli di beta-ossidazione vengono quindi prodotte 7 molecole di FADH2 e 7 molecole di NADH
che generano rispettivamente 7x2=14 e 7x3=21 molecole di ATP attraverso la terza fase della
respirazione cellulare. Il numero di molecole di ATP prodotte è quindi: 96+14+21=131 molecole di
ATP. Ricordando però che l'attivazione dell'acido grasso, in tal caso acido palmitico, richiede il
consumo di due molecole di ATP la resa complessiva del processo può essere valutata in 1312=129 molecole di ATP.
Ricordare che gli acidi grassi a catena dispari producono nell’ultimo ciclo di beta ossidazione una
molecola di propionil-CoA che può essere convertita in succinil-CoA alimentando il ciclo di Krebs.
E' importante sottolineare che i lipidi non possono essere usati per produrre glucosio mediante il
processo gluconeogenico. Infatti la trasformazione dell'acetil-CoA prodotto nella beta-ossidazione
in piruvato, primo intermedio della gluconeogenesi, è impossibile poiché a decarbossilazione
ossidativa del piruvato ad acetil-CoA è altamente esoergonica ed irreversibile.
Inoltre, la produzione di energia dagli acidi grassi e dalla sintesi di acetil-CoA mediante la betaossidazione può avvenire solo in presenza di adeguate quantità di ossalacetato, intermedio del
ciclo di Krebs. Le eventuali carenze di ossalacetato nel ciclo possono essere colmate grazie
all'azione dell'enzima piruvato carbossilasi o dell’enzima malico che catalizzano la trasformazione
anaplerotica del piruvato in ossalacetato (ricordare anche la reazione anaplerotica catalizzata da
PEPCK). Quindi l'ossalacetato, indispensabile al ciclo di Krebs, proviene principalmente dal
glucosio, precursore del piruvato. Quindi, in assenza di glucosio il ciclo di Krebs, non può avvenire.
Ecco perchè si suol dire che “i grassi bruciano nel fuoco degli zuccheri”.
In condizioni di ipoglicemia e bassi livelli di ossalacetato, l’acetil-CoA prodotto dalla beta
ossidazione si accumula, inibisce le fasi I e II della respirazione e condensa generando acetoacetato,
beta-idrossibutirrato e acetone definiti corpi chetonici . I corpi chetonici sono prodotti nel fegato e
sono importanti substrati energetici per il muscolo cardiaco ed il cervello in condizioni di elevato
fabbisogno energetico.
BIOSINTESI DEGLI ACIDI GRASSI
La beta-ossidazione avviene nella matrice mitocondriale mentre la biosintesi degli acidi grassi
avviene a livello citoplasmatico. Utilizza per i processi riduttivi molecole di nicotinammide adenina
di nucleotide fosfato ridotto (NADPH), la forma fosforilata del coenzima NAD e come molecola
precursore l’acetil-CoA prodotto principalmente dal catabolismo dei carboidrati o dell’etanolo.
Quindi i carboidrati possono essere precursori dei lipidi generando acetil-CoA mediante la
decarbossilazione ossidativa del piruvato catalizzata dalla piruvato deidrogenasi. Ricordare che la
reazione è irreversibile e che, per questo motivo, la conversione degli acidi grassi in zuccheri non è
possibile, .
Nella biosintesi citoplasmatica degli acidi grassi l’acetil-CoA (molecola a due atomi di carbonio),
prodotto a livello mitocondriale, non può attraversare la membrana mitocondriale interna per
raggiungere il citoplasma. Viene quindi convertito in citrato dalla citrato sintasi. Il citrato può essere
trasportato nel citoplasma attraverso un sistema di trasporto specifico (antiporto citrato-malato;
un’eccellente trattazione dei sistemi di trasporto mitocondriali è disponibile al link:
http://www.chembio.uoguelph.ca/educmat/chm452/lectur11.htm) e nuovamente trasformato in
acetil-CoA dalla ATP-citrato liasi citoplasmatica (processo endoergonico che richiede ATP).
L’acetil-CoA è ulteriormente attivato mediante una reazione endoergonica di carbossilazione a
malonil-CoA (molecola a tre atomi di carbonio). Il complesso multienzimatico dell’acido grasso
sintasi catalizza la sintesi di acidi grassi saturi a non più di 16 atomi di carbonio a partire da
acetil-CoA e malonil-CoA legati simultaneamente a siti tiolici della proteina trasportatrice di acili
(ACP), componente della acido grasso sintasi, mediante legami tioesterei. Questo favorisce
stericamente la reazione di condensazione. Le unità di acetile contengono due atomi di carbonio.
Quindi negli organismi superiori è possibile solo la sintesi di acidi grassi a catena pari. Nell’uomo,
diversi cicli biosintetici permettono di sintetizzare acidi grassi a catena ≤ 16C. L’acido palmitico
(C16:0) può generare acidi grassi a catena più lunga ed alcuni acidi grassi insaturi per azione di
enzimi chiamati rispettivamente elongasi e desaturasi. Il doppio legame non può essere prodotto
mai nel nostro organismo oltre l’atomo di carbonio in posizione 9. Per questo motivo, l’organismo
non può sintetizzare acidi grassi insaturi come l’acido linoleico (n-6) e linolenico (n-3), che
contengono doppi legami oltre il C9 (acidi grassi essenziali), sono assunti solo tramite dieta e sono
precursori di importanti molecole che si comportano come ormoni (prostaglandine, leucotrieni e
tromboxani) e sono fondamentalmente coinvolte nella regolazione dei processi infiammatori.
REGOLAZIONE CONCERTATA DI BETA-OSSIDAZIONE E BIOSINTESI.
a) regolazione ormonale di acetil-CoA carbossilasi (inibita da glucagone ed attivata da
insulina).
b) Regolazione allosterica della acetil-CoA carbossilasi da citrato e palmitato.
c) Regolazione allosterica della carnitina aciltransferasi I dal malonil-CoA e acido malonico.
CATABOLISMO DELLE PROTEINE E DEGLI AMMINOACIDI
La digestione delle proteine ha inizio nello stomaco dove il pH estremamente acido denatura le
proteine favorendo l’azione dell'enzima pepsina. Tale proteasi è generata da una forma inattiva, il
pepsinogeno che viene attivato e trasformato nell'enzima corrispondente mediante una
modificazione post-traduzionale che consiste nella rimozione di alcuni residui amminoacidici
dalla sequenza primaria. La pepsina idrolizza i legami ammidici (peptidici) tra specifici
amminoacidi (AA) dando luogo a polipeptidi di vario peso molecolare. Il pH ottimale delle pepsine
è compreso tra 1.6 e 3.2, intervallo che comprende il valore di pH gastrico. La pepsina è quindi
inattiva a livello intestinale dove i valori di pH sono maggiori.
Nell’intestino tenue i peptidi ottenuti dall'azione della pepsina vengono ulteriormente degradati per
azione della tripsina e della chimotripsina, potenti enzimi proteolitici funzionali ad un pH neutro.
Come la pepsina, anche tripsina e chimotripsina vengono ottenute da un processo di maturazione
proteine dei precursori tripsinogeno e chimotrispinogeno, rispettivamente. La digestione porta alla
produzione di AA e dipeptidi. Il trasporto degli AA dall’intestino tenue ai tessuti avviene in maniera
simile al trasporto del glucosio a livello enterocitario. Si tratta quindi di un trasporto attivo che
ottimizza l'assorbimento degli AA a livello intestinale.
Gli AA assunti tramite la dieta
a) sono utilizzati senza che subiscano modifiche strutturali per la sintesi di proteine codificate dal
genoma della specifica cellula o tessuto in condizioni di limitato fabbisogno di energia
b) come substrati catabolici in condizioni di elevato fabbisogno energetico.
La degradazione degli AA prevede formazione di ammoniaca ottenuta dalla rimozione del gruppo
alfa-amminico dell’AA. La reazione che sposta il gruppo amminico da un generico AA ad un alfachetoacido (piruvato, ossalacetato, alfa-chetoglutarato) accettore di tale gruppo prende il nome di
transaminazione. L'AA transaminato si trasforma in un alfa-chetoacido diverso da quello accettore.
Quest’ultimo accetta il gruppo amminico diventando un AA:
alfa-AA (1) + alfa-chetoacido (2) : alfa-chetoacido (1) + alfa-AA(2)
Gli enzimi che catalizzano tali reazioni di ossidoriduzione reversibili prendono il nome di
transaminasi o amminotransferasi.
Molti alfa-chetoacidi (1) ottenuti in tal modo sono intermedi del ciclo di Krebs (dall'aspartato si
ottiene ad esempio l'ossalacetato) o piruvato nel caso dell'AA alanina. Gli AA che generano tali
alfa-chetoacidi vengono definiti gluconeogenici, poiché precursori dell’ossalacetato e quindi del
glucosio e possono alimentare il ciclo di Krebs in condizioni di elevato fabbisogno energetico
(anaplerosi). Lo scheletro carbonioso dell'AA può anche generare acetil-CoA. In tal caso gli AA
vengono definiti chetogenici in quanto poteniali precursori di corpi chetonici.
Di particolare importanza è la transaminazione che coinvolge un amminoacido generico e l'alfachetoacido alfa-chetoglutarato (un intermedio del ciclo di Krebs).
alfa-AA+ alfa-chetoglutarato → alfa-chetoacido + glutammato
Mediante tale reazione l' alfa-chetoglutarato viene convertito nell'amminoacido glutammato che è
l'unico amminoacido dal quale possa essere ottenuta ammoniaca, prodotto finale del catabolismo
proteico, mediante una reazione di deaminazione ossidativa catalizzata dall’enzima glutammato
deidrogenasi. Quindi, l'alfa-chetoglutarato può essere considerato accettore finale di tutti i gruppi
amminici derivanti da AA perchè unico precursore di glutammato.
L’ammoniaca prodotta da tale reazione viene attivata mediante una reazione endoergonica con il
bicarbonato e trasformata in carbamilfosfato.
Il carbamilfosfato viene quindi trasformato in urea mediante il ciclo omonimo, che avviene a
livello epatico e coinvolge sia citoplasma che mitocondri dell'epatocita (ricordare l’integrazione di
ciclo dell’urea e ciclo di Krebs sintesi di fumarato nella conversione di arginosuccinato a
arginina). L'urea viene infine eliminata con le urine.
Il catabolismo proteico e le transaminazioni che avvengono nel muscolo in condizioni di elevato
fabbisogno energetico e per alimentare il ciclo di Krebs (anaplerosi) richiedono un sistema di
trasporto dell'ammoniaca al fegato in cui avviene il ciclo dell’urea. A livello muscolare, un alfachetoacido accettore del gruppo amminico di amminoacici è il piruvato che si trasforma in
alanina. L'alanina trasportata al fegato attraverso il flusso ematico viene nuovamente transaminata
per reazione con alfa-chetoglutarato generando piruvato che può entrare nella gluconeogenesi
(ciclo glucosio-alanina) e glutammato che procede invece verso la deamminazione ossidativa ed il
ciclo dell'urea. L’alanina ha quindi sia un ruolo gluconegenico che detossificante, rimuovendo
ammoniaca dal muscolo.
Un altro importante trasportatore di gruppi amminici dal muscolo al fegato è la glutammina,
ottenuta dal glutammato mediante la reazione endoergonica catalizzata dalla glutammina
sintetasi. Tale reazione richiede il consumo di una molecola di ATP (accoppiamento di reazioni) e
trasforma il gruppo carbossilico gamma del glutammato in gruppo ammidico mediante la
condensazione con ammonio dell’intermedio acil-fosfato (molecola ad alta energia). La
glutammina viene trasportata dal muscolo al fegato o al rene dove viene convertita nuovamente in
glutammato ed NH4+ mediante la reazione catalizzata dall’enzima glutaminasi. Nel fegato
l’ammonio entra nel ciclo dell’urea mentre nel rene viene escreto attraverso le urine.