Piano Lauree Scientifiche – Chimica - Ciamician
Dispense esperienza quantitativa: AAS
Piano Lauree Scientifiche – Chimica - Ciamician
Dispense esperienza quantitativa: AAS
1
1. ANALISI DEI RESIDUI DELLO SPARO
2
Spettri di emissione, spettri di assorbimento
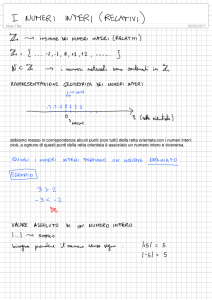
Le lunghezze d’onda che un atomo è in grado di assorbire sono quantizzate, cioè non variano con
1.1 Introduzione
continuità. Questo è dovuto al fatto che sono quantizzati i livelli elettronici. L’insieme delle
Nel caso di reati che comportino l’uso di esplosivi, gli operatori della Polizia Scientifica hanno la
lunghezze d’onda che un atomo è in grado di assorbire si chiama spettro di assorbimento.
necessità di rilevare tracce dei residui dello sparo (GSR, Gun Shot Residues). Tali GSR possono
Quando un atomo viene opportunamente eccitato, per esempio per collisione con atomi fortemente
essere messi in relazione sia con la provenienza dell’esplosivo originale, sia con l’identità di
energetici, esso emette delle lunghezze d’onda. L’insieme delle lunghezze d’onda che un atomo è in
sospetti autori di reati sui quali siano state rilevate tracce di GSR. In tale tipo di indagine utili
grado di emettere si chiama spettro di emissione.
markers sono antimonio, bario e piombo.
Lo spettro di assorbimento e lo spettro di emissione sono rappresentabili sotto forma di grafici.
L’esperienza qui illustrata propone un semplice metodo di chimica analitica quantitativa
Registrando lo spettro di emissione mediante opportuna strumentazione si osserva che esso è uno
strumentale basato sulla spettrometria di assorbimento atomico che permette l’analisi quantitativa
spettro a righe. Registrando lo spettro di assorbimento mediante opportuna strumentazione si
del piombo nei GSR estratti da un bossolo.
osserva che esso è uno spettro a picchi molto stretti (bande di assorbimento). Le lunghezze d’onda
Il metodo utilizzato è la spettrofotometria d'assorbimento atomico in fiamma (AAS). Tale metodo è
in corrispondenza delle quali cadono le righe dello spettro di emissione coincidono con i punti di
caratterizzato da limiti di rilevabilità molto bassi ed è adatto alla determinazione di metalli in tracce
massimo delle bande di assorbimento.
in matrici acquose.
Le concentrazioni vengono determinate per interpolazione da una retta di taratura precedentemente
Assorbanza e legge di Lambert-Beer
ottenuta con una serie di standard.
Se in una fiamma a temperatura dell’ordine di 2000 gradi, ottenibile per esempio bruciando
acetilene in aria, si nebulizza una soluzione che contiene atomi di Pb tali atomi vengono a trovarsi
Seguono alcuni concetti base che vengono richiamati allorché si esegue un’analisi di metalli da
in fase gassosa allo stato fondamentale.
GSR mediante spettrometria di assorbimento atomico in fiamma.
Se un raggio di luce di intensità P0 e lunghezza d’onda λ0 compresa tra quelle dello spettro di
emissione attraversa la fiamma, gli atomi l’assorbono e la sua intensità diminuisce ad un valore P.
La grandezza:
1.2 La spettrometria di assorbimento atomico in fiamma
Definizione
La spettrometria di assorbimento atomico (AAS) è una tecnica analitica che sfrutta l’interazione
A = log
in fase gassosa essi vengono assorbiti e provocano transizioni tra livelli elettronici; gli atomi
vengono portati ad una stato eccitato per poi tornare in breve tempo allo stato fondamentale di
partenza restituendo l’energia assorbita, per esempio sotto forma di calore o sotto forma di altri
fotoni meno energetici (fenomeno della luminescenza).
eq. 1.2.1
Si chiama assorbanza ed è una misura dell’entità dell’assorbimento.
Se c (mol l-1) è la concentrazione molare della soluzione nebulizzata, vale la legge di Lambert-Beer:
A=k c
della luce con la materia. La luce utilizzata ha lunghezza d’onda (λ) nell’intervallo dell’ultravioletto
(UV, tra 200 e 400 nm) – visibile (Vis, tra 400 e 800 nm). Quando fotoni di tali λ colpiscono atomi
P0
P
eq. 1.2.2
Dove k è una costante di proporzionalità che dipende da molte variabili sperimentali e dalla
struttura degli atomi. A parità di elemento atomizzato e condizioni sperimentali (tra queste ultime in
particolare è importante la lunghezza d’onda, che deve essere costante) l’eq. 1.2.2 si può utilizzare
per misurare c. Per farlo occorre un apparato strumentale chiamato spettrometro per assorbimento
atomico.
Piano Lauree Scientifiche – Chimica - Ciamician
Dispense esperienza quantitativa: AAS
Piano Lauree Scientifiche – Chimica - Ciamician
Dispense esperienza quantitativa: AAS
3
1.3 Lo spettometro AAS in fiamma
1.4 Metodi quantitativi in AAS
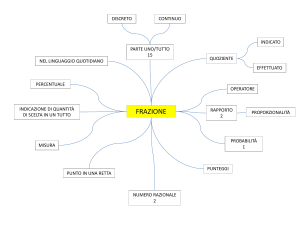
Schema a blocchi
sussistono le seguenti condizioni:
Lo schema strumentale di uno spettrometro AAS è rappresentato nella figura sottostante:
•
4
Il metodo quantitativo ideale è quello della retta di taratura. Tale metodo si può applicare se
monocromatore
il segnale analitico (che nel nostro caso è l’assorbanza) deve dipendere linearmente dalla
concentrazione;
-
•
l’assorbanza non supera 1, cioè il raggio incidente P0 è attenuato non più di 10 volte.
+
•
È assente l’effetto matrice cioè la capacità di influenzare il valore di assorbanza da parte di ciò
LCC
Fiamma
aria-acetilene
rivelatore
che accompagna l’analita nel campione originale.
•
È disponibile l’analita puro, col quale sia possibile preparare soluzioni a concentrazione nota,
che vengono dette soluzioni standard o semplicemente standard.
Sorgente luminosa LCC
Il metodo della retta di taratura è brevemente descritto di seguito.
È una lampada a catodo cavo (LCC), un cilindro di vetro con finestra di uscita in quarzo entro il
1) Si esegue la misura di A nel caso delle soluzioni standard. Siano xi, =1, ..n le concentrazioni
quale è presente gas di argon a pochi torr di pressione. Dentro l’involucro in vetro è collocato un
note degli standard e siano yi, =1, ..n le assorbanze misurate.
catodo fatto del metallo da analizzare. Quando tra anodo e catodo si applica una tensione continua,
2) Si esegue la misura di A nel caso della soluzione incognita. Sia y0 il segnale letto.
ioni argon vanno a colpire il catodo provocando l’espulsione di atomi di metallo, che passano in
3) Si determina per via statistica (v. cap. 3) la retta di equazione
fase gassosa e si trovano allo stato eccitato: essi emettono lo spettro di righe caratteristico
dell’elemento.
y =a+b x
eq. 1.4.1
Che meglio si adatta ai dati sperimentali (xi, yi) degli standard.
4) Si calcola la concentrazione incognita x0 mediante la formula:
Fiamma
Il combustibile in genere è acetilene, il comburente può essere aria oppure per es. protossido
d’azoto, che dà fiamme più calde. La temperatura della fiamma condiziona la resa di atomizzazione,
cioè la frazione di atomi nebulizzati che riesce a trovarsi nelle condizioni ottimali per assorbire
fotoni.
Monocromatore
Il monocromatore è un dispositivo ottico in grado di selezionare uno stretto intervallo di lunghezze
d’onda da uno spettro luminoso che lo colpisca. Tale stretto intervallo si chiama banda passante. La
banda passante è monocromatica, cioè è caratterizzata da lunghezza d’onda costante.
In ASS il compito del monocromatore è selezionare la lunghezza d’onda analitica, quella su cui cioè
si vuole applicare la legge di Lambert-Beer, che come si è detto vale per raggi monocromatici.
Elaborazione dati
Un circuito elettronico compara P0 con P e dà la misura di assorbanza corrispondente.
x0 =
y0 − a
b
eq. 1.4.2
Piano Lauree Scientifiche – Chimica - Ciamician
Dispense esperienza quantitativa: AAS
Piano Lauree Scientifiche – Chimica - Ciamician
Dispense esperienza quantitativa: AAS
5
6
1.5 Procedura sperimentale per la ricerca di Pb in bossoli
1.6 Trattamento dati per la ricerca di Pb in bossoli
1.5.1 Materiale da utilizzare
Lampada a catodo cavo al piombo (Pb), spettrometro AAS (Atomic Absorption Spectrometer), 1
1.6.1 Unità di concentrazione
bossolo, pipetta graduata da 5 ml, provetta, portaprovette, piastra riscaldante, filtri per siringa a 0,22
Concentrazione molare o molarità
µm, siringa da 5 ml di plastica.
La molarità della specie X si indica con c=[X] è espressa in mol/l ed è così definita:
[X ] =
1 matraccio da 25 ml; 5 matracci 50 ml classe A. Pipette classe A da 1, 2, 3, 4, 5 ml; acqua milliQ.
1.5.2 Sostanze da utilizzare
eq. 3.1.1
m
PM V
dove m è espresso in grammi (g) ed è la massa di sostanza pesata, PM è il suo peso molecolare
Acqua deionizzata ultrapura, HNO3 0,5 M, SOLUZIONE MADRE di piombo (Pb2+) 100 mg/l =
espresso in g/mol, e V è il volume espresso in litri (l) nel quale è stata sciolta la massa pesata.
100 ppmP/V.
Dunque la massa da pesare per preparare un volume V di soluzione a molarità c è:
m = c V PM
1.5.3 Parte sperimentale
Estrazione di Pb: Dopo aver indossato i guanti e gli occhiali, operando sotto cappa, trasferire il
Parti per milione o ppm
bossolo nella provetta insieme a 5 ml di HNO3 0,5 M prelevato con pipetta graduata, e scaldare per
La concentrazione di X è uguale ad 1 ppm se vi è un microgrammo di X per ogni grammo di
15 min a bagnomaria. In seguito aspirare la soluzione d'estrazione con la pipetta pasteur e trasferirla
soluzione. Nel caso di soluzioni acquose diluite si può considerare che un ml di soluzione pesi un
nel matraccio da 25 ml previa filtrazione a 0,22 µm. Eseguire 2 lavaggi del bossolo con aliquote da
grammo. In tal caso:
c X ( ppm) =
5 ml ciascuna di HNO3 0,5 M trasferendo nuovamente le acque di lavaggio nel matraccio (previa
filtrazione). In seguito portare a volume di 25 ml con HNO3 0,5 M il matraccio, ottenendo la
SOLUZIONE INCOGNITA.
mX
106
msoluzione
eq. 3.1.2
dove m è espresso in grammi (g). La massa mX da pesare per preparare una soluzione di massa msoluz
a concentrazione cX ppm è:
mX =
Preparazione degli standard (Pb). Utilizzando pipette a bolla tarate da 1, 2, 3, 4, 5 ml introdurre nei
eq. 3.1.3
c X msoluz
106
matracci da 50 ml aliquote della soluzione MADRE da 100 ppm e portare a 50 ml con HNO3 0,5 M.
In questo modo si ottengono le concentrazioni 2, 4, 6, 8, 10 mg/l (ppm) (soluzioni standard).
1.6.2 L’errore sperimentale
Qualunque misura sperimentale della grandezza X, ripetuta più volte, non fornisce mai lo stesso
Misure d'assorbanza. Con l’aiuto del tecnico misurare allo spettrometro atomico l'assorbanza del
risultato. Le misure sono infatti affette da incertezza legata a errori casuali ed errori sistematici.
campione ottenuto per estrazione del piombo dal bossolo e delle soluzioni standard. Utilizzando le
Il risultato di una misura viene allora sempre fornito come intervallo di valori centrato su un valore
rette di taratura calcolate dallo strumento, risalire alla concentrazione di piombo (Pb) nella
medio ( x ) ed avente un’ampiezza pari all’errore (∆x). L’intervallo x ± ∆x si chiama intervallo di
soluzione incognita, e da questa alla massa di piombo (espressa in mg) estratta dal bossolo in
confidenza.
esame.
L’errore è calcolabile a partire da una grandezza statistica che si chiama deviazione standard (s).
Nel caso di n misure ripetute di x, s si calcola mediante la formula seguente:
n
s=
∑ (x
i
i =1
ν
− x)
2
eq. 3.2.1
Piano Lauree Scientifiche – Chimica - Ciamician
Dispense esperienza quantitativa: AAS
7
Piano Lauree Scientifiche – Chimica - Ciamician
Dispense esperienza quantitativa: AAS
8
dove ν è il numero di gradi di libertà, definito come la differenza tra il numero di misure
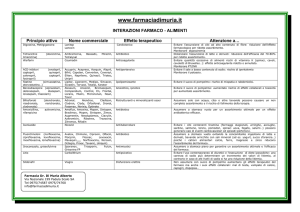
Un programma di calcolo determina i valori di a e b che minimizzano le distanze dei punti
sperimentali effettuate ed il numero di grandezze cercate.
sperimentali da una retta avente equazione y=a + b x. Più esattamente, ciò che viene minimizzato è
la somma degli scarti quadratici medi rappresentati dalla grandezza sy/x:
1.6.3 L’intervallo di confidenza
n
L’intervallo di confidenza si calcola dalla deviazione standard, semplicemente moltiplicandola per
sy / x =
∑ ( y − yˆ )
i =1
il parametro t-Student. Il parametro t è tabulato e dipende da:
1) livello di confidenza scelto; il livello di confidenza è la probabilità di ritrovare un’ulteriore
n
2
i
i
n−2
=
∑ [ y − (a + b x )]
i =1
2
i
eq. 3.5.1
i
n−2
La retta ottenuta minimizzando sy/x è detta retta di regressione lineare.
misura dentro l’intervallo di confidenza. Si chiama poi livello di significatività (α) la differenza
Il programma di calcolo fornisce anche le deviazioni standard su a e b, che indichiamo con sa e sb.
tra 100% ed il livello di confidenza.
Viene poi fornita la s sul dato interpolato:
2) Numero di gradi di libertà. Nel caso di una retta di taratura costruita da n soluzioni standard
ν=n-2 poiché due sono i parametri misurati (intercetta a e pendenza b della retta).
1.6.4 Le cifre significative
s x0
2
sy / x 1 1
( y0 − y )
=
+
+
n
b m n
b2
( xi − x )2
i =1
1
2
∑
∆x0 = tα ,n−2 ⋅ sx0
Cifre significative = tutte le cifre certe più la prima su cui cade l’errore. La prima cifra incerta è
determinata dal numero che dà l’errore, espresso con una sola cifra significativa.
eq. 3.5.2
eq. 3.5.3
Es: 0.0137995 ± 0.0003 = 0.0138 ± 0.0003
Esprimendo il risultato numerico in forma esponenziale, le cifre significative sono quelle del fattore
1.6.6 Sensibilità, limite di rivelabilità
Nel caso dei metodi qui proposto, la sensibilità è la pendenza b della retta di taratura.
pre-esponenziale.
Il limite di rivelabilità è la minima quantità (xLoD) misurabile col metodo adottato. Nel caso della
Esempi:
retta di taratura si dimostra che:
-4
0.00017368 (errore su 8) = 1.7368 10 ha 5 cifre significative
xLoD = 3
6
1349000 (errore sul 9) = 1.349 10 ha 4 cifre significative
1.6.5 La regressione lineare per calcolare la retta di taratura
La figura seguente illustra il metodo:
yn
yi
y0
y1
x1
x0 x
i
xn
sy / x
b
eq. 3.6.1
Piano Lauree Scientifiche – Chimica - Ciamician
Dispense esperienza quantitativa: AAS
9
INDICE
1.
ANALISI DEI RESIDUI DELLO SPARO ..................................................... 1
1.1
Introduzione ............................................................................................... 1
1.2
La spettrometria di assorbimento atomico in fiamma ................................. 1
1.3
Lo spettometro AAS in fiamma ................................................................... 3
1.4
Metodi quantitativi in AAS .......................................................................... 4
1.5
Procedura sperimentale per la ricerca di Pb in bossoli .............................. 5
1.5.1 Materiale da utilizzare ............................................................................ 5
1.5.2 Sostanze da utilizzare ............................................................................. 5
1.5.3 Parte sperimentale................................................................................... 5
1.6
Trattamento dati per la ricerca di Pb in bossoli ......................................... 6
1.6.1 Unità di concentrazione .......................................................................... 6
1.6.2 L’errore sperimentale.............................................................................. 6
1.6.3 L’intervallo di confidenza ....................................................................... 7
1.6.4 Le cifre significative ............................................................................... 7
1.6.5 La regressione lineare per calcolare la retta di taratura............................ 7
1.6.6 Sensibilità, limite di rivelabilità .............................................................. 8