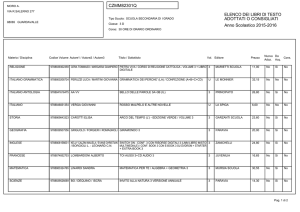
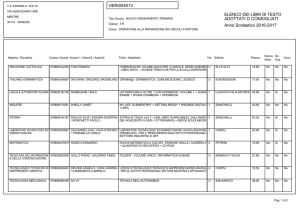
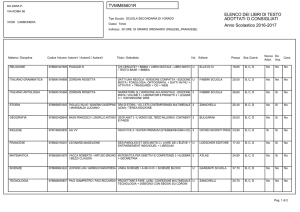
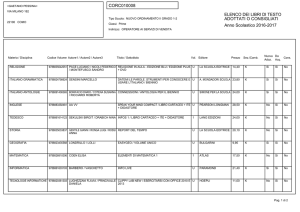
Gli equilibri in fase liquida
Le soluzioni sono sistemi omogenei a cui si
possono estendere le leggi dell’equilibrio chimico
discusse per la fase gassosa
Tratteremo in questa parte i seguenti equilibri :
¾Equilibri semplici di acidi e basi monoprotici
¾Equilibri multipli di acidi poliprotici
¾Equilibri semplici e multipli di idrolisi
¾Equilibri semplici e multipli di soluzioni tampone
Equilibri acido base
Le prime teorie sugli acidi e sulle basi
Teoria di Arrhenius (1887): sono acidi quelle sostanze
che solubilizzate in acqua liberano ioni H+, sono basi
quelle sostanze che solubilizzate in acqua liberano ioni
OHHCl (acq)
NaOH (acq)
H2O
H2O
H+(acq) + Cl-(acq)
Na+(acq) + OH-(acq)
Limiti della teoria: esiste un comportamento acido-base
anche in solventi diversi da H2O;
Equilibri acido base
Le prime teorie sugli acidi e sulle basi
Teoria di Bronsted Lowry (1923): sono acidi quelle
sostanze che sono in grado di donare H+, a qualunque
sostanza in una reazione chimica; sono basi quelle
sostanze in grado di accettare H+ dall’acido.
HCl (g) + H2O(l)
Acido 1
Base 2
HCl (g) + NH3 (g)
Acido 1
Base 2
HNO3 (acq) + NH3 (g)
Acido 1
Base 2
H3O+(acq) + Cl-(acq)
Acido 2
Base 1
NH4Cl (s)
Acido 2 + Base 1
NH4+ (acq) + NO3- (acq)
Acido 2
Base 1
Equilibri acido base
Le prime teorie sugli acidi e sulle basi
HCl (g) + H2O(l)
Acido coniugato
della base Cl-
Base coniugata
dell’acido H3O+
H3O+(acq) + Cl-(acq)
Acido coniugato
della base H2O
Base coniugata
dell’acido HCl
Equilibri acido base
Le prime teorie sugli acidi e sulle basi
Teoria di Lewis : sono acidi quelle sostanze che sono in
grado di accettare un doppietto elettronico; sono basi
quelle sostanze in grado di donare
un doppietto
elettronico.
B:
Alcune basi di Lewis
Alcune acidi di Lewis
Al metallico 3s2 3p1
A
| NH3
Al3+
3s 3p
H2O
BF3
2s2 2p1
Forza di un acido e di una base
Si prenda la reazione
HNO3 (acq) + H2O(l)
H3O+(acq) + NO3-(acq)
La forza dell’acido dipende dal valore della costante di
equilibrio espressa come:
[ NO3− ] ⋅ [ H 3 O + ]
Ka =
[ HNO3 ]
Forza di un acido e di una base
Si prenda la reazione
NaOH (acq) + H2O(l)
Na+(acq) + OH-(H2O)(acq)
La forza della base dipende dal valore della costante di
equilibrio espressa come:
[ Na + ] ⋅ [OH − ]
Kb =
[ NaOH ]
Forza di un acido e di una base
La forza di un acido o una base si esprime anche
come:
pKa = − log Ka
Acidi e basi deboli
pKb = − log Kb
pKa o pKb
Acidi e
basi forti
Ka o Kb
Acidi e basi
debolissimi
Fattori che influenzano l’acidità
In linea generale l’acidità di un composto aumenta
all’aumentare della stabilità della base coniugata.
Alcuni dei fattori che aumentano la stabilità sono:
Elettronegatività
Risonanza
Fattori che influenzano l’acidità
Elettronegatività
All’aumentare dell’elettronegatività dell’atomo centrale
aumenta la forza dell’acido perché la carica negativa su un
atomo più elettronegativo porta ad una base coniugata più
stabile
Ka HCl > 1
Ka
Ka
Ka
Ka
> 1
HBr
HF
> 7 ⋅ 10
−4
− 14
H 2O
= 1 ⋅ 10
−7
H 2S
= 1 ⋅ 10
Ka
H 3 PO
Ka
HNO 3
4
= 7 . 5 ⋅ 10
> 1
−3
Fattori che influenzano l’acidità
Risonanza
KaCH 3COOH = 1.8 ⋅ 10−5
Fattori che influenzano l’acidità
Risonanza
OH
Fenolo
C6H5OH
KaC 6 H 5OH = 1 ⋅ 10
−10
pH di una soluzione acquosa
E’ il parametro attraverso il quale si valuta l’acidità o la
basicità di una soluzione
Per definizione, il pH di una soluzione è :
pH= -log [H+]
Per cui il pH è una misura della quantità di ioni H+ che sono
presenti all’interno della soluzione.
Come si costruisce la scala del pH?
Il nostro punto di partenza è l’acqua alla T di 25°C.
Supponiamo di avere 1 l di H2O ovvero 55,5 moli per l di H2O
2H2O(l)
H3O+(acq) + OH- (acq)
Equilibrio di autoprotolisi dell’acqua
+
−
[H3O ]⋅[OH ]
−18
K=
=
3
.
24
⋅
10
[H2O]2
A causa della debolezza dell’H2O la sua concentrazione si può
considerare costante e pari 55,5moli/l
Come si costruisce la scala del pH?
K (55.5)2 = [ H3O+ ]⋅ [OH − ] = 10−14
Kw = [ H 3O + ] ⋅ [OH − ] = 10−14
[ H3O+ ] = [OH− ] = 10−14 = 10−7 moli/ l
Quindi il pH dell’acqua è
pH = − log[ H
pOH
+
]= 7
= − log[ OH
−
]= 7
Costante del prodotto ionico dell’H2O
Quando
[H+]=[OH-]
soluzione si dice neutra
la
Come si costruisce la scala del pH?
Equazione equivalenti a
Kw = [ H 3O + ] ⋅ [OH − ] = 10 −14
pKw = pH + pOH = 14
Qualunque sistema che sciolto in acqua modifica la
concentrazione di H+ o la concentrazione di OH- modificano il
pH del sistema
N.B. Qualunque sia la modifica apportata all’acqua vale sempre
Kw = [ H 3 O + ] ⋅ [OH − ] = 10 − 14
La scala del pH
Soluzioni a ,[H+] = 1M
Soluzioni a ,[H+] = 10-14 M
Si possono avere soluzione a pH<0 per [H+]> 1M e pH > 14 per
[H+]< 10-14 M
Calcolo del pH di soluzioni di acidi
monoprotici forti
Data una soluzione acquosa di HNO3 , Ka>1, di concentrazione
Ca
HNO3 (acq) + H2O(l)
H3O+(acq) + NO3-(acq)
Equazione semplificata
HNO3 (acq)
H2O(l)
H+(acq) + NO3-(acq)
H+(acq) + OH- (acq)
pH = -log [H+]totale = -log ([H+]a + [H+]H2O
[H+]a = Ca
[H+]H2O = ????
Calcolo del pH di soluzioni di acidi
monoprotici forti
[H+]H2O = [OH-]
Ricordando che :
Kw = [H+]totale [OH-] = 10-14
[OH-] = Kw / [H+]totale
[H+]totale = Ca + Kw / [H+]totale
[H+]2totale – Ca [H+]totale - Kw =0
Calcolo del pH di soluzioni di acidi
monoprotici forti
Se Ca > 10-6 M si può considerare trascurabile il contributo
dell’acqua agli H+ totali e l’equazione diventa:
[H+]totale ≈ [H+]a = Ca
pH = - log Ca
Calcolo del pH di soluzioni di basi
monoprotiche forti
Data una soluzione acquosa di NaOH , Kb>1, di concentrazione
Cb
NaOH (acq)
H2O(l)
Na+(acq) + OH-(acq)
H+(acq) + OH- (acq)
pOH = -log [OH-]totale = -log ([OH-]b + [OH-]H2O
pH = 14-pOH
[OH-]b = Cb
[OH-]H2O = ????
Calcolo del pH di soluzioni di basi
monoprotiche forti
[OH-]H2O = [H+]
Ricordando che :
Kw = [H+] [OH-] totale = 10-14
[H+] = Kw / [OH-]totale
[OH-]totale = Cb + Kw / [OH-] totale
[OH-]2totale – Cb [OH-]totale - Kw =0
Calcolo del pH di soluzioni di basi
monoprotiche forti
Se Cb > 10-6 M si può considerare trascurabile il contributo
dell’acqua agli OH- totali e l’equazione diventa:
[OH-]totale ≈ [OH-]b = Cb
pOH = - log Cb e poi il pH
pH= 14-pOH
Calcolo del pH di soluzioni di acidi
monoprotici deboli
Data una soluzione acquosa di HA , di concentrazione Ca
HA (acq)
H2O(l)
H+(acq) + A-(acq)
H+(acq) + OH- (acq)
pH = -log [H+]totale = -log ([H+]a + [H+]H2O
[H+]a
[H+]H2O = ????
[ H + ] ⋅ [ A− ]
Ka =
[ HA]
Calcolo del pH di soluzioni di acidi
monoprotici deboli
In questo caso la [H+]totale deve soddisfare ai 2 equilibri
simultanei
Kw = [H+]totale [OH-] = 10-14
[ H + ]totale ⋅ [ A− ]
Ka =
[ HA]
perciò il calcolo rigoroso del pH risulta particolarmente
complesso
Calcolo del pH di soluzioni di acidi
monoprotici deboli
Si procede attraverso l’applicazione di un bilancio di massa ed un
bilancio di carica in soluzione
[HA]= Ca - [A-]
bilancio di massa (1)
[H+]totale= [A-] + [OH-]
bilancio di carica (2)
L’equazione (2), tenuto conto dell’equilibrio dell’acqua diventa.
[H+]totale= [A-] + Kw/[H+] totale
(3)
[A-]= [H+]totale - Kw/[H+] totale
(4)
Calcolo del pH di soluzioni di acidi
monoprotici deboli
Ricordando che:
[ H + ]totale ⋅ [ A − ]
Ka =
[ HA]
[H
+
] totale
= Ka
[ HA ]
[A − ]
Sostituiamo l’equazione (1) al posto di [HA] al numeratore.
+
[ H ]totale
Ca − [ A − ]
= Ka
[ A− ]
Sostituiamo l’equazione (4) al posto di [A-] dell’equazione (5).
Kw
Ca − ([ H + ]totale − +
)
[ H ]totale
[ H + ]totale = Ka
Kw
([ H + ]totale − +
)
[ H ]totale
Calcolo del pH di soluzioni di acidi
monoprotici deboli
[H
+
] totale
Ca [ H
[H
+
+
] 2 totale − Kw
Ca − (
)
[ H + ] totale
= Ka
[ H + ] 2 totale − Kw
(
)
[ H + ] totale
[H
] totale = Ka
+
− [ H + ] 2 totale − Kw
[ H + ] totale
[ H + ] 2 totale − Kw
(
)
[ H + ] totale
]
totale
[ H + ]3 totale − [ H + ]totale Kw = KaCa[ H + ]
totale
− Ka[ H + ]2 totale + KaKw
[ H + ]3 totale + Ka[ H + ]2 totale − [ H + ]totale( Kw + KaCa) − KaKw = 0
Calcolo del pH di soluzioni di acidi monoprotici
deboli
Se Ca > 10-6 M e la Ka > 10-14 si può considerare trascurabile il
contributo dell’acqua agli H+ totali per cui il pH è solo dovuto
agli H+ della dissociazione dell’acido.
+
−
[H ]⋅[ A ]
Ka =
[ HA ]
Calcolo del pH di soluzioni di acidi
monoprotici deboli
HA (acq)
Conc iniziale
Ca
Conc prodotti
Conc equ.
[ x] ⋅ [ x]
Ka =
Ca − [ x]
Ca-x
H+(acq) + A-(acq)
-
-
x
x
x
x
[ x ]2
Ka =
Ca − [ x ]
[ x ] 2 + Ka [ x ] − KaCa
= 0
Calcolo del pH di soluzioni di acidi
monoprotici deboli
Se Ca > 10-6 M e la Ka < 10-6 si può considerare trascurabile la
[x] al denominatore della equazione di 2° grado per cui il calcolo
del [H+] diventa:
Ka
[x]
=
Ca
[x] =
2
KaCa
Calcolo del pH di soluzioni di basi
monoprotiche deboli
Consideriamo solo il trattamento semplificato per il calcolo della
[OH-], ovvero consideriamo il caso in cui Cb > 10-6 M e la Kb >
10-14
BOH (acq)
B+(acq) + OH-(acq)
Conc iniziale
Cb
Conc prodotti
Conc equ.
[ y] ⋅ [ y]
Kb =
Cb − [ y ]
Cb-y
-
-
y
y
y
y
[ y ]2
Kb =
Cb − [ y ]
[ y ]2 + Kb[ y ] − KbCb = 0
Calcolo del pH di soluzioni di basi
monoprotiche deboli
Se Cb > 10-6 M e la Kb < 10-6 si può considerare trascurabile la
[y] al denominatore della equazione di 2° grado per cui il calcolo
degli [OH-] diventa:
[ x ]2
Kb =
Cb
[ y ] = KbCb
Calcolo del pH di soluzioni di acidi
poliprotici
Addefiniscono
eccezione dell’acido
pH degli
acidi poliprotici
Si
poliproticisolforico,
gli acidiil che
contengono
più di unsi
calcola ionizzabile
considerando solo gli H+ derivanti dalla prima
idrogeno
dissociazione.
H2CO3 (acq)
H+(acq) + HCO3-(acq) Ka1= 4.5 10-7
HCO3- (acq)
H+(acq) + CO32-(acq)
Ka2= 5.7 10-11
H2SO4 (acq)
H+(acq) + HSO4-(acq)
Ka1 > 1
HSO4- (acq)
H+(acq) + SO42-(acq)
Ka2= 2 10-2
H3PO4 (acq)
H+(acq) + H2PO4-(acq) Ka1= 7.1 10-3
H2PO4- (acq)
H+(acq) + HPO42-(acq) Ka2= 6.2 10-8
HPO4- (acq)
H+(acq) + PO43-(acq)
Ka3= 4.4 10-13
Calcolo del pH di una soluzione di acido
soforico
H2SO4 (acq)
H+(acq) + HSO4-(acq)
Ka1 > 1
HSO4- (acq)
H+(acq) + SO42-(acq)
Ka2= 2 10-2
[H+]totali = [H+]1 + [H+]2
[ H + ]1 = Ca
2−
[ H + ]totale ⋅ [ SO4 ]
Ka2 =
[ HSO4− ]
Calcolo del pH di una soluzione di acido
soforico
HSO4-(acq)
Conc iniziale
Ca
Conc prodotti
Conc equ.
Ca-x
H+(acq) + SO42-(acq)
-
-
Ca+x
x
Ca+x
x
Ca + [ x ] ⋅ [ x ]
Ka 2 =
Ca − [ x ]
x = [H
+
]2
Si fa notare che il valore di x corrisponde anche alla [SO42-]
Calcolo del pH di un acido poliprotico
HS-(acq)
Conc iniziale Ca
-7
H+(acq) + HS-(acq) Ka1 >1 10
-13
H+(acq) + S2-(acq) Ka2= 1,2 10
-
Conc prodotti
x
x
x
x
H2S (acq)
Conc equ.
Ca-x
[ x] ⋅ [ x]
Ka1⋅ =
Ca
[ x ]2
Ka 1 =
Ca
[x] =
Ka 1 Ca
Calcolo di tutte le specie in soluzione
-7
H+(acq) + HS-(acq) Ka1 >1 10
-13
H+(acq) + S2-(acq) Ka2= 1,2 10
H2S (acq)
HS-(acq)
[H2S], [HS-], [S2-]??????
[H + ] =
Ka 1 Ca
+
−
[H
] = [ HS
Poiché dato il valore di Ka2 si considera
trascurabile la dissociazione di HS- al secondo
stadio
]
[ H2 S ] = Ca − [ H + ] = Ca − [ HS− ]
Ka 2 − [ HS
[ S 2− ] =
[H + ]
−
]
[S
2−
] = Ka 2
Calcolo del pH di miscele di acidi
Data una soluzione formata da due acidi forti, la [H+] totale è
data dalla somma delle concentrazioni di H+ dei due acidi
[H+]totale = Ca1+Ca2
Data una soluzione formata da un acido debole ed un acido forte
con Ca> 10-6 moli/l, la [H+] totale è pari a quella dell’acido forte.
HCl (acq)
HA(acq)
H+(acq) + A-(acq)
H+(acq) + OH- (acq)
Calcolo del pH di miscele di acidi
Una soluzione formata da due acidi deboli, se la differenza di Ka
è molto alta si tratta come se fosse una soluzione di acido forte e
acido debole e la [H+] è data dall’ acido avente il valore di Ka
più alta.
In una soluzione formata da due acidi deboli, a forza
paragonabile, per il calcolo degli [H+] si procede al trattamento
di equilibri multipli.