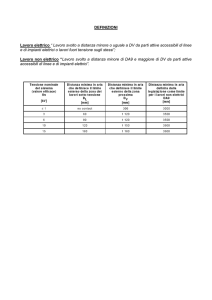
DIFFUSIONE ALLO STATO
SOLIDO
Ia legge di Fick: relazione più semplice tra causa ed
effetto.
L’effetto è proporzionale alla causa che lo ha
generato; matematicamente:
∂C A
J = −D
∂z
La costante di proporzionalità D è detta diffusività o
coefficiente di diffusione; contiene la dipendenza dalla
temperatura del fenomeno
Il fenomeno è assunto monodimensionale (z)
Il segno “ – ” per avere J > 0
08/06/2007
Chimica e Scienza e Tecnologia dei Materiali Elettrici – L12
1
DIFFUSIONE NON STAZIONARIA
IIa legge di Fick: descrizione quantitativa
dei fenomeni non stazionari (variabili nel
tempo).
Bilancio di massa sull’ elemento di volume:
IN – OUT + GEN = ACC
IN = J1S OUT = J2S GEN = 0
ACC = d(CAV)/dt
d (VC A )
;V = Sdz e quindi :
J ( z ) S − J ( z + dz ) S =
dt
∂J dC A
J ( z + dz ) − J ( z ) dC A
−
=
⇒−
=
∂z
dz
dt
dt
08/06/2007
Chimica e Scienza e Tecnologia dei Materiali Elettrici – L12
2
DIFFUSIONE NON STAZIONARIA
∂C A
∂
∂C A ∂C A
J = −D
⇒ − − D
=
∂z
∂z
∂z ∂t
Per D indipendente da C (e quindi da z) si ha:
∂C A
∂ 2C A
=D
∂t
∂z 2
Equazione differenziale alle derivate parziali
Condizioni iniziali e al contorno per la risoluzione
(sorgente infinita):
x = 0, ∀ t ≥ 0 ⇒ CA (x,t) = Cs
t = 0, ∀ x > 0 ⇒ CA (x,t) = C0
08/06/2007
Chimica e Scienza e Tecnologia dei Materiali Elettrici – L12
3
DIFFUSIONE NON STAZIONARIA
Per risolvere è utile il cambio di variabile:
w=
z
2 Dt
Dt = lunghezza caratteris tica di diffusione
La soluzione è la seguente (piastra semi-infinita):
C A ( z, t ) − C0
= 1 − erf ( w )
CS − C0
erf(w) è una funzione tabellata (funzione degli errori),
crescente a valori tra 0 e 1.
2 w −t 2
erf ( w) =
e dt
∫
0
π
08/06/2007
Chimica e Scienza e Tecnologia dei Materiali Elettrici – L12
4
TABELLA di erf(w)
Profili di concentrazione
a tempi variabili
c
Cs
C0
08/06/2007
Chimica e Scienza e Tecnologia dei Materiali Elettrici – L12
z
5
EFFETTO DELLA TEMPERATURA
SULLA DIFFUSIONE
Dipendenza di D con la
temperatura: relazione di tipo
Arrenhius
Q
D = D0 exp −
RT
Linearizzazione del modello:
Q1
ln D = ln D0 −
RT
Modello a due parametri D0, Q
08/06/2007
Chimica e Scienza e Tecnologia dei Materiali Elettrici – L12
6
COEFFICIENTE DI DIFFUSIONE
PER DIVERSI SISTEMI
D in funzione di T per vari droganti
nel silicio
08/06/2007
Chimica e Scienza e Tecnologia dei Materiali Elettrici – L12
7
ALCUNE APPLICAZIONI DELLA
DIFFUSIONE
Drogaggio dei semiconduttori: operazione
fondamentale nella produzione dei dispositivi
elettronici, volta ad ottenere semiconduttori
estrinseci:
Diffusione con sorgente infinita;
Diffusione con sorgente finita
Cementazione degli acciai.
08/06/2007
Chimica e Scienza e Tecnologia dei Materiali Elettrici – L12
8
CONDUCIBILITÀ IONICA
Diffusione di particelle cariche trasporto di carica
Difetti puntuali (vacanze) sono indispensabili
Assenza di campo elettrico
movimento casuale
delle vacanze: non c’è
carica netta trasportata
In presenza di campo
elettrico le vacanze si
muoveranno in relazione
alla direzione del campo
applicato: c’è una
conduzione ionica
08/06/2007
Chimica e Scienza e Tecnologia dei Materiali Elettrici – L12
9
CONDUCIBILITÀ IONICA
Movimento nel reticolo attivato termicamente
(barriera energetica da superare);
σ
nZ 2 e 2
=
D
kT
Relazione tra σ e D
(Nernst-Einstein)
σ0
Ea
σ = exp −
T
kT
08/06/2007
Chimica e Scienza e Tecnologia dei Materiali Elettrici – L12
10
CONDUCIBILITÀ IONICA
σ =
∑ n (Ze )µ
σ = conducibilità elettrica (Ω–1m–1)
n = concentrazione dei portatori di carica (m–3)
Z = carica dello ione
e = carica elementare (dell’elettrone) (1.6x10–19
coul)
µ = mobilità dello ione (velocità di
deriva/campo elettrico applicato) (m2V–1s–1)
08/06/2007
E
µ ∝ exp − a
RT
Chimica e Scienza e Tecnologia dei Materiali Elettrici – L12
11
CONDUCIBILITÀ IONICA
Fattori importanti nella conduzione ionica:
Struttura cristallina (presenza di cammini preferenziali)
Dimensione degli ioni (ioni più grandi sono ostacolati
nella mobilità a causa delle interazione degli elettroni
più esterni)
Carica degli ioni (ioni a carica più elevata polarizzano
ioni di carica opposta innalzando la barriera energetica)
08/06/2007
Chimica e Scienza e Tecnologia dei Materiali Elettrici – L12
12
CONDUCIBILITÀ IONICA
Comportamenti
anomali
Ea
ln σ T = ln σ 0 −
kT
Molto spesso è diagrammato
il ln(σ) al posto di ln(σT)
perché c’è poca differenza
08/06/2007
Chimica e Scienza e Tecnologia dei Materiali Elettrici – L12
13
DIAGRAMMA DI NaCl
∆H f E a
pendenza
+
k
2k
Comportamento intrinseco ed
Intrinseco
estrinseco
Intrinseco: trascurabile effetto di difetti
legati a impurezze (n non costante);
Estrinseco: comportamento governato
dalle impurezze (n costante).
∆H f
(Ze )µ
σ = N exp −
2kT
1 ∆H f Ea
σ0
+
σ = exp −
T
k
T 2k
∆H f Ea 1
ln σT = ln σ 0 −
+
k T
2k
NaCl
Estrinseco
E
pendenza a
k
pendenza
08/06/2007
Chimica e Scienza e Tecnologia dei Materiali Elettrici – L12
14
ANOMALIA DI AgI (FAST-ION
CONDUCTORS)
α-AgI conducibilità 104 maggiore di β-AgI;
Come è possibile: polimorfismo tra le forme
β e α.
La forma α ha una struttura cristallina
particolare che rende agevole la mobilità dei
cationi Ag+.
08/06/2007
Chimica e Scienza e Tecnologia dei Materiali Elettrici – L12
15
CONDUCIBILITÀ IONICA
Grande interesse nelle celle elettrochimiche
con elettroliti solidi:
Batterie allo stato solido;
Celle a combustibili ad ossidi;
Sensori di gas (sonda lambda).
08/06/2007
Chimica e Scienza e Tecnologia dei Materiali Elettrici – L12
16
CONDUCIBILITÀ IONICA
Celle a combustibile a ossidi (SOFC)
ZrO2-Y2O3 (8 % mol)
08/06/2007
Chimica e Scienza e Tecnologia dei Materiali Elettrici – L12
17
CONDUCIBILITÀ IONICA
Struttura della zirconia drogata con yttria
ZrO2-Y2O3 (8 % mol)
Zr+4,Y+3
Formula chimica?
O–2
Struttura cubica della fluorite
Soluzione solida sostituzionale in
cui Y+3 sostituisce Zr+4
Come si bilancia questo deficit di
carica positiva?
Cationi più grandi stabilizzano la
forma cubica
Y+3 = 0.106 nm, Zr+4 = 0.087 nm
08/06/2007
Chimica e Scienza e Tecnologia dei Materiali Elettrici – L12
18
CONDUCIBILITÀ IONICA
Caratteristiche dei vari materiali:
Elettrolita:
Non poroso
Conducibilità ionica molto elevata
Conducibilità elettronica molto bassa
Elettrodi:
Alta conducibilità elettronica
Stabilità chimica
Sufficientemente poroso per agevolare il flusso dei gas
08/06/2007
Chimica e Scienza e Tecnologia dei Materiali Elettrici – L12
19
CONDUCIBILITÀ IONICA
Catodo : O2 ( p ' ) + 4e − → 2O −2
Sensore di ossigeno
Anodo : 2O − 2 → O2 ( p" ) + 4e −
Globale : O2 ( p' ) → O2 ( p" )
Nernst :
p’
p”
0.0591
p" 0.0591
p'
log =
log
p'
4
4
p"
p" è una p di riferimento (esempio 0.21 atm)
E = E° −
E=
0.0591
p'
log
; per T variabile :
pRif
4
E=
RT ln 10
p'
log
4F
p Rif
Da V si ricava p’
08/06/2007
Chimica e Scienza e Tecnologia dei Materiali Elettrici – L12
20
COMPORTAMENTO ELETTRICO
DEI MATERIALI
Classificazione tradizionale dei materiali
ingegneristici dal punto di vista del
comportamento elettrico:
08/06/2007
conduttori;
semiconduttori;
isolanti.
Chimica e Scienza e Tecnologia dei Materiali Elettrici – L12
21
COMPORTAMENTO ELETTRICO
DEI MATERIALI
La classificazione è fatta in base ai valori della
proprietà intrinseca conducibilità elettrica (σ) o
del suo inverso resistività elettrica (ρ).
Valori indicativi per la classificazione:
08/06/2007
Conduttori ↔ alta σ e bassa ρ ↔ ρ ≈ 1.6x10−8 ÷
1.4x10−6 Ωm
Isolanti ↔ bassa σ e alta ρ ↔ ρ ≈ 107 ÷ 1018 Ωm
Semiconduttori ↔ valori intermedi di σ e ρ
Chimica e Scienza e Tecnologia dei Materiali Elettrici – L12
22
CONDUCIBILITÀ ELETTRICA DI ALCUNI
MATERIALI A 300 K (Ω−1m−1)
Argento
Rame
6.3x107
6x107
Ferro
Grafite (C)
Germanio
Silicio
Vetro
Diamante
Polietilene
1.0x107
3x104
2.2
4x10–4
10–10
10–14
10–15
08/06/2007
Chimica e Scienza e Tecnologia dei Materiali Elettrici – L12
23
DIAGRAMMI A BANDE
ENERGETICHE
Le bande sono discrete ma
la distanza tra due livelli è
piccolissima perché ci
sono ≈ 1024 livelli/cm3.
08/06/2007
Chimica e Scienza e Tecnologia dei Materiali Elettrici – L12
24
DIAGRAMMI A BANDE
ENERGETICHE
Le bande sono discrete ma
la distanza tra due livelli è
piccolissima perché ci
sono ≈ 1024 livelli/cm3.
08/06/2007
Chimica e Scienza e Tecnologia dei Materiali Elettrici – L12
25
DIAGRAMMI A BANDE ENERGETICHE
DEI MATERIALI: SITUAZIONE A 0 K
Si evidenzia un livello energetico molto importante
Ef: a 0 K non ci sono elettroni con energia
maggiore di Ef.
08/06/2007
Chimica e Scienza e Tecnologia dei Materiali Elettrici – L12
26