Chimica Organica II
Composti aromatici: quali sono?
• Formule di risonanza di Kekulè (no)
• Molto stabili ⇒ poco reattivi (non sempre)
• Reazioni di sostituzione elettrofilica (non sempre)
• Corrente di anello (NMR downfield shift, 6-9 ppm, sempre)
• 4n+2 elettroni in sistema π delocalizzato (sempre)
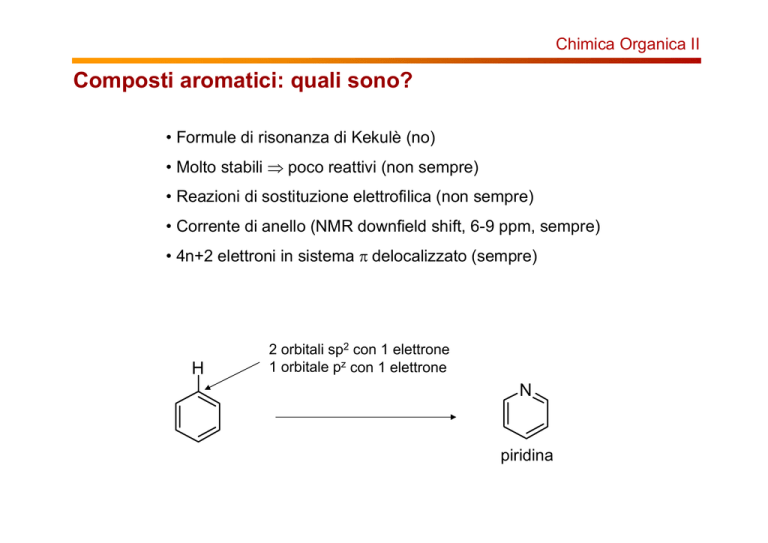
H
2 orbitali sp2 con 1 elettrone
1 orbitale pz con 1 elettrone
N
piridina
Chimica Organica II
Composti aromatici: quali sono?
N
N
N
H
S
S
H
N
Chimica Organica II
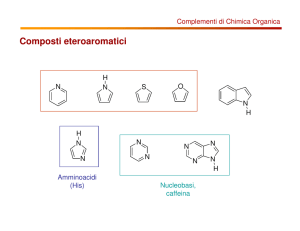
Composti eteroaromatici
H
N
N
S
O
N
H
H
N
N
Amminoacidi
(His)
N
N
N
N
N
Nucleobasi,
caffeina
N
H
Chimica Organica II
Piridina: struttura e proprietà
1
6
N
N
2
5
N
N
N
3
4
Energia di coniugazione: 134 KJ/mol
H
N
N
pKa = 5
Il doppietto non condiviso si trova su
un orbitale sp2, inoltre la solvatazione
del piridinio è poco efficiente: la
piridina è una base debole.
Chimica Organica II
Piridina: reazioni all’atomo di azoto
CH3
N
CH3I
N
Formazione di sali di
ammonio quaternari
O
N
H2O2
AcOH
N
PCl3
N
Formazione (reversibile)
di N-ossidi
Chimica Organica II
Piridina: reazioni all’anello aromatico
N
N
N
N
La presenza dell’atomo di azoto impoverisce la densità elettronica del
sistema aromatico: la piridina è disattivata verso le sostituzioni e subisce
la sostituzione preferenzialmente in posizione 3,5.
Molte reazioni di sostituzione avvengono in condizioni acide: la specie
reagente non è la piridina ma il catione piridino (ancora più disattivato)
Chimica Organica II
Piridina: reazioni all’anello aromatico
N
HNO3
N
H2SO4, 300° C
N
H2SO4, HgSO4
NO2
H
N
230° C
N
Br2, H2SO4
SO3
N
N
Basse rese
300° C
Br
Br
Br
La reazione di Friedl-Craft non avviene sulla piridina
Chimica Organica II
Piridina: reazioni all’anello aromatico
N
NaNH2
Cl
N
NH2
La piridina è simile al nitrotoluene: SNAr
toluene,
110 °C
NH2
N
OCH 3
N
N
N
H
N
N
N
Chimica Organica II
Piridina: reazioni all’anello aromatico
O
N
O
N
O
N
O
N
…
La piridina N-ossido è più attiva rispetto alla piridina (non rispetto al benzene). La
sostituzione avviene preferenzialmente in posizione 2,4,6.
O
N
HNO3 fumante
O
N
PCl3
N
H2SO4, 90° C
NO2
NO2
Chimica Organica II
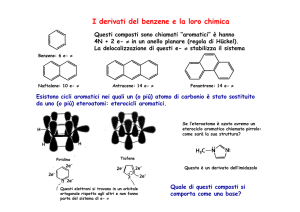
Eterocicli aromatici a 5 atomi: struttura e proprietà
1
X
5
4
X
2
α
X
…
3
β
1 formula di risonanza Kekulè, 4 a separazione di carica
H
N
Pirrolo
89 KJ/mol
Furano
66 KJ/mol
Tiofene
120 KJ/mol
O
S
Chimica Organica II
Eterocicli aromatici a 5 atomi: reattività
X
X
X
…
La presenza dell’eteroatomo aumenta la la densità elettronica del sistema
aromatico: gli eterocicli aromatici a 5 atomo sono attivati verso le
sostituzioni.
La sostituzione avviene preferenzialmente in posizione a: intermedio arenio
di questo cammino di reazione è più stabile.
Chimica Organica II
Pirrolo: proprietà e reattività
Il doppietto elettronico non condiviso fa parte del sistema aromatico: il pirrolo è
base debolissima.
L’azoto sp2 è più elettronegatico e l’anione è stabilizzato per risonanza: il pirrolo è
acidio debolissimo.
H
N
H pKa = 0.4
H
H
N
pKa = 16.5
N
CH3I
prodotti di polimerizzazione
CH3
N
Chimica Organica II
Pirrolo: reattività
Il pirrolo è molto più reattivo del benzene. Non si possono usare acidi forti o acidi
di Lewis.
H
N
H
N
SO3
CH3CO2NO2
H
N
H
N
NO2
SO3
Piridina
H
N
I2
H
N
I
I
KI
I
H
N
(CH3CO)2O
H
N
COCH3
I
Chimica Organica II
Porfirine
L
NH
Mn+
N
N
N
N
N
M
N
N
M
N
HN
N
N
L
porfina
COOH
HOOC
● Trasporto ossigeno
N
eme
N
● Ossidazione (citocromi)
Fe
N
● Fotosintesi
N
● Decomposizione H2O2 (catalasi)
Chimica Organica II
Porfirine
H
N
CHO
BF3
NH HN
DDQ
NH HN
● Catalizzatori di reazioni di ossidazione
● Recettori supramolecolari
● Coloranti e fluorofori
NH
N
N
HN
Chimica Organica II
Furano: proprietà e reattività
Il furano è molto più reattivo del benzene. Non si possono usare acidi forti o acidi
di Lewis. Si osservano facilmente prodotti di addizione
O
CH3CO2NO2
O
SO3
H3CCO2
O
O
SO3
O
COCH3
Piridina
O
(CH3CO)2O
BF3
NO2 Piridina
O
NO2
Chimica Organica II
Tiofene: proprietà e reattività
Il tiofene è molto più del benzene. Più stabile agli acidi di pirrolo e furano ma
polimerizza con acidi fortissimi e AlCl3.
S
CH3CO2NO2
S
NO2
SO3
S
S
SO3
Piridina
O
N Br
S
S
O
S
Br
(CH3CO)2O
SnCl4
S
COCH3
Chimica Organica II
Politiofeni: polimeri coniugati
S
e-
S
S
FeCl3
S
S
S
● Organic Light Emitting Diodes (OLED)
● Plastic Solar Cells
● Organic Field Effect Transistors