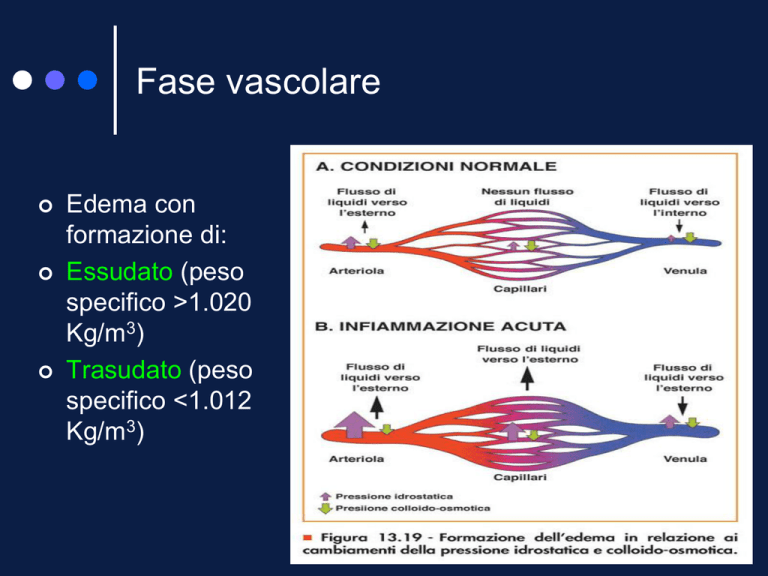
Fase vascolare
Edema con
formazione di:
Essudato (peso
specifico >1.020
Kg/m3)
Trasudato (peso
specifico <1.012
Kg/m3)
Fase cellulare
Cellule dell’immunità innata con attività fagocitaria (neutrofili, monociti-macrofagi)
ma anche linfociti, cellule NK e numerosi fattori solubili (citochine e chemochine).
Le cellule (monociti-macrofagi, PMN, cell. dendritiche) presentano recettori per il
riconoscimento di costituenti generici dei patogeni o dei tessuti danneggiati:
Recettori solubili – includono numerose molecole note anche come proteine
di fase acuta (Fattori del complemento (C3), collectine, pentrassine).
Recettori di membrana – in grado di riconoscere diverse componenti presenti
in differenti patogeni (C-type lectin receptors (CLR), Toll-like receptors (TLR),
recettori spazzino (scavenger)).
Recettori citoplasmatici - proteine presenti nel citoplasma dove sono in
grado di riconoscere costituenti endogeni o esogeni espressione di danno
cellulare (NOD-like e RIG-like receptors).
Il meccanismo di risposta porta all’attivazione di fattori trascrizionali (es. NF-kB)
che attivano geni che codificano per numerose citochine e chemochine e
modificano l’attività cellulare (fagocitosi, presentazione antigene).
Toll-like receptors (TLR)
Conservati nel corso dell’evoluzione
(inizialmente identificati in Drosophila).
Proteine transmembrana (10 identificate
nell’uomo)
Regione extracellulare LRR (leucinrich region) che è in grado di
riconoscere costituenti dei patogeni.
Dominio
intracellulare TIR (TollInterlelin-1 receptor) che attiva la
cascata di trasduzione del segnale
Sono localizzati alla membrana o
associati
a
vescicole
intracellulari
(endosomi).
Sono presenti come omo- o eterodimeri
Migrazione leucocitaria
I leucociti presenti nel sangue e coinvolti nella risposta infiammatoria passano
attraverso la parete dei vasi (extravasazione, principalmente a livello delle venule
post-capillari) e migrano nel tessuti raggiungendo la sede del danno
(chemiotassi).
Modificazioni a carico del flusso ematico e degli endoteliociti che costituiscono la
parete dei vasi (attivazione dell’endotelio) regolano il processo.
Marginazione
Rotolamento (Rolling)
Adesione
Il processo è regolato da molecole di adesione espresse sulla superficie
dell’endotelio e sui leucociti e da numerosi fattri solubili (citochine e chemochine).
Selectine (L-, E- e P selectina)
Immonoglobuline (ICAM-1, ICAM-2, PECAM-1)
Integrine (eterodimeri formati da 11 catene a e 6 catene b differentemente
combinate)
L’espressione di questi segnali di superficie è up-regolata dall’azione di
specifiche citochine (in particolare TNF e IL-1) e di fattori chemiotattici.
Mediatori solubili dell’infiammazione (1)
Molti fattori solubili regolano ed amplificano la risposta infiammatoria.
Mediatori plasmatici – sist. del complemento, sist. delle chinine e fattori
della coagulazione e fibrinolitici.
Mediatori preformati –
già sintetizzati ed accumulati in granuli
(istamina).
Mediatorila sintesi è attivata dallo stimolo infiammatorio;
Mediatori neosintetizzati –
la cui sintesi è attivata dallo stimolo
infiammatorio (prodotti di derivazione lipidica, citochine e chemochine
di natura proteica).
Amine vasoattive
L’istamina interviene solo inizialmente nella vasodilatazione. Essa è
sintetizzata dai granulociti basofili del sangue e dai mastociti che la
immagazzinano in granuli citoplasmatici da dove è liberata a seguito dello
stimolo flogistico (degranulazione dei mastociti).
Causa vasodilatazione delle arteriole ed aumenta la permeabilità delle
venule
E’ un importante mediatore nei fenomeni allergici.
Mediatori solubili dell’infiammazione (2)
Metaboliti dell’acido arachidonico
L’ac. arachidonico è presente nei fosfolipidi delle membrane cellulari
dei mammiferi. Esso è liberato dall’azione di una fosfolipasi e nel
citoplasma è metabolizzato da due distinti sistemi enzimatici
microsomiali:
(COX) – da cui derivano le prostaglandine (PGI2,
PGD2, PGE2, PGF2) ed il trombossano A2 (TXA2)
Ciclossigenasi
Lipossigenasi
– da cui derivano i leucotrieni (LTB4, LCT4, LTD4,
LTE4)
Queste vie sono attive in molti tipi cellulari e nel contesto del
processo infiammatorio interessano particolarmente macrofagi,
mastociti, e piastrine.
Mediatori solubili dell’infiammazione (3)
Chemochine
Le chemochine sono una classe di citochine rilasciate dalle cellule del focolaio
flogistico che svolgono un’azione di richiamo di altre cellule nella sede
dell’infiammazione (attività chemiotattica).
Sono piccole proteine basiche caratterizzate dalla presenza, in più
punti della molecola di 4 residui di cisteina che intervengono nella
formazione di ponti disolfuro.
Ne sono state identificate almeno una cinquantina.
Citochine
Le citochine sono mediatori solubili che trasferiscono segnali di attivazione o
inibizione tra i diversi tipi cellulari coinvolti nei fenomeni di difesa e riparo.
Interleuchina-1 (IL-1) - una delle più studiate per i molteplici effetti nella
risposta immunitaria e infiammatoria .
Fattore di necrosi tumorale (TNF) – uno dei principali mediatori
dell’infiammazione acuta. Molte funzioni (recluta neutrofili e monocitimacrofagi nel sito d’infiammazione). Effetti dipendenti dalla
concentrazione sierica.
Cellule coinvolte nel processo
infiammatorio (1)
Le chemochine ed altri fattori chemiotattici richiamano nel focolaio infiammatorio
diversi tipi cellulari.
Le principali funzioni sono:
produrre citochine la cui azione modula l’andamento del processo
infiammatorio
eliminare gli agenti flogogeni attraverso la fagocitosi
porre il connessione risposta flogistica e risposta immunitaria
Tali cellule sono di norma quiescenti dal punto di vista funzionale e sono attivate da
costituenti microbici o da altre citochine. L’attivazione prevede la sintesi di:
recettori per le chemochine, così da riconoscere i segnali chemiotattici
recettori per molecole di adesione (marginazione dei neutrofili, interazione nel
focolaio flogistico con cellule e molecole della matrice connettivale)
enzimi inducibili (NOS e glicossigenasi)
citochine ed altri mediatori
recettori per le citochine
proteine coinvolte nell’apoptosi (morte programmata della cellula)
Cellule coinvolte nel processo
infiammatorio (2)
Mastociti
Cellule di forma tondeggiante presenti nel connettivo di molti organi con
citoplasma ricco di numerosi granuli. Sono attivati da specifici ligandi per i
quali presentano recettori di superficie:
anafilotossine (C3a, e C5b)
Allergeni (che interagiscono con le IgE fissate a specifici recettori)
L’attivazione comporta la degranulazione dei mastociti.
Granulociti neutrofili
Sono richiamati nel focolaio infiammatorio da fattori chemiotattici (inf. da
microrganismi) e attivamente migrano dal sangue nei tessuti (diapedesi).
Partecipano all’infiammazione con la produzione di mediatori chimici e la
fagocitosi dei microrganismi, direttamente o dopo opsonizzazione.
Cellule coinvolte nel processo
infiammatorio (3)
Monociti/Macrofagi
Sono attivati da diverse citochine (in particolare IFN-g). Nel focolaio
infiammatorio esplicano diverse funzioni:
inglobano sostanze estranee e microrganismi (fagocitosi)
presentano l’antigene a linfociti T CD4+
sintetizzano e secernono diverse citochine
intervengono nella cronicizzazione del processo infiammatorio
Cellule Natural Killer (NK)
Intervengono direttamente uccidendo i microrganismi e le cellule infettate
da virus.
Piastrine
Sono cellule prive di nucleo che si formano dai megacariociti. Sono
presenti nel focolaio flogistico se sono presenti gravi lesioni della parete
dei capillari ed intervengono producendo mediatori chimici come i derivati
dell’ac. arachidonico.
Cellule coinvolte nel processo
infiammatorio (4)
Linfociti
Sono sempre presenti nel focolaio flogistico specie in presenza di
un’infiammazione cronica. Intervengo più tardivamente ed il loro ruolo è
connesso all’attivazione del sistema immune. Sono tra i principali produttori
di citochine.
Endoteliociti
Formano la parete dei capillari e mediano gli interscambi tra sangue e
focolaio infiammatorio. Presentano numerosi recettori per molteplici
citochine alla cui azione rispondono attivamente (attivazione dell’endotelio)
determinando:
Aumento del diametro del vaso (iperemia)
Aumento della permeabilità capillare
Espressione di molecole di adesione (marginazione e diapedesi)
Fibroblasti
Fisiologicamente presenti nel connettivo hanno un ruolo principalmente nel
processo riparativo che risolve l’infiammazione.
Formazione dell’essudato
La formazione dell’essudato (edema infiammatorio), cioè il passaggio della
componente liquida del plasma dal compartimento vasale a quello
interstiziale, dipende da:
Aumentata permeabilità capillare
Aumentata pressione idrostatica
Aumentata concentrazione di proteine nel compartimento interstiziale
Ridotto drenaggio del sistema linfatico
Caratteristiche dell’essudato sono:
pH acido (presenza di ac. lattico)
proteine derivate dal plasma e sostanze liberate dalle cellule lesionate
mucopolissaccaridi acidi del connettivo
La componente cellulare varia a seconda del tipo di essudato con
prevalenza di cellule della serie bianca del sangue quali i polimorfonucleati.
Il ruolo dell’essudato è per lo più protettivo, in quanto favorisce il contatto
di mediatori e cellule del sist. Immune con il patogeno.
Fagocitosi (1)
La fagocitosi ha sicuramente un ruolo molto importante nell’infiammazione. Le
cellule munite di questa funzione si distinguono in:
Professionali – cellule per le quali l’attività fagocitaria è
funzione preminente (neutrofili, eosinofili, monociti-macrofagi).
Fagociti Facoltativi – cellule per le quali la fagocitosi è funzione
marginale (fibroblasti, mastociti, endoteliociti ecc.).
Fagociti
I fagociti professionali sono richiamati nel focolaio infiammatorio da
chemochine e fattori chemiotattici. Qui vengono in contatto con il materiale
estraneo (corpo estraneo, microrganismo, detriti cellulari), su cui agiscono
secondo il seguente schema:
ed internalizzazione mediante l’emissione di pseudopodi e
formazione del fagosoma
Fusione del fagosoma con il lisosomi e formazione del fagolisosoma
Digestione del materiale fagocitato ad opera degli enz. lisosomiali
Esocitosi dei residui del materiale digerito.
Adesione
Fagocitosi (2)
Alcune specie microbiche ed
agenti
flogogeni
possono
resistere all’azione degli enzimi
digestivi restando trattenuti nel
citoplasma dei fagociti. Questa
condizione
nei
macrofagi
innesca
la
cronicizzazione
dell’infiammazione.
L’opsonizzazione facilita la
fagocitosi (le cellule presentano
recettori per il frammento Fc
degli Ab e per C3b).
E’ da ricordare inoltre il ruolo
che i fagociti hanno come
cellule
APC
(Antigen
Presenting Cells).
Enzimi lisosomiali
Sono contenuti in forma inattiva nei lisosomi (granuli) delle cellule con
attività fagocitaria (granulociti neutrofili, monociti/macrofagi) e possono
essere liberati nel focolaio infiammatorio.
I granulociti neutrofili contengono tre tipi di granuli:
Primari (azzurrofili) – contengono idrolasi acide.
Secondari o specifici – contengono collagenasi e proteine basiche
(lisozima e lattoferrina).
Terziari o particelle C – contengono catepsine e gelatinasi.
Con la fagocitosi gli enzimi idrolitici dei granuli sono liberati nel
fagolisosoma e concorrono alla digestione dei costituenti batterici e di altri
materiali.
Quando riversati all’esterno degradano un ampio spettro di substrati
biologici , tra cui i componenti del tessuto connettivo, contribuendo
all’evoluzione del processo infiammatorio.
Ossido nitrico (NO)
E’ prodotto da diversi citotipi a partire
dall’aminoacido arginina e per azione dell’enzima
nitrico sintasi (NOS) di cui si conoscono tre
forme:
Costitutiva (cNOS)
Inducibile (iNOS)
Cerebrale (nNOS)
L’attività di NOS aumenta rapidamente dopo
attivazione di specifici recettori sulla superficie
degli endoteliociti da parte di mediatori della
flogosi.
Gli effetti del NO si manifestano in vicinanza del
punto di rilascio (gas diffusibile), determinando:
rilascio della muscolatura liscia della parete
delle venule
inibizione di alcune funzioni piastriniche
(aggregazione e vasocostrizione)
la lisi di alcuni microrganismi per azione
delle cellule fagocitarie.
Esito dell’infiammazione acuta
L’infiammazione acuta dinamicamente evolve con tre possibili esiti:
Necrosi – L’azione dei leucociti, con liberazione di enzimi lisosomiali
distrugge non solo i microrganismi ma anche cellule circostanti i cui
costituenti, liberati all’esterno, sono fagocitati. Se questo essudato
purulento si raccoglie in cavità si forma l’ascesso. Se esso riesce ad
aprirsi un varco verso l’esterno si forma una fistola.
Cronicizzazione – quando la reazione flogistica non elimina del tutto
l’agente flogogeno.
Guarigione – L’essudato è riassorbito e si innescano processi
riparativi del tutto identici a quelli descritti in precedenza.
Riparazione del danno ai tessuti
Il processo di riparazione del danno tissutale avviene sostanzialmente
sempre con le stesse modalità, con differenze dipendenti dal tipo di
tessuto e cellule coinvolte.
Complicanze del processo
riparativo
Infezioni – La ferita crea una facile via
di accesso per i microrganismi: cocchi,
clostridi sotto forma di spore (tetano e
gangrena gassosa).
Deiescenza – Rottura delle ferite in
corso di guarigione (particolarmente
quelle addominali in soggetti debilitati
o in condizioni di sforzo).
Formazione del cheloide – formazione
di una cicatrice esuberante per un
eccesso
di
tessuto
connettivo
neoformato,
probabilmente
in
relazione con una iperproduzione di
fattori di crescita per i fibroblasti.
Infiammazione cronica (istoflogosi)
L’infiammazione cronica è un processo di lunga durata in cui i fenomeni di
attiva infiammazione, distruzione tissutale, risposta immunitaria e riparo
coesistono.
La cronicizzazione può insorgere come evoluzione dell’infiammazione
acuta (mancata eliminazione dell’agente flogogeno) o ex novo
(infiammazione cronica primaria) come espressione di fenomeni
infiammatori a lenta evoluzione.
In essa si osserva:
progressiva riduzione dei fenomeni vasculo-ematici.
sostituzione dei polimorfonucleati con un infiltrato cellulare costituito
prevalentemente da macrofagi, linfociti (B e T), plasmacellule e cellule
NK.
proliferazione dei fibroblasti con eccessiva produzione di tessuto
connettivo (fibrosi o sclerosi).
Le infiammazioni croniche si distinguono in non granulomatose e
granulomatose entrambe caratterizzate da leucocitosi linfomonocitaria.
Infiammazioni cronica di tipo
granulomatoso (1)
E’ un tipo particolare d’infiammazione cronica in cui l’agente lesivo non
provoca un danno esteso ma localizzato.
La formazione di un granuloma si osserva quando microrganismi, prodotti di
questi, o materiali di varia natura (organica e inorganica) permangono indigeriti
nei fagolisosomi dei macrofagi.
L’infiltrato cellulare è caratterizzato dal prevalere dei macrofagi che formano
strutture tondeggianti (granulomi).
L’analisi istologica dei granuli evidenzia una struttura circolare con al centro:
una cellula multinucleata formatasi dalla fusione dei macrofagi.
Macrofagi periferici che assumono un aspetto epitelioide (cellule
epitelioidi)
strato più periferico di linfociti e/o fibroblasti
Si possono osservare deviazioni da questo schema generale dipendenti dalla
natura dell’agente flogogeno.
L’assenza di vascolarizzazione del granuloma e la liberazione di sostanze
tossiche da parte di microrganismi inglobati nel granuloma sono responsabili
della necrosi verso cui evolvono la maggior parte dei granulomi.
Infiammazioni cronica di tipo
granulomatoso (2)
E’ un tipo particolare d’infiammazione cronica in cui l’agente lesivo non provoca un
danno esteso ma In base all’eziologia si distinguono:
Granulomi non immunologici da corpo estraneo – il ricambio di cellule che
partecipano alla formazione del granuloma è molto lento
Granulomi di tipo immunologico o da ipersensibilità – provocati da agenti forniti
di potere antigenico capaci di suscitare reazioni di ipersensibilità (sono a
rapido ricambio cellulare).
Manifestazioni sistemiche
dell’infiammazione (1)
L’infiammazione è un processo prevalentemente localizzato, tuttavia
manifestazioni sistemiche sono connesse all’azione che alcune citochine,
attraverso il sangue, possono avere su cellule di organi anche distanti dal
focolaio infiammatorio.
Manifestazioni sistemiche sono:
La leucocitosi
La febbre
La risposta di fase acuta
Leucocitosi
Aumento del numero dei leucociti del sangue (4000-10000/mm3). Esso
interessa diversi leucociti a seconda della natura dell’agente eziologico:
Neutrofili nella maggior parte dei casi (neutrofilia)
Eosinofili nelle flogosi allergiche o da parassiti
Monociti e linfociti in alcune infezioni croniche ed in convalescenza
(monocitosi e linfocitosi)
In genere la leucocitosi neutrofila caratterizza l’infiammazione acuta e la
leucocitosi linfomonocitaria l’infiammazione cronica.
Manifestazioni sistemiche
dell’infiammazione (2)
La Febbre
E’ una forma di ipertermia dovuta ad una alterazione funzionale
temporanea dei neuroni dei centri termoregolatori ipotalamici dipendente
dall’azione di alcune citochine sintetizzate e rilasciate in eccesso da
numerose cellule dell’organismo. Si ha uno spostamento verso l’alto del
punto di equilibrio tra processi di termogenesi e termodispersione
(normalmente a 37°C).
Numerose sono le sostanze ad effetto pirogeno. Si distinguono:
Pirogeni esogeni – alcune endotossine e costituenti batterici
Pirogeni endogeni – un gran numero di citochine.
Patogenesi della Febbre
Le citochine pirogene possono o attraversare la barriera emato-encefalica
o stimolare le cellule endoteliali di questa a produrre citochine che non
agiscono direttamente sui neuroni dei centri termoregolatori ipotalamici ma
inducono altre cellule a produrre PGE2 che agisce sui neuroni ipotalamici.
Recettori per il PGE2 inducono l’attivazione dell’adenilciclasi per la sintesi
di cAMP che inibisce i neuroni ipotalamici, proporzionalmente alla quota di
pirogeni circolanti. L’inibizione sposta verso l’alto il punto di equilibrio della
termoregolazione.
I farmaci antipiretici agiscono sulla glicossigenasi bloccando la sintesi di
PGE2.
La risposta di fase acuta
L’infiammazione determina un cambiamento anche nel contenuto
proteico (aumentato) del plasma.
Questo cambiamento si manifesta molto precocemente e si parla
quindi di proteine di fase acuta. La sintesi ha luogo negli epatociti
del fegato che sono stimolati a produrre tali proteine da diverse
citochine (IL-1, TNF-a, IL-6). Un aumento della VES è associato in
questi casi all’aumentata quota di proteine plasmatiche.
I Tumori
I tumori (neoplasie) sono costituiti da un insieme di cellule somatiche originatesi
solitamente da un’unica cellula in cui, l’accumulo sequenziale di alterazioni
genomiche (mutazioni), ha determinato importanti cambiamenti:
autonomia moltiplicativa – incapacità a sottostare ai meccanismi preposti al
controllo della proliferazione cellulare;
riduzione o perdita della capacità differenziativa;
perdita della capacità di andare incontro a morte cellulare programmata
(apoptosi).
Tutti i citotipi possono andare incontro a trasformazione neoplastica sviluppando
molti tipi diversi di tumori, che tuttavia rispondono a questo schema generale.
Gli agenti eziologici dei tumori umani possono essere molteplici e di varia natura
(chimica, fisica, biologica) e spesso più fattori concorrono a creare le condizioni per
lo sviluppo di una neoplasia. Fattori esogeni possono talora aggiungersi a cause
endogene (es. mutazioni trasmesse dai genitori) che creano una maggiore
predisposizione allo sviluppo del tumore.
I tumori vengono solitamente distinti in due grossi gruppi:
Tumori Benigni
Tumori Maligni
Circa l’80% ha origine epiteliale, mentre il restante 20% ha origine mesenchimale.
Tumori benigni
Le cellule conservano un buon grado di
differenziazione
morfologica
e
funzionale, pur mostrando di non
rispondere ai meccanismi di controllo
della proliferazione cellulare.
Essi hanno uno sviluppo che non
prevede infiltrazione tra le cellule dei
tessuti circostanti. La massa tumorale si
espande ma risulta ben distinta e
distinguibile rispetto ai tessuti circostanti.
Talora una guaina fibrosa può delimitare
il tumore. Il danno è spesso correlato
alla compressione che la massa
tumorale può esercitare su tessuti ed
organi contigui. Nei tumori benigni di
ghiandole endocrine (adenomi) il danno
può risultare dalla iperproduzione
incontrollata di ormoni.
L’asportazione chirurgica è risolutiva e
non recidivante.
Tumori maligni
Le cellule sono tipicamente morfologicamente e
funzionalmente diverse dalle cellule del tessuto da cui
il tumore origina. Il grado di indifferenziazione è tanto
più elevato quanto più il tumore è in uno stadio
avanzato. Le alterazioni morfologiche riguardano la
forma, gli organuli cellulari e soprattutto il nucleo.
Il tumore maligno tende ad infiltrare i tessuti limitrofi
(invasività neoplastica).
Le cellule tumorali possono raggiungere e penetrare
la parete endoteliale dei vasi passando nel sangue.
Trasportate dal sangue possono raggiungere altri
tessuti ed organi dove attecchiscono e sviluppano il
tumore (metastasi).
La metastatizzazione rappresenta lo stadio più
avanzato di evoluzione di un tumore maligno.
La tendenza ad infiltrare i tessuti circostanti
(invasività) comporta la comparsa di recidive dopo
asportazione chirurgica del tumore che non
garantisce la totale eliminazione delle cellule tumorali.
Nomenclatura e classificazione dei
tumori (1)
Nella classificazione e nomenclatura dei tumori un parametro che viene valutato è
l’analisi istologica che tende ad identificare il tessuto di origine della neoplasia. Nei
tumori altamente indifferenziati può non essere possibile riconoscere i segni del
tessuto d’origine del tumore (tumori anaplastici).
Epiteli di rivestimento (cute e mucose)
Tumori benigni - si presentano con l’aspetto di protuberanze che emergono
dal tessuto (polipi e papillomi)
Tumori maligni – irregolari e scarsamente limitati rispetto al tessuto
circostante, spesso duri e con fenomeni emorragici e ulcerativi (epitelioma
basocellulare o basalioma; epitelioma spinocellulare).
Epitelio ghiandolare
Tumori benigni – sono detti adenomi e ripropongono in maniera
abbastanza fedele l’architettura della ghiandola da cui originano.
Tumori maligni – adenocarcinomi se sufficientemente differenziati così da
riprodurre la struttura ghiandolare e carcinomi nelle forme più
indifferenziate.
Tessuto connettivo
Tumori benigni - indicati dal suffisso oma.
Tumori maligni – indicati dal termine sarcoma.
Nomenclatura e classificazione dei
tumori (2)
Tessuto emolinfopoietico
I tumori che originano da cellule staminali emopoietiche del midollo osseo sono
definiti leucemie mentre quelli che sviluppano da linfociti maturi sono detti linfomi. La
classificazione è in continua evoluzione.
Nelle leucemie si riscontrano due caratteristiche principali:
abnorme proliferazione delle cellule staminali trasformate (neoplastiche)
blocco maturativo – le cellule non sono capaci di differenziare e quindi si
accumulano nel midollo o passano nel sangue come elementi immaturi
incapaci di svolgere la loro funzione.
Tessuto nervoso
Classificazione complessa che si basa sul tipo di cellule coinvolte, con tumori sia
benigni che maligni.
Gradazione e Stadiazione
La gradazione è la valutazione del grado di malignità del tumore in
funzione dell’ analisi del grado di differenziazione delle cellule
tumorali rilevabile dall’analisi anatomo-istopatologica del tessuto
tumorale. Utile ai fini prognostici e terapeutici è anche la valutazione
dello stadio di sviluppo della neoplasia (stadiazione) che viene oggi
effettuata secondo precisi schemi di classificazione dettati dall’OMS.
Il sistema di classificazione TNM tiene conto:
delle dimensioni del tumore primario (Tn)
dello stato dei linfonodi regionali (Nn)
dell’assenza o presenza di metastasi (Mn)
Quali sono i fattori
responsabili
dell’invasività delle
cellule neoplastiche?
Metastatizzazione (1)
La metastasi è espressione di una capacità di autotrapianto acquisita dalle cellule
neoplastiche. Esse sono cioè capaci di distaccarsi dal tumore primitivo e impiantarsi
in una sede diversa, dove danno origine ad un tumore secondario.
La metastatizzazione rappresenta un ulteriore evoluzione della malignità del tumore.
Come per altre caratteristiche descritte, anche la capacità di dare metastasi è
espressione dell’acquisizione di nuove caratteristiche fenotipiche da parte della
cellula neoplastica come prodotto di un ulteriore riarrangiamento del suo genoma
che si somma alle mutazioni preesistenti.
Perché la metastasi si realizzi è necessario che alcune cellule neoplastiche
acquisiscano il fenotipo metastatico, esse devono cioè essere in grado di:
distaccarsi dal tumore primario
Invadere tessuto connettivo, capillari sanguigni e linfatici
Sopravvivere nel sangue e nella linfa
Arrestarsi aderendo alle cellule endoteliali (espressione di specifiche molecole
di adesione quali le integrine)
Attraversare la parete endoteliale del vaso
Moltiplicarsi e invadere il tessuto colonizzato (espressione di molecole di
adesione specifiche di quel tessuto)
Produrre fattori angiogenetici che consentano la vascolarizzazione e quindi
l’accrescimento del tumore secondario.
Metastatizzazione (2)
L’espressione
di
specifiche
molecole
di
adesione
è
responsabile
dell’organotropismo delle metastasi, per cui un certo tipo di tumore metastatizza in
particolari tessuti ed organi ma non in altri.
Il trasporto delle cellule tumorali dalla sede di sviluppo del tumore primario alla
localizzazione metastatica avviene attraverso diverse vie:
Ematica – le cellule tumorali penetrano nel sangue attraverso la parete
endoteliale dei vasi e vengono rivestite dalla fibrina e da aggregati piastrinici.
Fenomeni coagulativi innescati dalle alterazioni dell’endotelio ne possono
favorire l’adesione
Linfatica – attraverso il sistema linfatico le cellule neoplastiche possono
raggiungere il linfonodi regionali o il sangue.
Transcelomatica – seguita dai tumori che si sviluppano in organi contenuti
nelle cavità celomatiche
Canalicolare – per i tumori di ghiandole dotate di dotti escretori per cui la
metastatizzazione può avere luogo in organi e tessuti serviti da queste.
Genetica dei Tumori
Studi sulla relazione età – tumore hanno evidenziato che sarebbero
necessarie una media di sei o sette mutazioni successive per convertire
una cellula normale in un carcinoma invasivo. La probabilità che ciò
accada è trascurabile, tuttavia esistono due meccanismi generali che
possono favorire la progressione neoplastica.
Alcune mutazioni aumentano la proliferazione cellulare, creando una
popolazione espansa di cellule bersaglio per la mutazione successiva.
Altre mutazioni intaccano la stabilità dell’intero genoma, facendo
aumentare il tasso di mutazioni complessivo.
I geni dei tumori
Esistono tre gruppi di geni che risultano frequentemente mutati nelle
neoplasie:
Gli oncogeni - la cui azione promuove positivamente la proliferazione
cellulare. Nella forma normale, non mutata sono indicati come protooncogeni. La forma mutata è attiva in modo improprio o eccessivo. Un
singolo allele mutante può influenzare il fenotipo dell’intera cellula.
I geni soppressori dei tumori (TS) - la cui funzione è quella di inibire la
proliferazione cellulare. Nelle cellule tumorali, la forma mutata perde la
sua funzione. Per cambiare il comportamento di una cellula devono
essere inattivati entrambi gli alleli di un gene TS.
I geni mutatori - responsabili del mantenimento dell’integrità del genoma
e della fedeltà di trasferimento dell’informazione. La loro inattivazione
aumenta la possibilità che la cellula possa commettere errori, e questi
possono coinvolgere oncogeni o geni TS.
Virus oncogeni
Alcune forme di tumori negli animali (incluso l’uomo) possono essere
causate da virus. I virus tumorali rientrano in tre ampie classi:
I virus a DNA, che normalmente infettano la cellula con modalità
litiche, possono causare tumori mediante anomale integrazioni del
DNA virale in cellule ospiti non permissive. L’integrazione innesca
segnali di attivazione della trascrizione o di replicazione virali
nell’ospite attivando la proliferazione cellulare incontrollata.
I retrovirus, che hanno il genoma a RNA, si replicano mediante un
intermedio di DNA, prodotto da una trascrittasi inversa virale. Questi
virus in genere non uccidono la cellula ospite e raramente la
trasformano in cellula neoplastica.
I retrovirus a trasformazione acuta, a differenza dei retrovirus
normali, trasformano rapidamente e ad alta efficienza la cellula
ospite in neoplastica. Il loro genoma contiene un gene aggiuntivo
l’oncogene virale, che solitamente sostituisce alcuni geni essenziali
del virus. Per potersi replicare, essi richiedono quindi la coinfezione
di un virus helper che svolge le funzioni mancanti.
Gli oncogeni
Lo studio dei retrovirus e dei loro oncogeni ha rapidamente chiarito che le
cellule normali contengono degli equivalenti di tutti gli oncogeni virali che in
realtà sono geni cellulari trasdotti.
Gli oncogeni virali differiscono dai loro equivalenti cellulari (proto-oncogeni)
per sostituzioni e tagli aminocidici che attivano il proto-oncogene (lo
trasformano cioè in oncogene).
Lo studio dei retrovirus ha consentito di identificare più di 50 oncogeni,
evidenziando come essi fossero coinvolti proprio in quelle funzioni cellulari
che si era previsto fossero perturbate nei tumori.
Possiamo distinguere cinque classi principali di oncogeni:
Fattori di crescita secreti
Recettori della superficie cellulare
Componenti di sistemi intracellulari di trasduzione del segnale
Proteine nucleari che si legano al DNA (fattori di trascrizione, ecc.)
Componenti del circuito delle cicline, chinasi ciclina-dipendenti e
inibitori delle chinasi (che governano la progressione del ciclo
cellulare).
Attivazione dei proto-oncogeni (1)
L’attivazione dei proto-oncogeni può essere:
Quantitativa - con un aumento cioè della produzione di un prodotto non
modificato.
Qualitativa - con produzione di un prodotto leggermente modificato in seguito ad
una mutazione o alla formazione di un nuovo prodotto da un gene chimerico
creato da un riarrangiamento cromosomico.
Questi cambiamenti sono dominanti e normalmente interessano solo uno degli alleli
di un gene.
Negli oncogeni le mutazioni attivanti sono quasi invariabilmente mutazioni
somatiche, in quanto mutazioni costituzionali sarebbero probabilmente letali.
Attivazione a seguito di mutazioni puntiformi
Un esempio è il gene HRAS, che appartiene alla famiglia dei geni ras, coinvolti nella
trasduzione del segnale a partire da recettori accoppiati alla proteina G. Il segnale
che perviene al recettore attiva il legame del GTP a RAS ed il complesso GTP-RAS
trasmette il segnale ad altri fattori a valle di questo sistema. RAS ha attività
GTPasica e rapidamente converte il complesso GTP-RAS in GDP-RAS
funzionalmente inattivo. Mutazioni puntiformi che alterano la funzione GTPasica di
RAS ne limitano l’inattivazione determinando una eccessiva risposta della cellula al
segnale proveniente dal recettore.
Attivazione dei proto-oncogeni (2)
Traslocazioni cromosomiche che possono creare geni chimerici
Tipicamente le cellule tumorali hanno cariotipi grossolanamente alterati. La
maggior parte di questi cambiamenti sono casuali è riflettono una generica
instabilità del genoma che è componente normale della carcinogenesi.
Sono stati tuttavia caratterizzati riarrangiamenti tumore-specifici.
Il più conosciuto produce il cromosoma Filadelfia (Ph1), un piccolissimo
cromosoma acrocentrico presente nel 90% dei pazienti con leucemia
mieloide cronica.
Il cromosoma Filadelfia è il prodotto di una traslocazione bilanciata (9;22).
Sul cromosoma 9 il punto di rottura è in un introne dell’oncogene ABL. La
traslocazione lo unisce al gene BCR sul cromosoma 22 creando un gene
chimerico il cui prodotto è una proteina di fusione, una tirosina chinasi
correlata ad ABL ma con anomale proprietà trasformanti (non risponde più
ai normali controlli).
Si conoscono molti riarrangiamenti che producono geni chimerici o anche
pongono oncogeni in un contesto cromatinico attivamente trascritto come
ad esempio i geni per le immunoglobuline nei linfociti.
Geni oncosoppressori
Esperimenti di fusione in vitro tra cellule neoplastiche e cellule normali, ha
evidenziato che, in alcuni casi, il fenotipo trasformante può essere corretto.
Ciò ha fornito la prova che lo sviluppo dei tumori non dipende solo da
oncogeni attivati dominanti, ma anche da mutazioni recessive che
conducono alla perdita di funzione di altri geni. Questi sono appunto i geni
soppressori dei tumori (tumor suppressor TS gene).
Il meccanismo con cui i geni TS vengono inattivati è spiegato dall’ipotesi
del doppio colpo di Knudson (1971), confermata da studi successivi che
hanno interessato in particolare il retinoblastoma, un raro e aggressivo
tumore infantile della retina. Per questo esiste un 60% di casi sporadici
unilaterali e un 40% di casi ereditari. Nei casi familiari non sono infrequenti
i tumori bilaterali.











