Matteo Luca Ruggiero
DISAT@Politecnico di Torino
Fisica 1
Anno Accademico 2011/2012
(4 Giugno - 8 Giugno 2012)
1 ESERCIZI SVOLTI AD ESERCITAZIONE
Sintesi
1
Abbiamo formulato il primo principio della
termodinamica che regola gli scambi di calore, la variazione di energia interna, e il
lavoro nelle trasformazioni fra stati di equilibrio
di un sistema termodinamico. Abbiamo quindi introdotto le trasformazioni cicliche fatte
da un sistema termodinamico, e studiato il ciclo di Carnot. In generale, abbiamo introdotto
il concetto di rendimento di una macchina
termica e di efficienza di una macchina
frigorifera.
Esercizi svolti ad Esercitazione
Esercizio 11.1 (da S. Rosati, R. Casali, “Problemi di
Fisica Generale”)
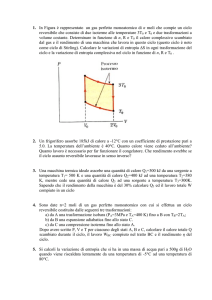
Una mole di un gas perfetto monoatomico, inizialmente alla pressione atmosferica e alla temperatura TA = 500 K effettua le seguenti trasformazioni:
(1) isoterma reversibile dallo stato iniziale A allo stato B, in cui VB = 2VA ;
(2) adiabatica irreversibile dallo stato B allo stato C, tale che VC = 3VB
e TC = TA /2; (3) isoterma reversibile fino a un certo stato D; (4) isobara
reversibile fino a tornare nello stato iniziale A.
(1) Calcolare lo stato termodinamico del sistema in A,B,C,D; (2) calcolare
lavoro eseguito e calore scambiato in ciascuna delle trasformazioni effettuate;
(3) calcolare il rendimento del ciclo.
Traccia di Soluzione. L’equazione di stato
pV = nRT
(1)
permette di calcolare lo stato del gas in tutti gli stati di equilibrio, a partire
dalla conoscenza del valore delle variabili termodinamiche nello stato iniziale
A. Dal primo principio, ricaviamo nella trasformazione A → B
QAB = LAB = nRTA ln
VB
.
VA
(2)
Nella trasformazione B → C
QBC = 0,
Fisica 1
m Home Page di ML Ruggiero
LBC = −ncV (TC − TB )
T 0110907329
(3)
B [email protected] Pagina 2
1 ESERCIZI SVOLTI AD ESERCITAZIONE
Nella trasformazione C → D
QCD = LCD = nRTC ln
VD
.
VC
(4)
Nella trasformazione D → A
LDA = 0,
QDA = ncp (TA − TD ) .
(5)
Notiamo che, essendo QAB > 0, QDA > 0, mentre QCD < 0, possiamo scrivere
per il rendimento
η=
L
LAB + LBC + LCD
=
.
|Qass |
QAB + QDA
(6)
Esercizio 11.2 (da S. Rosati, R. Casali, “Problemi di
Fisica Generale”)
Un recipiente contenente del gas perfetto biatomico è diviso da un setto fisso
in due parti A e B, aventi volume VA = 22.4 litri e VB = 44.8 litri. Inizialmente, pA = 6atm, TA = 273 K, pB = 3 atm, TB = 546 K. Il recipiente è
isolato adiabaticamente dall’esterno, mentre il setto separatore è diatermico.
(1) Calcolare la temperatura del gas quando l’equilibrio termico è stato raggiunto. (2) Calcolare le pressioni del gas in A e B all’equilibrio.
Traccia di Soluzione. Il sistema effettua una trasformazione adiabatica,
per cui indicando con QA , QB la quantità di calore scambiata rispettivamente
dal gas A e B, deve risultare QA + QB = 0. Dato che non c’e’ variazione
di volume, i gas non compiono lavoro per qui QA = ∆UA , QB = ∆UB (dal
primo principio). Si ottiene quindi la temperatura finale
Tf =
nA TA + nB TB
nA + nB
(7)
dalla quale, poi, utilizzando l’equazione di stato è possibile determinare le
pressioni finali dei due gas.
Esercizio 11.3 (da S. Longhi, M. Nisoli, R. Osellame, S.
Stagira “Fisica Sperimentale”)
Un gas perfetto monoatomico compie un ciclo motore reversibile formato da
due adiabatiche e da due isobare, a pressione p1 e p2 > p1 .
(1) Calcolare il rendimento del ciclo in funzione del rapporto p2 /p1 .
Traccia di Soluzione. Nelle due trasformazioni isobare possiamo scrivere
cp
(8)
QAB = ncp (TB − TA ) = pA (VB − VA )
R
Fisica 1
m Home Page di ML Ruggiero
T 0110907329
B [email protected] Pagina 3
1 ESERCIZI SVOLTI AD ESERCITAZIONE
cp
pC (VD − VC )
(9)
R
dove si è usata l’equazione di stato per introdurre la variazione di volume.
Sia p2 = pA , p1 = pC . Essendo Qass = QAB , Qced = QCD i calori assorbito e
ceduto, rispettivamente, possimo scrivere il rendimento
QCD = ncp (TD − TC ) =
η =1−
|Qced|
p1 V C − V D
=1−
Qass
p2 V B − V A
(10)
Usando la relazione di Poission pV γ = cost per una adiabatica reversibile,
otteniamo
γ−1
p1 γ
η =1−
(11)
p2
Quesiti Proposti
11.1 Un gas perfetto compie una trasformazione fra due stati di equilibrio,
A e B.
1. Se la temperatura iniziale è uguale a quella finale, il calore scambiato
è necessariamente nullo
2. Se la temperatura iniziale è maggiore di quella finale, il calore scambiato
è necessariamente positivo
3. Se la trasformazione è adiabatica e reversibile, ad un aumento di pressione corrisponde una diminuzione di volume
4. Se la trasformazione è adiabatica e reversibile il lavoro è necessariamente nullo..
11.2 Si consideri il rendimento di una macchina termica, operante fra
due termostati a temperatura T1 , T2 , con T2 > T1 .
1. Se si tratta di una macchina di Carnot, il rendimento risulta essere
η = 1 − T 1/T 2 solo se il fluido con cui opera è un gas perfetto
2. Se la macchina compie un ciclo reversibile con un gas perfetto, il rendimento risulta essere η = 1 − T 1/T 2 in ogni caso
3. Se la macchina compie un ciclo irreversibile con un gas perfetto, il
rendimento risulta essere η ≤ 1 − T 1/T 2
4. Se si tratta di una macchina di Carnot, il rendimento dipende dal tipo
di gas perfetto utilizzato
Fisica 1
m Home Page di ML Ruggiero
T 0110907329
B [email protected] Pagina 4
1 ESERCIZI SVOLTI AD ESERCITAZIONE
Soluzioni dei Quesiti Proposti
10.1
Un gas perfetto monoatomico compie un ciclo.
1. Alla fine del ciclo, la temperatura non è variata solo se le trasformazioni
effettuate sono tutte reversibili
2. Nel ciclo il gas assorbe calore solo se il ciclo contiene almeno una
trasformazione irreversibile
3. Nel ciclo il gas cede calore solo se il ciclo contiene tutte trasformazioni
reversibili
4. Il prodotto fa il calore scambiato ed il lavoro fatto dal gas è sempre
una quantità positiva. ∗
10.2 Un gas perfetto monoatomico è contenuto in un recipiente A, il
quale è collegato tramite una valvola ad un altro recipiente B, contenente
gas perfetto biatomico. La valvola viene aperta. L’intero sistema è isolato
adiabaticamente.
1. Il gas contenuto inizialmente in A effettua una trasformazione adiabatica.
2. Il gas contenuto inizialmente in B effettua una trasformazione adiabatica.
3. Il calore ceduto/assorbito dal gas inizialmente in A è uguale a quello
assorbito/ceduto dal gas inizialmente in B ∗
4. Il calore ceduto/assorbito dal gas inizialmente in A è maggiore a quello
assorbito/ceduto dal gas inizialmente B
Fisica 1
m Home Page di ML Ruggiero
T 0110907329
B [email protected] Pagina 5