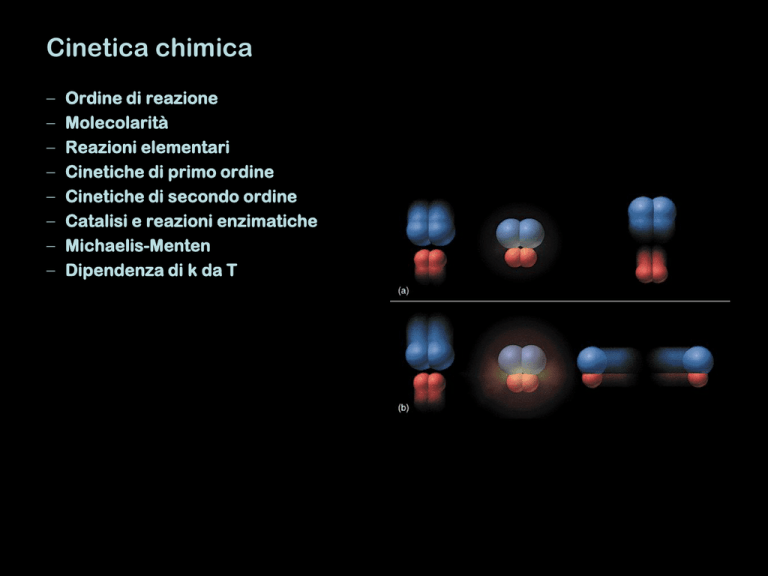
Cinetica chimica
Ordine di reazione
Molecolarità
Reazioni elementari
Cinetiche di primo ordine
Cinetiche di secondo ordine
Catalisi e reazioni enzimatiche
Michaelis-Menten
Dipendenza di k da T
1
Cinetica chimica
Quanto tempo impiega una
sistema a raggiungere
l'equilibrio chimico?
– In altri termini, qual è la
cinetica di una reazione
chimica?
– Le risposte alle domande
precedenti si basano sullo
studio della velocità di reazione
o reattività chimica.
– Per comodità, l'argomento è
diviso in tre parti:
– definizioni e metodi (1),
– applicazioni (2),
– interpretazione/calcolo di
costanti cinetiche (3).
–
2
Esempi
–
Esempio
– Due soluzioni A+ B sono mescolate ed agitate; si aggiungono poi la
soluzione C e la ferroina (un indicatore)
– Soluzione A: KBrO3 o NaBrO3 dissolto in acqua, con aggiunta di H2SO4 .
– Soluzione B: acido malonico e KBr dissolti in acqua.
– Soluzione C: Ce(NH4)2(NO3)6 in H2SO4.
– Soluzione di ferroina: 1,10-fenantrolina (C12H8N2)in acqua, con FeSO4.
– La soluzione A+B diviene color ambra, e poi torna limpida dopo pochi
minuti. Dopo aver aggiunto C e la soluzione di ferroina, il colore cambia
nel tempo in modo ciclico (verde, blu, viola e rosso) ogni 30 minuti
– Si tratta di una versione semplificata della famosa reazione di BelousovZhabotinsky, una reazione oscillante che implica, con un meccanismo
molto complesso, l’ossidazione dell’acido malonico dagli ioni di bromato
in ambiente acido, catalizzata dagli ioni cerio.
– Il meccanismo si basa sul contemporaneo consumo e sviluppo di ioni
bromo.
– I vari intermedi prodotti sono responsabili del colore:
∙
bromo elementare (ambra)
∙
ferroina complessata [rosso con Fe(II), blue con Fe(III)]
∙
ioni Ce4+ (giallo)
3
Variazione di concentrazione
–
–
La variazione nel tempo della
composizione di un sistema è
oggetto di studio della cinetica
chimica.
Le concentrazione delle varie
specie chimiche [A], [B] etc. si
possono seguire nel tempo
misurando una o più proprietà
che
dipendono
dalla
concentrazione (e.g. intensità di
assorbimento
della
luce,
pressione, conducibilità).
A+BC+D
[A]: concentrazione di A
[B]: concentrazione di B
[C]: concentrazione di C
[D]: concentrazione di D
4
Cinetica chimica
Semplificazione: reazione condotta in condizioni di
1) equilibrio termico (temperatura costante)
2) equilibrio meccanico (ad esempio a pressione costante)
3) mescolamento completo
stato istantaneo del sistema reattivo specificato dalle concentrazioni
volumetriche delle specie, [ J ] , come funzioni del tempo (per un sistema
reattivo costituito da miscela ideale gassosa, [ J ] pJ / RT ).
[A]0 , [B]0 , [C]0
,
[A], [B] , [C]
, ...
...
stato iniziale
stato istantaneo
al tempo t
t
[A]eq , [B]eq , [C]eq
...
stato stazionario
(equilibrio)
Si usano concentrazioni (e non molalità) per poter descrivere anche
cinetiche in fase gassosa
5
,
Per una generica reazione:
( A )A ( B )B ...
C C D D ...
Reagenti
Prodotti
si può monitorare sperimentalmente le concentrazioni [ J ] delle varie specie nel tempo
(ad esempio mediante tecniche spettrofotometriche misurando l’assorbanza a
lunghezze d’onda di assorbimenti specifici...).
Definizione della velocità della reazione indipendente dalla specie:
1 d[ J ]
v
J dt
Relazione con il grado di avanzamento della reazione:
grado di avanzamento della reazione
nJ nJ 0 J
[J ]
V
V
d [ J ] J d
dt
V dt
v
d ( / V )
dt
6
Misura della velocità di reazione
–
–
–
Per reazioni chimiche che decorrono in tempi
lunghi (ore, giorni) può essere sufficiente
– prelevare ad intervalli regolari campioni
dal sistema,
– sottoporli
a
raffreddamento
per
bloccare il decorso della reazione
– procedere
ad
un'analisi
chimica
quantitativa
Per reazioni che decorrono in tempi veloci
(da minuti fino a millisecondi) si possono
impiegare semplici tecniche fisiche per
seguire il decorso della reazione nel tempo,
come per esempio
– spettri di assorbimento
– misure di costanti dielettriche
– misure di conducibilità elettrica
– misure dell'indice di rifrazione
– metodi dilatometrici
– misure di variazione di pressione (in
fase gas)
Per reazioni rapide (microsecondi): metodo
del flusso interrotto o rilassamento
7
Come dipende la velocità di reazione dalle variabili macroscopiche del
sistema reattivo?
Per fissati T , p , ambiente di reazione (solvente) vale il postulato: ad un certo istante
la velocità v dipende solo dalle concentrazioni istantanee delle specie e non dipende
esplicitamente dal tempo,
v f [ A],[ B],[C ],...
dove
f( ,,, )
legge cinetica
indica la legge cinetica per la particolare reazione.
Ipotesi implicita: assenza di memoria degli stati precedenti.
Vincolo sulla legge cinetica derivante dalla condizione di equilibrio:
v |eq f ([ A]eq ,[ B]eq ,[C ]eq , ) 0
In linea di principio la legge cinetica può essere determinata sperimentalmente:
f [ A]0 ,[ B]0 ,[C ]0 ,... da misure di v t 0 al variare
delle concentrazioni iniziali
8
Struttura matematica: un’unica equazione differenziale (del primo ordine) da
risolvere:
x(t )
(t )
V
; x(0) 0
nJ (t ) nJ (0) vJ (t )
[J ]
[ J ]0 J x(t )
V
V
1 d [ J ] dx(t )
v
J dt
dt
dx
f ([ A]0 A x, [ B]0 B x, [C ]0 C x...) F ( x)
dt
Nota la soluzione x(t), si calcolano le concentrazioni di tutte le specie come
funzioni del tempo.
9
Cinetiche irreversibili: se la reazione termina (stato di equilibrio) quando la
concentrazione di almeno uno dei reagenti si annulla.
( A )A ( B )B ... C C DD ...
Per le reazioni irreversibili, spesso la velocità di reazione è proporzionale alle
potenze delle concentrazioni dei soli reagenti
ordini di reazione parziali; n nA nB ... è l’ordine globale
v k [ A]nA [ B]nB ...
costante cinetica; dimensione fisica
(moli/litro)(1-n)s-1
Allora si dice che esistono gli ordini di reazione (o che la reazione li possiede).
Vincolo derivante dalla condizione di equilibrio:
nA , nB ,
0
10
11
Note
1) Non sempre una reazione irreversibile possiede ordini di reazione, ad
esempio:
H 2 (g) + Br2 (g) 2HBr(g)
[H 2 ][Br2 ]3/2
vk
[Br2 ] k '[HBr]
2) Non esiste una relazione diretta tra ordini di reazione e coefficienti
stechiometrici della reazione.
12
Soluzione della legge cinetica in casi semplici
1) Cinetica del primo ordine con un solo reagente .
d [ A]
v
k [ A]
dt
A Prodotti
d [ A]
d ln[ A] k dt
[ A]
[A]
ln[A] ln[A]0 =ln
kt
[A]0
[A] [A]0 ekt
Decadimento esponenziale della concentrazione: il diagramma ln[ A] vs. t
evidenzia una legge cinetica del primo ordine.
Tempo di dimezzamento t1/ 2 (riferito ad un certo reagente): tempo richiesto
per dimezzare la concentrazione iniziale del reagente.
t t1/2 :
Cinetica del primo ordine:
iniziale).
[ A] [ A]0 / 2
ln 2
t1/ 2
k
(indipendente dalla concentrazione
Esempio di tempo di dimezzamento per il decadimento radioattivo di nuclei
14
C 14N
v k 14C
t1/2 = 5770 anni
13
14
E la concentrazione del prodotto
Se
[P]0 0:
A P?
[P] [A]0 [A] [A]0 [A]0 exp( kt) [A]0 1 exp( kt)
15
2) Cinetica del secondo ordine con un solo reagente , es. 2I (g) I2 (g)
d [ A]
v
k[ A]2
dt
A Prodotti
d [ A]
2
[ A]
•
•
d (1/ [ A]) k dt
1
1
kt
[ A] [ A]0
Andamento lineare: 1/[A] vs. t.
Tempo di dimezzamento dipendente dalla
concentrazione iniziale
[A]0
[A]
1+[A]0kt
1
t1/ 2
k[ A]0
Esercizio. Dimostrare che sui tempi brevi, t t1/ 2 , le cinetiche del 1°
e 2° ordine producono entrambe un decadimento lineare della
concentrazione contro il tempo.
16
17
3) Cinetica del 2° ordine con due reagenti ciascuno del primo ordine
A + B Prodotti
v k[ A][B]
Casi limite:
1) Se [ A]0 [ B]0
cinetica
allora [ A] [ B] a tutti i tempi, semplificando la legge
[A]0
[A] [ B]
1+[A]0kt
d [ A]
v
k[ A][ B] k[ A]2
dt
2) Se [A]0 [B]0
v
[B] [B]0 circa costante!
d [A]
k[B][A] k[B]0 [A] k '[A]
dt
k'
[A] [A]0 exp( k ' t )
• Cinetica del pseudo primo ordine
• tempo di dimezzamento dipendente
ln2
ln2
t1/ 2
dalla concentrazione di B
k'
k[B]0
18
Soluzione generale (separazione delle variabili):
d [ A]
d [ B]
k[ A][ B]
dt
dt
dx
[ A] [ A]0 x(t ) , [ B] [ B]0 x(t )
k [ A]0 x[ B]0 x
dt
v
dx
kdt
[ A]0 x[ B]0 x
[ A]0 x [ B]0 x
1
dx
[ A]0 [ B]0 [ A]0 x[ B]0 x
1
[ A]0 [ B]0
dx
dx
[
B
]
x
[
A
]
x
0
0
1
d ln([ B]0 x) d ln([ A]0 x)
[ A]0 [ B]0
Integrando:
([ A]0 x)[ B]0
1
kt
ln
[ A]0 [ B]0 ([ B]0 x)[ A]0
x(t ) ...
[ A] ... ,[ B] ...
19
Leggi cinetiche integrate
Ordine
Reazione
Legge
Legge
integrata
0
AProdotti
vk
[A] kt [A]0
t1/ 2
[A]0
2k
1
AProdotti
v k[A]
[A] [A]0 e kt
t1/ 2
ln 2
k
2
AProdotti
v k[A]2
1
[A]
kt
1
[A]0
Tempo t1/2
t1/ 2
1
k[A]0
d [ A]
v
dt
20
Come ottenere teoricamente la legge cinetica?
Come spiegare a livello molecolare le leggi cinetiche?
Descrizione macroscopica della cinetica chimica: dipendenza temporale
di concentrazioni macroscopicamente misurabili.
Descrizione microscopica della cinetica chimica secondo processi
elementari, cioè trasformazioni di singole molecole (senza riferimento alle
concentrazioni)
Due tipi di processi elementari:
1) processi unimolecolari (ad esempio il decadimento radioattivo)
A prodotto/ prodotti
2) processi bimolecolari
A B prodotto/ prodotti
La cinetica osservabile macroscopicamente è l’esito di un insieme di
processi elementari, descritti dal meccanismo di reazione costituito in
generale da più stadi identificati con processi elementari.
21
Esempio: decomposizione dell’ozono in fase gassosa
Processo cinetico osservabile macroscopicamente:
2 O3
3 O2
Meccanismo di reazione a tre stadi:
1) O3 O 2 O (unimoleco lare)
2) O 2 O O3
(bimoleco lare)
3) O O3 2 O 2 (bimoleco lare)
La specie O (ossigeno atomico) non è rilevabile macroscopicamente
(specie labile estremamente reattiva e quindi presente a
concentrazioni troppo basse per essere misurate) e quindi non
compare nella reazione globale (macroscopica)
22
Esempio: idrolisi di un alogenuro terziaro RX in acqua
Reazione globale:
RX + 2H2O ROH + X- + H3O+
RX R + + X R + + X- RX
Meccanismo di reazione (processo di
eliminazione):
R + + H 2O ROH +2
ROH +2 + H 2O ROH + H3O+
ROH + H3O + ROH +2 + H 2O
R + , ROH +2
sono specie labili che non compaiono nella reazione globale
23
Può la legge cinetica essere derivata sulla base del meccanismo di reazione?
Quant’è il contributo di un processo elementare alla velocità totale di reazione?
Caso semplice: una reazione il cui meccanismo è costituito da un unico
stadio unimolecolare (es. decadimento radioattivo)
A prodotti
Nota: in questo caso la notazione della cinetica macroscopica e del
meccanismo coincidono.
Assunzione per la velocità di reazione:
vunim
d A
kunim [A]
dt
[A] nA /V N A / VN Avog. N A n di molecole A
dN A
dN A
kunimN A
kunimdt
dt
NA
Il tasso di decremento
dN A / N A delle molecole è proporzionale
all’intervallo temporale dt .
Perché?
kunim
kunim : coefficiente di proporzionalità
A
Prodotti
24
Caso di una reazione il cui meccanismo è costituito da un unico stadio
bimolecolare
A B prodotti
Assunzione per la velocità di reazione:
Perché?
[A] nA /V N A / VN Avog.
vbim
d A
d B
kbim [A] [B]
dt
dt
N A n di molecole A
dN A
dN A
kbim N A[B]
kbim[B] dt
dt
NA
Il tasso di decremento dN A / N A delle molecole A è proporzionale anche
alla probabilità di collisione con una molecola B, e quindi alla sua
concentrazione.
kbim
kbim : coefficiente di proporzionalità
A+B
Prodotti
Se B coincide con A?
1 d [ A]
vbim
kbim [ A]2
2 dt
kbim
2A Prodotti
25
Meccanismo di reazione a più stadi
Esempio dell’interconversione tra due specie
A
B
d [A]
con una velocità di reazione determinabile come
v
dt
k1
1)
A
B
Meccanismo della reazione costituito da
due stadi unimolecolari:
Se fosse presente solo il primo stadio:
o solo il secondo stadio:
k2
2) B
A
d[A] / dt 1 k1[A]
d[A] / dt 2 k2[B]
Assunzione: i due stadi contribuiscono indipendentemente alla
velocità direazione
d [A] d [A] d [A]
v
k1[A] k2 [B]
dt
dt 1 dt 2
ottenendo così la legge cinetica
v k1[A] k2 [B]
26
d [A] d [B]
k1[A] k2 [B]
dt
dt
Analisi della legge cinetica
v
All’equilibrio
v 0:
k1[A]eq k2 [B]eq 0
k1 [B]eq
K (costante di equilibrio)
k2 [A]eq
Nelle cinetiche reversibili, esiste una relazione tra costante di
equilibrio e costanti cinetiche dei processi elementari
Come evolvono le concentrazioni verso i valori di equilibrio?
[A] [B] [A]eq [B]eq
[A] [A]eq ([B] [B]eq )
[B]
[A]
d[A] d [ A]
k1[A] k2 [B] k1 ([A] [A]eq ) k2 ([B] [B]eq )
dt
dt
(k1 k 2 )[A] k1[A]eq k 2 [B]eq [A] [A] exp[ (k k )t ]
0
0
1
2
27
Caso generale di un meccanismo con più stadi
Postulato: i vari stadi elementari del meccanismo di reazione,
contribuiscono indipendentemente alla variazione temporale netta
della concentrazione di ciascuna specie.
Velocità di formazione
della specie J
d[ J ]
dt
M stadi elem.
m 1
d[ J ]
dt m
contributo dello stadio
elementare m-esimo
Sistema di equazioni differenziali!
k1
O3
O2 O
k1 '
O 2 O
O3
k2
O O3
2O 2
28
Esempio: decomposizione dell’ozono in fase gassosa,
Meccanismo:
k1
O3 O 2 + O
k1 '
O 2 + O O3
k2
O + O 3 2O 2
2O3 3O2
Sistema di equazioni completo:
d [O3 ]
k1[O3 ] k1 '[O2 ][O] k2 [O][O3 ]
dt
d [O2 ]
k1[O3 ] k1 '[O2 ][O] 2k2 [O][O3 ]
dt
d [O]
k1[O3 ] k1 '[O2 ][O] k2 [O][O3 ]
dt
Come determinare la legge cinetica dalla velocità di reazione
macroscopica?
1 d [O3 ]
v
f ([O3 ],[O2 ])
2 dt
Un criterio semplice è che nella legge cinetica (macroscopica) non
debba comparire la concentrazione [O] della specie labile (non
misurabile).
29
La specie ossigeno atomico, essendo labile, rimane sempre a
bassissima concentrazione; quindi anche la sua derivata temporale
assume valori molto piccoli
[O] 0
d [O]
0
dt
Questa ipotesi fisica è compatibile con il metodo (approssimazione)
dello stato stazionario per la specie labile
0
d [O]
k1[O3 ] k1 '[O2 ][O] k2[O][O3 ]
dt
Concentrazione della specie labile in funzione delle concentrazioni
macroscopicamente misurabili
[O]
k1[O3 ]
k1 '[O2 ] k2 [O3 ]
N.B. Non si può utilizzare l’approssimazione [O]=0; la specie O deve essere
comunque presente affinchè la reazione globale avvenga.
30
Per sostituzione si ottengono equazioni differenziali riferite alle sole
concentrazioni macroscopicamente misurabili
d [O3 ]
2k1k2[O3 ]2
k1[O3 ] k1 '[O2 ][O] k2[O][O3 ]
dt
k1 '[O2 ] k2[O3 ]
3k1k2 [O3 ]2
d [O2 ]
k1[O3 ] k1 '[O2 ][O] 2k2 [O][O3 ]
dt
k1 '[O2 ] k2 [O3 ]
Derivazione della legge cinetica
k1k2 [O3 ]2
1 d [O3 ] 1 d [O2 ]
v
2 dt
3 dt
k1 '[O2 ] k2[O3 ]
N.B. Assenza di ordine di reazione.
31
Un esempio per verificare la validità del metodo dello stato stazionari:
meccanismo a due stadi unimolecolari consecutivi.
Reazione globale:
AC
Sistema di equazioni:
d [ A]
1)
dt k1[ A]
d [ B]
k1[ A] k2 [B] 2)
dt
d [C ]
3)
dt k2 [ B]
[ A] [ A]0 e
k1t
x(t ) [ B]ek2t
Meccanismo:
k1
k2
A B C
Condizioni iniziali scelte:
[ A]0 0 , [ B]0 [C]0 0
Vincolo stechiometrico:
[ A] [ B] [C] [ A]0 [ B]0 [C]0 [ A]0
dx(t )
k1[ A]0 e(k1 k2 )t
dt
e k1t e k2t
[ B] k1[ A]0
k2 k1
x(0) 0
d [ B]
k1[ A]0 ek1t k2[B]
dt
( k k )t
1
e 1 2
x(t ) k1[ A]0
k
k
k
k
2
1
2
1
[C ] [ A]0 [ A] [ B] ...
32
Se si applica il metodo dello stato stazionario alla specie B:
k
d [ B]
k1[ A] k2 [ B] [ B] 1 [ A]
dt
k2
d [C ]
v
k2 [ B] k1[ A]
legge cinetica: v k1[ A]
dt
0
È come se la reazione globale fosse una conversione diretta da A in C e
seguisse una cinetica del primo ordine controllata dalla costante cinetica
del primo stadio (“rate determining step”).
k1
A C
Sotto quali condizioni la soluzione esatta giustifica l’impiego del metodo dello
stato stazionario riferito alla specie B?
ek1t ek2t
[ B] k1[ A]0
k2 k1
Allora, da [C ] [ A]0
macroscopica
k2 k1
[ B]
k1
k2
k1
[ A]0 ek1t 0
k2
A B C
33
[ A] [ B] [ A]0 [ A], si ottiene la legge cinetica
d [C ]
d [C ]
v
k1[ A]
dt
dt
in accordo con il metodo dello stato stazionario
k2 = 5 k 1
Punti: formazione di [C] con
cinetica del primo ordine secondo k1
C
0.8
0.14
0.12
0.6
0.10
[B] / [A]0
0.4
0.08
0.06
B
0.04
A
0.02
0.00
0
0.2
1
2
3
4
5
t k1
B
k2 = 20 k1
0.0
1
2
3
4
5
t k1
1.0
C
0.8
0.05
0.04
0.6
[B] / [A]0
0
[Specie] / [A]0
[Specie] / [A]0
1.0
0.03
0.02
0.01
0.4
A
B
0.00
0
1
2
3
4
5
6
t k1
0.2
B
0.0
0
1
2
3
345
4
t k1
Analisi secondo il metodo dello stato stazionario dell’idrolisi in acqua
dell’alogenuro terziario: RX + 2H2O ROH + X- + H3O+
Sistema di equazioni completo:
d [ RX ]
k1[ RX ] k1 '[ R ][ X ]
dt
d[R ]
k1[ RX ] k1 '[ R ][ X ] k2 [ R ][ H 2O]
dt
d[ X ]
k1[ RX ] k1 '[ R ][ X ]
dt
d [ ROH 2 ]
k2 [ R ][ H 2O] k3[ ROH 2 ][ H 2O] k3 '[ ROH ][ H 3O ]
dt
d [ ROH ]
k3[ ROH 2 ][ H 2O] k3 '[ ROH ][ H 3O ]
dt
Meccanismo:
k1
RX R + + X +
-
k1 '
R + X RX
+
k2
R + H 2O ROH +2
k3
+
ROH 2 + H 2O ROH + H3O+
k3 '
+
ROH + H3O ROH +2 + H 2O
d [ H 3O ]
k3[ ROH 2 ][ H 2O] k3 '[ ROH ][ H 3O ]
dt
d [ H 2O ]
k2 [ R ][ H 2O] k3[ ROH 2 ][ H 2O] k3 '[ ROH ][ H 3O ]
dt
Approssimazione di stato stazionario sugli intermedi R+ e ROH2+
35
d[ R ]
k1[ RX ] k1 '[ R ][ X ] k2[ R ][ H 2O] 0
dt
d [ RX ]
k1[ RX ] k1 ' [ R ][ X ]
dt
[ R ]
k1[ RX ]
k1 '[ X ] k2[ H 2O]
k1k2 [ RX ][ H 2O]
k1 '[ X ] k2 [ H 2O]
d [ ROH 2 ]
k2 [ R ][ H 2O] k3[ ROH 2 ][ H 2O] k3 '[ ROH ][ H 3O ] 0
dt
k3[ ROH 2 ][ H 2O] k2 [ R ][ H 2O] k3 '[ ROH ][ H 3O ]
k k [ RX ][ H 2O]
d [ ROH ]
k3[ ROH 2 ][ H 2O] k3 '[ ROH ][ H3O ] k2 [ R ][ H 2O] 1 2
dt
k1 '[ X ] k2[ H 2O]
Legge cinetica osservabile sperimentalmente monitorando le conc. di RX e/o
v
d [ RX ] d [ ROH ]
dt
dt
k1k2 [ RX ][ H 2O]
k1 '[ X ] k2[ H 2O]
In eccesso di acqua (solvente), cioè per k2[ H 2O]
ordine rispetto all’alogenuro:
v
ROH:
k1 '[ X ] , la cinetica effettiva è del 1°
k1[ RX ]
36
Esempio di meccanismi complessi: combustione dell’idrogeno in fase
gassosa.
Reazione globale:
2H2 +O2 2H2O
Meccanismo:
37
Un meccanismo di reazione è ipotetico in quanto
1) per una stessa reazione globale sono ammissibili, a priori,
meccanismi diversi
2) la presenza di intermedi labili, quali R+ nell’idrolisi
dell’alogenuro, può non essere accertabile sperimentalmente
e/o la loro concentrazione può non essere misurabile
3) non è possibile effettuare misure indipendenti sui singoli
processi elementari
Diversi meccanismi portano a leggi cinetiche diverse; un meccanismo
è suffragato solo sulla base dell’accordo tra previsioni e misure.
38
Legge di Arrhenius - Dipendenza dalla temperatura
Le costanti cinetiche dei processi elementari sono da intendersi
come parametri fissi per un ambiente di reazione fissato
(temperatura, pressione, solvente, forza ionica, ecc...):
k k (T ,ambiente di reazione)
Legge (empirica) di Arrhenius per la dipendenza dalla temperatura:
k A e Ea / RT
Ea : energia di attivazione
A : fattore pre-esponenziale (è la costante cinetica stessa nel limite T )
ln k
ln A
Al diminuire della temperatura la velocità
del processo decresce ( k diminuisce)
Ea/R
0
39
1/T
A parità di ordine del processo, e di ambiente di reazione, i fattori preesponenziali sono paragonabili, mentre è l’energia di attivazione a variare
maggiormente e a regolare il valore della costante cinetica:
40
Interpretazione molecolare (1)
• La legge di Arrhenius
descrive la dipendenza dalla
temperatura della costante
cinetica di una reazione
elementare:
k A exp( Ea / RT )
• Il fattore pre-esponenziale e
l’energia
di
attivazione
dipendono dalla temperatura
41
Interpretazione molecolare (2)
• L'interpretazione intuitiva ma sostanzialmente corretta
della legge di Arrhenius è la seguente:
• una reazione chimica avviene solo quando le molecole
di reagente hanno una energia superiore ad una data
reazione di soglia, l'energia di attivazione.
• Il numero di molecole con un'energia superiore ad
un valore dato Ea è proporzionale al fattore di
Boltzmann exp(-Ea/RT);
• la costante k dipende quindi da questo termine e da altri
fattori (legati essenzialmente alle caratteristiche steriche
delle molecole), cumulativamente riassunti dal termine
A.
42
Interpretazione molecolare (3)
• In realtà una teoria delle velocità di reazione
non può essere generale.
– Le reazioni monomolecolari per esempio devono
essere in qualche modo essere trattate come casi a
parte,
– la reattività delle molecole è in generale diversa se
considerata in fase gas o in soluzione.
• Nel seguito, concentremo la nostra attenzione
su una reazione bimolecolare, e molte delle
considerazioni
che
faremo
saranno
sostanzialmente valide in fase gas.
43
44
Approccio statistico / teoria delle collisioni
• Il primo tentativo di prevedere la costante
cinetica di una reazione è stato fondato sulla
teoria delle collisioni:
• si tratta di un approccio statistico che tenta di
valutare separatamente l'importanza dei vari
fattori che influenzano la costante k
– le caratteristiche di forma (fattore sterico) delle
molecole di reagente
– la velocità media con cui i reagenti si possono
incontrare
– l'energia minima (energia di attivazione) che le
molecole devono possedere per dare luogo ai prodotti
quando si incontrano
45
Superficie di potenziale
• La reazione è vista come la trasformazione degli
stati legati degli atomi costituenti le molecole di
reagenti (minimo iniziale) negli stati legati
costituenti le molecole di prodotti (minimo finale)
seguendo un cammino di reazione;
– le reazioni che avvengono su un'unica superficie di
potenziale sono dette reazioni adiabatiche.
– Esistono
naturalmente
reazioni,
dette
nonadiabatiche, in cui la reazione chimica coinvolge più
di una superficie di energia potenziale
46
47
48
Teoria dello stato di transizione (1)
• Consideriamo una reazione bimolecolare adiabatica, e
non consideriamo esplicitamente l'effetto dell'intorno. In
altri termini, la reazione avviene in una fase gassosa
perfetta.
• L'ipotesi fondamentale dello ST formulata da Eyring è
seguente:
– la reazione decorre con la formazione di un intermedio
non direttamente rilevabile, ma in equilibrio con i
reagenti, che decade a prodotti.
– L'ipotesi ST postula che la formazione dell'intermedio,
possa essere descritta come un pre-equilibrio, seguito
dalla trasformazione vera e propria in prodotti.
K†
[ AB] P
A B
†
†
49
12/01/2017
Antonino Polimeno
50
Teoria dello stato di transizione (2)
• La costante di equilibrio è legata alla
formazione dello stato di transizione
K
†
pCi RT
nCi
V
pAB† p
p A pB
pAB†
p A pB
K
p
†
RT Ci
RT †
AB K A B
p
†
51
Teoria dello stato di transizione (3)
• La velocità di formazione dei prodotti è
d P
RT †
v
AB K A B
dt
p
v
d P
dt
†
†
†
k A B
RT †
k K
p
†
52
12/01/2017
Antonino Polimeno
53
Teoria dello stato di transizione (6)
hv
†
54
Teoria dello stato di transizione (7)
kBT †
†
K †K
h
RT †
k K
p
†
k BT RT † k BT †
k
K
=
K
c
h p
h
k BT †G / RT k BT † S / R † H / RT
e
e
h
h
55
Interpretazione termodinamica (3)
• Il confronto diretto tra le grandezze di attivazione
e le grandezze di equilibrio (energia libera,
entalpia ed entropia di reazione) va sotto il nome
di analisi di correlazione.
• P. es. esiste una relazione lineare tra le energie
libere di attivazione e reazione
– la reazione chimica aumenta la propria velocità
quando divenga termodinamicamente più favorita.
– Varie relazioni empiriche lineari tra sono oggi note,
con il nome di relazioni lineari di energia libera, per
serie omologhe di reazioni chimiche.
56
Catalisi
–
–
Un catalizzatore è una sostanza in grado di accelerare una reazione
pur rimanendo inalterata alla fine della reazione.
Il catalizzatore agisce diminuendo l’energia di attivazione.
–
–
Un esempio: decomposizione dell’acqua ossigenata ad acqua ed
ossigeno
La reazione è molto lenta (a T ambiente non procede in modo
apprezzabile); l’aggiunta di un catalizzatore (ioduro di potassio), accelera
la reazione in modo drammatico
senza cat.
con cat.
H2O2(aq) + I-(aq) OI-(aq) + H2O(l)
H2O2(aq) + OI-(aq) H2O(l) + O2(g) + I-(aq)
E
a
RT
c
Eac
a
a
k Ae
kc Ae
E E
kc k
RT
A parità di temperatura quindi la reazione procede più velocemente in
presenza di catalizzatore
57
senza catalizzatore ...
con catalizzatore ...
58
Enzimi (1)
–
–
Gli enzimi sono (quasi sempre) proteine con strutture tridimensionali
(conformazioni) e caratteristiche chimiche che si esplicano in una
attività di catalisi di specifiche reazioni chimiche.
L’attività catalitica è selettiva, si applica cioè solo ad una particolare
reazione chimica.
Gli enzimi sono molecole di
dimensioni relativamente grandi
rispetto alle molecole coinvolte
nelle reazioni catalizzate, e
presentano
di
solita
una
specifica zona reattiva detta
centro di reazione dove la
reazione chimica catalizzata ha
luogo.
59
Un enzima (E) è è una sostanza biologica (normalmente una
proteina) che agisce come catalizzatore molto specifico per una
singola reazione o gruppo di reazioni.
La molecola su cui agisce il catalizzatore (il reagente) viene detto
substrato (S).
Normalmente il substrato si lega ad un sito attivo dell’enzima, cioè
ad una parte della macromolecola che è in grado di alloggiare
selettivamente il substrato
Velocità di reazione trascurabile per la conversione diretta da
substrato (S) a prodotto (P)
SP
Velocità di reazione significativa in presenza di un opportuno enzima
S E P E
60
61
62
Meccanismo di Michaelis-Menten
Meccanismo:
k1
S E ES
k1
ES S E
k2
ES P E
Sistema di equazioni completo:
d[S ]
k1[ E ][ S ] k1[ ES ]
dt
d[E ]
k1[ E ][ S ] k1[ ES ] k2 [ ES ]
dt
d [ ES ]
k1[ E ][ S ] k1[ ES ] k2 [ ES ]
dt
d [ P]
k2 [ ES ]
dt
Approssimazione di stato stazionario al complesso-intermedio ES:
d [ ES ]
k1[ E ][ S ] k1[ ES ] k2 [ ES ] 0
dt
[ ES ]
k1[ E ][ S ]
[ E ][ S ]
;
k1 k2
KM
k k
K M 1 2 : costante di Michaelis (moli/litro); 1/ K M misura l'affinità enzima-substrato
k1
Conviene esprimere [ES] ed [E] in funzione della concentrazione totale di
enzima E 0 : E ES quale parametro facilmente determinabile
K M [ ES ] [ E ][ S ] ([ E ]0 [ ES ])[ S ]
[ S ][ E ]0
[ ES ]
KM [S ]
63
d [ P]
k2 [ ES ]
dt
[S ]
k2 [ E ]0
K M [S ]
v
Situazioni limite:
1) [S] K M [ES] [E0 ] [E]
v k2 [E]0 v max
[S]
[E 0 ] [E]0 [E]
KM
k2 [S]
cinetica del (pseudo) primo
v
[E]0
ordine rispetto al substrato
KM
2) [S] K M [ES]
64
Rappresentazione lineare della velocità di reazione: grafico di
Lineweaver-Burk, 1/v in funzione di 1/[S]:
k2 [E]0 [S] v max [S]
v max
v
K M [S] K M [S] K M 1
[S]
Diagramma di Lineweaver-Burk,
o dei doppi reciproci
KM 1
1
1
v v max v max [S]
Dal diagramma si determinano
vmax e KM
65
La velocità massima di enzimolisi è data da
vmax k3[E]0
Si definisce come numero di turnover o costante catalitica il
valore della velocità massima vmax diviso per la concentrazione
dell’enzima:
kcat
v max
k2
[E]0
unità di misura:s-1
Si può considerare come il massimo numero di molecole di
substrato che nell’unità di tempo possono essere convertite in
prodotti da una molecola di enzima.
66
Relazione tra cinetica e termodinamica in prossimità dell’equilibrio
Ovvero: che relazione c’è tra la “forza termodinamica” che spinge il
sistema reattivo verso l’equilibrio e la velocità della reazione?
Consideriamo il caso semplice della seguente reazione in soluzione ideale
diluita, a (T,p) costanti:
Approfodimento
ABC
Aspetto termodinamico: energia libera di reazione
termodinamica che spinge il sistema verso l’equilibrio
mJ
[ J ] / solv ;
K
mC eq
m Aeq mB eq
m
K conc solv m ;
K conc
mC
mC
r G r G RT ln
m RT ln K RT ln
m
m
m
m
m
A B
A B
come
forza
[C ]eq
[ A]eq [ B]eq
1
[C ]
RT ln
K
[
A
][
B
]
conc
67
Aspetto cinetico: come e su che tempi si tende all’equilibrio.
k1
v1 k1[ A][ B]
AB C
k1
v1 k1[C ]
Approfodimento
C AB
In questo caso, per la reazione globale vale: v
1 d
v1 v1
V dt
All’equilibrio:
k1 / k1 Kconc
veq 0 ,
v1eq v1eq
Fuori equilibrio: v v1 v1 0
... però v v1 v1 v1 1 v1 / v1
,
k1[C ]
G / RT
v1 1
v1 1 e r
k1[ A][ B]
e per piccoli scostamenti dall’equilibrio, dove r G / RT
v1
v1eq
,
v
v1eq
r G
RT
1 , si ha
68
Introduciamo il flusso del grado di avanzamento:
Approfodimento
d
J
dt
Vv
Vv1eq
r G
RT
proporzionalità tra causa (forza termodinamica = energia libera di
reazione) ed effetto (flusso del grado di avanzamento): uno scostamento
dall’equilibrio ( r G 0 ) implica un flusso per il ripristino dello stato di
equilibrio. Nota bene: la relazione vale solo per piccoli scostamenti
dall’equilibrio!
Questa relazione rientra in un’ampia categoria di relazioni di
proporzionalità tra forze termodinamiche e flussi in contesti di varia
natura: sono la base della termodinamica di non-equilibrio.
Quali sono le implicazioni in relazione con il Secondo Principio della
Termodinamica?
69
Consideriamo il sistema reattivo a contatto con un termostato
(“term”), il tutto isolato adiabaticamente.
Introduciamo la velocità di produzione di entropia
dell’incremento di entropia nel tempo) nel sistema globale:
(entità
dSad
S (t )
dt
H G
T
dG
dSad
T
Approfodimento
Sad Sterm S Sterm
dH
dSterm
T
S
1 dG
T dt
S
1 G
d
T T , p dt
Vv1eq
RT
2
r G
2
0
G
r J
T
Vv1eq
J
r G
RT
relazione quadratica tra
velocità di produzione di
entropia e affinità!
S 0 assicura che l’entropia del sistema globale isolato aumenti nel
tempo, fino ad arrestarsi quando la reazione è all’equilibrio
(r G 0).
70