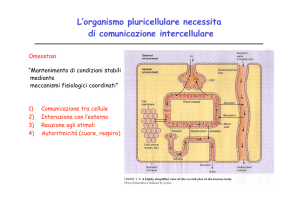
TRASDUZIONE DEL SEGNALE
Per trasduzione del segnale intendiamo quell'insieme di meccanismi biologici che permettono la
comunicazione tra cellule al fine di ottenere diversi risultati, come l'attivazione di certi pathway
metabolici o la secrezione di specifiche molecole attraverso l'attivazione o l'inibizione dell'espressione
genica di specifici fattori di trascrizione, responsabili dell'espressione di altri geni.
Le biomolecole che fungono da segnale presentano 4 caratteristiche principali:
• Specificità: la molecola segnale è perfettamente complementare al suo recettore in maniera
esclusiva (altre molecole non vengono legate);
• Amplificazione: quando un enzima o il secondo messaggero attiva un enzima, si ottiene una
cascata di attivazione in cui le molecole coinvolte aumentano in maniera esponenziale;
• desensibilizzazione/adattamento: l'attivazione del recettore innesca un circuito a feedback
che "spegne" il recettore o lo rimuove dalla superficie della cellula;
• integrazione: quando due segnali hanno effetti opposti su una stessa caratteristica metabolica
(come la concentrazione del secondo messaggero), il risultato deriva dall'effetto integrato
dell'azione dei due recettori.
Segnale juxtacrino
Le cellule comunicano via canali di giunzione (gap junctions) o attraverso una molecola di superficie che
interagisce con una proteina recettore che a sua volta induce l'attivazione di una cascata di eventi
all'interno della cellula bersaglio. Questa modalità di segnale è tipica delle proteine coinvolte
nell'interazione cellula-cellula (ad esempio inibizione da contatto, adesione tra cellule, o attività peculiari
delle cellule del sistema immunitario).
Segnale endocrino
Questa modalità coinvolge la propagazione di segnali tra cellule separate da ridotta o ampia distanza; le
cellule trasmittenti sono entità specializzate distribuite in tessuti ghiandolari capaci di sintetizzare e
secernere molecole segnale dette ormoni. Gli ormoni vengono poi rilasciati nel torrente ematico e
possono così raggiungere le cellule bersaglio, situate anche in numerosi distretti anatomici diversi.
Ovviamente soltanto le cellule che presentano recettori specifici per l'ormone potranno esserne
bersaglio.
Solitamente i recettori ormonali hanno un'elevatissima affinità e specificità per l'ormone, in quanto
l'effettiva concentrazione di ormone nel sangue, anche in condizioni di secrezione massiva da parte della
ghiandola, è piuttosto bassa (tra picomolare e nanomolare). A causa di questa grande specificità, il
complesso ormone-recettore è molto stabile.È importante notare che è richiesto un tempo abbastanza
lungo affinchè la concentrazione dell'ormone in circolo possa subire variazioni significative. Ciò
comporta una persistenza del segnale nelle cellule che lo hanno generato, ma anche una notevole
influenza sui meccanismi con cui le cellule estinguono la loro risposta.
Segnale paracrino
La cellula trasmittente non secerne le molecole segnale nel circolo sanguigno, ma semplicemente le
libera nella matrice extracellulare che la circonda. Di conseguenza la molecola secreta, per diffusione
passiva, si lega ai recettori presenti sul plasmalemma delle cellule viciniori. Le molecole segnale secrete
in modalità paracrina, per il loro ridotto raggio di azione, vengono definite "mediatori locali" e si
trovano in concentrazioni relativamente alte (range nano-micromolare). L'affinità dei recettori per i
mediatori locali è notevolmente più bassa rispetto a quella per molecole secrete secondo la modalità
endocrina, e come conseguenza di questa affinità limitata il mediatore può rapidamente dissociarsi dal
recettore non appena la concentrazione si abbassa. Ne deriva che il segnale paracrino verrà utilizzato
per comunicazioni intercellulari rapide e ben mirate.
Segnale sinaptico
Si tratta di un particolare tipo di segnale paracrino, utilizzato dalle cellule nervose a livello delle
sinapsi. Le molecole segnale sono dette neurotrasmettitori, ed essendo lo spazio sinaptico molto
ridotto, la concentrazione di neurotrasmettitore risulta molto alta (range micro-millimolare). Ne deriva
che l'affinità dei recettori per le molecole segnale sia relativamente scarsa. Infatti il neurotrasmettitore
si dissocia velocemente dal recettore, una volta diminuita la sua concentrazione nello spazio sinaptico.
In questo modo la neurotrasmissione ha una durata molto limitata (ms).
Segnale autocrino
Si può considerare come un segnale paracrino, con la caratteristica che la cellula trasmittente è anche la
cellula bersaglio. È tipica di organismi in fase di sviluppo (embrione, neonato) in cui è attiva la
differenziazione di organi e tessuti.
RECETTORI.
I recettori per le molecole segnale li suddividiamo in 2 classi principali: recettori intracellulari e
recettori presenti sulla membrana plasmatica.
Molecole di natura idrofoba, come gli ormoni steroidei o alcune vitamine, attraversono facilmente per
diffusione il plasmalemma della cellula bersaglio, e si legano a recettori citosolici di natura proteica,
tramite cui entrano nel nucleo dove agiscono come regolatori dell'espressione genica.
Sono recettori intracellulari quelli deputati a legare gli ormoni steroidei, derivati della vitamina D3,
l'acido retinoico e gli ormoni tiroidei.
Sono recettori di membrana quelli che agiscono come elemento di riconoscimento per una vastissima
gamma di molecole segnale che per l'elevato peso molecolare o l'elevata idrofilia non possono
attraversare il plasmalemma della cellula bersaglio. Queste molecole segnale si legano a proteine
integrali di membrana che fungono da recettori, i quali innescano una varietà di reazioni biochimiche
(cascata di trasduzione del segnale). La tappa più importante di una "cascata" di trasduzione è la
formazione del secondo messaggero, ovvero una molecola segnale intracellulare.
Abbiamo 4 categorie di recettori membranari: recettori-canale ionico (ligand-gated-ion channel);
recettori con attività enzimatica o che legano enzimi; recettori per citochine; recettori legati a proteineG
TRASDUZIONE INTRACELLULARE MEDIATA DA RECETTORI PRESENTI SUL PLASMALEMMA
Si definisce ligando una qualsiasi molecola in grado di legarsi a una proteina con funzione di recettore.
Un agonista è un ligando che in seguito ad interazione con il recettore è in grado di attivare la
trasduzione di un segnale; un antagonista è un ligando che interagendo con un recettore ne altera la
capacità di trasdurre il segnale.
Dopo la formazione del complesso ligando-recettore, quest'ultimo assume una conformazione "attiva"
che innesca la cascata di trasduzione, ad esempio attivando un enzima (effettore) che produce il secondo
messaggero, che a sua volta si lega ad altri enzimi, attivandoli.
Recettori ionotropici (ligand-gated-ion channel)
Numerosi neurotrasmettitori, seppure non tutti, si legano a recettori con caratteristiche di canali ionici
corredati da chiusure controllate da ligando. I ligandi extracellulari per questo tipo di recettori sono
esclusivamente molecole organiche a basso peso molecolare, come amminoacidi, ammine o nucleotidi.
Sono normalmente inclusi all'interno di vescicole sinaptiche (nella porzione terminale dell'assone che
partecipa alla sinapsi) che vengono liberate per rapida esocitosi nello spazio intersinaptico. Questi
ligandi diffondono rapidamente e si legano a recettori che hanno una scarsa affinità (per permettere una
rapida dissociazione una volta ridotta la concentrazione nello spazio intersinaptico).
L'interazione del neurotrasmettitore col recettore-canale ionico induce una modificazione
conformazionale pressochè istantanea che permette agli ioni di permeare il complesso recettore-ligando.
Il flusso di questi ioni modifica rapidamente il potenziale di membrana della cellula.
Se abbiamo un flusso di cationi, come Na+, la cellula andrà incontro a depolarizzazione (solitamente
eccitatoria); se abbiamo un flusso di anioni, come Cl-, la cellula andrà incontro a iperpolarizzazione
(solitamente inibitoria).
I recettori-canali per cationi legano neurotrasmettitori come acetilcolina, glutammato, serotonina e ATP.
I recettori-canali per anioni sono controllati da ligandi come il GABA e la glicina.
I recettori nicotinici dell'acetilconina, del GABA, della glicina, della serotonina e sono proteine
pentameriche, ovvero costituiti da 5 subunità che circoscrivono il canale ionico; i recettori del
glutammato sono invece proteine tetrameriche.
Recettori metabotropici: recettori con attività catalica
I recettori per molti fattori di crescita di natura polipeptidica e per ormoni sono proteine transmembrana
dotate di intrinseca attività catalica. L'interazione recettore-ligando comporta l'attivazione del dominio
catalitico intracellulare della proteina-recettore. Quest'ultima può agire come chinasi, fosfatasi,
proteasi e nucleoside fosfodiesterasi. I recettori catalitici meglio noti hanno attività tirosin-chinasica
(RTK); altri recettori di questa categoria comprendono recettori con attività serin/treonin-chinasica e
recettori con attività guanilato ciclasica.
La maggior parte degli RTK sono monomerici, ma alcuni, come quello per l'insulina (tetramerico, con
due subunità di legame e due catalitiche), sono multimerici. Il legame dell'agonista permette
l'avvicinamento del dominio catalitico intracellulare e la sua attivazione. La prima tappa catalitica è
l'autofosforilazione del recettore: vi sono infatti parecchi residui di tirosina nel dominio catalitico (Cterminale). Questi siti fosforilati del recettore fungono da centri di riconoscimento e ancoraggio delle
proteine substrato.
Geni che codificano per RTK possono comportarsi come oncogeni se soggetti a mutazioni.
Il segnale si spegne con la dimerizzazione del recettore, che induce l'internalizzazione del complesso
ligando-recettore in un endosoma che sarà poi digerito e smaltito dai lisosomi.
Recettori metabotropici: recettori accoppiati a proteine G
I recettori GPCR (G-Protein Coupled Receptor) interagiscono con un'ampia varietà di ligandi con
funzione di agonisti, quali peptidi, proteine, aminoacidi e loro derivati, catecolamine, lipidi, nucleotidi e
nucleosidi. Questi agonisti possono essere neuromodulatori, ormoni o mediatori locali. I GPCRs svolgono
importanti ruoli nella genesi di segnali di tipo endrocrino, sinaptico, paracrino e autocrino in una
moltitudine di cellule e tessuti. Numerose proteine negli organi di senso sono recettori legati a proteine
G; tra queste ricordiamo la rodopsina coinvolta nel processo della visione.
Ciascun recettore GPCR è costituito da una proteina integrale di membrana costituita da una subunità
con 7 domini transmembrana (7 eliche). Le proteine G sono invece costituite da 3 subunità. La subunità
α,idrofila, ha un sito di legame per il GDP o il GTP e possiede attività GTPasica che è cruciale per una
corretta regolazione della interazione recettore/proteina G.
In condizioni basali le proteine G esistono come complesso eterotrimerico αβγ in cui il sito di legame per
i nucleotidi presente nella subunità α è occupato da GDP. A seguito dell'interazione della proteina G con
il recettore GPCR legato all'agonista, il GDP dissocia dalla subunità α che lega subito GTP (molto più
abbondante). In questo stato, la subunità α si distacca dal complesso αβγ e interagisce con un effettore
(spesso un enzima che produce un secondo messaggero, ad esempio l'adenilato ciclasi che produce
cAMP a partire da ATP). Anche il dimero βγ può interagire con effettori (ad esempio canali ionici del
potassio, controllandone l'apertura).
Il segnale trasdotto tramite GPCR viene spento tramite fosforilazione del recettore da parte di PKA
(Protein Kinase A) o di ARK (Adrenergic Receptor Kinase), ma vi possono essere anche enzimi che
degradano l'agonista nello spazio extracellulare.
Alcune subunità α di proteine G contengono sequenze aminoacidiche che possono essere soggette ad
ADP-ribosilazione da parte di alcune tossine batteriche secrete da Vibrio Cholerae e Bordetella Pertussis.
La tossina colerica comporta una inibizione dell'attività GTPasica che si traduce in una dissociazione
permanente della subunità α dal dimero βγ. Si induce quindi un'attivazione continua dell'adenilato ciclasi
e dunque una costante ed elevata produzione di cAMP. Nell'intestino crasso l'alta concentrazione di
cAMP consente una frenetica attività della PKA, che fosforila i canali del cloro: l'iperattivazione di questi
canali altera profondamente il trasporto dell'acqua e dei sali, comportando una diarrea costante e
massiva tale da pregiudicare la sopravvivenza del soggetto infettato dal vibrione.
TRASDUZIONE DI SEGNALI INDOTTI DA AMP CICLICO
Il cAMP, sintetizzato dall'adenilato ciclasi, si lega alla PKA (Proteina Kinase A) costituita da 4 subunità, 2
regolatorie e 2 catalitiche. In dettaglio, 2 molecole di cAMP si legano a una subunità regolatoria,
permettendo il distacco della subunità catalitica che può così fosforilare vari substrati, come la
glicogeno fosforilasi chinasi (attivandola) o la glicogeno sintasi (inibendola). La fosforilazione mediata
dalla PKA può regolare l'attività di numerosi canali ionici (potassio,cloro,calcio). Inoltre, il trasbordo
della PKA nel compartimento nucleare comporta la regolazione di fattori di trascrizione di specifici geni.
Il cAMP viene demolito da apposite fosfodiesterasi, che producono 5'-AMP.
TRASDUZIONE DI SEGNALI INDOTTI DAL CALCIO
Lo ione calcio
è un messaggero ubiquitario ed ha un importante ruolo nei segnali che coinvolgono
la motilità cellulare, la fecondazione della cellula uovo, la neurotrasmissione, la secrezione, la
differenziazione e la proliferazione. La concentrazione intracellulare del calcio è finemente regolata e
utilizza una varietà di meccanismi, coinvolgendo anche la compartimentalizzazione cellulare. Ad
esempio, la concentrazione intracellulare può essere abbassata mediante sequestro di ioni dentro il
reticolo endoplasmatico grazie alle Ca 2+ ATPasi; il calcio può anche essere legato da proteine chelanti
come la calsequestrina. L'espulsione del calcio dal RE avviene tramite due tipi di canali: il canalerecettore per l'IP3 e il canale recettore per la rianodina, presente solo nel tessuto muscolare scheletrico
e cardiaco.
La calmodulina è una proteina ubiquitaria composta da due domini globulari simili organizzati ad alfaelica. Dato che ogni dominio presenta 2 siti di legame per il calcio, la calmodulina è in grado di legare 4
ioni calcio. Il complesso calcio-calmodulina è capace di modificare e legarsi a proteine substrato come la
cAMP-fosfodiesterasi, alcune isoforme dell'adenilato ciclasi e varie proteine chinasi. Tra quest'ultime
citiamo la Ca2+/Calmodulina-chinasi II, coinvolta nella regolazione del metabolismo delle riserve
energetiche, della permeabilità ionica, della neurotrasmissione e della fosforilazione della miosina.
(Ca2+)
TRASDUZIONE DI SEGNALI INDOTTI DA GMP CICLICO
il cGMP è un importante secondo messaggero implicato nella regolazione del processo della visione, del
volume ematico e della contrattilità di tipo muscolare e non. È sintetizzato dalla guanilato ciclasi a
partire da GTP ed è degradato da fosfodiesterasi specifiche. La guanilato ciclasi è presente in varie
isoforme ma 2 sono le più diffuse: una è una proteina integrale di membrana, facente parte del dominio
catalitico del recettore per il fattore natriuretico atriale (ANF) e l'altra è una proteina citosolica presente
in molti tessuti.
Il recettore per l'ANF è presente nelle cellule muscolari liscie che avvolgono i vasi e nelle cellule
renali. L'ANF è un ormone peptidico secreto dai miocardiociti atriali (cellule mioepiteliali) in risposta ad
un aumento di volemia e/o pressione sanguigna.
La guanilato ciclasi citosolica è un eterodimero che lega costitutivamente una molecola di eme.
L'interazione tra l'eme e il monossido d'azoto NO induce una modificazione conformazione della
guanilato ciclasi che acquista una capacità catalitica elevata. L'NO è generato enzimaticamente dalla
ossido nitrico sintasi (NOS) e diffonde velocemente attraverso le membrane.
La maggior parte degli effetti determinati da cGMP comportano l'attivazione di proteina chinasi ad esso
sensibili (PKG). Le PKG fosforilano:
• proteine che inibiscono i canali del calcio del reticolo endoplasmatico (attivandole)
• fosfatasi attive sulle catene leggere della miosina (indebolendo l'interazione actina-miosina)
• canali del potassio che inducono una iperpolarizzazione della membrana e pertanto reprimono il
flusso di calcio dall'esterno all'interno della cellula mediato dai canali del calcio voltaggio
dipendenti (VOCC).
L'effetto finale del cGMP è spesso il rilassamento della muscolatura liscia (in quanto si evita l'afflusso di
calcio e viene ostacolata l'interazione tra actina e miosina, entrambi fattori fondamentali per la
contrazione muscolare).
TRASDUZIONE DI SEGNALI INDOTTI DA FOSFOLIPIDI
Enzimi afferenti alla classe delle fosfolipasi C idrolizzano fosfatidilinostilo e formano inositolo fosforilato
e diacilgliceroli (digliceridi); i fosfatidilinositoli possono anche essere ulteriormente fosforilati da una
fosfatidilinositolo-3-chinasi con formazione di fosfatidilinositolo-3,4,5-trifosfato (PIP3). Le fosfolipasi D
idrolizzano fosfatidil-etanolammine/coline per dare infine diacilgliceroli; le fosfolipasi A2 idrolizzano
differenti fosfolipidi per produrre acido arachidonico e lisofosfolipidi.
Recettori GPCR o con attività tirosin-chinasica attivano le fosfolipasi C che producono IP3 e DAG
(diacilglicerolo) a partire da PIP2. Il DAG interagisce con le PKC (proteina chinasi C), attivandole. Le
numerose isoforme di PKC fosforilano fattori di trascrizione, canali ionici, ionofori e altre chinasi.
La fosfatidilinositolo-3-chinasi, che fosforila fosfoinositidi per ottenere PIP3, può essere attivata
mediante fosforilazione da recettori con attività tirosin chinasica legati all'agonista (spesso fattori di
crescita). Altre isoforme sono invece attivate da interazione con il dimero βγ di proteine G trimeriche.
PIP3 si lega alle PKB (proteina chinasi B), attivandole. Questa famiglia di chinasi potenzia la
sopravvivenza cellulare, reprimendo le vie di segnale responsabili della morte cellulare e regolando altre
chinasi coinvolte nel trasporto del glucosio e nel metabolismo del glicogeno.
Infine le fosfolipasi A2, regolate tramite numerosi fattori tra cui il calcio, producono acido arachidonico,
subito catabolizzato e ossidato nel citoplasma con formazione di eicosanoidi. Gli eicosanoidi, a differenza
di altri secondi messaggeri, sono secreti nell'ambiente cellulare dove agiscono come agonisti di recettori
presenti sulla superficie di cellule vicine. È un segnale autocrino/paracrino coinvolto nei processi di
infiammazione, coagulazione del sangue, controllo del tono vascolare, funzionalità renale ed altri.