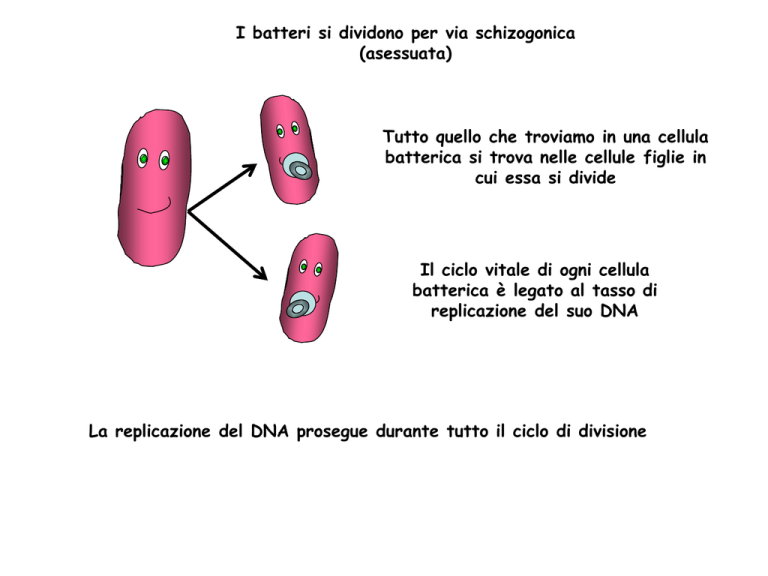
I batteri si dividono per via schizogonica
(asessuata)
Tutto quello che troviamo in una cellula
batterica si trova nelle cellule figlie in
cui essa si divide
Il ciclo vitale di ogni cellula
batterica è legato al tasso di
replicazione del suo DNA
La replicazione del DNA prosegue durante tutto il ciclo di divisione
L’inizio della replicazione richiede un DnaA, DnaB, DnaC, Hu, Girasi, SSB
set di proteine specifiche
oriC
i filamenti si separano in corrispondenza
di un sito particolare
(oriC-245 bp) che è l’origine di
replicazione del cromosoma
Osservando le fasi della replicazione al ME, si
distingue una struttura a “occhio”
terC
Seguita da una struttura a
“Theta” (θ)
Nella regione oriC sono presenti sequenze ripetute di 9 e 13 basi, diverse
tra loro ma entrambe ricche in AT
13 bp
13 bp
9 bp
13 bp
Dna-A si lega alle sequenze di 9bp
13 bp
13 bp
13 bp
9A
bp
9Abp
9A
bp
Fino a formare un nucleo di 20-40 monomeri
attorno al quale si avvolge il DNA di oriC
9 bp
9 bp
I filamenti si separano in corrispondenza delle sequenze di 13 bp
DnaC (fattore di carico) favorisce il
legame dell’elicasi (DnaB)
C
La DNA-girasi coadiuva DnaB in
questo processo
B
C
DnaB si lega alle estremità
dell’apertura; il distacco di
DNAC la attiva in modo che il
DNA comincia a essere svolto
B
Le proteine SSB (Single Strand Binding)
impediscono il riappaiamento dei filamenti
L’enzima primasi (DnaG) si lega alla bolla di replicazione e
sintetizza primer di RNA per entrambi i filamenti, con
l’intervento anche di altre proteine accessorie (PriA,B,C e DnaT)
P
B
L’insieme di queste proteine costituisce il «primosoma»
La sintesi, operata da DnaPol III,
procede nelle due direzioni
B
ORIGINE
FORCA REPLICATIVA
ORIGINE
FORCA REPLICATIVA
la Dna-polimerasi III inizia a duplicare i filamenti
aggiungendo i nucleotidi all’estremità 3’ (-OH)
Il “filamento guida” (loading-veloce) può
essere sintetizzato in modo continuo
Ma il “filamento copia” (lagging-lento) è
sintetizzato in modo discontinuo
(frammenti di Okazaki)
oriC
3’
5’
3’
Frammento di
Okazaki
Forche replicative
5’
Intervengono quindi diversi
enzimi, il cui insieme è definito
«REPLISOMA»
Zona del replisoma
REPLISOMA
Primasi (Dna G)
DNA pol I
Ligasi
Elicasi (Dna B)
DNA polIII
ssb
Il filamento lagging forma un cappio per poter
essere duplicato
topoisomerasi
PER IL FILAMENTO LAGGING SERVE
L’INTERVENTO DI MOLTI ENZIMI
3’
P
5’
Primasi: sintetizza inneschi di RNA
3’
5’
III
DNA polimerasi III: aggiunge nucleotidi al 3’ fino a raggiungere il
frammento precedente
3’
I
5’
5’
L
DNAsi polI: elimina l’innesco di RNA, lo sostituisce con DNA e si
stacca
3’
5’
DNA ligasi I: unisce i frammenti in un unico filamento
La DNA-polimerasi III ha
diverse subunità
Core enzima
α (attività polimerasica)
ε (esonucleasi correzione di bozze 3’5’)
θ
core
core
t (dimerizzazione)
γδχψ: complesso di trasporto
della pinza
β “pinza scivolante”
le subunità attive del dimero di PolII
si muovono in direzione 3' 5’
DnaB
sintetizzando il DNA
in direzione 5' 3’
β
β
Dopo il completamento di un
frammento di Okazaki, la pinza lo lascia
Una nuova subunità beta
tira il primer successivo
portandolo a contatto con
il core enzima
DnaB
sintetizzando il DNA
in direzione 5' 3’
β
β
La replicazione è soggetta a una continua
correzione di bozze
PolIII deve avere alle spalle una coppia di nucleotidi appaiati correttamente
(necessità dell’innesco!)
In caso contrario si ferma
Torna indietro
Elimina la base sbagliata e
la sostituisce
Poi riprende la sintesi del
nuovo filamento
La replicazione termina in corrispondenza di “ter C” (sito di terminazione) dove le
forche si incontrano in corrispondenza di copie multiple di una sequenza di 23 bp
La prima forcella che raggiunge ter C, a cui è legata la proteina Tus (Terminus
Utilization Substance) si ferma; la seconda si ferma quando incontra la prima
I due cromosomi figli sono
intrecciati in concatenamero
Le topoisomerasi provvedono a
separarli
E a rinsaldare la rottura dopo la
separazione
Nel ciclo cellulare di E. coli si possono distinguere diversi momenti
I
variabile
C
D
40 min
20 min
Fase I (interinizio) la cellula si prepara alla replicazione del DNA
Si osserva in cellule che si dividono lentamente (T>60’);
Fase C (copia) periodo necessario a replicare il DNA. Il limite è
rappresentato dalla velocità di sintesi della DNA polimerasi
Fase D (divisione): tra il completamento della replicazione del
cromosoma e la divisione delle cellule figlie
La velocità di divisione può essere inferiore ai 40 minuti
necessari per la duplicazione del cromosoma
infatti diverse replicazioni si avviano in sequenza
rapida, e il cromosoma che entra in una cellula
figlia ha già intrapreso una nuova duplicazione
La scansione temporale tra l’inizio di una replicazione è
regolata da tre parametri
Stato di
emimetilazione di
OriC
Rapporto
ATP/ADP
Rapporto
DnaA/cassette
Quando la cellula cresce e raggiunge dimensioni idonee
oriC
La concentrazione di DnaA permette
che si formino due replisomi uno su
ciascun filamento di OriC
I replisomi iniziano a muoversi in
direzioni opposte
il DNA legato a DnaA si svolge e DnaA
viene gradatamente rimossa da oriC
Una volta rilasciata, DnaA-ATP si trasforma
DnaA-ATP
DnaA-ADP
Questo contribuisce a prevenire nuovi inizi prematuri
Rapporto
ATP/ADP
la presenza di ATP è segno
che la cellula ha raggiunto le
dimensioni per dividersi
La quantità di DNA è abbondante:
è tempo di dividersi
DnaA ha la stessa affinità per
ATP o ADP
Ma solo DnaA-ATP può iniziare la
duplicazione del cromosoma
ADP
ATP
ATP
DUPLICAZIONE SI’
ADP
DUPLICAZIONE NO
Per ogni replicazione che ha inizio
sono necessari 5 dimeri di DnaA
Il rapporto tra proteina e siti
bersaglio è importante
La sintesi di DnaA è
strettamente regolata
Dopo la divisione è necessario che i livelli di proteina
tornino a salire prima di un nuovo inizio
Il filamento parentale è metilato
Quello neo formato non lo è ancora
GAT C
DAM
ATP
DnaA
Un nuovo inizio è possibile solo se oriC è
del tutto metilata
GAT C
GAT C
DAM
SeqA è una proteina di membrana che riconosce «GATC»
solo se è emimetilata; quando si lega a due o più siti
GATC in corrispondenza di OriC, mantiene lo stato
emimetilato della regione, perché maschera le cassette
alla Dam-metilasi DnaA non può legarsi e non si hanno
nuovi inizi
Il distacco casuale di SeqA permette alla Dam-metilasi di agire
GAT C
GAT C
ATP
ATP
DnaA
DnaA
DnaA può ora attaccarsi al nuovo filamento, metilato, e dare inizio a un nuovo ciclo,
L’interferenza di SeqA ritarda fortemente la metilazione di oriC (3’ per tutto il
resto del cromosoma- tra 10 e 13’ per questa piccola regione) impedendo un
reinizio precoce anche nel caso in cui lo stato di DnaA lo permettesse
La divisione di una cellula comporta la formazione di un setto, che avviene quando
la distanza tra il centro dei due nucleoidi è pari a una “lunghezza cellulare”
1L
La forma della cellula batterica si mantiene durante la divisione
La cellula si allunga; il cromosoma si duplica,
restando attaccato alla membrana
I nucleoidi si separano
la proteina FtsZ forma un anello (Z-ring)
nello spazio tra i nucleoidi, e recluta altre
proteine che partecipano alla formazione del setto
La formazione dello Z-ring è dovuta alla capacità della
proteina FtsZ di polimerizzare
Z-ring
FtsZ-GFP
La sintesi parte da un “sito del setto a livello della membrana
citoplasmatica e prosegue nelle due direzioni, a formare l’anello
L’anello si stringe progressivamente
Forzando la membrana
citoplasmatica verso l’interno
il setto si completa, si formano due pareti
distinte e le cellule figlie si separano
la divisione avviene sempre e solo dopo la duplicazione del DNA
(se la sintesi di DNA si blocca la divisione non ha luogo)
nei batteri bastoncellari il setto si localizza
esattamente al centro della cellula
SI
NO
Il corretto posizionamento del setto è dovuto a :
OCCLUSIONE
DEL NUCLEOIDE
SISTEMA Min
il cromosoma circolare parzialmente replicato
è attaccato alla membrana plasmatica per le origini
di replicazione dei cromatidi fratelli
I siti d’attacco sono indipendenti e ciascun
cromosoma segue la crescita della membrana .
Il setto si forma al centro della cellula in divisione
Ogni cellula figlia ha un cromosoma connesso alla
membrana plasmatica.
OCCLUSIONE DEL NUCLEOIDE
La presenza del nucleoide in una regione
inibisce la formazione del setto
Nella regione mediana la concentrazione
del DNA è diminuita per la separazione del
nucleoidi: il setto è libero di formarsi
La proteina MukB è probabilmente implicata nell’addensamento del
nucleoide. In sua assenza, l’effetto negativo del nucleoide sulla
formazione degli Z-ring è parzialmente soppressa
Le estremità della cellula (poli) sono libere dal
nucleoide e potenziali siti di formazione del setto
Ma la formazione di un setto in corrispondenza di un polo provoca
la formazione di “minicellule” (piccole e prive di cromosoma)
minicellula
In passato, ceppi mutati erano usati per produrre minicellule allo scopo di operare
trasformazioni enzimatiche in un contesto cellulare impossibilitato a moltiplicarsi
SISTEMA Min:
La formazione del setto ai poli della cellula
è regolata negativamente anche dal sistema Min CDE
MinD è una ATPasi che si associa
alla membrana e forma filamenti
quando lega ATP ma se ne stacca
e passa al citoplasma se lega ADP
MinC inibisce FtsZ; non è in
grado di spostarsi lungo la
cellula ma si associa a MinD
seguendone le oscillazioni
MinE forma un anello (E-ring)
all’estremità della zona occupata
da MinD e stimola l’idrolisi di
MinD, seguendo la contrazione
della zona occupata da questa
durante un ciclo cellulare, quindi, la presenza di MinC attivata è
statisticamente maggiore ai due poli dove impedisce a FtsZ di reclutare
le altre proteine necessarie a formare il setto
Una volta nel citoplasma, MinD-ADP torna a legare ATP e a a legarsi
alla membrana, al polo opposto, dando inizio a un nuovo ciclo
durante la replicazione l’informazione genetica è
copiata (DNADNA) per essere perpetuata
Ma durante la vita della cellula l’informazione genetica è
copiata per ottenere l’ RNA e le proteine necessarie
(DNARNA = trascrizione dei geni)
tRNA
RNA 5; 16; 23
+
Proteine
ribosomi
PROTEINE
mRNA
RNA polimerasi
Nucleo enzimatico
La RNA polimerasi batterica è un complesso
proteico costituito da 5 subunità: α2ββ’σ
α2ββ’
Fattore sigma
σ
Il fattore sigma riconosce il promotore e viene rilasciato
dopo che sono state trascritte le prime 5-6 basi
I batteri hanno la possibilità di sintetizzare fattori sigma alternativi che
riconoscono promotori con consensus anche molto diversi quello descritto, che è il
promotore “housekeeping, riconosciuto dal sigma che, in E. coli, ha il nome di “70”
Il nucleo enzimatico sintetizza RNA sullo stampo di DNA Aprendo la
doppia elica, che si richiude alle sue spalle e copiando lo stampo
CONFORMAZIONE DEL DNA
Lo stato di avvolgimento del DNA nella regione del
promotore influenza il grado di trascrizione
B-DNA
“standard”
Z-DNA
regioni ricche di GC
e/o metilate
L’inizio del gene da copiare è indicato alla RNA
polimerasi da una regione del promotore
La regione -10 indica l’inizio del
gene da trascrivere
Q
U
I
Di là
La regione -35 determina il senso
della trascrizione
-35
-10
-10
-35
regione -35
T82T84G78A65C54A45
regione -10
T80A95T45A60A50T96
“TERMINAZIONE”
Rho-indipendente
la sequenza di terminazione causa
il distacco della polimerasi
5’-A-A-A-G-C-C-G-C-C-G-N-N-N-N-C-C-G-G-C-G-G-C-U-U-U-U-U-U-U-3’
Formando una forcina grazie all’appaiamento
delle sequenze invertite e ripetute
N
N
N
G C
C G
C G
G C
C G
G C
A U
A U
A U
N
C
regione ricca in GC
serie di U
U U U U U
Rho-dipendente
la sequenza di terminazione arresta la
polimerasi; Rho ne causa il distacco
la polimerasi è ferma in una
regione ricca di GC
La proteina Rho riconosce una
sequenza ricca di “C” nel trascritto
Vi si lega e avanza
in direzione 5’3’
CGCGC
ρ cccc
Raggiunge la polimerasi e scioglie
la struttura ibrida DNA-RNA
Il tratto compreso tra un promotore e un terminatore è la “unità di trascrizione” e
comprende il sito d’attacco al ribosoma (RBS- regione Shine-Dalgarno)
un solo gene
mRNA=monocistronico
P
T
ORF
rbs
Più di un gene
(operone)
mRNA=policistronico
rbs
P
rbs
rbs
ORF 1
rbs
rbs
rbs
ORF 2
rbs
ORF 3
rbs
ORF 4
T
Nei procarioti trascrizione traduzione avvengono contemporaneamente. Appena
l’estremità 5’ dell’mRNA è sintetizzata la traduzione può iniziare
5’
mRrna
AGGAGGUUUGACCUAUG
UCCUCCA
3’
16s Rrna
5’
3’
Le due subunità del ribosoma procariotico si assemblano quando un mRNA si lega al
ribosoma (interazione RBS-16S rRNA), un tRNAf-met si lega al primo codone, formando
il complesso d’inizio su cui si assembla la subunità 50S
Nei batteri, anche se più raramente, il codone d’inizio
può essere anche GUG o UUG invece che AUG. Il
tRNA iniziatore è comunque sempre tRNAf-met
Il ribosoma assemblato (70S) scorre sul mRNA, “leggendolo” e traducendolo
LA CONOSCENZA DELLE ESIGENZE NUTRIZIONALI, DEGLI
OPTIMUM DI TEMPERATURA E pH E DELLE STRATEGIE DI
PRODUZIONE DI ENERGIA DEI MICRORGANISMI
E’ indispensabile per la coltivazione
in laboratorio
Che fornisce informazioni sulla
fisiologia
E permette di ottenere biomassa
La crescita di una coltura è rappresentata
dall’aumento del numero delle cellule
Una curva di crescita "standard"
(sistema chiuso) prevede diverse fasi,
correlate
al consumo dei
nutrienti
all’accumulo dei
prodotti di scarto
3
4
2
1
A diverse velocità di crescita corrispondono
diverse quantità di ribosomi, DNA e proteine
la curva di crescita è riferita alla
POPOLAZIONE
Le cellule che crescono
velocemente sono più grandi
e si segue attraverso la variazione del
numero di Unità Formanti Colonia (UFC)
La crescita di una coltura è rappresentata
dall’aumento del numero delle cellule
Una curva di crescita "standard"
(sistema chiuso) prevede diverse fasi, correlate
al consumo dei
nutrienti
all’accumulo dei
prodotti di scarto
3
4
2
1
la curva di crescita è riferita alla
POPOLAZIONE
E si segue attraverso la variazione
dell’assorbanza della coltura
1-Fase di latenza (lag)
Corrisponde al tempo necessario alle cellule batteriche per
adeguarsi alle condizioni del terreno
La sua durata dipende
dal tipo di inoculo
(età, entità)
dalla natura del terreno
latenza
La Fase di latenza è un esempio di crescita sbilanciata
alcuni componenti sono sintetizzati e altri no
Passando a un ambiente PIU’ ricco
prima di moltiplicarsi vanno sintetizzati
nuovi ribosomi per adeguare il ritmo della
sintesi proteica alle nuove disponibilità
Terreno ricco
Terreno povero
Passando a un ambiente MENO ricco
le cellule si adeguano al
nuovo stato
Terreno ricco
Terreno povero
Sopprimono le attività non necessarie e non si
moltiplicano finchè non siano stati prodotti gli
enzimi biosintetici necessari a sopravvivere
Se la coltura è invecchiata
o danneggiata
È necessario riparare i danni prima che possa
iniziare la moltiplicazione
2-Fase esponenziale (log)
la crescita raggiunge la massima
velocità possibile
la popolazione cellulare è uniforme (adatta
per studi biochimici e fisiologici)
logaritmica
la fase esponenziale è un esempio di CRESCITA BILANCIATA in cui tutti i
componenti cellulari sono sintetizzati a velocità costanti e coordinate
3-Fase stazionaria
i batteri arrivano a densità di
popolazione di circa 109cellule/ml, alghe,
miceti e protozoi a circa 106
una coltura entra in fase stazionaria
a causa della deplezione in nutrienti (o in O2)
o dell’accumulo di metaboliti tossici (es ac lattico)
stazionaria
4-Fase di morte accelerata
Questa fase è evidente solo se si contano le cellule: l’assorbanza
della coltura non scende se le cellule morte non lisano
4
A volte può esserci una fase di sopravvivenza
Lo studio della curva di crescita permette di
sorvegliare lo stato della coltura
Per motivi pratici, si esegue spesso
rilevando l’assorbanza della coltura stessa
Con questa tecnica, la curva
assume un aspetto diverso
Una curva particolare è la diauxia
la popolazione batterica
esaurisce un primo
nutriente
Entra in una seconda
fase lag
Sintetizza gli enzimi necessari a utilizzare
un’altra fonte di carbonio (inducibili)
riprende a crescere
secondo la normale curva
COLTURE SINCRONE
La sequenza di quel che accade durante la
crescita di una popolazione batterica
Si può seguire con precisione
in una coltura sincrona
La sincronia si
perde dopo 2-3
generazioni
che può essere avviata con mezzi fisici (filtrando
per selezionare le cellule più piccole)
O limitando i nutrienti
La velocità di crescita può essere calcolata con l’equazione
n = logN – log N0/0,301
valore di n in un intervallo
di tempo definito
n = numero di generazioni
N = numero di cellule
Tempo generazionale
log 2 x intervallo tempo
logOD(2)-logOD(1)
Quanto tempo impiegherà
la mia coltura ad arrivare
a una certa densità?
Tgen*logOD(?)-log OD(obs)
log(2)
A diverse velocità di crescita corrispondono diverse quantità di
ribosomi, DNA e proteine
Le cellule che crescono
velocemente sono più grandi
Di quelle che crescono
lentamente
COLTURE CONTINUE
A volte, per studiare la crescita microbica in
condizioni di nutrienti basse, simili a quelle naturali
È utile ottenere colture che restino in fase
esponenziale, crescendo a velocità nota
Questo è possibile nel
CHEMOSTATO
CHEMOSTATO
il terreno contiene un fattore
limitante
motore
aria
Terreno
sterile
crescita
scarto
il tasso di crescita dipende dalla velocita’ di immissione di terreno fresco
e può essere mantenuto costante
In alcuni casi la parete è formata da due strati e solo quello
interno partecipa alla formazione del setto
Quando il setto si ispessisce rompe
la parte esterna della parete su un
solo lato
le due cellule figlie si allontanano facendo perno sul lato
opposto a quello della rottura
Questo meccanismo è detto divisione a scatto
DIVISIONE POLARE
A volte la crescita e la divisione della
cellule batteriche sono polari
La divisione per gemmazione è uno di questi casi
LA DIVISIONE INEGUALE PERMETTE L’EVOLUZIONE DI UNA
DIVERSA COMPLESSITÀ STRUTTURALE
Nitrobacter: le lamelle di invaginazioni della
membrana non sono presenti al polo della cellula
da cui si origina la gemma
gemmazione
Gemmazione con ifa
Anche il processo di sporificazione è una
divisione ineguale
Come tutti i batteri, gli sporigeni si
dividono solitamente per schizogonia
Ma in condizioni di carenza di nutrienti
o di altri tipi di stress ambientali
O in colture molto affollate, si innesca
il processo di sporulazione
VII- rilascio
VI- maturazione
II-Divisione asimmetrica
III- Protoplasto prespora
V- tuniche
IV- Parete e cortex
Ciclo cellulare di Caulobacter crescentus:
alternanza delle forme prostecata e flagellata
Il ciclo vitale di Streptomyces
uno dei cicli più complessi tra i procarioti
1) Micelio del substrato
Un micelio vegetativo (Micelio del substrato)
formato da ife intrecciate, dà luogo a una colonia
Le ife si affondano nel terreno,
traendone i necessari nutrienti
Nel micelio del substrato i filamenti non
sono settati e intrecciandosi danno alla
colonia una consistenza compatta
lo sviluppo coordinato multicellulare porta alla produzione di antibiotici e,
contemporaneamente, inizia a comparire un micelio aereo specializzato
2) MICELIO AEREO
Quando le ife aeree sono cresciute, inizia un secondo momento di
sviluppo che porta a una nuova e articolata regolazione della
crescita, del ciclo cellulare e dei processi di morfogenesi
Quando si formano gli sporofori (e poi le spore)
la colonia assume un aspetto polveroso
ANCHE IL CICLO VITALE DEI MYXOBATTERI E’ COMPLESSO
Inizio del
differenziamento
Corpo fruttifero
germinazione
sciame











![mutazioni genetiche [al DNA] effetti evolutivi [fetali] effetti tardivi](http://s1.studylibit.com/store/data/004205334_1-d8ada56ee9f5184276979f04a9a248a9-300x300.png)