Università degli Studi Kore di Enna
Facoltà di Scienze dell’Uomo e della Società
CdL in “Scienze delle attività motorie e sportive”
AA 2013-2014
Biochimica
Domenico Ciavardelli - Ph.D.
email: [email protected]
AA 2013-2014
Biochimica-Lezione 1
Domenico Ciavardelli
Biochimica: dettagli
•36 ore
•Orario di Ricevimento:
Mercoledì 11,30 – 13,30 e giovedì 11,30 – 13,30,
Studio Docenti presso il Plesso di Psicologia; da
• Contatti:
concordare via e-mail.
[email protected]
•In ogni e-mail dovrete specificare nell’oggetto il corso
di laurea e indicare nome, cognome e recapito
telefonico!
AA 2013-2014
Biochimica-Lezione 1
Domenico Ciavardelli
Biochimica: libri di testo
Antonio Di Giulio, Amelia Fiorilli e Claudio Stefanelli
Biochimica per le Scienze Motorie,
prima edizione edizione
(Casa Editrice Ambrosiana, 2011)
AA 2013-2014
Biochimica-Lezione 1
Domenico Ciavardelli
Biochimica: libri di testo
+
Michele Samaja,
Massimo Stefani e Niccolò Taddei,
Chimica, Biochimica e Biologia Applicata, Corso di Biochimica per le Lauree Sanitarie,
seconda edizione (Piccin Nuova Libraria, 2007)
seconda edizione (Zanichelli, 2008)
AA 2013-2014
Biochimica-Lezione 1
Domenico Ciavardelli
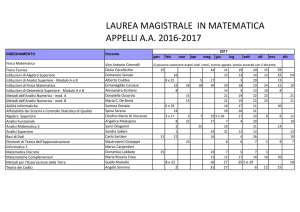
Biochimica: programma
Struttura delle
lezioni frontali
N. ore
Contenuti
5
Introduzione alla Biochimica:
3
Molecole organiche: descrizione della struttura e delle proprietà chimico fisiche dei
acqua, soluzioni e loro proprietà; equilibri chimici;
acidi e basi: definizione; significato biologico del pH e delle sue variazioni.
principali gruppi funzionali (idrocarburi alifatici e aromatici; alcoli, tioli e ammine; aldeidi e
chetoni; acidi carbossilici e derivati anidridici, esterei e ammidici; tioesteri; derivati dell’acido
fosforico).
4
Struttura e
biomolecole:
proprietà
chimico-fisiche
delle
principali
carboidrati (il legame glicosidico; monosaccaridi, oligo- e polisaccaridi);
lipidi (legami estereo e fosfoestereo; trigliceridi, fosfolipidi, colesterolo e colesterilesteri);
acidi ribonucleici e deossiribonucleici (doppia elica, legame fosfodiestereo
e
interazione tra basi puriniche e pirimidiniche);
proteine (amminoacidi: proprietà chimico-fisiche e classificazione sulla base della catena
laterale; legame ammidico; struttura primaria, secondaria, terziaria e quaternaria delle proteine,
avvolgimento casuale; denaturazione: effetto della temperatura e del pH; proteine fibrose:
actina, miosina e collagene; proteine globulari: mioglobina ed emoglobina; affinità per
l’ossigeno: descrizione della curva di saturazione; definizione di allosterismo; effettori
allosterici positivi e negativi dell’emoglobina; emoglobina e pH ematico: regolazione e potere
tampone).
AA 2013-2014
Biochimica-Lezione 1
Domenico Ciavardelli
Struttura
delle lezioni
frontali
N. ore
5
Contenuti
Introduzione al metabolismo:
anabolismo e catabolismo.
Cenni di termodinamica; definizione di processo endoergonico ed esoergonico e variazione di energia libera di Gibbs; diagrammi
dell’energia: definizione di energia di attivazione, stato di transizione e intermedio di reazione.
Introduzione al catabolismo ossidativo:
reazioni di ossidoriduzione e differenza di potenziale normale di riduzione; relazione tra G° e E°.
Cenni di cinetica e catalisi.
Enzimi: classificazione, definizione di cofattore e coenzima, catalisi enzimatica, costante di Michaelis-Menten e regolazione
(inibizione diretta, indiretta, retroinibizione).
Bioenergetica: molecole ad alta energia (adenosina 5’-trifosfato, tioesteri; fosfocreatina): accoppiamento di reazioni e calcolo di
G° e E° per il processo complessivo.
Membrana cellulare: potenziale elettrochimico di membrana, osmosi e diffusione, trasporto passivo facilitato e trasporto attivo.
16
Metabolismo dei carboidrati:
digestione dei polisaccaridi: biodisponibilità; assorbimento intestinale del glucosio; prima fase della respirazione cellulare:
trasformazione del glucosio in piruvato e bilancio energetico; il destino anaerobico del piruvato: fermentazione omolattica e
fermentazione alcolica; destino aerobico del piruvato: il mitocondrio, ciclo di Krebs e bilancio energetico, reazioni anaplerotiche;
catena di tarsporto degli elettroni e fosforilazione ossidativa: ipotesi chemiosmotica e calcolo della resa energetica; glicogeno,
glicogenolisi e glicogenosintesi: descrizione, cenni sulla regolazione ormonale, modificazioni concertate di glicogenosintasi e
glicogenofosforilasi; gluconeogenesi: descrizione, cenni sulla regolazione ormonale e regolazione concertata di glicolisi e
gluconeogenesi; ciclo di Cori.
Metabolismo dei lipidi:
digestione dei lipidi: ruolo dei sali biliari, assorbimento intestinale, trasporto e complessi lipoproteici; il tessuto adiposo: cenni sulla
regolazione ormonale; beta-ossidazione e bilancio energetico; cenni sulla biosintesi degli acidi grassi; integrazione di catabolismo
glucidico e lipidico; corpi chetonici.
Metabolismo delle proteine:
digestione delle proteine ed enzimi proteolitici; transaminazione e deaminazione ossidativa: ruolo di glutammato, glutammina e
alanina; ciclo dell’urea ed integrazione con il ciclo di Krebs; amminoacidi gluconeogenici e chetogenici; ciclo glucosio-alanina;
cenni sulla biosintesi delle proteine.
3
AA 2013-2014
Elementi di Biochimica d’organo e di tessuto: integrazione del metabolismo glucidico, lipidico eBiochimica-Lezione
proteico in fegato e muscolo. 1
Adattamenti metabolici all’attività motoria.
Domenico Ciavardelli
E’ previsto che lo studente conosca i seguenti argomenti:
• Modello atomico e definizione di orbitale.
•Costruzione delle configurazioni elettroniche degli
elementi dei primi 3 periodi.
•Ibridazione del carbonio.
•Proprietà periodiche della materia ed elettronegatività.
•Definizione di valenza e numero di ossidazione.
•Legame: legame covalente puro, legame covalente polare,
legame dativo, legame ionico.
Tali argomenti sono stati trattati durante i CORSI DI
ORIENTAMENTO.
AA 2013-2014
Biochimica-Lezione 1
Domenico Ciavardelli
Biochimica: metodi di valutazione
•L’esame prevede una prova scritta e una prova orale.
• L’ammissione alla prova orale è
CONDIZIONATA
dal superamento della prova scritta.
•La prova scritta prevede 15 domande a risposta multipla e 5
quesiti a risposta aperta.
•La valutazione minima per l’ammissione alla prova orale è di
15 punti su 30 complessivi.
AA 2013-2014
Biochimica-Lezione 1
Domenico Ciavardelli
Perché Biochimica?
Biochimica
Fisiologia
Anatomia
“Human physiology is the science of the mechanical,
physical, and biochemical functions of humans, their
organs, and the cells of which they are composed.”
AA 2013-2014
Biochimica-Lezione 1
Domenico Ciavardelli
Lezione 1:
Introduzione alla Biochimica
AA 2013-2014
Biochimica-Lezione 1
Domenico Ciavardelli
:
:
Vettore momento di dipolo,
L’acqua è una molecola polare
χO-H = 1,3
Doppietti elettronici non condivisi dell’ossigeno
Ricordare che la configurazione elettronica dell’ossigeno è:
O:[He] 2s2 2p4
AA 2013-2014
Biochimica-Lezione 1
Domenico Ciavardelli
Polarità e solubilità
Interazioni con il solvente.
Classificazione in base alla solubilita’:
•Sostanze idrofile: solubili in acqua (polarita’ maggiore).
Es: proteine citoplasmatiche, carboidrati, acidi nucleici.
•Sostanze lipofile o Idrofobe: scarsamente solubili in acqua, solubili in solventi
organici poco polari (polarita’ minore).
Es: lipidi, proteine di membrana.
•In generale
“ simile scioglie simile”.
AA 2013-2014
Biochimica-Lezione 1
Domenico Ciavardelli
Interazioni Intermolecolari (Forze di Van der Waals).
Sono legami più deboli rispetto ai legami INTRAMOLECOLARI (covalente, ionico, dativo)
•Legame di idrogeno: interazione elettrostatica tra N, O, X e un atomo di idrogeno legato a O, N, X.
•Legame ione-dipolo: interazione elettrostatica tra una specie carica e una molecola polare.
•Interazioni Dipolo-Dipolo o dipolo-dipolo idotto: interazione elettrostatica tra dipoli (due molecole polari o
una molecola polare ed una apolare in cui viene GENERATO un momento di dipolo).
•Forze di dispersione (LONDON): interazione elettrostatica tra dipoli temporanei generati IN DUE
MOLECOLE APOLARI dalla repulsine tra le NUBI ELETTRONICHE (orbitali molecolari).
•OSS.: nel caso di MACROMOLECOLE come molte biomolecole tali interazioni potranno essere anche
intramolecolari.
Legame d’idrogeno
0.177nm
Legame covalente
0.0965nm
AA 2013-2014
Biochimica-Lezione 1
Domenico Ciavardelli
Gross L., Mohn F., Moll N., Liljeroth P., Meyer G. “The chemical structure of a molecule
resolved by Atomic Force Microscopy” Science, 2009; 325: 11110-1114.
http://cen.acs.org/articles/87/i35/Molecules-Atoms-Bonds-Visualized.html
AA 2013-2014
Biochimica-Lezione 1
Domenico Ciavardelli
SOLVATAZIONE degli ioni e stabilizzazione in soluzione acquosa
I composti IONICI (ELETTROLITI) sono di solito molto
solubili in acqua (interazione ione-dipolo).
Ione Na+ solvatato
Ione Cl- solvatato
AA 2013-2014
Biochimica-Lezione 1
Domenico Ciavardelli
AA 2013-2014
Biochimica-Lezione 1
Domenico Ciavardelli
Biomolecole polari, anfotere, lipofile
(forma ionica a pH=7)
Polari
Glucosio
Glicina
Gruppi polari
Gruppi lipofili
Molto solubili in acqua.
Aspartato
Lattato
Glicerolo
Lipofile
Esteri (Cere)
Solubili in solventi apolari.
Anfotere
Fenilalanina
Fosfatidilcolina
Molecole
amfipatiche
(contenenti
contemporaneamente gruppi polari e
apolari)
sono
i
DETERGENTI
comunemente utilizzati per solubilizzare
in acqua sostanze apolari.
AA 2013-2014
Biochimica-Lezione 1
Domenico Ciavardelli
La solubilità ed in generale le proprietà chimico-fisiche delle
molecole organiche e quindi delle biomolecole dipendono dai
GRUPPI FUNZIONALI che le caratterizzano.
I GRUPPI FUNZIONALI sono insiemi di specifici atomi legati
e disposti nello spazio in modo definito.
I GRUPPI FUNZIONALI permettono la classificazione dei
composti organici.
Molte biomolecole sono caratterizzate da più di un gruppo
funzionale e quindi presentano le proprietà chimico fisiche di
diverse classi di composti organici.
AA 2013-2014
Biochimica-Lezione 1
Domenico Ciavardelli