Le unità di misura e le relazioni di base chimica,
termofisica, fisica, fisica tecnica
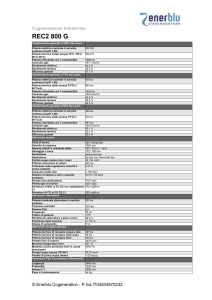
Il S.I. è un insieme di definizioni e regole che forniscono un
approccio organico e completo per ottenere le unità per ogni
quantità.
Si basa su 7 unità fondamentali e due addizionali, tutte le
altre unità possono essere derivate da queste in funzione
della seguente espressione
1/6
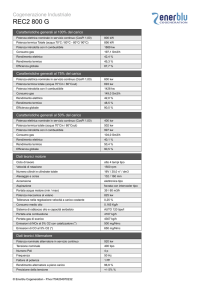
Le unità di misura e le relazioni di base chimica,
termofisica, fisica, fisica tecnica
Alcune unità di misura derivate sono:
Tempo/spazio
Velocità (m/s), velocità angolare (rad/s), frequenza (1/s)
Meccanica
Densità (kg/m3), forza (N), coppia energia lavoro calore (J),
potenza (W), pressione (Pa)
Elettricità/magnetismo
Potenziale elettrico (V), forza magnetomotrice (A), resistenza
(Ω)
Luce
Flusso luminoso (lumen), illuminamento (lux)
Volume
(m3), (l)
Energia
(J), Calorie (cal), (Wh)
Potenza
(W), Cavallo (Hp), calorie ora (cal/h)
Calore specifico
(J/kg*K)
Energia specifica
(J/kg), (J/m3)
2/6
1
3/6
Le unità di misura e le relazioni di base chimica, termofisica,
fisica, fisica tecnica
Alcune relazioni di fisica, termofisica, fisica tecnica da non
dimenticare:
Q = m.cp**.dT
E = Pm.t
Massa=densità*volume
K = 273,15 + °C
PCI olio combustibile=41860 kJ/kg, PCI** gas naturale
34325 kJ/Sm3 , gasolio =42700 kJ/kg, carbone =29300 kJ/kg
Importante è anche la dimensione temporale da tenere sotto
controllo.
4/6
2
DEFINIZIONE
**Per potere calorifico si intende quantità di calore prodotta dalla
combustione completa di una quantità unitaria (di massa o di
volume) di gas a determinate condizioni, quando la pressione di
reazione è mantenuta costante ed i prodotti della sua combustione
vengono riportati alla temperatura iniziale dei reagenti: si parla di
Potere Calorifico Superiore (PCS) se si considera tutta l’energia
prodotta dal combustibile (di Potere Calorifico Inferiore se, invece,
si sottrae dall’energia totale prodotta l’energia impiegata per
l’evaporazione dell’acqua formatasi durante la combustione).
Disponibile da glossario Snam rete gas
Calore specifico: quantità di calore necessaria per aumentare di 1 K
la temperatura di un'unità di massa (generalmente un grammo o un
chilogrammo) del materiale.
5/6
Le unità di misura e le relazioni di base chimica, termofisica,
fisica, fisica tecnica, economia
Relazioni chimiche da ricordare per la valutazione del
contenuto di carbonio:
1 Sm3 di gas naturale è costituito generalmente dal 99% da
CH4 : C pm =12 H pm = 1 >> pm CH4 =16;
La densità del GN è pari a 0,75 kg /Sm3 >> 1 Sm3 equivale
ad un contenuto di C pari a (1*0,99*0,75*12/16 in kg)
Se si vuole valutare quanta CO2 si forma dalla combustione
perfetta di 1 Sm3 allora:
CH4 +2O2>CO 2 +2H2O
pm CO 2 =12+2*16=44 >> 12/44 di C rispetto a CO 2
Quindi contenuto CO2 =44/12 contenuto di C
1 Sm3 GN >> circa 2 kg CO 2
6/6
3