CASO CLINICO
Scompenso cardiaco destro in un paziente
con insufficienza tricuspidale di origine incerta
e una rara cardiopatia congenita
Vincenzo Tufaro, Massimo Slavich, Andrea Fisicaro, Giacomo Ingallina, Alberto Margonato,
Eustachio Agricola
Cardiologia Diagnostica Non Invasiva, Ospedale San Raffaele, IRCCS, Milano
We report the case of a 63-year-old woman admitted to the intensive care unit because of acute decompensated right heart failure. Transthoracic and transesophageal echocardiography revealed severe right ventricular dysfunction with severe tricuspid regurgitation of unknown origin and a large membrane running
from the inferior vena cava to the interatrial septum with significant diastolic transmembrane gradient, consistent with the diagnosis of cor triatriatum dexter.
The clinical interest of our findings relies on the coexistence of multiple diseases, which actually contributed
in a different but synergistic manner to right heart failure.
Key words. Cor triatriatum dexter; Right heart failure; Tricuspid regurgitation.
G Ital Cardiol 2013;14(7-8):555-557
CASO CLINICO
Presentiamo il caso di una donna di 63 anni, giunta presso il nostro reparto di terapia intensiva per l’insorgenza di scompenso
cardiaco destro acuto. In anamnesi, la paziente presentava insufficienza renale cronica, diabete mellito di tipo 1 e insufficienza epatica di origine sconosciuta dal 2001. Inoltre, la paziente aveva in anamnesi una diagnosi di infarto miocardico
acuto senza sopraslivellamento del tratto ST nel 2010 e un successivo intervento di bypass aortocoronarico associato ad anuloplastica mitralica, a causa di un’insufficienza mitralica ad eziologia imprecisata. L’ecocardiografia transtoracica, eseguita nel
2010, prima della dimissione ospedaliera, riportava una frazione di eiezione del 55%, ipocinesia della parete inferiore, insufficienza mitralica residua lieve-moderata, assenza di insufficienza tricuspidale e normale pressione polmonare. Nel 2011,
per la comparsa di bradiaritmie veniva posta indicazione ad impianto di pacemaker; un esame ecocardiografico transtoracico, effettuato durante il ricovero, mostrava un ventricolo destro con normale morfologia e funzione, assenza di insufficienza tricuspidale e pressione polmonare nella norma.
Al momento del ricovero presso il nostro reparto di terapia
intensiva, veniva rilevata la presenza di ascite con distensione
addominale e un aumento della pressione venosa centrale (18
mmHg). L’ecocardiogramma transtoracico documentava dilatazione (diametro telediastolico 46 mm) e disfunzione sistolica
del ventricolo destro valutata attraverso l’escursione sistolica
© 2013 Il Pensiero Scientifico Editore
Ricevuto 20.02.2013; nuova stesura 02.05.2013; accettato 03.05.2013.
Gli autori dichiarano nessun conflitto di interessi.
Per la corrispondenza:
Dr. Vincenzo Tufaro Cardiologia Diagnostica Non Invasiva,
Ospedale San Raffaele, IRCCS, Via Olgettina 60, 20132 Milano
e-mail: [email protected]
dell’anello tricuspidale (15 mm), severa insufficienza tricuspidale con normale dimensione dell’anello tricuspidale (34 mm),
normale pressione polmonare (30 mmHg), funzione ventricolare sinistra conservata, lieve insufficienza mitralica e la presenza di una membrana che divideva l’atrio destro in due camere. Successivamente, veniva eseguito un esame ecocardiografico transesofageo che confermava una severa dilatazione
del ventricolo destro associata a disfunzione sistolica e insufficienza tricuspidale di grado severo da tethering dei lembi. Inoltre, si confermava la presenza di un’ampia membrana che decorreva dalla vena cava inferiore al setto interatriale, separando l’atrio destro in due camere (Figura 1). Attraverso la membrana, si registrava un flusso diastolico con significativo gradiente diastolico transmembrana (medio 10 mmHg, massimo
16 mmHg) (Figura 1). Questi reperti erano ritenuti compatibili
con una diagnosi di cor triatriatum destro (CTD). Da segnalare
anche un flusso sistolico attraverso la membrana, causato dalla severa insufficienza tricuspidale. Veniva eseguita, inoltre, una
tomografia assiale computerizzata del cuore, che confermava
la presenza di una membrana in atrio destro, con le caratteristiche già descritte all’ecocardiografia (Figura 2).
La paziente veniva trattata con terapia diuretica, inotropa e
con emofiltrazione e paracentesi. Dopo consulenza cardiochirurgica, veniva esclusa l’opzione chirurgica a causa della grave disfunzione del ventricolo destro con associata insufficienza epatica
e trombocitopenia. Si decideva, pertanto, di continuare la terapia
medica, ma la paziente aveva prognosi infausta dopo 2 settimane dal ricovero, per scompenso cardiaco destro intrattabile.
DISCUSSIONE
Questo caso risulta interessante per due motivi: primo, per la
concomitante presenza di diverse patologie, di cui una rara,
che hanno contribuito in maniera differente, ma sinergica, alG ITAL CARDIOL | VOL 14 | LUGLIO-AGOSTO 2013
555
V TUFARO ET AL
A
B
C
D
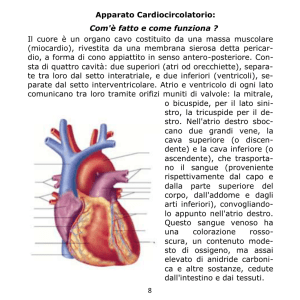
Figura 1. A: l’ecocardiogramma transesofageo in proiezione off-axis mostra
un’ampia membrana, che divide l’atrio destro in due camere (freccia bianca). B:
tethering della valvola tricuspide e interferenza dell’elettrocatetere (freccia rossa).
C: il color Doppler rivela un flusso sistolico (freccia nera) attraverso la membrana
(freccia bianca), causato da severa insufficienza tricuspidale. D: il Doppler continuo registra un elevato gradiente diastolico transmembrana (medio 10 mmHg,
massimo 16 mmHg).
L, lembi della tricuspide; LA, atrio sinistro; RA, atrio destro; RV, ventricolo destro.
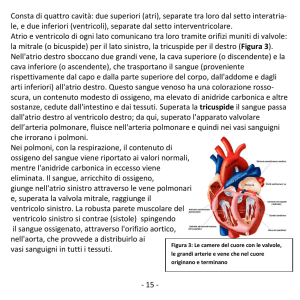
Figura 2. Tomografia assiale computerizzata del cuore in fase arteriosa. A: ricostruzioni su piani assiali, severa dilatazione della vena cava inferiore e del ventricolo destro. B-D: ricostruzioni sequenziali ottenute
partendo dalla vena cava inferiore al setto interatriale, che mostrano
un’ampia membrana (freccia rossa) che decorre dalla vena cava inferiore al setto interatriale.
IVC, vena cava inferiore; LA, atrio sinistro; LV, ventricolo sinistro; RA,
atrio destro; RV, ventricolo destro.
l’insorgenza dello scompenso cardiaco destro; secondo, per i
complessi meccanismi fisiopatologici che hanno determinato la
comparsa di insufficienza tricuspidale e la successiva dilatazione e disfunzione ventricolare destra.
556
G ITAL CARDIOL | VOL 14 | LUGLIO-AGOSTO 2013
Il CTD è una rara cardiopatia congenita (meno dello 0.1%
di tutte le anomalie cardiache congenite), causata dalla persistenza della valvola destra del seno venoso del cuore embrionale. Durante la vita fetale, la valvola destra del seno venoso divide l’atrio destro quasi completamente in due camere. Questa
valvola serve a dirigere il sangue ossigenato proveniente dalla
vena cava inferiore verso l’atrio sinistro, tramite il forame ovale. Normalmente regredisce tra la nona e la quindicesima settimana di gestazione. La completa persistenza della valvola destra del seno venoso determina il CTD, caratterizzato dalla presenza di un diaframma o un setto fibromuscolare anomalo che
divide l’atrio destro in due camere. Tale membrana varia notevolmente in termini di dimensioni e forma e la comunicazione
tra le camere atriali separate può essere ampia, piccola o del
tutto assente1.
Il reperto ecocardiografico è generalmente rappresentato
da una membrana che decorre dalla vena cava inferiore a quella superiore, separando l’auricola dell’atrio destro e la valvola
tricuspide dalle grosse vene. Il CTD è frequentemente associato a malformazioni gravi, quali la stenosi o l’atresia dell’arteria
polmonare, malformazioni della valvola tricuspide, forame ovale pervio e anomalia di Ebstein2-5. Le principali diagnosi differenziali da prendere in considerazione sono la valvola di Eustachio e di Tebesio, in quanto la loro origine embriologica è simile a quella del CTD. Non è facile definire la variabilità anatomica dovuta alla persistenza della valvola destra del seno venoso.
Un elemento che può aiutare nella diagnosi differenziale tra
queste strutture è il riscontro di un significativo gradiente transmembrana, infatti molti autori definiscono il CTD solo in presenza di un’ostruzione all’afflusso.
Le manifestazioni cliniche variano in base al grado di comunicazione tra le due camere atriali separate. Se la divisione
delle due camere è incompleta, il paziente è spesso asintomatico e la diagnosi è accidentale. Nei casi, invece, di completa
SCOMPENSO CARDIACO E COR TRIATRIATUM DESTRO
separazione dell’atrio destro in due camere distinte, il cor triatriatum può determinare uno scompenso cardiaco destro e un
aumento della pressione venosa centrale. Le forme emodinamicamente significative sono diagnosticate in età pediatrica. Il
CTD è stato descritto occasionalmente anche in pazienti adulti, ma si tratta di condizioni che non determinano un’ostruzione significativa all’afflusso destro e che vengono riscontrate
spesso casualmente, nel corso di valutazioni eseguite per altra
causa.
I pazienti asintomatici in genere non vengono trattati, a meno che non debbano essere sottoposti a cardiochirurgia per altri motivi. Al contrario, il trattamento del cor triatriatum ostruttivo è esclusivamente chirurgico, a parte sporadiche segnalazioni6,7.
Nel nostro paziente, la comparsa di insufficienza tricuspidale severa può essere ritenuta responsabile del grave sovraccarico di volume e, di conseguenza, della disfunzione del ventricolo destro. Il CTD, con un elevato gradiente transmembrana, potrebbe aver contribuito all’aumento della pressione venosa centrale, portando al peggioramento dell’insufficienza renale ed epatica e accentuando i segni e sintomi di scompenso
cardiaco destro. Tuttavia, nel nostro caso non è stato possibile
confermare con un riscontro anatomo-patologico la diagnosi
di CTD. Inoltre, è da rilevare che il gradiente intra-atriale destro
potrebbe essere espressione in parte di una “stenosi relativa”,
causata da un aumento di flusso secondario al severo rigurgito tricuspidale.
L’origine fisiopatologica dell’insufficienza tricuspidale è di
difficile interpretazione. In prima ipotesi, potrebbe essere una
complicanza pacemaker-correlata, generalmente causata da
lead impingement sui lembi tricuspidali oppure da perforazione o lacerazione dei lembi della tricuspide durante l’impianto o
l’estrazione del pacemaker8,9. Un altro possibile meccanismo è
la comparsa di dissincronia meccanica del ventricolo destro pacemaker-indotta. Tale dissincronia può portare allo sviluppo di
insufficienza tricuspidale o peggiorare una insufficienza tricuspidale preesistente, mediante un’alterazione della contrazione
del setto interventricolare e dei tempi di contrazione dei muscoli
papillari, con conseguente alterazione della dinamica di chiusura della valvola tricuspide10. L’ipotesi di un coinvolgimento
reumatico della valvola tricuspide, invece, è poco probabile, data l’assenza di ispessimento e retrazione dei lembi e/o fusione
delle corde tendinee. Un altro possibile meccanismo dell’insufficienza tricuspidale potrebbe essere di tipo funzionale, secon-
daria alla dilatazione del ventricolo destro e dell’anulus tricuspidale e correlata a un’ipertensione polmonare di lunga durata da attribuire all’insufficienza mitralica e alla conseguente malattia vascolare polmonare. Tuttavia, negli ecocardiogrammi
precedenti la pressione polmonare era nella norma, rendendo
perciò poco probabile tale ipotesi.
Pertanto, l’ipotesi più plausibile sulla patogenesi dell’insufficienza tricuspidale è che il paziente abbia sviluppato un’insufficienza severa indotta dall’impianto del pacemaker, attraverso un duplice meccanismo: 1) mediante interferenza dell’elettrocatetere, che rende meno efficace la chiusura dei lembi della tricuspide; 2) inducendo dissincronia meccanica del ventricolo destro, che determina riduzione delle forze di chiusura
della valvola tricuspide. Inoltre, la comparsa di insufficienza tricuspidale può determinare dilatazione e disfunzione del ventricolo destro e peggiorare ulteriormente l’insufficienza tricuspidale stessa attraverso la dilatazione dell’anulus e la comparsa di tethering dei lembi, in un circolo vizioso.
In conclusione, questo caso clinico permette di evidenziare
due importanti aspetti: innanzitutto, la necessità di valutare
sempre il potenziale ruolo del pacemaker nello sviluppo di una
insufficienza tricuspidale severa; in secondo luogo, l’importanza di una valutazione ecocardiografica accurata, che in taluni
casi può rilevare la presenza di anomalie congenite, in precedenza misconosciute, che possono agire come concausa o fattore di aggravamento del quadro clinico del paziente.
RIASSUNTO
Riportiamo il caso di una donna di 63 anni, che giunge alla nostra
unità di terapia intensiva per scompenso cardiaco destro acuto.
L’ecocardiogramma transtoracico e transesofageo hanno rilevato
la presenza di: 1) una grave disfunzione ventricolare destra, associata ad insufficienza tricuspidale di grado severo ad eziologia incerta; 2) un’ampia membrana che decorre dalla vena cava inferiore al setto interatriale, con un significativo gradiente diastolico
transmembrana, compatibile con una diagnosi di cor triatriatum
destro.
L’interesse clinico del caso in questione è dato dalla concomitante
presenza di diverse patologie, delle quali una estremamente rara,
che determinano in modo differente, ma sinergico, una condizione di scompenso cardiaco destro.
Parole chiave. Cor triatriatum destro; Insufficienza tricuspidale;
Scompenso cardiaco destro.
BIBLIOGRAFIA
1. Shirani J, Acharya YR, Kalyanasundaram
A. Cor triatriatum. eMedicine Jun 20, 2012.
http://emedicine.medscape.com/article/
154168-overview.
2. Embrey RP. Cor triatriatum, pulmonary
vein stenosis, atresia of the common pulmonary vein. In: Mavroudis C, Backer CL,
eds. Pediatric cardiac surgery. 2nd edition. St
Louis, MO: Mosby-Year Book, 1994:503-4.
3. Kessel-Schaefer A, Linka A, Pretre R,
Buser P. Inferior sinus venosus defect associated with incomplete cor triatriatum dexter
and patent foramen ovale. Eur J Echocardiogr 2006;7:239-42.
4. Caliskan M, Erdogan D, Gullu H, Muder-
risoglu H. Cor triatriatum dexter in two
adult patients. Int J Cardiovasc Imaging
2006;22:383-7.
5. Joe BN, Poustchi-Amin M, Woodard PK.
Case 56: cor triatriatum dexter. Radiology
2003;226:701-5.
6. Ott DA, Cooley DA, Angelini P, Leachman
RD. Successful surgical correction of symptomatic cor triatriatum dexter. J Thorac Cardiovasc Surg 1979;78:573-5.
7. Savas V, Samyn J, Schreiber TL, Hauser A,
O’Neill WW. Cor triatriatum dexter: recognition and percutaneous transluminal correction. Cathet Cardiovasc Diagn 1991;23:
183-6.
8. Lin G, Nishimura RA, Connolly HM,
Dearani JA, Sundt TM 3rd, Hayes DL. Severe
symptomatic tricuspid valve regurgitation
due to permanent pacemaker or implantable cardioverter-defibrillator leads. J
Am Coll Cardiol 2005;45:1672-5.
9. Loupy A, Messika-Zeitoun D, Cachier A,
et al. An unusual cause of pacemaker-induced severe tricuspid regurgitation. Eur J
Echocardiogr 2008;9:201-3.
10. Al-Mohaissen MA, Chan KL. Tricuspid
regurgitation following implantation of a
pacemaker/cardioverter-defibrillator. Curr
Cardiol Rep 2013;15:357.
G ITAL CARDIOL | VOL 14 | LUGLIO-AGOSTO 2013
557