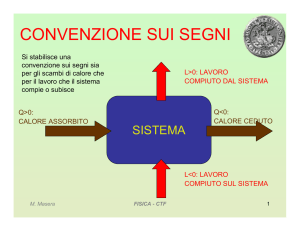
Significato microscopico della
temperatura
La temperatura è una misura dell’energia cinetica traslazionale media delle
molecole del gas, o, il che è lo stesso, della loro velocità quadratica media
La velocità
q.m. è alta, ma il
moto è caotico
M. Masera
FISICA - CTF
1
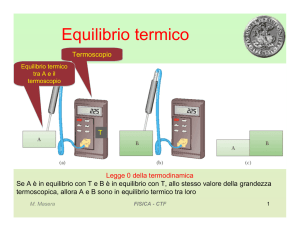
Distribuzione maxwelliana
dN e’ il numero di molecole con velocità compresa tra v e v+dv. La
distribuzione di probabilità F(v) è detta distribuzione maxwelliana (James
Clerk Maxwell 1852)
vp
M. Masera
FISICA - CTF
vm
2
Equipartizione dell’energia
Ogni molecola ha un certo numero f di gradi di
libertà, che sono i modi indipendenti con i quali
la molecola può immagazzinare energia.
Ciascuno di questi gradi di libertà è associato in
1
media ad un’energia 2 k BT per ogni molecola
1
o
per ogni mole
RT
2
Per una trasformazione
isocora dL=0 e quindi
dU=dQ
f
f
U = nN A kB T = n RT
2
2
1 ⎛ dQ ⎞
1 ⎛ dU ⎞ f
cV ≡ ⎜
⎟ = ⎜
⎟= R
n ⎝ dT ⎠V n ⎝ dT ⎠ 2
Ne segue che
M. Masera
U = ncV T
FISICA - CTF
⇒
dU = ncV dT
3
Calore molare a volume
costante
M. Masera
FISICA - CTF
4
Calore molare a pressione
costante
Q = nc P ΔT per trasf. ISOBARE
dU = dQ − pdV
M. Masera
dU = ncV dT
dQ = nc p dT
d ( pV ) = pdV = nRdT
FISICA - CTF
ncV dT = nc p dT − nRdT
cV = c p − R
Nota come relazione
5
di Mayer
trasformazioni isoterme
(gas ideale)
nRT
dL = pdV =
dV
V
Vf
dV
⇒
V
Vi
∫ dL = nRT ∫
L = nRT ln
pV=costante
Vf
Vi
Il lavoro svolto in
un’espansione isoterma è
positivo
M. Masera
FISICA - CTF
6
Adiabatiche (gas ideali)
Trasformazioni reversibili
pV γ = cost
TV (γ −1) = cost
L’espansione libera è un processo adiabatico irreversibile. Visto che il lavoro è nullo,
non c’è variazione di energia interna. Quindi la temperatura non varia:
Tf=Ti
M. Masera
piVi=pfVf
FISICA - CTF
7
Trasformazioni cicliche
Per una trasformazione ciclica: Q=L
Se viene prodotto lavoro, viene assorbito calore e il dispositivo
che compie il ciclo è detto macchina termica.
termica Si parla di
macchina frigorifera quando il lavoro è compiuto sul sistema.
Il calore scambiato dal fluido che compie il ciclo è dato dalla
somma del calore assorbito (>0) dal sistema e del calore ceduto
all’ambiente (<0)
QA
L
Qc
La frazione di calore assorbito trasformata in lavoro (=rendimento)
FISICA - CTF
8
nonM.èMasera
mai pari a 1
Secondo principio della
termodinamica
Enunciato di Kelvin-Planck
E` impossibile realizzare un processo che abbia come unico
risultato la trasformazione in lavoro del calore fornito da
una sorgente a temperatura uniforme
M. Masera
FISICA - CTF
9
Reversibilità
• Trasformazioni reversibili:
– il sistema alla fine di un ciclo rev. torna allo stato iniziale.
– L’ambiente invece ha subito una modifica (ad esempio può
avere ceduto calore ed assorbito lavoro).
– Percorrendo il ciclo in senso inverso si riporta l’ambiente allo
stato iniziale
• Trasformazioni irreversibili:
– non si possono riportare sistema ed ambiente nelle condizioni
iniziali. Esempi:
9 Presenza di attrito: il calore dissipato per attrito non può essere
ritrasformato integralmente in lavoro
9 Espansione libera di un gas. Per ripristinare lo stato inziale occorre
compiere del lavoro
9 Passaggio spontaneo di calore tra 2 corpi. Per il passaggio inverso
occorre usare una macchina frigorifera e compiere del lavoro
M. Masera
FISICA - CTF
10
Ciclo di Carnot
1) AÆB Espansione isoterma reversibile
2) BÆC Espansione adiabatica reversibile
3) CÆD Compressione isoterma reversibile
4) DÆA Compressione adiabatica reversibile
Si considera il ciclo
descritto da un gas
ideale operante tra
due sorgenti alle
temperature T1 e
T2 (con T1<T2)
Si può dimostrare
che il rendimento
di questo ciclo vale
T1
η = 1−
T2
M. Masera
FISICA - CTF
11
Rendimenti macchine
termiche
Il teorema di Carnot sancisce che tutte le macchine reversibili che operano tra due
sorgenti hanno rendimento pari a quello della macchina di Carnot. Le macchine
irreversibili hanno rendimento minore
T1
η ≤ 1−
T2
Q1
T1
⇒ 1+
≤ 1−
Q2
T2
Q1 Q2
⇒
+
≤0
T1 T2
Per macchine a più sorgenti, questa diseguaglianza viene generalizzata come
N
Qi
∑T ≤0
i=1 i
Diseguaglianza di Clausius
Nel caso di un sistema che operi con un insieme continuo di sorgenti, la
sommatoria è sostituita da un integrale
∫
M. Masera
dQ
≤0
T
FISICA - CTF
12
Frigoriferi
Una macchina termica reversibile può essere fatta
operare in modo che assorba lavoro dall’ambiente e
trasferisca calore dalla sorgente fredda a quella calda.
E’ necessario fornire lavoro dall’esterno, visto che le
trasformazioni reali evolvono lungo una direzione
preferenziale.
Il secondo principio può essere enunciato in modo
alternativo affermando che il frigorifero ideale è
impossibile
Enunciato di Clausius
E` impossibile realizzare un processo che abbia come unico
risultato il trasferimento di una quantita` di calore da un corpo ad
M. Masera
FISICA - CTF
un altro a temperatura maggiore
13
La macchina 2
può essere
dimensionata
in modo che
Il frigorifero 1 viola
l’enunciato di
Clausius
Q1=Q<0
La macchina termica 2 compie il lavoro W>0 dato da:
La sorgente fredda non scambia complessivamente calore:
il sistema converte integralmente in lavoro calore assorbito
dalla sorgente calda, violando l’enunciato di Kelvin-Planck
M. Masera
FISICA - CTF
14
Entropia / 1
Le trasformazioni 1 e 2 sono entrambe
reversibili: 1+(-2) è un ciclo reversibile
dQ
⎛ dQ ⎞
⎛ dQ ⎞ B ⎛ dQ ⎞ B ⎛ dQ ⎞
∫ T = ∫A ⎜⎝ T ⎟⎠ + ∫B ⎜⎝ T ⎟⎠ −2 = ∫A ⎜⎝ T ⎟⎠1 − ∫A ⎜⎝ T ⎟⎠2 = 0
1
B
A
⎛ dQ ⎞
⎛ dQ ⎞
∫A ⎜⎝ T ⎟⎠1 = ∫A ⎜⎝ T ⎟⎠2
B
B
Dato che 1 e 2 sono arbitrarie, ne segue che per una
qualsiasi trasformazione reversibile
⎛ dQ ⎞
∫A ⎜⎝ T ⎟⎠ = S (B ) − S ( A) = ΔS
rev
B
M. Masera
La funzione di stato S
FISICA -(u.m.
CTF
J/K) è detta entropia15
Entropia / 2
La variazione elementare di entropia per una trasformazione
infinitesima e` dS = ⎜⎛ dQ ⎟⎞
⎝ T ⎠ rev
dS è un differenziale esatto, mentre dQ non lo è
¾ L’entropia è una quantità additiva perché Q è additivo
¾ L’entropia è una grandezza estensiva
¾ Trasformazioni irreversibili che legano A e B Æ
l’entropia si calcola su una trasformazione reversibile che
lega i medesimi stati
M. Masera
FISICA - CTF
16
Diagrammi TS /1
L’entropia, essendo una funzione di stato, puo` essere usata
come variabile indipendente per descrivere un sistema.
L’area sottesa dalla trasformazione
reversibile AÆ B in un diagramma TS
rappresenta il calore assorbito
(se S(B)-S(A)>0):
L’area delimitata da una trasf. ciclica
reversibile è il calore totale scambiato Æ
lavoro prodotto.
17
M. Masera
FISICA - CTF
Diagrammi TS /2
¾ Trasf. isoterme reversibili: rette orizzontali
¾ Trasf. adiabatiche reversibili: rette verticali
¾ Un ciclo di Carnot è rappresentato da un rettangolo
A
Il rendimento vale:
B
C
D
F
E
Il rendimento coincide con il rapporto tra l’area del
rettangolo ABCD e quella del rettangolo ABEF.
18
M. Masera
FISICA - CTF
Aumento di entropia
¾ Se avviene un processo in un sistema isolato, l’entropia S
del sistema aumenta se si tratta di un processo irreversibile,
mentre rimane costante se il processo reversibile
¾Tutti i processi irreversibili comportano un aumento
dell’entropia dell’universo
¾ I processi naturali sono processi irreversibili
I processi naturali si svolgono sempre nel verso che
determina un aumento dell’entropia complessiva del
19
M. Masera
FISICA - CTF
sistema e del suo ambiente
Entropia di un gas ideale
n moli di gas ideale
Per il calcolo
dell’entropia, occorre considerare una trasf. reversibile da A a B . Dal primo
principio e dall’equazione di stato pV=nRT si ha
La variazione di entropia vale
Usando l’eq. di stato, ΔS può essere espressa in funzione di (p,V) o (p,T).
20
M. Masera
FISICA - CTF
Entropia e statistica /1
Una scatola isolata
contiene 6 molecole
identiche di gas.
Ognuna ha una
probabilita` eguale di
trovarsi in ciascuna
delle due meta`
Ogni configurazione (e.g. 2 molecole a
destra e 4 a sinistra) puo’ essere realizzata
da microstati diversi (15 nell’esempio).
Ogni microstato e’ equiprobabile.
n1
n2
W
12
3456
1
13
2456
2
14
2356
3
15
2346
4
16
2345
5
23
1256
6
24
1356
7
25
1346
8
26
1345
9
34
1256
10
35
1246
11
36
1256
12
45
1236
13
46
1235
14
56
1234
15
Nel caso di N molecole, il numero di
microstati che realizzano una certa
configurazione e`:
W=
N!
n1!n2 !
Sei molecole in una scatola
21
M. Masera
FISICA - CTF
Entropia e statistica /2
Un sistema tende ad evolvere
verso configurazioni ad elevata
probabilita` termodinamica.
L. Boltzmann propose una
relazione tra entropia e W:
S = k B ln W
Per N grande, questo e’ il numero
di microstati in funzione del
numero di molecole in una meta`
della scatola: la massima
probabilita’ termodinamica e`
raggiunta dalla configurazione di
equipartizione
delle molecole
22
M. Masera
FISICA - CTF
BACKUP
M. Masera
FISICA - CTF
23
Cammino libero medio
In un percorso lungo h, una molecola “spazza” un volume
Il risultato corretto, che si ottiene tenendo conto del movimento delle
molecole è
(a p e T standard, λ=0,1 μm )
M. Masera
FISICA - CTF
24
Calori molari
CV/R in funzione di T per un gas
biatomico (H2). I gradi di libertà
rotazionali e vibrazionali si eccitano
solo ad alte temperature
M. Masera
FISICA - CTF
25
AZOTO
Gas reali
isoterme
• I gas reali approssimano i gas ideali ad alta temperatura e bassa pressione
• Sono soggetti a transizioni di fase (allo stato liquido e solido)
L’energia interna dei gas reali non dipende solo dalla temperatura. Per un’espansione
isoterma dallo stato (p,T) a (p0<p,T) si osserva:
M. Masera
FISICA - CTF
26
Curva CA: curva di
saturazione del
vapore
Diagrammi p-V
punto critico
Curva CB: curva di
saturazione del
liquido
Curva BA: linea
tripla (Tt,pt)
Tensione di vapore
saturo:
isoterma critica
gas
A e B debolmente
variabili con T
vapore
M. Masera
FISICA - CTF
27
v=V/m (volume specifico)
Equazione di Van der Waals
Equazione semi-empirica (1873) che descrive
il comportamento di un gas in prossimita`
della transizione di fase
a e b sono coeffcienti caratteristici del gas.
L’eq. di Van der Waals non
descrive la regione eterogenea
gas-liquido
M. Masera
FISICA - CTF
28