Chimica-Fisica
Biologica
http://people.unica.it/flaminiacesaremarincola/
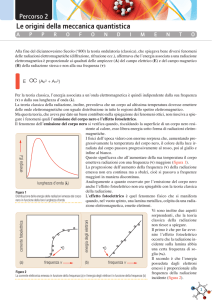
SPETTROSCOPIA
Spettro elettromagnetico
Radiazioni elettromagnetiche (r.e.m)
Modello classico e quantistico
Assorbimento di r.e.m
Emissione di r.e.m.
Spettroscopia di assorbimento
Spettroscopia di emissione
Il BIOLOGO MOLECOLARE
• studia negli organismi viventi i meccanismi molecolari fisiologici e patologici,
concentrandosi in particolare sulla struttura e sulle interazioni tra le macromolecole.
•analizza le funzioni che DNA, RNA, e proteine svolgono all'interno della cellula e
dell'organismo ed i contenuti di informazione dei genomi.
•valuta la relazione tra struttura e funzione delle macromolecole; studia gli effetti
provocati, nella cellula e nell’organismo, da alterazioni strutturali e funzionali di
DNA, RNA e proteine, accidentali o progettate.
Come è possibile osservare ciò che accade
a livello molecolare ?
http://www.youtube.com/watch?v=IkKZ_gxAOXI&feature=related
Spettroscopia
Studia le proprietà della materia attraverso l’interazione con
diverse componenti dello spettro elettromagnetico
Permette di estrarre informazioni di varia natura quali:
•energia degli stati rotazionali, vibrazionali o elettronici,
•struttura e simmetria delle molecole,
•proprietà dinamiche,
•………..e molto di più
Spettroscopia
Quando una radiazione elettromagnetica attraversa la materia
vi è sempre una interazione; la natura di questa interazione
può variare da un caso all’altro.
Riflessione: si verifica quando la luce incontra una superficie lucida, per
esempio uno specchio.
Il raggio che proviene dall'oggetto, (chiamato raggio incidente), e il raggio
che ritorna dalla superficie lucida (chiamato raggio riflesso), formano
angoli uguali con la superficie riflettente.
Spettroscopia
Quando una radiazione elettromagnetica attraversa la materia
vi è sempre una interazione; la natura di questa interazione
può variare da un caso all’altro.
cannucce
Rifrazione: È un fenomeno dovuto alla diversa velocità della luce in mezzi diversi: il passaggio
da un mezzo a bassa densità come l'aria a un mezzo a densità elevata come l'acqua ne riduce la
velocità e ne causa la deviazione (eccetto nel caso in cui entri perpendicolarmente alla superficie
del mezzo).
Spettroscopia
Quando una radiazione elettromagnetica attraversa la materia
vi è sempre una interazione; la natura di questa interazione
può variare da un caso all’altro.
La radiazione trasmessa può:
•assumere diverse direzioni di propagazione (riflessione, rifrazione)
•vibrare su un piano diverso (polarizzazione),
•viaggiare con velocità minore,
•essere meno intensa di quella incidente (assorbimento).
Spettroscopia
Radiazione Elettromagnetica
Radiazione Elettromagnetica
Dispersione e rifrazione della luce solare
contro le pareti delle gocce.
Radiazione Elettromagnetica
Che cosa è la radiazione elettromagnetica?
una forma di energia che si propaga attraverso lo spazio
ad altissima velocità.
Modello classico ad onda sinusoidale
La radiazione elettromagnetica è composta da onde
elettromagnetiche, consistenti, cioè, nell'oscillazione
concertata di un campo elettrico e di un campo
magnetico. Queste onde si propagano in direzione
ortogonale a quella di oscillazione
Radiazione Elettromagnetica
Le onde elettromagnetiche sono definite
da alcuni parametri quali:
lunghezza
ampiezza
frequenza
velocità di propagazione
energia
intensità
Radiazione Elettromagnetica
Proprietà delle onde
l= lunghezza d’onda
l
Radiazione Elettromagnetica
Proprietà delle onde
l= lunghezza d’onda
Nel SI l’unita’ di misura e’ il metro (m).
Per lunghezze d’onda corte si usano i
prefissi:
p
10-12
pico
n
10-9
nano
μ
10-6
micro
m
10-3
milli
c
10-2
centi
l
Si usa anche l’Angström (Å)
che corrisponde a 10-10 m.
Radiazione Elettromagnetica
Proprietà delle onde
l= lunghezza d’onda
Radiazione Elettromagnetica
Proprietà delle onde
n = frequenza
Nel SI l’unita’ di misura e’ l’Hertz (Hz, ha le dimensioni di s-1).
Corrisponde al numero di cicli al secondo.
Si usano i prefissi:
M
106
mega
G
109
giga
T
1012
tera
P
1015
peta
E
1018
exa
Radiazione Elettromagnetica
Proprietà delle onde
c=velocità
c=ln=2,9979*108 m/s
Radiazione Elettromagnetica
Proprietà delle onde
E=energia
E=hn
h=6,62618*10-34 J s
Costante di Planck
la quantità di energia trasportata per
unità di tempo e di superficie
ortogonale alla direzione di
propagazione.
Intensità
(legata all’ ampiezza dell’onda)
Joule su metri quadrati al secondo
(J/(m2·s)).
Effetto fotoelettrico
Nel tardo 800 i risultati di alcuni esperimenti indicavano che, quando la luce
ultravioletta colpiva una lastra di zinco carica negativamente, questa si
scaricava. In altre parole un certo numero di elettroni venivano emessi
dalla piastra.
UV
Lastra di zinco
Ciò accadeva solo con luce ultravioletta
Con raggi di luce di frequenza più piccola (lunghezza d'onda più lunga) il
fenomeno non si verificava. Altri esperimenti vennero effettuati e si dimostrò che
per materiali diversi dallo zinco erano altre le frequenze a permettere l'emissione
di elettroni.
Radiazione Elettromagnetica
Nell'ambito della fisica classica i risultati sperimentali potevano essere spiegati con
l'idea che:
quando le onde luminose colpivano gli elettroni, questi si sarebbero messi a vibrare
fino a quando non avessero raggiunta l'energia sufficiente per essere emessi dalla
piastra.
Tuttavia ci sono dei punti deboli in questa spiegazione.
• L'energia dell'elettrone emesso non dipende dall'intensità della luce.
• Per una data sostanza, nessun elettrone viene emesso sotto una certa frequenza. Al
di sopra della frequenza critica, gli elettroni vengono emessi con una energia che
cresce proporzionatamente alla frequenza del raggio luminoso.
Radiazione Elettromagnetica
1905: Albert Einstein, sempre nel tentativo di spiegare il modo in cui
radiazione e materia interagiscono tra loro, suppose che la radiazione
stessa fosse composta da quanti (fotoni), ovvero da "pacchetti"
di energia, con energia E pari a hn
Radiazione Elettromagnetica
1905: Albert Einstein, sempre nel tentativo di spiegare il modo in cui
radiazione e materia interagiscono tra loro, suppose che la radiazione
stessa fosse composta da quanti (fotoni), ovvero da "pacchetti"
di energia, con energia E pari a hn
Questa ipotesi spiega i risultati ottenuti
sperimentalmente.
Appena un fotone con sufficiente energia
colpisce un elettrone, l'elettrone l'assorbe ed
acquisisce una energia sufficiente a liberarsi dei
suoi legami atomici. La quantità minima di
energia necessaria a causare ciò corrisponde
direttamente alla frequenza critica menzionata
sopra. E quando il fotone ha maggior energia
rispetto a quella richiesta, quella energia in più
viene convertita in energia cinetica
L’intensità
di
una
radiazione
elettromagnetica dipende:
•dal numero di fotoni che attraversa in
un
secondo
una
superficie
perpendicolare al flusso di fotoni
•dall’energia del fotone.
Radiazione Elettromagnetica
1923: Un terzo tipo di interazione tra la radiazione e la materia venne
descritto in maniera semplice e soddisfacente da Arthur Holly
Compton, il quale riprese l'idea di Einstein che la luce fosse costituita
da particelle dotate di energia e impulso.
Quest'ultima era la prova definitiva che
convinse la comunità scientifica circa la
NATURA CORPUSCOLARE
DELLA LUCE.
Radiazione Elettromagnetica
Emerse quindi un nuovo modello del campo elettromagnetico,
descritto dalla MECCANICA QUANTISTICA:
la luce, accanto alle proprietà ondulatorie
classiche, in determinate condizioni, manifesta
anche proprietà corpuscolari.
Questi "quanti di luce" di cui è composta la
radiazione elettromagnetica sono detti fotoni
Radiazione Elettromagnetica
Che cosa è la radiazione elettromagnetica?
una forma di energia che si propaga attraverso lo spazio
ad altissima velocità.
Modello corpuscolare
la radiazione è descritta come un flusso di particelle
discrete, o pacchetti d’onde, chiamati fotoni. Da una
parte, i fotoni hanno caratteristiche simili a quella di un
onda (es. hanno una frequenza e danno fenomeni di
interferenza), dall’altra hanno proprietà simili a quella di
una particella.
L’energia di un fotone è proporzionale alla frequenza della
radiazione elettromagnetica a cui appartiene:
E=hn
Radiazione Elettromagnetica
Modello corpuscolare
la radiazione è descritta come un flusso
di particelle discrete, o pacchetti
d’onde, chiamati fotoni. Da una parte, i
fotoni hanno caratteristiche simili a
quella di un onda (es. hanno una
frequenza e danno fenomeni di
interferenza), dall’altra hanno proprietà
simili a quella di una particella.
L’energia di un fotone è proporzionale
alla frequenza della radiazione
elettromagnetica a cui appartiene:
E=hn
Quantizzazione di Energia
Base comune di tutte le forme di spettroscopia è il
concetto di transizione:
il passaggio di un atomo o molecola da uno
stato energetico ad un altro.
L’interazione tra energia radiante e materia
segue differenti meccanismi a seconda della
radiazione impiegata
Quantizzazione di Energia
L’energia interna delle molecole è quantizzata (sono permessi solo valori
finiti) e l’energia di ogni molecola poliatomica deriva da diversi contributi :
Etot = Etras + Erot + Evib +Eele+ Eelv + En
•Etras = Energia traslazionale dovuta al movimento dovuta al movimento traslazionale
della molecola della molecola
•Erot = Energia rotazionale dovuta al movimento di rotazione della molecola
•Evib = Energia vibrazionale dovuta alle vibrazioni cui sono soggetti gli atomi della
molecola
•Eele = Energia dovuta agli elettroni di non legame (interni)
•Eelv = Energia dovuta agli elettroni di valenza
•En = Energia nucleare legata all’energia delle particelle che compongono il nucleo
Quantizzazione di Energia
ROTAZIONALE in virtù’ della
rotazione intorno al suo centro di massa
VIBRAZIONALE per gli spostamenti
periodici degli atomi dalla loro
posizione di equilibrio,
ELETTRONICA poiché gli elettroni
intorno all’atomo o quelli di legame
sono in continuo movimento.
Ognuno dei termini energetici ha valori quantizzati e
compresi in un intervallo di valori di energia paragonabile alle
energie delle differenti zone dello spettro elettromagnetico.
Quantizzazione di Energia
Primo livello elettronico
eccitato
DE1 >DE2 >DE3
DE1
DE3
DE2
Livello elettronico fondamentale
Livelli rotazionali
Livelli vibrazionali
Eccitazione e Rilassamento
Primo livello elettronico
eccitato
e-
Eccitazione
assorbimento
eLivello elettronico fondamentale
Eccitazione e Rilassamento
Rilassamento non radioattivo:
Primo livello elettronico
l’energia viene trasferita mediante piccole collisioni alle
eccitato ma senza emissione di fotoni. C’è un
molecole circondanti,
piccolo aumento di temperatura nel mezzo.
Rilassamento radioattivo (EMISSIONE):
l’energia viene trasferita mediante emissione di fotoni.
Si può raggiungere uno stato intermedio di decadimento
termico e riemissione di una radiazione con frequenza
minore della radiazione che provoca l’eccitazione, si parla
in questo caso di fluorescenza e di fosforescenza.
In alcuni casi, l’energia elettromagnetica assorbita è
rilassata interamente in forma di radiazione con frequenza
diversa, si ha allora la diffusione per effetto Raman.
Rilassamento
emissione
Spettroscopia
Spettroscopia di assorbimento
studia l’assorbimento di radiazione elettromagnetica da parte
di atomi e molecule.
Spettroscopia
Spettroscopia di emissione
studia l’emissione di radiazione elettromagnetica da
parte di atomi e molecole.
Spettroscopia
Tanto la spettroscopia di emissione
quanto quella di assorbimento
forniscono identica informazione circa
gli intervalli che separano i livelli
energetici; la scelta di una tecnica
rispetto ad un’altra poggia su
considerazione di ordine pratico.
Spettroscopia
Spettro d’Assorbimento
Asse X
Asse Y: l’assorbimento