PROCESSAZIONE STRATI:
TRA MITO E REALTÀ
Autore
Pelloni Michela
Sede
Istituto cantonale di patologia, Locarno 2005
Responsabile
Dottor Luca Mazzucchelli
INDICE
RIASSUNTO...................................................................................................................................5
INTRODUZIONE ..........................................................................................................................6
OBIETTIVI.....................................................................................................................................7
MATERIALE E METODI .............................................................................................................8
MATERIALE .......................................................................................................................................................................................................... 8
COLORAZIONI UTILIZZATE NELLE DIFFERENTI BIOPSIE ................................................................................................................. 8
SUDDIVISIONE DELLE VARIE PROGRAMMAZIONI................................................................................................................................ 9
DISTRIBUZIONE DELLE BIOPSIE GASTRICHE FRA LE DIFFERENTI PROGRAMMAZIONI...10
DISTRIBUZIONE DELLE BIOPSIE DEL COLON FRA LE DIFFERENTI PROGRAMMAZIONI...10
DISTRIBUZIONE DELLE BIOPSIE DEL ILEO FRA LE VARIE PROGRAMMAZIONI ...................11
DISTRIBUZIONE DELLE BIOPSIE DEL RETTO FRA LE VARIE PROGRAMMAZIONI ...............11
DISTRIBUZIONE DELLE BIOPSIE DELL’ ESOFAGO FRA LE PROGRAMMAZIONI ...................12
DISTRIBUZIONE DELLE BIOPSIE DEL FEGATO FRA LE VARIE PROGRAMMAZIONI ............12
PROCESSAZIONE .............................................................................................................................................................................................. 12
INCLUSIONE IN PARAFFINA ......................................................................................................................................................................... 14
TAGLIO AL MICROTOMO .............................................................................................................................................................................. 14
COLORAZIONI ................................................................................................................................................................................................... 15
VALUTAZIONE DEI TAGLI............................................................................................................................................................................. 16
PERSONALE COINVOLTO .............................................................................................................................................................................. 17
METODO DI STANDARDIZZAZIONE E CONTROLLO DI QUALITÀ .................................................................................................. 17
RISULTATI ..................................................................................................................................18
COMPARAZIONE FRA LA PROGRAMMAZIONE ORIGINALE E LA PROGRAMMAZIONE TEST 2 INERENTI LE BIOPSIE
DEL FEGATO....................................................................................................................................................................................................... 18
COMPARAZIONE FRA LA PROGRAMMAZIONE ORIGINALE, TEST 2 E TEST 6 INERENTE LE BIOPSIE DELLO
STOMACO ............................................................................................................................................................................................................ 18
COMPARAZIONE FRA LA PROGRAMMAZIONE ORIGINALE, TEST 2 E TEST 6 INERENTI LE BIOPSIE DEL ILEO.......... 19
COMPAREZIONE FRA LA PROGRAMMAZIONE ORIGINALE, TEST 2 E TEST 6 INRERENTE LE BIOPSIE DEL RETTO.. 20
COMPARAZIONE FRA LA PROGRAMMAZIONE ORIGINALE, TEST 2 E TEST 6 INERENTI LE BIOPSIE DEL COLON ..... 20
DISCUSSIONE ............................................................................................................................21
CONCLUSIONI............................................................................................................................22
RINGRAZIAMENTI ....................................................................................................................23
BIBLIOGRAFIA ..........................................................................................................................24
LIBRI..................................................................................................................................................................24
MANUALI D’USO, DISPENSE........................................................................................................................24
INTERNET.........................................................................................................................................................25
SUPPORTO CD-ROM.......................................................................................................................................26
LESSICO ......................................................................................................................................27
ALLEGATI ...................................................................................................................................30
LA FISSAZIONE.................................................................................................................................................................................................. 30
CAMPIONI UTILIZZATI NELLA RICERCA................................................................................................................................................ 31
PROCESSAZIONE .............................................................................................................................................................................................. 35
COLORAZIONI ................................................................................................................................................................................................... 36
DIFFERENTI TIPI DI COLORAZIONI........................................................................................................................................................... 38
2
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
ALCIAN-BLUE pH 2.5 ....................................................................................................................................39
BLU PRUSSIA..................................................................................................................................................40
CAB....................................................................................................................................................................42
ELASTICA VAN GIESON..............................................................................................................................44
GIEMSA............................................................................................................................................................46
GIEMSA MODIFICATO CBG.......................................................................................................................48
GÖMÖRI...........................................................................................................................................................49
HE ......................................................................................................................................................................51
MASSON TRICROMICA ...............................................................................................................................53
ORCEINA .........................................................................................................................................................55
PAS.....................................................................................................................................................................57
ROSSO CONGO-ROSSO SIRIUS..................................................................................................................59
IMMUNOISTOCHIMICA .................................................................................................................................................................................. 61
SMASCHERAMENTO DELL’ANTIGENE .................................................................................................61
ARTEFATTI E RISCHI D’ERRORE NELLE TECNICHE IMMUNOISTOCHIMICHE......................62
DIFFERENTI METODI IMMUNIISTOCHIMICI ............................................................................................64
VISUALIZZAZIONE DELLA REAZIONE ANTIGENE-ANTICORPO.........................................................66
TECNICHE DI MARCAGGIO IMMUNOISTOCHIMICO, ASPETTI PRATICI ...........................................66
DETECTION DAB PROTOCOLLO .............................................................................................................72
PROTEASE 1 PROTOCOLLO..........................................................................................................................73
PROTOCOLLO#5:CD 3 (02/04/2005)............................................................................................................75
PROTOCOLLO#77: HELICOBACT. (03/06/2003)......................................................................................77
PROTOCOLLO#88: HEP (21/12/2004) .........................................................................................................79
PROTOCOLLO #2 MNF 116 (25/05/2004) ....................................................................................................81
DOCUMENTAZIONE FOTOGRAFICA DEI VARI TAGLI OTTENUTI DURANTE LA RICERCA .................................................. 83
Colorazione He (ematossilina-eritrosina) casi 1069/2741..............................................................................83
Tabella valutativa casi 1069/2741....................................................................................................................84
Colorazione Blu di Prussia casi 1069/2741 .....................................................................................................85
Tabella valutativa casi 1069/2741....................................................................................................................86
Colorazione Evg casi 1069/2741.......................................................................................................................87
Tabella valutativa casi 1069/2741....................................................................................................................87
Tabella valutativa casi 1069/2741....................................................................................................................90
Colorazione Orceina casi 1069/2741 ...............................................................................................................91
Tabella valutativa casi 1069/2741....................................................................................................................92
Colorazione cab casi 1069/2741 .......................................................................................................................93
Tabella valutativa casi 1069/2741....................................................................................................................94
Colorazione per la messa in evidenza del anticorpo Hep casi 1069/2741.....................................................95
Tabella valutativa casi 1069/2741....................................................................................................................96
Colorazione He (ematossilina-eritrosina) casi 1283/1719/5375.....................................................................97
Tabella valutativa casi 1283/1719/5375...........................................................................................................98
Colorazione Pas casi 1283/1719/5375 ..............................................................................................................99
Tabella valutativa casi 128371719/5375 ........................................................................................................100
Colorazione Giemsa casi 1283/1719/5375 .....................................................................................................101
Tabella valutativa casi 1283/1719/5375.........................................................................................................102
Colorazione Giemsa modificato casi 1283/1719/5375 ..................................................................................103
Tabella valutativa casi 1283/1719/5375.........................................................................................................104
Colorazione per la messa in evidenza del anticorpo Helicobat casi 1283/1719/5375 ................................105
Tabella valutativa casi 128371719/5375 ........................................................................................................106
Colorazione He (ematossilina-eritrosina) casi 1454/4250/4350...................................................................107
Tabella valutativa casi 1454/4250/4350.........................................................................................................107
Colorazione Masson casi 1454/4250/4350 .....................................................................................................109
Tabella valutativa casi 1454/4250/4350.........................................................................................................110
Colorazione Evg casi 1454/4250/4350............................................................................................................111
Tabella valutativa casi 1454/4250/4350.........................................................................................................112
Colorazione per la messa in evidenza del anticorpo MNF 116 casi 1454/4250/4350 ......................................113
Tabella valutativa casi 1454/4250/4350.........................................................................................................114
Colorazione He(ematossilina-eritrosina) casi 1461/2709/4588....................................................................115
Tabella valutativa casi 1461/2709/4588.........................................................................................................116
Colorazione Masson casi 1461/2709/4588 .....................................................................................................117
3
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Tabella valutativa casi 1461/2709/4588.........................................................................................................118
Colorazione per la messa in evidenza del anticorpo CD3 casi 1461/2709/4588 .........................................119
Tabella valutativa casi 1461/2709/4588.........................................................................................................120
Colorazione He (ematossilina-eritrosina) casi 1477-1/5267-1/4354-1 .........................................................121
Tabella valutativa casi 1477-1/5267-1/4354-1 ...............................................................................................122
Colorazione Alcian-blue casi 1477-1/5267-1/4354-1.....................................................................................123
Tabella valutativa casi 1477-1/5267-1/4354-1 ...............................................................................................124
Colorazione per la messa in evidenza del anticorpo MNF 116 casi 1477-1/5267-1/4354-1.......................125
Tabella valutativa casi 1477-1/5267-1/4354-1 ...............................................................................................126
4
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
RIASSUNTO
Scopo:
La prospettiva di questo studio riguarda l’individuazione di
una nuova programmazione che mi permetta di processare
in tempi ridotti delle minuscole biopsie comunemente
chiamate strati. Inoltre dovrà essere mantenuto lo stesso
grado di qualità già presente nella programmazione
originale. Si prevede una riduzione di tempo di 30 minuti,
rispetto alla programmazione originale che mantiene una
durata di 89 minuti.
Materiale e metodo:
Dalla macroscopia sono state prelevate delle biopsie
riguardanti gli strati. Gli organi coinvolti sono stati lo
stomaco, l’intestino , l’esofago ed il fegato. In media, sono
state fornite giornalmente dalle 3-6 biopsie da poter testare
per le nuove programmazioni. La processazione è stata
effettuata sull’apparecchio TCP 15 Processing.
L ‘apparecchio è composto da 15 bagni contenti Alcool a
differenti concentrazioni (partendo dall’alcool 70% fino al
Alcool 100%), xilolo, paraffina liquida. L’unico fattore che
è stato modificato nelle mie programmazioni, rispetto alla
programmazione originale è stato il tempo. Durante
l’esecuzione di differenti programmazioni , veniva fatta una
colorazione al Ematossilina-Eritrosina per verificarne o
meno l’attendibilità. Il passo successivo era di provare a
testare il tessuto della nuova programmazione; con delle
colorazioni speciali, e con degli anticorpi inerenti
l’immunoistochimica.
Risultati:
è stato possibile identificare una programmazione che
presenta un tempo di riduzione di 40 minuti. La conferma è
stata dimostrata testando differenti tessuti
utilizzando delle colorazioni speciali e degli anticorpi.
Conclusioni:
L’obiettivo proposto all’inizio della ricerca, ossia la
riduzione dei tempi di processazione di 30 minuti è stato
raggiunti e superato. Infatti con il programma di
processazione selezionato è ora possibile guadagnare 40
minuti. Ulteriori indagini sono in corso per verificare
l’attendibilità della programmazione test 2 e della
programmazione test 6. Infatti, verranno eseguiti dei ritagli
ogni sei mesi e colorati con la colorazione HE. Queste
indagini serviranno per escludere la possibilità di escludere
un processo proteolitico con degradazione del tessuto.
Infatti i blocchetti di paraffina vengono conservati per
decenni per cui processi di putrefazione devono essere
esclusi. Questi processi non influiscono sulla diagnosi che
viene fatta nelle ore/giorni seguiti alla nuova processazione
ma potrebbero avere un effetto negativo su analisi
particolari, quali l’immunoistochimica, che in alcuni casi
possono avvenire anche anni dopo la diagnosi iniziale.
Pur pose:
The purpose of this study was to identify a new
programming which would allow reduced-time processing
of small biopsies commonly called layers (strati), while
maintaining the same level of quality as that achieved in the
original programming. A time reduction of 30 minutes was
anticipated, compared with the original programming,
which lasts 89 minutes.
Methods and materials:
From the macroscopy, biopsies of the layers were taken.
Organs involved were the stomach, the intestine,
oesophagus and the liver. On average, 3-6 biopsies were
supplied daily, to be tested with the new programming,
which was carried out with the apparatus TCP 15
Processing. This is composed of 15 baths containing
alcohol of various concentrations, (from 70% to 100%
alcohol), xylol, and liquid paraffin. The only factor which
was modified in my programming compared with that of
the original programming was the time. During the
application of different programmings, staining with
Ematoxiline-Erithrosine was carried out to verify the
reliability of the test. The next stage was to try to test the
tissue with the new programming with special staining and
with antibodies inherent in immunohistochemistry.
Results:
It was possible to identify a new programming which
permits diagnosis with a time reduction of 40 minuts. The
confirmation of this was demonstrated by testing different
tissues with special stains and antibodies.
Conclusion:
The target of this study is the search and the reduction of
the processing time for 30 minutes. This has been reached
and exceeded. In fact within the program for the selected
processing it’s now possible to gain 40 minutes. Furthers
inquires where intended to verify there reliability of the
programming test 2 and for the programming test 6. In fact
they will execute cutting for the different tissues tested,
every 6 months and colored with the coloration He
(Ematoxiline-Erithrosine). This inquires will serve to
exclude the possibility for the proteolitic process, with the
degradation of the tissue. In fact the cubes of paraffine
come preserve for decades, in fact the process of
putrefaction should be excluded. This process does not
influence the diagnosis to be executed in the next
hours/days following the new processing but could have a
negative effect for the particular analyse for
immunohistochemistry that in any case can happen also
happen after many years the initial diagnosis.
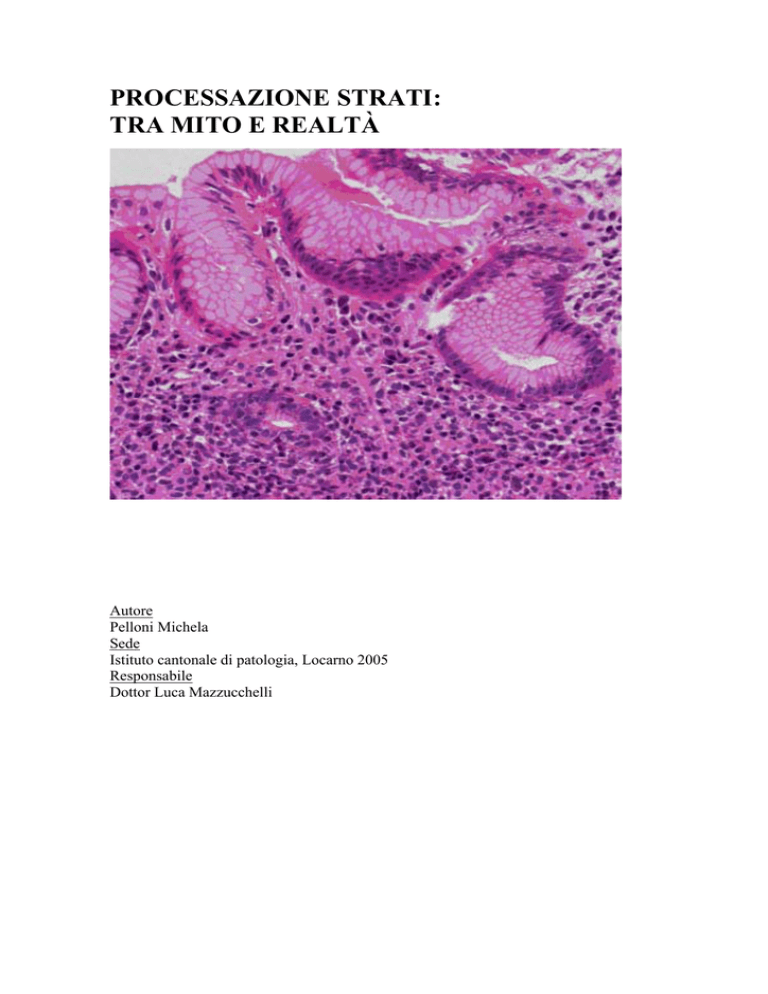
Immagine documentata nella copertina mostra una fotografia eseguita durante la ricerca. La foto mostra una biopsia dello stomaco durante un
processo infiammatorio, colorata con la colorazione ematossilina-eritrosina, caso numero.1719 anno 2005
5
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
INTRODUZIONE
La problematica riguardante il tempo di processazione di biopsie molto ridotte (tra 0.1cm e 1cm,
dette anche “strati”), è un tema cruciale nei laboratori di istopatologia, . Ogni laboratorio utilizza
tempi di processazione differenti a dipendenza di quali tipi di soluzione usa e dalle quantità di
biopsie che deve processare. Ottenere una processazione di tessuti con tempi ridotti aiuterebbe i
tecnici di laboratorio a procedere più velocemente ai passaggi successivi. Per affrontare questo
tema è importante conoscere a fondo le varie tecniche che vengono applicate in un laboratorio di
istopatologia. È opportuno approfondire i vari passaggi che riguardano la fissazione dei tessuti,
la processazione, e l’inclusione in paraffina. La conoscenza e l’utilizzo di differenti soluzioni
come l’alcool, formalina, xilolo sono pure di notevole rilievo.
Per quanto concerne la processazione, è essenziale valutare l’importanza di diversi fattori oltre il
tempo, quali la temperatura, le varie soluzioni impiegate, e la pressione che viene esercitata
all’interno di ogni bagno per permettere un buon scambio tra acqua e soluzione disidratante e
rispettivamente chiarificante, all’interno del tessuto. Inoltre è opportuno conoscere l’utilizzo di
differenti cromogeni e sali per le svariate colorazioni che vengono eseguite sui tagli istologici in
base alla loro struttura anatomica e alle possibili patologie.
In questo lavoro, le colorazioni utilizzate più frequentemente in un laboratorio di istopatologia
vengono valutate su diversi protocolli di processazione, e tra le differenti possibilità viene
individuata quella che oltre a ridurre il tempo di lavoro, mantiene un ottima qualità comparabile
a quella precedente. Da ultimo viene affrontato il problema dell’immunoistochimica. Grazie a
questa tecnologia, è possibile identificare molteplici proteine presenti nella cellula che
permettono una corretta caratterizzazione della malattia. Per analizzare meglio che cosa accade
durante la processazione di un tessuto è importante conoscere le modalità di fissazione prima
dell’accettazione in laboratorio. Infatti, per ottenere una buona processazione è importante che la
biopsia sia fissata adeguatamente. Bisogna quindi tener conto dei differenti tipi di formalina usati
nelle varie sale operatorie, come pure delle tecniche di prelievo e dei tempi necessari per il
trasporto delle biopsie dagli ospedali e studi medici al laboratorio.
Principi teorici: la qualità di biopsie di dimensioni ridotte puó essere influenzata da diversi
fattori, quali la fissazione, il calore, il tempo di processazione. Per poter garantire risultati
ottimali é importante tenere in considerazione questi fattori. In particolare, per quello che
concerne il tempo di processazione, é importante scegliere dei tempi gradualmente ridotti al fine
di identificare un’ idonea programmazione. (Teoria tratta dal libro TECHNIQUES D’HISTOPATHOLOGIE ET DE
CYTOPATHOLOGIE (4) e LABORATORY METHODS IN HISTOTECHNOLOGY (8)).
Durante la ricerca, non è stato possibile identificare eventuali risultati ottenuti da ricerche simili
malgradfo che si tratti di un tema di discussione in differenti laboratori di istopatologia.
Nel lavoro sono inclusi capitoli su materiale e metodi, dove vengono spiegati gli apparecchi
principali utilizzati nella ricerca, il tipo di materiale biologico utilizzato, le colorazioni eseguite,
l’utilizzo degli anticorpi, la scelta delle programmazioni e le varie procedure che vanno dalla
fissazione della biopsia al taglio al microtomo. Inoltre si espone una tabella di valutazione dei
tagli istologici, partendo da 1 (insufficiente) a 5 (ottimo). Viene inoltre prestata attenzione nel
mantenere una certa standardizzazione durante le varie procedure di laboratorio.
Il capitolo dei risultati, dove vengono mostrati dei grafici per ogni tipo di tessuto utilizzato,
espone una media dei punteggi ottenuti per ogni colorazione eseguita su ogni taglio.
Da ultimo abbiamo la discussione in merito ai risultati ottenuti, e la conclusione del lavoro.
6
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
OBIETTIVI
Questo lavoro di ricerca verte soprattutto sulla problematica del tempo nella fase di
processazione degli strati. Da diversi anni viene utilizzato all’Istituto Cantonale di Patologia di
Locarno (ICP) un programma apposito per gli strati che tiene conto delle dimensioni ridotte di
questi prelievi. Ciononostante i tempi di processazione rimangono piuttosto lunghi, ossia 1h 14
minuti.
La riduzione del tempo di processazione, è suggerita dal fatto che negli ultimi anni il numero di
analisi degli strati è duplicato. Oggi si analizzano in media 80 strati al giorno, arrivando
addirittura a punte di 106 strati in un solo giorno.
Poter ridurre anche di soli 30 minuti il tempo di processazione degli strati, sarebbe di grande
aiuto ai tecnici di istopatologia. Potrebbero infatti disporre in tempi ragionevoli del tessuto
processato da poter includere in paraffina e successivamente tagliare, colorare e, se necessario
analizzare con tecniche di immunoistochimica.
La qualità degli strati dopo la processazione è di notevole rilevanza per poter leggere i tagli
istologici e deve assolutamente essere mantenuta se accelerando la fase di processazione si vuole
permettere ai patologi di lavorare in condizioni ottimali. Razionalizzare il lavoro di laboratorio
aumenterebbe l’efficienza delle prestazioni dell’ICP e quindi interessare ulteriori medici, che
spediscono biopsie nella Svizzera tedesca. Lo studio è giustificato dal fatto che in Svizzera
tedesca il tempo di attesa, dalla spedizione del tessuto alla diagnosi è relativamente breve dal
momento che la maggior parte dei laboratori di istologia oltre alpe, è situato negli ospedali.
Questo crea loro un enorme vantaggio, essendo vicini alla sala operatoria, il materiale arriva in
continuazione e non rimane per ore se non per giorni in circolazione come accade in Ticino.
Questa ricerca si prefigge quindi, non solo di ottenere in minor tempo lo stesso numero di tessuti
da tagliare, ma anche di poter far fronte ad un futuro aumento del numero di analisi di strati.
7
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
MATERIALE E METODI
MATERIALE
Il materiale biologico utilizzato in questo lavoro è costituito da biopsie della routine giornaliera.
Queste comprendono principalmente prelievi dell’apparato gastro-intestinale e del tratto
respiratorio. Possono presentarsi, anche se molto raramente, delle biopsie cardiache oppure dei
prelievi stereotassici del cervello. Le biopsie provengono dagli studi medici e dalle sale
operatorie degli ospedali e delle cliniche del canton Ticino. Il materiale studiato è stato
selezionato dal patologo in sala di macroscopia in modo da non compromettere la diagnosi.
In particolare in una prima fase non abbiamo utilizzato tessuto di pazienti in accertamenti per
malattie tumorali. I tessuti con sospetto tumore, sono stati studiati solo dopo aver ottenuto dati
preliminari a sufficienza con tessuti non tumorali. Gli studi sono stati eseguiti su 3-8 biopsie al
giorno per un totale di 90 prelievi. Per permettere un confronto, parte delle biopsie analizzate con
nuove programmazioni di processazione sono sempre state processate in parallelo con il
protocollo originale.
Le tabelle che seguono mostrano i vari tessuti che sono stati scelti in base alle loro caratteristiche
morfologiche, da poter documentare nel lavoro. I vari casi sono stati poi documentati con delle
fotografie ed una tabella di valutazione, nel capitolo degli allegati.
COLORAZIONI UTILIZZATE NELLE DIFFERENTI BIOPSIE
Tabella 1.
Alcian
blue
Argentometenanine
(Grocott)
Cab
EVG
Ferro
Giemsa
Giemsa
modificato
(CBG)
Gömöri
He
Masson
Orceina
PAS
Stomaco Colon
x
Retto Esofago
Ileo
Fegato
x
x
x
x
Cieco
Polmone
x
x
x
x
x
x
x
x
x
x
x
x
x
x
x
x
x
x
x
x
x
x
x
x
x
DIFFERENTI ANTICORPI UTILIZZATI NELLE VARIE BIOPSIE
Tabella 2.
CD3
Stomaco Colon
x
Retto Esofago
x
Ileo
Fegato
Cieco
x
Polmone
x
8
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
HELICOBACT
HEP
MNF 116
x
x
x
x
x
x
Verranno eseguiti dei controlli di qualità interni che riguardano le colorazioni speciali e l’utilizzo
degli anticorpi.
La tabella mostra la programmazione originale già presente all’istituto. Le successive
programmazioni sono state create riferendoci alla programmazione originale.
PROGRAMMAZIONE
Originale
Test 1
Test 2
Test 3
Test 4
Test 5
Test 6
MINUTI
89 minuti
57 minuti
49 minuti
32 minuti
29 minuti
17 minuti
9 minuti
SUDDIVISIONE DELLE VARIE PROGRAMMAZIONI
BIOPSIE UTILIZZATE
Il grafico seguente mostra la percentuale di biopsie testate durante la ricerca.
Nel grafico è presente una percentuale notevole di biopsie dello stomaco utilizzate per la ricerca
(53%), seguono il colon con il 22%, l’ileo con il 16%, il retto e l’esofago con il 4%, e da ultimo
il fegato con 1%.
Inoltre, per ogni tessuto testato, è stato fatto un grafico che rappresentasse in percentuale, le varie
programmazioni.
9
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
DISTRIBUZIONE DELLE BIOPSIE GASTRICHE FRA LE DIFFERENTI
PROGRAMMAZIONI
DISTRIBUZIONE DELLE BIOPSIE DEL COLON FRA LE DIFFERENTI
PROGRAMMAZIONI
10
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
DISTRIBUZIONE DELLE BIOPSIE DEL ILEO FRA LE VARIE PROGRAMMAZIONI
DISTRIBUZIONE DELLE BIOPSIE DEL RETTO FRA LE VARIE
PROGRAMMAZIONI
11
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
DISTRIBUZIONE DELLE BIOPSIE DELL’ ESOFAGO FRA LE PROGRAMMAZIONI
DISTRIBUZIONE DELLE BIOPSIE DEL FEGATO FRA LE VARIE
PROGRAMMAZIONI
Nelle biopsie del fegato, l’unica programmazione utilizzata è stata il Test 2 (100%),
PROCESSAZIONE
È molto importante standardizzare la processazione, l’inclusione in paraffina, i tagli, le
colorazioni e l’utilizzo degli anticorpi. La processazione del tessuto è stata analizzata con
12
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
l’apparecchio TCP 15 Tissue Processing Center della ditta Medite (Burgdorf), schematizzato qui
sotto:
TPC 15 Tissue Processing Center
Fig. 2) L’immagine seguente è tratta dall’opuscolo TPC 15 TISSUE PROCESSING CENTE. mode d’emploi
fornito dalla ditta Medite, (19). Lo schema mostra la struttura dell’apparecchi e del loro contenuto.
La figura 2 da l’idea di come è strutturato il processatore, le date indicate nei bagni non
corrispondono alla realtà.
Inoltre è importante sottolineare che l’immagine nei bagni numero 1 e 2 contiene della
formalina al 4%, mentre nella nostra ricerca i bagni 1 e 2 contengono dell’alcool 70%, e il
bagno 3 contiene alcool al 80%, mentre il 4 e 5 contengono alcool al 95%. I restanti bagni
rappresentano le stesse concentrazioni che sono state utilizzate per valutare i vari programmi di
processazione.
Tutti i bagno hanno una temperatura di 40°C tranne le quattro paraffine che si trovano a
temperatura di 60°C. L’apparecchio, oltre a possedere bagni con differenti contenuti in
agitazione, presenta un vacum costante che facilita il passaggio dei vari liquidi all’interno del
tessuto, impiegati per il processo di disidratazione. Nel laboratorio sono presenti due processing
TPC, che lavorano contemporaneamente. La prima programmazione che parte nella mattinata è
quella inerente gli strati, seguono poi le cuti e poi il programma biopsie grandi che avendo un
tempo di processazione lungo, termina il giorno dopo, verso le cinque di mattina.
Pur avendo a disposizione due processatori, è importante che il cestello contenete la routine e
quello contenente le biopsie test partano sullo stesso apparecchio. L’apparecchio è in grado di
regolarsi, evitando che i due cestelli debbano entrare nello stesso bagno, scontrandosi. È
importante far partire per primo il cestello con le biopsie test e far partire il secondo con le
biopsie originali. Si tratta di una semplice comodità, perché dal momento che il cestello con i
vari test presenta un tempo di processazione ridotto, uscirà per primo lasciando il posto al resto
della routine.
(Citazioni tratte dall’opuscolo TPC 15 TISSUE PROCESSING CENTER, mode d'emploi, fornito dalla ditta Medite, (19))
13
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
INCLUSIONE IN PARAFFINA
Fig. 3) Immagine tratta dal libro, TECHNIQUES D’HISTOPATHOLOGIE ET DE CYTOPATHOLOGIE, (4).
La foto mostra l’inclusione nella paraffina, di un tessuto dopo la processazione.
L’inclusione in paraffina, e soprattutto l’orientamento del tessuto sarà importante per ottenere
tagli istologici in cui sia facile orientarsi permettendo una rapida e precisa diagnosi.
Fig. 4) La foto è tratta dal testo HISTOTECHNOLOGY A SELF-INSTRUCTIONAL TEXT, (2)
Vengono mostrati due differenti tessuti. Il primo da sinistra riguarda dei noduli linfatici, mentre la
seconda foto mostra delle biopsie gastro-intestinali, comunemente chiamate strati nel campo dell’istologia.
L’inclusione è stata eseguita dall’équipe di laboratorio rispettando le regole vigenti all’ICP.
TAGLIO AL MICROTOMO
Dopo aver incluso i tagli nella paraffina, i blocchi di paraffina sono stati tagliati al microtomo.
Le sezioni misurano circa 3 micron, ottenendo sul taglio praticamente un solo strato di cellule.
14
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Tutto questo per permettere una buona visione al microscopio e facilitare la diagnosi. Il taglio
viene poi immerso in un bagno contenente dell’acqua ad una temperatura di 43°C. Il calore
permette al taglio di distendersi e di facilitare la sua applicazione sul vetrino.
(Citazioni tratte secondo il metodo di laboratorio)
Fig. 5) La foto è tratta dal libro HISTOTECHNOLOGY A SELF-INSTRUCTIONAL TEXT , (2)
L’immagine mostra come viene eseguito il taglio del tessuto incluso nella paraffina al microtomo.
COLORAZIONI
È stata eseguita una colorazione di base chiamata He (ematossilina-eritrosina) per verificare
l’attendibilità della programmazione. Una volta dimostrato che il taglio presenta tutte le
caratteristiche desiderate, si è proceduto con l’analisi delle colorazioni speciali. È importante per
ogni tessuto, conoscere la sua struttura e la sua composizione chimica per poter facilitare la
scelta di una colorazione specifica. Inoltre le colorazioni speciali possono essere mirate e mettere
in evidenza particolari patologie. In casi selezionati, per lo stesso tessuto sono state effettuate tre
colorazioni di base. La prima su tessuto sano, la seconda su tessuto coinvolto in un processo
infiammatorio e la terza su tessuto tumorale.
Lo stesso approccio e poi stato utilizzato per l’analisi delle colorazioni speciali. Negli allegati
vengono discusse il principio delle colorazioni, le rispettive metodiche ed i possibili impieghi nel
tessuto. Le colorazioni come He, Alcina-blue, Evg, e Pas sono state eseguite con l’apparecchio
Tissue Stainer TST 44 della ditta Medite (Svizzera). Le restanti colorazioni quali il Gömöri,
Masson, Giemsa, Giemsa mod., Cab, Orceina, e Ferro, sono state fatte manualmente. Inoltre
sono stati analizzati dei prelievi con tecniche di immunoistochimica per verificare che
un’accorciamento dei tempi di processazione non influenzasse la sensibilità e la specificità degli
anticorpi primari utilizzati. In questo senso, particolare attenzione è stata dedicata a selezionare
anticorpi che necessitano di un pretrattamento diverso dal tessuto quali ad esempio il calore
oppure l’incubazione con proteasi. Come anticorpi sono stati utilizzati MNF116, Hep, Helicobat,
e il CD3. L’apparecchio utilizzato per l’immunoistochimica è il Benchmark della ditta Ventana
(Texas, USA).
(Nota: Approfondimenti inerenti le colorazioni, e l’utilizzo degli anticorpi si trovano nel capitolo degli allegati)
15
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
VALUTAZIONE DEI TAGLI
Per verificare l’attendibilità della processazione, dopo la colorazione del taglio è stata creata una
tabella che ha permesso di valutare il tessuto seguendo una scala di giudizio composta da 5 note,
(5 molto buono, 4 buono, 3 discreto, 2 sufficiente, 1 insufficiente). Sono stati valutati il nucleo,
il citoplasma, il colore di fondo e per le colorazioni specifiche, ciò che doveva essere
evidenziato. In seguito per ogni tessuto è stata fatta una media dei vari punteggi ottenuti, i quali
sono stati poi rappresentati con un grafico nel capitolo dei risultati.
Per ogni tessuto è stata creata una tabella che riassume l’attendibilità della processazione
valutando assieme le varie colorazioni speciali e i vari anticorpi. Negli allegati sono riassunte le
varie colorazioni ed i rispettivi risultati.
Nota
Nucleo
5 Molto buono
Colorazione ben
nitida. Nucleo con
un’ottima trasparenza
s’intravvedono
nucleoli, ev vacuoli,
cromatina omogenea.
Eseguibile una corretta
diagnosi.
Colorazione
omogenea, nucleo
buona trasparenza,
s’intravvedono i
nucleoli ed eventuali
vacuoli. Cromatina
risulta ben evidenziata.
Risulta eseguibile una
buona diagnosi.
4 Buono
3 Discreto
2 Sufficiente
Citoplasma
Ottima
differenziazione tra
nucle-citoplasma.
Distinguibile la
presenza di vacuoli
ev. organelli.
Eseguibile una
corretta diagnosi.
Colorazione
omogenea,
colorazione nitida,
buona lettura della
densità, consistenza
del
citoplasma.
Visione di eventuali
vacuoli. Eseguibile
una
buona
diagnosi.
Discreta lettura, è
Nucleo mediamente
presente la
trasparente,
distinzione nucleocolorazione
citoplasma. Il
relativamente
omogenea, tendente al citoplasma risulta o
troppo scuro (S) o
scuro (S) o al chiaro
troppo chiaro (C).
(C). Ancora
distinguibili nucleoli e S’intravedono
eventuali vacuoli.
vacuoli ma con
Diagnosi eseguibile.
difficoltà. Cromatina
disomogenea.
Diagnosi eseguibile.
Colorazione del nucleo Colorazione del
appena accettabile.
citoplasma tendente
Difficoltà
allo scuro (S) o al
nell’intravvedere i
chiaro (C). Appena
nucleoli ev. vacuoli.
distinguibile il
Cromatina
citoplasma dal
disomogenea, al limite nucleo, difficoltà
del diagnosticabile.
nel identificare
Tendente allo scuro
eventuali vacuoli.
(S) o al chiaro (C).
Al limite del
Colore
di fondo
Colorazione
specifica
Le cellule sono
perfettamente
differenziate dal resto
del tessuto. Il colore
di fondo permette
un’ottima
differenzazione ed
una corretta diagnosi.
Buona
differenziazione tra
la cellula e il resto
del tessuto. Facilità
nel evidenziare un
eventuale cellula
sospetta. Eseguibile
una buona diagnosi.
Ottima messa in
evidenza della
struttura cellulare o
microrganismo da
ricercare, in modo da
poter agevolare la
diagnosi.
Le cellule sono
distinguibili dal resto
del tessuto. La
colorazione risulta
ancora omogenea,
tendenza allo scuro
(S) o al chiaro (C), la
diagnosi può essere
eseguita.
Le strutture che
devono essere
evidenziate si
differenziano dal
resto della cellula. La
loro colorazione
risulta ancora
omogenea, può
risultare scura (S) o
chiara (C), diagnosi
eseguibile.
Il colore di fondo
tende allo scuro (S) o
al chiaro (C).
Difficoltà nel
intravedere la cellula
dal resto del tessuto.
Al limite del
diagnosticabile.
Difficoltà nella
differenziazione tra la
struttura da ricercare
e il resto della cellula.
Tendenza ad una
tonalità scura (S) o
chiara ©.
Buona messa in
evidenza della
struttura cellulare o
microrganismo da
ricercare.
16
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
1 Insufficiente
Non è possibile
distinguere il nucleo
dal citoplasma, nucleo
disomogeneo, non
visibili nucleoli dalla
cromatina. Non visibili
vacuoli. Impossibile la
diagnosi.
Addensamento di
eventuali orfanelli.
Non interpretabile
impossibile la
diagnosi.
diagnosticabile.
Difficoltà nella
distinzione nucleocitoplasma.
Colorazione
disomogenea. Non
interpretabile,
impossibile la
diagnosi
Non distinguibile la
cellula dal resto del
tessuto, la
colorazione del
tessuto risulta
totalmente
omogenea. Non
interpretabile,
impossibile la
diangosi
La struttura presente
non viene
evidenziata.
Difficoltà di ricerca.
Colorazione
omogenea su tutto il
tessuto. Non
interpretabile,
impossibile la
diagnosi.
PERSONALE COINVOLTO
Durante questa ricerca sono stata sostenuta dall’équipe di istologia. È importante che tutti i
passaggi siano eseguiti da chi utilizza gli apparecchi di processazione nella routine. L’inclusione
del taglio dei blocchetti sono pure stati eseguiti da tutto il personale, in particolare gli strati sono
stati tagliati a 3 micron di spessore. La valutazione dei tagli è stata eseguita dal direttore,dalla
capo laboratorista e da me, seguendo la scala di valutazione.
METODO DI STANDARDIZZAZIONE E CONTROLLO DI QUALITÀ
Nella raccolta dei risultati si è tenuto conto di ogni possibile cambiamento che abbia potuto in
qualche modo influenzare i dati. Le varie colorazioni specifiche sono state eseguite in parallelo
su campioni di tessuto di controllo noti per dare un segnale specifico per una particolare
colorazione.
Lo stesso vale per l’utilizzo di anticorpi, che prevede l’impiego di controlli. I vari controlli sono
stati applicati sullo stesso vetrino con il taglio processato con la programmazione selezionata. In
questo modo si è mantenuto uno standard durante i vari passaggi della colorazione. Un errore
durante la procedura delle colorazioni, si riprodurrebbe infatti sul taglio del controllo. La riuscita
della colorazione è stata valutata al microscopio paragonando il controllo positivo ed il tessuto
da valutare.
17
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
RISULTATI
COMPARAZIONE FRA LA PROGRAMMAZIONE ORIGINALE E LA
PROGRAMMAZIONE TEST 2 INERENTI LE BIOPSIE DEL FEGATO
Grafico 1
Comparazione fra le due programmazioni inerenti
le biopsie del fegato
6
scala valutativa
5
4
MEDIA ORIGINA LE
3
MEDIA TEST 2
2
1
0
1
2
5
MEDIA
ORIGINA LE
4.666666667
MEDIA TEST 2
Nel grafico 1 è stato possibile comparare solamente due programmazioni. Visto il numero ridotto
di biopsie del fegato, non è stato possibile testare la programmazione test 6.
La media dei risultati ottenuti per la programmazione test 2 risultano tra il buono e ottimo (4.7).
COMPARAZIONE FRA LA PROGRAMMAZIONE ORIGINALE, TEST 2 E
TEST 6 INERENTE LE BIOPSIE DELLO STOMACO
Grafico 2
Com parazione fra le tre program m azioni ine re nti le
biops ie gas triche
6
scala valutativa
5
4
MEDIA ORIGINA LE
3
MEDIA TEST 2
2
MEDIA TEST 6
1
0
1
MEDIA
ORIGINA LE
2
5
MEDIA TEST 2
4.954545455
MEDIA TEST 6
4.105263158
18
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Il secondo grafico mostra le tre programmazioni, l’originale, test 2 e test 6 inerenti le biopsie
gastriche. La programmazioni test 2 ha raggiunto risultati quasi paragonabili alla
programmazione originale ottenendo una media di 4.95. La programmazione test 6 mantiene
anche lei un buon livello di processazione con una media di 4.1.
COMPARAZIONE FRA LA PROGRAMMAZIONE ORIGINALE, TEST 2 E
TEST 6 INERENTI LE BIOPSIE DEL ILEO
Grafico 3
Com parazione fre le tre program m azioni ine re tni le biops ie
de l ile o
6
scala valutativa
5
4
MEDIA ORIGINA LE
3
MEDIA TEST 2
2
MEDIA TEST 6
1
0
1
MEDIA
ORIGINA LE
2
5
MEDIA TEST 2
4.875
MEDIA TEST 6
4.3125
Il grafico 3 mostra la comparazione fra le tre programmazioni per quello che concerne le biopsie
del ileo. La programmazione test 2 mostra una media di 4.87, comparabile alla programmazione
originale. La programmazione test 2 può essere valutata buona-ottima.
19
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
COMPAREZIONE FRA LA PROGRAMMAZIONE ORIGINALE, TEST 2 E
TEST 6 INRERENTE LE BIOPSIE DEL RETTO
Grafico 4
Com parazione fra le tre porgram m azioni ine re nti le
biops ie de l re tto
6
scala valutativa
5
4
MEDIA ORIGINA LE
3
MEDIA TEST 2
2
MEDIA TEST 6
1
0
1
2
MEDIA
ORIGINA LE
5
MEDIA TEST
2
4.818181818
MEDIA TEST
6
4.181818182
Il grafico 4 mostra la comparazione delle tre programmazioni inerenti le biopsie del retto. Per la
programmazione test 2, la media ottenuta è stata di 4.81, valutandola buono-ottimo, per la
programmazione test 6 la media è stata di 4.18, valutandola come una buona programmazione.
COMPARAZIONE FRA LA PROGRAMMAZIONE ORIGINALE, TEST 2 E
TEST 6 INERENTI LE BIOPSIE DEL COLON
Grafico 5
Com parazione fra le tre program m azioni ine re nti
le biops ie de l colon
6
5
4
M EDIA ORIGINA LE
3
M EDIA TEST 2
2
M EDIA TEST 6
1
0
1
M EDIA
ORIGINA LE
2
5
M EDIA TEST 2
5
M EDIA TEST 6
4 .3 6 3 6 3 6 3 6 4
Il grafico 5 mostra la comparazione delle tre programmazioni inerenti le biopsie del colon. Il
programmazione test 2 mostra un ottimo andamento con una media di 5. Mentre per la
programmazione test 6 la media ottenuta è stata di 4.36 ottenendo un buon giudizio.
20
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
DISCUSSIONE
In questo studio abbiamo dimostrato che si puó notevolmente accorciare il tempo di
processazione di piccole biopsie (“strati”) senza compromettere la qualità dei tagli istologici
colorati con la colorazione di routine HE, con numerose colorazioni speciali, oppure trattati con
tecniche di immunoistochimica. Infatti un’ analisi semiquantitativa dei tagli istologici non ha
evidenziato una differenza di qualità tra le diverse processazioni analizzate.
I risultati sono particolarmente significativi per i seguenti motivi:
1) è possibile ottenere tagli istologici con colorazione HE di qualità buona-ottima con 40 minuti
di anticipo sul programma di processazione utilizzato precedentemente nel laboratorio di
istopatologia.
2) I nuovi tempi di processazione non influiscono sulla qualità di numerose colorazioni speciali
che vengono utilizzate in casi selezionati nella routine giornaliera dell’ ICP
3) Le tecniche di immunoistochimica possono essere eseguite sul tessuto processato con i nuovi
protocolli senza comprometterne la sensitività e la specificità. In particolare in questa fase del
lavoro sono stati considerati anticorpi primari che necessitano differenti tipi di pretrattamento del
tessuto (ad esempio enzima oppure calore).
Dopo aver introdotto nella routine giornaliera, la programmazione Test 2 sostituendo quella
originale, sono state processate non solo le biopsie dell’apparato gastro-intestinale ma anche
dell’apparato respiratorio e biopsie epatiche. I risultati sono stati soddisfacenti. Nel capitolo dei
risultati non è stato possibile inserire delle biopsie dell’apparato respiratorio perché, essendo il
materiale sempre molto scarso, non è stato possibile eseguire piú di un tipo di processazione su
biopsie dello stesso paziente. Per contro, in una biopsia epatica siamo stati in grado di
confrontare direttamente la processazione originale con il Test 2.
La conferma della riuscita delle colorazioni speciali e degli anticorpi è dimostrata dall’utilizzo di
controlli di qualità interni documentati assieme ai casi fotografati. Per le colorazioni
istochimiche, l’utilizzo dei controlli è stato usato per Masson, Orceina. Le altre colorazioni non
necessitano di un controllo perché, in un paziente sano la presenza di strutture elastiche (Evg), di
strutture cellulari (He, Giemsa) e del ferro risultano positive. Per l’utilizzo degli anticorpi ci si
avvale sempre di un controllo di qualità interno ad eccezione degli anticorpi per l’Helicobacter
pylori. Tutto questo è giustificato dal fatto che in media ogni giorno abbiamo almeno una
biopsia positiva per l’Hp, in un secondo luogo, essendo uno strato e quindi di dimensioni ridotte
(0.1cm-1cm), il blocchetto contenete la minuscola biopsia dopo circa cinque tagli; non
rimarrebbe più del tessuto incluso nel blocchetto.
Per verificare o meno l’esistenza di una ricerca che abbia trattato la riduzione del tempo di
processazione degli strati è stato visitato il sito internet www.ncbi.nlm.nih.gov. Inoltre è stato
possibile informarsi direttamente con l’istituto cantonale di patologia a Berna. La ricerca non ha
dato nessun esito a favore.
21
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
CONCLUSIONI
L’obiettivo proposto all’inizio della ricerca, ossia la riduzione dei tempi di processazione di 30
minuti è stato raggiunto e superato. Infatti con il programma di processazione selezionato è ora
possibile guadagnare 40 minuti .
Ulteriori indagini sono in corso per verificare l’attendibilità della programmazione Test 2 e della
programmazione Test 6. Infatti, ogni sei mesi, gli stessi blocchetti che sono stati processati con
la programmazione test 2 e test 6 verranno nuovamente tagliati, fissati sul vetrino e colorati con
la colorazione HE (ematossilina-eritrosina).
Queste indagini serviranno per escludere la possibilità di un processo proteolitico con
degradazione del tessuto. Infatti i blocchetti di paraffina vengono conservati per decenni per cui
processi di putrefazione devono essere esclusi. Questi processi non influiscono sulla diagnosi che
viene fatta nelle ore/giorni seguenti alla nuova processazione ma potrebbero avere un effetto
negativo su analisi particolari, quali l’immunoistochimica, che in alcuni casi possono avvenire
anche anni dopo la diagnosi iniziale.
22
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
RINGRAZIAMENTI
I miei ringraziamenti vanno in particolar modo all’Istituto Cantonale di Patologia per la
disponibilità avuta nel avermi dato l'opportunità di poter utilizzare l’apparecchio Processing per
lo sviluppo di una nuova programmazione inerente le biopsie degli strati.
Ringrazio in particolare il direttore dell’istituto, il dottor Luca Mazzucchelli per avermi seguito
durante questi mesi osservando i tagli, e dandone dei giudizi che mi hanno aiutato nel proseguire
la ricerca per una nuova programmazione, e soprattutto per i preziosi consigli datomi durante il
periodo di pratica. Inoltre voglio ringraziare l’ex.direttore il dottor Enio Pedrinis ed vari patologi:
Peter Lusceti, Gabriele Bernasconi, Tiziana Rusca, Eliana Passega-Sidler, per avermi fornito
durante le varie macroscopie, i diversi tessuti da poter testare nella programmazione.
Ringrazio la capo reparto Lara Lunghi-Etienne, l’ex capo laboratorio Michelle Personeni, ed i
seguenti tecnici di laboratorio, che hanno contribuito nella realizzazione di questo lavoro: Ursula
Terribilini, Daniela Tavian, Paolo Mazzatorta, Stephan Zemp, Daniele Cavalli, Tripun Stojanov,
Silvia Giudici.
Ringrazio inoltre, il Dottor Bellezza Marco per l’aiuto prestatomi nelle scelta di alcune immagini
presenti nel mio lavoro, il Dottor Andrea Bordoni e Fabrizia Vanzetta per il prezioso aiuto
informatico.
Inoltre voglio ringraziare Andrea Boffini per essersi sempre messo a disposizione di fronte a
dubbi o incertezze che ho riscontrato durante il mio percorso.
Ringrazio Giovanni Togni per aver portato alcuni esempi su come svolgere un lavoro di diploma.
Ringrazio il professore Francesco Bezzola per essersi messo a disposizione di fronte ad lacune
che ho riscontrato nel mio lavoro nell’ambito dell’informatica. Voglio inoltre ringraziare la
docente d’inglese Gilbert Susanne per avermi corretto il riassunto tradotto in inglese.
Voglio inoltre ringraziare la ditta BIO-OPTICA di Milano, per avermi messo a disposizione un
CD-Rom sulle molteplici colorazioni presenti nel campo dell’istologia.
Da ultimo ringrazio Daniela Marcacci e Sonja Marci per avermi dato numerosi suggerenti per lo
svolgimento del lavoro.
23
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
BIBLIOGRAFIA
Nel testo sono presenti, al termine di ogni citazione di origine teorica, sono presenti delle
numerazioni che indicano da quale libro, testo o sito internet è stato estrapolato.
LIBRI
1. Barr, W.T,Allison, R.T, Culling, C.F.A
CELLULAR PATHOLOGY TECNIQUE.
IV Edition Butterworth London ( 1985)
2. Carson Freida, L.
HISTOTECHNOLOGY A SELF-INSTRUCTIONAL TEXT
II edition, Departement of Pathology Baylor University Medical Center
Dallas Texas (1996), Revision (2001)
3. Drago, M.
L’ENCICLOPEDIA DELLA MEDICINA
VIII edizione, Istituto Geografico DeAgostini, Novara (2001)
4. Hould, R.
TECNIQUES D’HISTOPATHOLOGIE ET DE CYTOPATOLOGIE
Centre Collégial de Dévéloppement de marériel didatique collège de Mauisonneuve (CCDMD)
Canada Québec (1984)
5. Mazzi, V.
MANUALE DI TECNICHE ISTOLOGICHE E ISTOCHIMICHE
Ed. Piccin Bucher Padova (1977)
6. Mojetta, A.
ENCICLOPEDIA SCIENZE (MATEMATICA, FISICA, CHIMICA, BIOLOGIA, SCIENZE
DELLA TERRA, BOTANICA, ZOOLOGIA)
Editore Garzanti,enciclopedia AVALLARDI Italia (1995)
7.Passananti, S
PRINCIPI DI CHIMICA IN 9 MODULI
Ed. Tramontana, Milano (2002)
8.Prophet, E.B., Millis, B., Arrington, J.B., Sobin, L.S
LABORATORY METHODS IN HISTOTECHNOLOGY
Prepared by the Armed Forces Institute of Pathology Washington (1992)
Reprinted with minor modifications (1994)
9. Reed,R. Holmes, D., Weyers, J., Jones, A.
METODOLOGIE DI BASE PER LE SCIENZE BIOMOLECOLARI
Edizione Zanichelli Bologna (2002)
10.Voet., D, Voet, J.G.,
BIOCHIMICA
Editore Zanichelli Bologna (1993)
MANUALI D’USO, DISPENSE
11 Dako Cytomation
CATALOG IMMUNOCYTOCHEMISTRY
Zugo (2004/05)
12 Dakocytomation
COURS D’INTRODUCTION TECNIQHE IMMUNOHISTOCHIMIE
École de laborantines et laborantins médicaux Genève (2003)
13Keller, F. CORSO D’IMMUNOLOGIA TEORICA E PRATICA PER LA FORMAZIONE DI
24
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
LABORATORISTI MEDICI Locarno (2004-2005)
14Lunghi, L.
PROTOCOL #2:CD 3 procedure iview dab Paraffin BenchMark IHC/ISH Staining Module
Istituto Cantonale di Patologia, Locarno (04.02.2005)
15Lunghi, L.
PROTOCOL #77:HELICOBACT procedure iview dab Paraffin BenchMark IHC/ISH Staining
Module
Istituto Cantonale di Patologia, Locarno (06.03.2003)
16Lunghi, L.
PROTOCOL #88:HEPprocedure iview dab Paraffin BenchMark IHC/ISH Staining Module
Istituto Cantonale di Patologia, Locarno (21.12.2004)
17 Lunghi, L.
PROTOCOL #2:MNF 116 procedure iview dab Paraffin BenchMark IHC/ISH Staining
Module
Istituto Cantonale di Patologia, Locarno (25.05.2004)
18 Marcacci, D. Monico, C.
DISPENSE DEL CORSO D’ISTOLOGIA PRATICA PER LA FORMAZIONE QUALE
LABORATORISTI MEDICI Locarno (2003)
19 Medite Medizintechnik,
TPC 15 TISSUE PROCESSING CENTER, mode d'emploi
Burgdorf (12.1999)
20.Ventana
CLINICAL DIAGNOSTIC REAGENTS
A COMPRENHENSIVE PORTFOLIO OF IMMUNOHISTOCHEMISTRY AND IN-SITU
HYBRIDIZATION
REAGENTS AND SPECIAL STAINS OPTIMIZED FOR USE WITH VENTANA STAINING
SYSTEMS.
Ventana Medical Sistem
France (2003/2004)
21.Ventana
KIT DE DETECTION DAB
Metodica per l’utilizzo di anticorpi con metodo enzimatico nei test immunoistochimici
Francia (2005)
22.Ventana
PROTEASE 1
Metodica per l’utilizzo della proteasi dei test immunoistochimici
Francia (2005)
INTERNET
Cossarizza, A
23.CARATTERISTICHE GENERALI DEGLI ANTIGENI
http://imoax1.unimo.it/~cossarizza/appunti/antigeni.htm
Università di Modena (ottobre-dicembre 2001)
24. Doi, P., Gianelli, U.
GLI ARTEFATTI E I RISCHI D’ERRORE NELLE TECNICHE ISTOCHIMICHE ED
IMMUNOISTOCHIMICHE
II Cattedra di Anatomia ed Istologia Patologica, Dipartimento di Medicina, Chirurgia e
Odontoiatria, Università degli studi di Milano
http//www.bio-optica.it/pdf1/bioinf1916.pdf
25
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
(non è stato possibile reperire la data di pubblicazione)
25.Evangelista A., Petrucci G., Sarti S., Maggiano N.,
LOCALIZZAZIONE IMMUNOISTOCHIMICA SEQUENZIALE DI ANTIGENI IN CELLULE
E TESSUTI
Istituto di Anatomia patologica, Università cattolica del S.Cuore. Largo F. Vito, 100168
Roma
http://www.bio-optica.it/pdf1/bioinf1911.pdf (23.09.2002)
26. Woods and Ellis
CAB (Mallory chromotrope blu di aniline)
Immagine di una biopsia epatica colorata con il CAB
Gallery of Histological© (2001)
http://home.primus.com.au/royellis/mallbod.html
27. GIEMSA
Immagine di un tessuto colorato con la metodica Giemsa
http://www.w.es/…/02-intG.piel.htm
(04-EX02-0052-4-C-Giemsa-x100-Ax1-RJM-intestine.jpg)
28. ORCEINA
Immagine di una biopsia epatica colorata con l’orceina
http://www.uv.es/~histomed/odontog/02-intG-piel/Pod05-piel-Orceina-10jpg
29 ponti metilici
http://publish.uwo.ca/~jkiernan/formglut.htm
SUPPORTO CD-ROM
30.Bio-optica
CHEMICALS 2005
Via San Faustino 58 Milano (2005)
31. VENTANA®
Voila TM
Tucson, Arizona (2004)
26
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
LESSICO
A
Anticorpi
Comunemente chiamate immunoglobuline,
sono costituiti da proteine e vengono prodotti
dai linfociti B, dopo una stimolazione
antigenica. Si suddividono in cinque classi
ben distinte: IgA, IgG, IgD, IgE, IgM.
Antigeni
Sostanze di origine proteica,lipidica o
glucidica, che è in grado di stimolare una
risposta immunitaria, con la produzione di
anticorpi rivolti contro le varie strutture
antigeniche.
Amine piogene
Riguarda basi organiche, dotate di gruppi
amminici (-NH2) che sono reperibili in forma
libera negli organismi viventi. In fisiologia
umana, invece indica un gruppo di sostanze
implicate nella conduzione di impulsi
elettrici.
B
Biopsia
Prelievo di tessuto vitale, da sottoporre ad
esame istologico per scopo diagnostico. Viene
eseguita con tecniche e modalità diverse.
C
Cromogeni
Composto benzenico provvisto di un
cromoforo, pur essendo colorato non possiede
proprietà coloranti. Deve contenere un gruppo
auxocromo che è costituito da gruppi con
cariche negative i quali possono legarsi a
proteine o a strutture del tessuto.
Cromofori
Raggruppamenti atomici, dai quali dipende il
colore, es:
C=C, C=O, C=S, C=N, N=N, N=O, NO2.
Criostato
Viene rappresentato come una cella ben
isolata nella quale è presente un microtomo.
La cella possiede una temperatura di
che varia da 0°C fino ad un massimo di
-50°C, e questo permette di poter tagliare
delle estemporane in urgenza senza doverle
fissare prima nella formalina..
Citocromi
Pigmenti a base proteinica contenenti ferro o
rame. Svolgono un ruolo importante nei
processi respiratori cellulari come
trasportatori di elettroni.
Catalasi
Enzima che catalizza la demolizione
dell’acqua ossigenata in acqua e ossigeno.
Sono metallo proteine, ed il loro gruppo
prostatico (parte non proteica) è rappresentata
dal ferro.
Coartazione
Restringimento di un lume o di un vaso o di
un canale
Condiloma
Escrescenza papillomatosa che si localizza
preferibilmente sulle zone genitali e per anali.
Carrier, proteina
Si tratta di una proteina che permette al
sistema immunitario di riconoscere altre
proteine (aptene) aventi masse molecolari
talmente piccole da non poter essere
riconosciute dal sistema immunitario, e quindi
da non riuscire ad indurre una risposta
immunitaria.
Carbossilici, gruppi
Fanno parte dei gruppi funzionali presentano
dei raggruppamenti di atomi ben definiti che;
conferiscono a esse proprietà simili e sono
responsabili della loro reattività: Es. gruppo
carbossilico (COOH) caratteristico degli acidi
D
Denaturazione
Perdita della struttura originaria e delle
proprietà di una macromolecola (proteina), in
seguito a trattamenti chimici (alcool, sali…)
calore, ecc.
Disidratazione
Eliminazione dell’acqua dal tessuto mediante
l’utilizzo di alcool.
Decalcificazione
Viene utilizzato una soluzione a base di acidi
inorganici (acido nitrico 3%-5%)e organici o
di agenti complessati, che permettono di poter
27
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
tagliare al microtomo tessuti ossei, e dentina
rendendoli “molli”.
E
Estemporanea
Prelievo bioptico di un qualsiasi tessuto, non
fissato ma crudo. Di solito proviene dalle sale
operatorio, l’esame istologico deve avere ogni
priorità, e i risultati devono essere trasmessi
immediatamente al medico curante.
Endopeptidasi
Sono enzimi che catalizzano l’idrolisi di
legami peptidici interni. Fanno parte di una
miscela di peptidasi dal momento che un solo
enzima non riuscirebbe a rompere tutti i
legami peptidici.
Epitopo
Parte dell’antigene contro la quale viene
indotta una risposta immunitari. Un antigene
può presentare numerosi epitopi, la parte
corrispondente viene chiamata paratopo.
Enzimi endogeni
Sono enzimi presenti nei tessuti danno luogo
a colorazioni non specifiche. Es. Perossidasi,
Fosfatasi alcalina, Biotina endogena.
F
Fissazione
La si ottiene o con il calore o con sostanze
chimiche come l’alcool etilico o il triossido di
cromo. Inattiva l’attività di enzimi autolisanti
che inducono la putrefazione del tessuto.
G
Glicogeno
Polisaccaride del glucosio presente nei tessuti
animali (specialmente nel fegato e nei
muscoli) come materiale energetico di riserva.
La sua struttura a catena ramificata può essere
scissa in molecole di glucosio destinate ad
essere demolite nel corso della glicolisi e
della respirazione cellulare (ciclo di Krebs)
con produzione di energia incorporati nei
legami dell’ATP.
H
I
Idrofilo
Che assorbe facilmente acqua. Le sostanze
che disciolte in acqua formano gelatine ed
alcuni gel sono idrofile.
Impregnazione
È la messa in evidenza del tessuto nel quale
penetra la paraffina calda allo stato liquido.
Immunogeno
Che induce, stimola una risposta immunitaria.
Possono avere caratteristiche immunogene le
proteine, gli zuccheri e i lipidi.
K
L
M
N
O
P
Pseudomelanosi
Si tratta di un cambiamento di colore (verde
marcio), di parti presenti nel cadavere
specialmente della mucosa intestinale. Esso
dipende dalla liberazione nei tessuti, dopo la
morte, durante la degradazione proteica, di
acido solfidrico (SH2) che si combina a
formare con l’emoglobina, sulfoemoglobina.
E con l’emosiderina e la ferritina, forma
solfuro di ferro.
Ponti metilici
Il gruppo aldeidico (HCHO) presente nella
formalina, si combina con HO presente nella
struttura proteica e con altri atomi presenti
sulla superficie della cellula. Questo legame
forma un ponte detto ponte metilico che
impedisce alla cellula di degradarsi,
mantenendo la sua morfologia. Ecco riassunta
in breve la reazione chimica:
(A) PROTEINA-H + HCHO→ PROTEINA-HCHOH
(B) PROTEINA-HCHOH + H-PROTEINA
→PROTEINA-C-PROTEINA +H2O
H2
L’ultima fase ha come formazione il ponte
metilico con formazione di una molecola di
acqua.
Perossidasi del rafano
Fa parte delle emoproteine che catalizzano il
trasferimento di due elettroni dai substrati del
perossido di idrogeno con la formazione di
acqua e di substrato ossidato, secondo la
formula: AH2+H2O2=A+2H2O
Precipitato
Sostanza risultante da una reazione di
precipitazione.
Precipitazione
Reazione chimica che porta alla formazione
di una sostanza insolubile, la quale per gravità
si deposita (precipita) sul fondo del recipiente
di reazione.
Q
28
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
R
Rifrazione
Fenomeno ottico per cui un raggio di luce
passando da un mezzo ad un’altro devia in
corrispondenza della superficie di
separazione, avvicinandosi alla normale
(o allontanandosene) se passa da un mezzo
meno denso ad uno più denso (e viceversa).
S
T
U
V
W
X
Y
Z
Tratto dal libro BIOCHIMICA, vedi bibliografia (10)
Tratta dal libro, HISTOTECHNOLOGY A SELF-INSTRUCTIONAL TEXT, vedi bibliografia. (2)
Tratto dall’ENCICLOPEDIA DELLA MEDICINA, vedi bibliografia. (3)
Tratto dal libro, MANUALE DI TECNICHE ISTOLOGICHE E ISTOCHIMICHE, vedi bibliografia (5)
Tartto dalle dispense del CORSO D’IMMUNOLOGIA TEORICA E PRATICA PER LA FORMAZIONE DI LABORATORISTI MEDICI, vedi
bibliografia (13)
Tratto dal libro,PRINCIPI DI CHIMICA IN 9 MODULI vedi bibliografia (7)
Tratto da ENCICLOPEDIA SCIENZE, vedi bibliografia (6)
Tratto da METODOLOGIA DI BASE PER LE SCIENZE BIOMOLECOLARI, vedi bibliografia (9)
29
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
ALLEGATI
LA FISSAZIONE
Le nozioni che seguono descrivono il principio della fissazione e della processazione dei tessuti. La
fissazione di un tessuto evita i processi chimico-morfologici che inducono l’autolisi dovuti ad
enzimi endocellulari, e germi che inducono la putrefazione del tessuto. La fissazione permette alla
biopsia di mantenere le cellule il più simile possibile allo stato naturale, anche dopo la morte
tessutale. Esistono diversi tipi di fissazione, tramite agenti fisici come il calore, o il congelamento;
che denaturano rapidamente le proteine, e rendono insolubili altri componenti cellulari. Ed infine
abbiamo gli agenti chimici, che sono composti da soluzioni di origine organica e non organica.
Quando la cellula muore, la membrana dei lisosomi viene distrutta e libera nel citoplasma degli
enzimi autolisanti che sono in grado di rompere catene proteiche in polipeptidi. Grazie alla
fissazione, questi enzimi vengono inattivati sottoponendo il tessuto ad agenti chimici capaci di
denaturare rapidamente le proteine e rendere insolubili gli altri costituenti cellulari. Nella
denaturazione, le proteine alterano soprattutto i rapporti con l’acqua e l’ambiente. I gruppi idrofili
formano tra loro dei legami tanto stretti da escludere l’acqua, in questo modo l’acqua legata alle
catene proteiche, permette la “coagulazione” delle proteine. La fissazione permette anche una certa
linearità liberando catene laterali o gruppi di catene polipeptidiche. Le proteine si rendono così, più
accessibili ai reagenti.
Alcuni fissativi anziché denaturare, creano una sorta di gelificazione che stabilizza le proteine
tramite la formazione di ponti metilenici, come nel caso della formalina, mentre si creano dei ponti
di natura non nota, per il tetrossido di osmio. I fissativi sono numerosi, e presentano tra loro, una
differente velocità di penetrazione del tessuto. Sono presenti fissativi primari coagulanti come
l’etanolo (alcool etilico), il cloruro mercurio, triossido di cromo e l’acido picrico. Abbiamo poi i
fissativi primari non coagulanti come la formaldeide, il tetrossido di osmio, il bicromato di potassio,
l’acido acetico, e alcuni tipi di sale detti sali indifferenti che sono dei gruppi di composti fatti da
solfato di sodio, cloruro di sodio ed altro. È possibile formare delle miscele fissative che tengono
conto della compatibilità e incompatibilità chimica dei diversi agenti fissativi. La formalina, nome
commerciale che deriva dal formaldeide, è il fissativo più usato, perché presenta un agevole
preparazione, ha un basso costo, presenta una buona fissazione e conservazione del tessuto, ed
inoltre è facile da miscelare con altri fissativi. Nel nostro laboratorio, come fissativo viene utilizzata
la formalina al 4%. Il pH della formalina è in genere acido, per la presenza di acido formico come
impurità o per la formazione di ossidazione della formaldeide. L’acidità può essere regolata
aggiungendo del cloruro di calcio 1% che neutralizza l’acido formico; indirizzando in pH verso
l’alcalinità. La fissazione viene così migliorata e alcune sostanze labili come i fosfolipidi e le amine
piogene ne traggono beneficio. La neutralizzazione della formalina viene ottenuta con una
soluzione tampone a base di fosfati. Se la biopsia deve rimanere a lungo nel fissativo, viene
consigliata la formalina salata, con l’aggiunta di soluzione fisiologica. La formalina reagisce con
gruppi funzionali ionizzanti e forma dei legami a ponte tra gruppi reattivi di molecole vicine. Si
formano ponti metilenici tra catene peptidiche contigue. I ponti metilenici fanno agire tra loro le
catene peptidiche assumendo così una struttura consolidata. Spezzandosi, numerosi gruppi
funzionali ritornano liberi e possono reagire meglio alle future colorazioni. Il tessuto immerso in
formalina per diverso tempo, può presentare spesso dei granuli nero-brunastri chiamati precipitati
formalinici causati soprattutto dalla presenza nel tessuto di emoglobina. Per eliminare questo
difetto, viene aggiunto del liquido di Kardasewitsch (ammoniaca 1%-5% e alcool etilico 70%).
(Citazioni tratte dal corso d’istologia pratica, (18), tratto da MANUALE DI TECNICHE ISTOLOGICHE E ISTOCHIMICHE, (5) e tratte da
CELLULAR PATHOLOGY TECNIQUE, (1)) tratto da http://publish.uwo.ca/~jkiernan/formglut.htm (29).
30
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
CAMPIONI UTILIZZATI NELLA RICERCA
Durante la ricerca, sono state create 6 differenti programmazioni aventi tempi di processazione
differenti tra loro partendo dalla programmazione originale (89 minuti). Per la programmazione test
1 il tempo di processazione è di 57 minuti, per la programmazione test 2 é di 49 minuti, per la
programmazione 3 è di 32 minuti, per la programmazione 4 è di 29 minuti, per la programmazione
5 è di 17 minuti, e per la programmazione 6 è di 9 minuti.
La tabella 1 mostra i vari casi che sono stati utilizzati durante la ricerca. Per ogni campione
utilizzato, sono state eseguite due programmazioni: La programmazione originale, che presenta un
tempo di processazione utilizzato fin’ora e una programmazione avente un tempo di processazione
ridotto rispetto al originale. Dopo aver ottenuto risultati soddisfacenti utilizzando la
programmazione Test 2, a partire dal 23.02.05, tutti gli strati sono stati processati utilizzando la
nuova programmazione. Per evitare situazioni “effetto placebo”, si è cercato di mantenere una certa
riservatezza nel divulgare la novità all’istituto.
Tabella 1
Numero
caso
1455-1
del Data
01.02.’05
1455-2
01.02.’05
1457-1
01.02.’05
1459
01.02.’05
1464-4
01.02.’05
1472-5
01.02.’05
1477-2
01.02.’05
1536-1
02.02.’05
1539-1
02.02.’05
1539-2
02.02.’05
1543-4
02.02.’05
1545
02.02.’05
1547
02.02.’05
1615-2
1621-1
03.02.’05
03.02.’05
1622-1
03.02.’05
Tessuto
Patologia
duodeno
Alterazioni
istopatologiche di
scarso rilievo
Antro gastrico Gastrite
cronica,
assenza di HP
Duodeno pars Alterazioni
II-III
istopatologiche di
scarso rilievo
1.Colon
1.Pseudomelanosi
lieve
Colon destro
Alterazioni
istopatologiche di
scarso rilievo
Colon random Alterazioni
istopatologiche di
scarso rilievo
Colon
Adenoma
sigmoideo
tubulovilloso, atipie
epiteliali moderate
Duodeno pars Lieve inf. cronica
II
Ileo terminale
Alterazioni
istipatologiche di
scarso rilievo
Colon random Moderata
Pseudomelanosi
Colon random Alterazioni
istopatologiche di
scarso rilievo
Antro-corpo
Gastrite
cronica,
gastrico
HP+
Antro gastrico Infiammazione
cronica, assenza HP
Colon trasverso Lieve edema
Duodeno
II-III
Duodeno
pars Alterazioni
istopatologiche
scarso rilievo
Alterazioni
istopatologiche
scarso rilievo
di
di
Programmazione Programmazione
originale
effettuata
eseguita
Test 1
eseguita
Test 1
eseguita
Test 1
eseguita
Test 1
eseguita
Test 1
eseguita
Test 1
eseguita
Test 1
eseguita
Test 1
eseguita
Test 1
eseguita
Test 1
eseguita
Test 1
eseguita
Test 1
eseguita
Test 1
eseguita
eseguita
Test 1
Test 1
eseguita
Test 1
31
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
1623-1
03.02.’05
Ileo terminale
1623-2
03.02.’05
Colon
ascendente
1623-3
03.02.’05
Retto
1624
03.02.’05
Ileo terminale
1628-1
03.02.’05
Antro gastrico
1628-2
03.02.’05
Ileo terminale
1629-1
03.02.’05
Duodeno
1714
04.02.’05
Antro gastrico
1717-1
04.02.’05
Antro gastrico
1718
04.02.’05
Antro gastrico
1719
04.02.’05
1722-1
04.02.’05
Biopsia antro
gastrico
Duodeno pars
II-III
1724-2
04.02.’05
Antro gastrico
2548-1
04.02.’05
Antro gastrico
2550-2
04.02.’05
Antro gastrico
2558
04.02.’05
Colon destro
2559
04.02.’05
Colon
ascendente
2560-2
04.02.’05
Antro gastrico
2561-1
04.02.’05
Duodeno
II-III
2561-2
04.02.’05
Antro gastrico
2565
04.02.’05
Antro gastrico
2567
04.02.’05
Antro
corpo
gastrico
2570-1
04.02.’05
Duodeno
I-II
pars
pars
Alterazioni
istopatologiche
scarso rilievo
Alterazioni
istopatologiche
scarso rilievo
Alterazioni
istopatologiche
scarso rilievo
Alterazioni
istopatologiche
scarso rilievo
di
di
di
di
Gastrite
cronica,
HP +++
Alterazioni
istopatologiche di
scarso rilievo
Alterazioni
istopatologiche di
scarso rilievo
Lieve
infiammazione
cronica, assenza HP
Live
infiammazione
cronica, assenza HP
Live
infiammazione
cronica, assenza HP
Gastrite
cronica
HP+
Alterazioni
istopatologiche di
scarso rilievo
Lieve
infiammazione
cronica
Gastrite
cronica,
lieve iperplasia
Lieve
infiammazione
cronica, assenza HP
Alterazioni
istopatologiche di
scarso rilievo
Alterazioni
istopatologiche di
scarso rilievo
Alterazioni
istipatologiche di
scarso rilievo
Alterazioni
istopatologiche di
scarso rilievo
Gastrite
cronica
HP+++
Gastrite Metaplasia
infiammatoria
Lieve
iperplasia
cellule
parietali,
assenza HP
Alterazioni
istopatologiche di
scarso rilievo
eseguita
Test 1
eseguita
Test 1
eseguita
Test 1
eseguita
Test 1
eseguita
Test 1
eseguita
Test 1
eseguita
Test 1
eseguita
Test 2
eseguita
Test 2
eseguita
Test 2
eseguita
Test 2
eseguita
Test 2
eseguita
Test 2
eseguita
Test 2
eseguita
Test 2
eseguita
Test 2
eseguita
Test 2
eseguita
Test 2
eseguita
Test 2
eseguita
Test 2
eseguita
Test 2
eseguita
Test 2
eseguita
Test 2
32
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
2646-2
22.02.’05
Ileo terminale
2646-3
22.02.’05
Colon random
2647-2
22.02.’05
Colon random
2648
22.02.’05
Corpo gastrico
2741
23.02.’05
2840
24.02.’05
Biopsia epatica
lobo destro
Colon random
2842-1
24.02.’05
Duodeno
II-IIII
2842-2
24.02.’05
Antro-corpo
gastrico
2843-1
24.02.’05
2931-1
25.02.’05
2931-2
25.02.’05
2932-2
25.02.’05
2934
25.02.’05
2939
25.02.’05
3477
08.03.’05
3478
08.03.’05
3482
08.03.’05
3484-1
08.03.’05
3484-2
08.03.’05
3485-1
08.03.’05
3486-1
08.03.’05
3486-2
08.03.’05
3622
10.03.’05
Alterazioni
istopatologiche di
scarso rilievo
Moderata
pseudomelanosi
Lieve
infiammazione
cronica
Infiammazione
cronica, assenza HP
eseguita
Test 2
eseguita
Test 2
eseguita
Test 2
eseguita
Test2
Epatite C cronica
eseguita
Test2
eseguita
Test3
eseguita
Test3
eseguita
Test3
eseguita
Test3
eseguita
Test 3
eseguita
Test 3
eseguita
Test 3
eseguita
Test 3
eseguita
Test 3
eseguita
Test 3
eseguita
Test 3
eseguita
Test 3
eseguita
Test 3
eseguita
Test 3
eseguita
Test 3
eseguita
Test 3
eseguita
Test 3
eseguita
Test 4
Alterazioni
istipatologiche
scarso rilievo
di
pars Alterazioni
istopatologiche
scarso rilievo
di
Alterazioni
istopatologiche di
scarso rilievo
Duodeno pars Duodenite cronica,
II-III
atrofia epiteliale
Duodeno pars Alterazioni
II-III
istopatologiche di
scarso rilievo
Corpo gastrico Alterazioni
istopatologiche di
scarso rilievo
Retto
Moderata
Pseudomelanosi
Antro gastrico Gastrite
cronica
con
metaplasia
intestinale assenza
HP
Colon
Adenoma
sigmoideo
tubulovilloso
Antro-corpo
Gastrite
cronica
gastrico
HP+
Antro-corpo
Minima
gastrico
infiammazione
cronica, assenza HP
Ileo terminale
Alterazioni
istopatologiche di
scarso rilievo
Retto
Adenoma tubulare
prossimale
Ileo terminale
Alterazioni
istipatologiche di
scarso rilievo
Ileo terminale
Alterazioni
istopatologiche di
scarso rilievo
Ileo terminale
Alterazioni
istopatologiche di
scarso rilievo
Colon
Adenoma
sigmoideo
tubulovilloso
Ileo terminale
Adenocarcinoma
33
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
3623
10.03.’05
Colon
ascendentetrasversodiscendente
Infiammazione
cronica
eseguita
Test 4
3634-1
10.03.’05
Antro-corpo
gastrico
Lieve
infiammazione
cronica, assenza HP
eseguita
Test 4
3634-2
3637-3
10.03.’05
10.03.’05
Esofago
Esofagite erosiva
Colon
sigmoideo
Infiammazione
cronica, angiectasia
eseguita
eseguita
Test 4
Test 4
4234
21.03.’05
Corpo gastrico
eseguita
Test 5
4237
21.03.’05
eseguita
Test 5
4238-1
21.03.’05
eseguita
Test 5
4238-2
21.03.’05
eseguita
Test 5
4239-1
21.03.’05
eseguita
Test 5
4350-2
4351-3
22.03.’05
22.03.’05
eseguita
eseguita
Test 6
Test 6
4354-1
22.03.’05
Duodeno
II-III
eseguita
Test 6
4588-5
25.03.’05
Retto
eseguita
Test 6
4589-2
25.03.’05
Colon random
eseguita
Test 6
4592
25.03.’05
eseguita
Test 6
4593-1
25.03.’05
eseguita
Test 6
4593-2
25.03.’05
eseguita
Test 6
4594-2
4683-1
25.03.’05
29.03.’05
eseguita
eseguita
Test 6
Test 6
4683-3
29.03.’05
eseguita
Test 6
4685-2
29.03.’05
eseguita
Test 6
4695-1
29.03.’05
eseguita
Test 6
5342
12.04’05
eseguita
Test 6
5344
12.04.’05
eseguita
Test 6
Piccole cisti dei
corpi ghiandolari,
assenza HP
Antro gastrico Infiammazione
cronica, assenza HP
Duodeno pars Infiammazione
II-III
cronica aspecifica
Corpo gastrico Gastrite
cronica,
HP+++
Duodeno
Infiammazione
cronica aspecifica
Ileo terminale
Stato infettivo
Colon random
Alterazioni
istopatologiche
scarso rilievo
pars Alterazioni
istopatologiche di
scarso rilievo
Polipi iperplastici
Alterazioni
istopatologiche
scarso rilievo
.Ileo
1.Alterazioni
istopatologiche
scarso rilievo,
Duodeno pars Alterazioni
II-III
istopatologiche
scarso rilievo
Corpo gastrico Alterazioni
istopatologiche
scarso rilievo
Antro gastrico Gastrite cronica
Duodeno
II-III
di
pars Alterazioni
istopatologiche
scarso rilievo
Ileo terminale
Alterazioni
istopatologiche
scarso rilievo
Colon random Alterazioni
istopatologiche
scarso rilievo
Ileo terminale
Alterazioni
istopatologiche
scarso rilievo
Esofago
Infiammazione
cronica
Esofago
Infiammazione
cronica
di
di
di
di
di
di
di
di
34
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
5367-2
12.04.’05
Antro gastrico
Alterazioni
istopatologiche di
scarso rilievo
Gastrite
cronica
HP+++
eseguita
Test 6
5375
12.04.’05
Antro gastrico
eseguita
Test 6
5378
12.04.’05
Esofago distale
Minima
infiammazione
cronica
eseguita
Test 6
5382-2
12.04’05
Corpo gastrico
Piccole cisti dei
copri ghiandolari
eseguita
Test 6
(Nota: HP è l’abbreviazione di Helicobacter pylori, e viene quantificato in lieve presenza +, alcuni ++, e
abbondanti +++).
Per comparare le varie colorazioni e i differenti anticorpi usati, si è cercato di avere tre differenti
programmazioni, eseguite su tre campioni diversi, ma aventi in comune le stesse patologie.
Sono stati presi in considerazione i casi più interessanti, e documentati con delle foto.
PROCESSAZIONE
Dopo la fissazione, segue la processazione del tessuto che consiste nella disidratazione graduale
attraverso una serie di alcool a concentrazioni crescenti; partendo dal alcool 70%, 80%, 95%, 100%.
Segue il trattamento schiarificante indotto dallo xilolo, che essendo uno schiarificatore rende il
pezzo di un colore biancastro. Lo xilene è affine alla paraffina alla quale successivamente lascerà il
posto. Fungendo da ponte tra l’alcool e la paraffina, lo cilene permette l’indurimento del pezzo ed
eleva l’indice di rifrazione, favorendo la visione al microscopio. Oltre allo xilene possono essere
usati il toluolo, il benzolo, il cloroformio. Gli ultimi stadi sono l’immersione in paraffina disciolta a
50°-60° gradi. Essa penetra nel tessuto sostituendo lo schiarificante solubile nella paraffina. Il
tempo di processazione del tessuto varia soprattutto dalla sua struttura cellulare e dalle sue
dimensioni. Tessuti di dimensioni ridotte verranno processati in tempi brevi; rispetto a tessuti di
dimensioni più grandi. La processazione dei tessuti è influenzata da alcuni fattori che favoriscono la
disidratazione, lo schiarimento e l’impregnazione. I principali fattori sono il tempo, la temperatura,
il vacum, il movimento circolare della soluzione presente nei bagni, e la presenza di ultrasuoni; che
non sono presenti nel nostro apparecchi Processing TPC15.
Fig. 6) Immagine tratta dal libro TECHNIQUES D’HISTOPATHOLOGIE ET CYTOLOGIE,.(4). L’immagine mostra gli effetti a lungo termine di
una pessima disidratazione.
35
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Il tessuto esposto all’aria, o all’eccesso di acqua si ritrae e non permette una corretta visione
topografica del tessuto dopo averlo tagliato e colorato. Dopo la processazione, il blocchetto viene
incluso in paraffina e tagliato al microtomo.
Una pessima processazione potrebbe interferire con la diagnosi, il blocchetto si mostrerebbe in
questo modo:
Fig. 7) Foto tratta dal libro HISTOTECHNOLOGY A SELF-INSTRUCTIONAL TEXT, (2).
Non essendo sufficientemente disidratato, la paraffina non ha potuto penetrare nel tessuto
completamente, come mostra la macchia biancastra al centro del tessuto. E questo comporta dei
problemi al taglio. Al contrario, una permanenza in xilolo per tempi troppo lunghi, può portare ad
un indurimento del tessuto, difficile da tagliare in seguito al microtomo. Anche il punto di fusione
della paraffina è molto importante. Con un punto di fusione molto alto, la paraffina può provocare
un’eccessiva basofilia delle matrici extracellulari.
(Citazione tratta dal libro HISTOTECHNOLOGY A SELF-INSTRUCTIONAL TEXT, (2) e tratto dal libro TECNIQUES
D’HISTOPATHOLOGIE ET DE CYTOPATOLOGIE (4).
COLORAZIONI
In questo capitolo vengono i procedimenti che devono essere eseguiti prima di una colorazione, i
vari metodi di colorazione presenti in laboratorio, e le principali colorazioni che sono state scelte in
base al tipo di tessuto e alle possibili patologie che potrebbero colpirlo. Verranno descritti i principi
della metodica, lo scopo, cosa viene messo in evidenza, e la procedura della colorazione.
Dopo aver incluso il tessuto processato nella capsula ed aver versato della paraffina liquida; la
capsula di paraffina viene tagliata al microtomo. I tagli vengono poi immersi in un bagno d'acqua ad
una temperatura di 45°C per distendere il taglio e facilitare l'applicazione del taglio sul vetrino.
Dopo aver fatto scivolare il taglio sul vetrino ed averlo contrassegnato con il numero del caso, viene
posto nella stufa a 60°C per 30'. Questa operazione permette far evaporare l'acqua presente sul
vetrini e di sciogliere la paraffina sul vetrino e sul tessuto. Questa operazione mi garantisce una
buona adesione del taglio sul vetrino, evitando che durante i passaggio della colorazione, il taglio
non venga perso.
Ogni colorazione segue un processo di idratazione, che permette al tessuto di favorire il legame dei
vari cromogeni. Come prima fase, al vetrino viene tolto il resto della paraffina immergendo il taglio
posto sul vetrini nello Xilolo. Lo Xilolo viene poi successivamente tolto con l'alcool 100%, seguono
poi altre concentrazioni di alcool decrescente e come ultimo passaggio viene immerso nell'acqua.
L'ultima fase può subire delle modifiche, in base al tipo di colorazione che si è scelto. Alcune
terminano il passaggio nell'acqua proveniente del rubinetto, altre nell'acqua demineralizzata, altri
ancora nell'alcool 70%, ecc.
(Citazioni tratte secondo le direttive di laboratorio)
36
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Fig. 8) Il disegno qui sopra è tratto dal libro TECHNIQUES D’HISTOPATHOLOGIE ET CYTOLOGIE, (4). Il disegno mostra le varie tappe della
colorazione eseguita manualmente.
Lo schema che segue mostra in generale, i vari passaggi della idratazione, dove l'ultima fase
termina nell'acqua prelevata dal rubinetto. Il termine idratazione viene comunemente chiamato
sparafinamento ed indica l’eliminazione della paraffina sul vetrino.
IDRATAZIONE
1. stufa 63°C
2. xilolo
3. xilolo
4. alcool 100%
5. alcool 100%
6. alcool 95%
7. alcool 70%
8. acqua corrente
30'
5'
5'
sciacquare
10'
sciacquare
5'
5'
Dopo aver immerso il vetrino nelle differenti soluzioni, in base al tipo di colorazione che si è scelto;
si procede con la deidratazione nel vetrino che segue la procedura dell’idratazione ma
all’incontrario.
DEIDRATAZONE
sciacquare in acqua corrente
Alcool 70%
Alcool 95%
Alcool 100%
Alcool 100%
Xilolo
Xilolo
montare con la macchina
sciacquare
differenziare
sciacquare
5’
sciacquare
5’
Qualsiasi tessuto, dopo essere stato disidratato viene colorato con la colorazione all’EmatossilinaEritrosina comunemente chiamata “HE”. Questo tipo di colorazione crea un aspetto tipografico del
37
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
tessuto e mi evidenzia le strutture cellulari. Dev’essere sempre eseguita una colorazione HE, in
seguito verranno scelte le colorazioni speciale ed eventualmente l’utilizzo di anticorpi. Le
colorazioni speciali che ho a disposizione possono evidenziare batteri, funghi, ferro, amiliode,
strutture cellulari mutate, ecc. Alcune colorazioni vengono eseguite automaticamente
dell’apparechio Tissue Steiner TST 44 che presenta nella sua memoria le seguenti colorazioni:
He, Elastica Van Giesan, Pas, Alcian Blue. Queste colorazioni non necessitano un controllo
positivo, perché sono tutte delle colorazioni che evidenziano una determinata caratteristica del
tessuto già presente in un paziente sano, magari in minor quantità ma comunque presente.
(Citazioni tratte secondo le direttive di laboratorio)
DIFFERENTI TIPI DI COLORAZIONI
Le cellule e i vari componenti possono assorbire in modo differente i vari coloranti, e quest'azione
dipende da tre fattori principali:
- l'affinità chimica fra i diversi costituenti del tessuto
- la concentrazione dei costituenti
- la permeabilità del tessuto.
Nel campo dell'istologia, le colorazioni sono molteplici e possono essere suddivise così:
Colorazioni semplici: presentano un solo tipo di colorante nella metodica, (es. determinazione del
Helicobacter con metodo CAB, Giemsa).
Colorazioni complesse: presentano più coloranti e possono essere successive, ( è il susseguirsi di
una o più colorazioni) oppure simultanee (l'azione si manifesta dopo aver mescolato più coloranti).
(es. Warthin starry modificato 4 pH, Grocott, Gömöri, Elastica Van Gisan, Argento Metenamina).
Metacromasia: sono colorazioni di differenti intensità e di differenti parti del tessuto, dove viene
usata la stessa sostanza che colora, (es. CAB, Giemsa).
Colorazioni progressive: questo metodo lo si ottiene colorando fino ad ottenere l'intensità che si
desidera, (es. Ematossilina-Eritrosina).
Colorazioni regressive: Viene colorato in eccesso, lentamente e con soluzioni molto diluenti, si
asporta in seguito, l'eccesso di colorante con un differenziatore (es. Orceina, Ziehl-Neelsen, Congo
rosso).
Colorazioni dirette: Viene utilizzato un solo colorante senza aggiungere ulteriori sostanze, (es.
CBG, Giemsa).
Colorazioni accentuate: L'aggiunta di sostanze accentua la colorazione che fa aumentare la
selettività o il potere del colorante di colorare, modificando per esempio, il pH, (es. Alcian-blue,
CAB).
Differenziare: Questo avviene nelle colorazioni regressive dove c'è un sovraccarico di colore, e
l'eccesso viene tolto con una soluzione differenziatrice. È molto importante sciacquare dopo la
differenziazione, per bloccare l'azione della soluzione scolora, (es. Orceina, Congo rosso, ZiehlNeelsen, Giemsa).
Mordente: Questo composto costituisce legame tra il tessuto ed il colorante. La maggior parte di
essi sono degli ossidanti. Per la colorazione Masson Tricormo viene impiegato l'acido picrico, (es.
Masson Tricromo).
Lacche: Sono gli allumi (es. di ferro, di potassio) che agiscono formando dei coloranti, dei
complessi molto colorati dette lacche; le quali sono molto resistenti e sopportano delle
controcolorazioni con dei coloranti acidi, (es. ematossiline nella colorazione ematossilinaeritrosina).
Nota: Alle metodiche delle colorazioni, che seguiranno, non sono state indicate le dosi dei
differenti componenti volutamente. Il dosaggio è stato indicato con una “X”, questo per
mantenere una certa riservatezza delle informazioni presenti nel laboratorio.
(Citazioni tratte dal corso d’istologia pratica, (18) e tratto secondo le direttive di laboratorio)
38
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
ALCIAN-BLUE pH 2.5
Fig. 9) Immagine mostra la colorazione Alcia-blue a pH 2.5 su un intestino
tratta dal CD-Rom BIO-OPTICA, (30).
Principio:
Questa colorazione mette in evidenza i mucopolisaccardi presenti nel tessuto. Si basa sull'affinità
dei gruppi acidi presenti nelle mucosostanze di tipo acido. L'Alcian-Blue é una sostanza
idrosolubile, che viene trasformata quando viene trattata con alcalini in un colorante insolubile. Si
presta per formare dei gruppi tra acidi e acidi mucopolisaccaridi. Il colorante basico é a base di
rame, viene diluito in una soluzione di acido acetico, che abbassando il pH permette di fissarsi sui
polimeri glucidici a carica negativa. Varia da pH 2.4-2.6 perché l'Alcian-Blue ha maggior affinità
visto il gran numero di mucopolisaccaridi e mucine. Malgrado il suo pH sia acido, l'Alcian-Blue
mantiene la sua alcalinità colorando i substrati acidi. A pH 2.5 vengono ionizzate la maggior parte
delle mucine acide.
Scopo: Viene richiesto per mettere in evidenza tumori mucosecernenti, un esempio possono essere
tumori del tratto gastro-intestinale come tumori gastrici o enterici.
Procedura:
1. Sparafinare fino all'acqua
2. alcian blue pH 2.5
3. lavare abbastanza in acqua demineralizzata
4. rosso per nuclei
5. sciacquare in acqua
6. deidratare e montare
Risultati:
muco, polisaccaridi acidi
nuclei
fondo
Soluzioni:
Soluzione di alcian blu
Alcian blu
Acido acetico 3%
Rosso per nuclei
5'
3'
blu turchese
rosa forte
rosa pallido
(X) g
(X) ml
Vedi colorazioni del ferro
(Citazioni tratte dal corso d’istologia pratica, (18))
39
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
BLU PRUSSIA
MESSA IN EVIDENZA DEL FERRO E DELL’AMIANTO
Fig. 11) L’immagine è tratta dal libro LABORATORY METHODS IN HISTOTECNOLOGY, (8).
Nel riquadro è presente una biopsia midollare colorata con blu di Prussica, per mettere
in evidenza il ferro.
Principio:
Si tratta di una reazione istochimica che evidenzia il ferro ionizzato. Questo metodo determina gli
ioni ferrici, trattando il tessuto con della soluzione acida di potassio exacianoferrato. E gli ioni di
ferro presentano una reazione insolubile acquastando una pigmentazione di colore bluastro.Quando
il ferro, assorbito nel tratto gastro-intestinale, viene combinato con una molecola proteica; viene
trasportato nel midollo. Nel midollo verrà incorporato alla molecola di emoglobina. Quest’ultima
rompendosi nei tessuti, deposita dell’emosiderina. L’emosiderina è un prodotto tardivo di
degradazione dell’emoglobina e compare quando vi è un sovraccarico di ferro. Di norma, l’eccesso
di ferro viene immagazzinato sotto forma di ferritina, ma se l’apporto supera la soglia, si accumula
nei tessuti sotto forma di emosiderina.
Gli ioni ferrici, reagendo con il ferricianuro di potassio, per mezzo di un acido danno luogo a
ferricianuro ferrino (Blu Prussica). Si tratta di una colorazione bicromica dove un colorante che
colora i nuclei (rosso per nuclei), succede alla reazione istochimica vera e propria. Si presenta un
precipitato di ferricianuro ferrino-blu.
Scopo:
Questo tipo di colorazione viene usato per individuare i depositi di ferro nel tessuto come
l’emosiderosi.
Procedura:
1. sparafinare i tagli fino all’acqua distillata
2. soluzione di lavoro
3. lavare bene in acqua
4. rosso per nuclei
5. acqua corrente
6. deidratare e montare
20’
5’
1’
Risultati:
40
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Ferro+++, amianto
Nuclei
Fondo
blu
rosso
rosa
Soluzioni:
EXACIANFERRATO DI POTASSIO 2%
Kaliumhexacyanoferrate II
(X)
Acqua distillata
(X)
ACIDO CLORIDRICO 2%
HCl concentrato al 37%
(X)
Acqua distillata
(X)
SOLUZIONE DI LAVORO
Mescolare le due soluzioni 1:2
ROSSO PER NUCLEI
Solfato di alluminio (Aluminiumsulfat)
(X)
Acqua distillata
(X)
-sciogliere
Rosso per nuclei (Nuclear Fast Red)
(X)
-sciogliere a 50°C
(Citazioni tratte dal CD-ROM BIO-OPTICA, (30))
41
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
CAB
MALLORI CHROMOTROP BLU DI ANALINA TRICROM
Fig 12) Immagine tratta dal sito INTERNET http://home.primus.com.au/royellis/mallbod.html, (26 )
Le frecce mostrano i corpi di Mallory presenti in una biopsia epatica.
Principio: Il cab si basa sull’accentuazione del tessuto utilizzando una colorazione di tipo semplice
che facendo parte delle colorazioni metacroatiche, colora il tessuto con differenti intensità.
Scopo: Mettere in evidenza le strutture cellulare del tessuto, dal citoplasma al nucleo, alla
muscolatura e per quello che concerne il fegato vengono messi in evidenza i corpi do Mallory
Procedura:
1. sparafinare i tagli fino all’acqua
2. Ematossilina di Weigert
3. acqua corrente
4. Aido fosfomolibdico 1%
5. sciacquare in acqua
6. Chromotrop-Blu di anilina
7. sciacquare in acqua corrente
8. Alcool 70% finché il blu diventa celeste
9. Alcool 95%
10. deidratare e montare
Risultati:
Nuclei
Citoplasmi
Muscolatura
Collageno
Fibre reticolari
Membrane basali
Corpi di Mallory
3’
10’
3’
6’
ca. 1’
ca. 1’
rosso porpora viola
celeste-grigio
rosso
blu brillante
blu brillante
blu brillante
azzurro luminoso o colore rosso con la periferia blu
Soluzioni:
Chromotrop blu di anilina
Blu di anilina
(X) gr.
42
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Acido cloridrico 37%
Acqua distillata
-sciogliere a caldo 50°C n2
Chromotrop 2R
-sciogliere
Deve presentare un pH di 1.0
(X) ml
(X) ml
(X) gr.
(Citazioni tratte dal sito internet http://home.primus.com.au/royellis/mallbod.html, (26))
43
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
ELASTICA VAN GIESON
Fig. 11) Immagine tratta dal CD-Rom BIO-OPTICA, (30), la foto mostra una biopsia cutanea
dove vengono evidenziate le strutture connettivali ed elastiche grazie alla colorazione
Elastica Van Gieson.
Principio:
Si tratta di una delle colorazioni più antiche esistenti nella storia dell’istologia.
In questa colorazione, il tessuto viene colorato con la fucsina-resorcina e poi differenziato
nell’alcool, fino ad ottenere colorate solamente le fibre elastiche. I nuclei vengono colorati con
l’ematossilina di Weigert, mentre la picrofucsina colora le fibre collagene. Negli eritrociti, e nella
muscolatura le piccole molecole di Acido picrico penetrano rapidamente in tutti i tessuti, ma
vengono trattenute solo dagli eritrociti e dai muscoli. Mentre le molecole più grandi di fucsina acida
entrano nei pori più grandi delle fibre collagene spingendo via l’acido picrico.
Scopo:
Viene impiegata per differenziare le fibre cellulari di sostegno ed in particolare le fibre elastiche.
Procedura:
1. sparafinare i tagli fino all’Alcool 70%
2. soluzione elastica Van Gieson
3. differenziare in Alcool 70% finché le fibre
elastiche siano colorate
4. Ematossilina di Weigert
5. acqua corrente
6. Picrofucsina: soluzione di lavoro
a. soluzione satura in acqua di acido picrico
(30gr. in 2000l)
b. Fucsina acida 1%
7. sciacquare in acqua
8. sciacquare in Alcool 95%
9. sciacquare in Alcool 100%
più alcune gocce di Acido Picrico
11. Alcool 100%, Xilolo, montare
30’
10’
10’
5’
(X) ml
(X) ml
30’’
44
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Risultati:
Fibre elastiche
Nuclei
Muscolatura
Collageno
viola scuro
blu
giallo
rosso
Soluzioni:
Elastica (resorcina-fucsina)
Fucsina (Fuchsin)
(X) gr.
Resorcina (Resocinol)
(X) gr.
Sciogliere in acqua distillata
(X) ml
- portare a ebollizione e cuocere
5’ a 45°C
-aggiungere Cloruro di Ferro
(Eisen IIIChlorid)
(X) gr.
acqua distillata
(X) ml
- riportare ad ebollizione e cuocere
5’
-raffreddare e filtrare
- il filtrato viene eliminato
- il filtro e il suo contenuto vengono rimessi in un recipiente di cottura
al quale viene aggiunto:
Alcool 95%
(X) ml
- si porta ad ebollizione attenzione il procedimento è rapido
- raffreddare completamente e completare il volume
ad 2000ml con Alcool 95%
- aggiungere:
Acido Cloridrico 37%
(X) ml
Ematossilina di Weigert
Soluzione A:
Ematossilina
Alcool 100%
(X) gr.
(X) ml
Soluzione B:
Liquorfenisesquiclorature
Eisen III Chlorid
(X) gr.
Acqua distillata
(X) ml
Acido Cloridrico
(X) ml
Mescolare la soluzione A e la soluzione B 1:2 per l’uso.
(Citazioni tratte dal corso d’istologia pratica, (18) e tratto secondo le direttive di laboratorio)
45
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
GIEMSA
Fig. 13) La foto tratta dal sito INTERNET http://www.w.es/…/02-intG.piel.htm (27)
mostra una biopsia intestinale colorata con la colorazione Giemsa
Principio:
Durante la valutazione dei risultati, è importante ricordare che la cromatina delle cellule può essere
notevolmente influenzata dal pH delle acque di lavaggio, e dal tampone di diluizione. L’intensità
della colorazione può variare in funzione dei tempi di differenziazione. L’azur blu assume diverse
tonalità di blu a dipendenza del pH presente nel tessuto, l’eosina invece colora la granulazione delle
cellule assumendo una tonalità rossa.
Scopo:
Questa colorazione serve per evidenziare parassiti, su una sezione di tessuto, oppure per identificare
il tessuto reticolo endoteliale, ed in prevalenza le cellule del tessuto linfoematopoietiche.
Procedura:
sparafinare i tagli fino all’acqua
soluzione di lavoro Giemsa
Midolli
Biopsie
3. soluzione di Acido acetico
4. Alcool 95%
5. Isopropanolo
6. Xilolo, montare il vetrino
Risultati:
Tessuto ematopoietico
Nuclei:
Nucleoli:
Eritrociti:
Citoplasmi dei precursori:
Citoplasmi dei megacariociti:
Normoblasti polimorfi:
Normoblasti ortomorti:
Eosinofili:
Basofili:
Neutrofili:
10’ a 55°C al microonde
6’’
6’’
20’’
6’’
8’’
20’’
blu
porpora
arancio-rosso
porpora
porpora
porpora-rosso
arancio
rosso
porpora scuro
rosso
46
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Soluzioni:
Tampone fosfato 0.1M pH5.7
A. Sodiofosfato monobasico
Acqua distillata
B. Sodiofosfato bibasico
Acqua distillata
pH 5.7
A:
B:
(X) gr.
(X) ml
(X) gr.
(X) ml
(X) ml
(X) ml
Soluzione di lavoro
Giemsa (Stock)
Acqua distillata
Tampone fosfato pH 5.7
-mescolare e filtrare
Soluzione di Acido acetico
Acqua distillata
Acido acetico glaciale
(X) ml
(X) ml
(X) ml
(X) ml
(X)gocce
(Citazioni tratte secondo le direttive di laboratorio)
47
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
GIEMSA MODIFICATO CBG
GIEMSA PER HELICOBARTER PYLORI
Fig. 14) L’immagine è tratta dal libro HISTOTECHNOLOGY A SELF-INSTRUCTIONAL TEXT, (2).
Viene mostrata una biopsia gastrica coloniata da batteri del tipo
Helicobacter pilori, evidenziati con la colorazione CBG (Giemsa modificato).
Principio:
Il blu di metilene si lega alle strutture chimiche presenti nella parete cellulare del battere
evidenziandolo dal resto del tessuto.
Scopo:
Mette in evidenza la presenza di batteri come Campilobacter o l’Helicobacter pyloris, presente nella
mucosa gastrica in concomitanza con una gastrite generalmente cronica.
Procedura:
1. sparafinare i tagli fino all’acqua
2. soluzione Giemsa diluita
3. sciacquare in acqua corrente
4. differenziare in Alcool 70%, 95%, 100%
5. Xilolo, montare il vetrino
30’
rapidamente
Risultati:
Helicobacter pyloris:
Fondo:
blu
celeste
Soluzioni:
Giemsa diluito
Giemsa (Stock)
Acqua corrente
(X) ml
(X) ml
La soluzione deve essere fresca, ogni volta che si effettua questa colorazione
(Citazioni tratte secondo le direttive di laboratorio)
48
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
GÖMÖRI
Fig. 18) L’immagine è tratta dal libro, HISTOTECHNOLOGY A SELF-INSTRUCTIONAL TEXT (2).
L’immagine mostra una biopsia con ingrandimento 40x,
evidenziando con la colorazione Gömöri, le fibre reticolari.
Principio:
Si tratta di una colorazione ad impregnazione d’argento, essendo affini per il nitrato d’argento.
Nella metodica sono usati il Cloruro d’oro e il Nitrato d’argento. Nelle reazioni agirofile, il sale
d’argento che si presenta incolore; viene ridotto ad una sostanza, come la Formalina, in un
composto nero. La prima fase della colorazione Gömöri prevede un’ossidazione con Permanganato
di Potassio che potenzia l’agirofilia. In seguito l’argento viene depositato in modo selettivo nelle
fibre e ridotto dalla formalina. Da ultimo vengono eliminati i residui d’argento ridotto.
Scopo:
Evidenziare le fibre reticolari, (la reticolino, le fibre nervose, i sali di calcio) essendo difficili da
vedere con una colorazione HE. È utile per la diagnosi di patologie linfoidi quali i Linfomi maligni,
di patologie epatiche come la cirrosi
Procedura:
sparafinare i tagli fino all’acqua
ossidare in Permanganato di Potassio 1%
sciacquare in acqua distillata
scolorare in metabisolfito di Potassio 3%
sciacquare in acqua distillata
sensibilizzare in Alume di ferro 2%
sciacquare in acqua distillata
soluzione di Nitrato d’argento
sciacquare in acqua distillata
ridurre in Formalina 4% non tamponata
sciacquare in acqua distillata
soluzione di lavoro Cloruro d’oro
sciacquare in acqua distillata
Thisolfato di sodio 3%
sciacquare in acqua distillata
Rosso per nuclei
sciacquare in acqua distillata
deidratare e montare il vetrino
1’
1’
1’
3’
3’
10’
1’
5’
49
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Risultati:
Fibre reticolari:
Fibre collagene:
Nuclei:
nero
porpora
rosa
Soluzioni:
Alume di Ferro
Ammoniumeisen III sulfat
(X) gr.
Acqua distillata
(X) ml
Soluzione di Nitrato d’argento
Lavare la vetreria con acqua distillata
Nitrato d’argento 10%
(X) ml
Idrossido di Potassio 10%
(X) ml
-Aggiungere dell’Ammonium hydroxide 25% goccia a goccia, mescolando bene la soluzione finché
diventi leggermente opalescente.
-Raddoppiare il volume con acqua distillata
Cloruro d’oro: Soluzione di stoccaggio
Gold (III) chloride 1%
Cloruro d’oro: Soluzione di lavoro
Soluzione di stoccaggio
(X) ml
Acqua distillata
(X) ml
(Citazioni tratte dal corso d’istologia pratica, (18 ), e citazioni tratte dal CD-ROM BIO-OPTICA, (30))
50
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
HE
Ematossilina-Eritrosina
Fig. 12) L’immmagine in questione tratta dal libro HISTOTECHNOLOGY A SELF-INSTRUCTIONAL TEXT, (2)
L ‘immagine mostra una biopsia intestinale colorata con la colorazione HE.
Principio:
Si tratta di una soluzione bicromica recessiva. L’ematossilina colora in eccesso i nuclei ed i
substrati basofili ( a carica negativa). l’alcool acido toglie l’eccesso di colorante (differenziazione),
mentre l’eritrosina colora i substrati acidofili (carica positiva), e quindi i citoplasmi. L’ematossilina
è una sostanza estratta da un legno tropicale. Allo stato puro non è un colorante, viene poi ossidata
ad ematina tramite la maturazione, ciò che avviene con un processo naturale esponendola all’aria e
alla luce del sole. Il periodo di esposizione può variare da 1 a 2 mesi, oppure con l’aggiunta di
agenti ossidanti. L’ematina, o ematossilina è anionica e non presenta particolari affinità con gli acidi
nucleici e con i nuclei cellulari. Per conferire al composto la positività; è importante utilizzare un
mordente (Alluminio, Ferro, Cromo, Rame,…) che assieme all’ematossilina costituirà una lacca
insolubile (legame del mordente al colorante, e al tessuto). Per l’ematossilina di Mayer, viene
utilizzato un allume (solfato doppio di Alluminio e Potassio). Successivamente, viene utilizzato un
colorante “nucleare” basico, e un colorante “citoplasmatico” acido. L’ematossilina colora i nuclei in
differenti tonalità di blu, mentre l’eritrosina colora i citoplasmi in rosa e gli eritrociti in arancione.
Alcuni prodotti dell’ossidazione dell’ematossilina sono insolubili e devono essere eliminati
filtrando la soluzione regolarmente. Questa necessità si manifesta ogni volta che sulla superficie del
colorante è presente una pellicola lucente, metallica che il colorante esprime.
Esistono due tipi di ematossiline:
Ematossilina di Mayer o E. alluminica: viene usata per colorare i nuclei, forma delle lacche blu che
evidenziano i dettagli cromatinici.
Ematossilina di Weigert o E. ferrica: Viene utilizzata quando il tessuto subisce altri trattamenti e
soprattutto con l’utilizzo degli acidi. Ogni tipo di tessuto viene prima colorato con la colorazione
all’Ematossilina-Eritrosina ed in seguito; in base a ciò che si vuole evidenziare; vengono scelte
delle colorazioni specifiche.
Emtossilina di Gill II e III si differenziano dalla concentrazione. E. Gill III viene usata
prevalentemente per le urgenze. Tutte e due sono delle lacche.
Ematossilina di Boehmer deve maturare naturalmente, senza l’aggiunta di acceleratori presenti nelle
altre ematossiline. Si tratta di una Ematossilina di origini naturali che ha un tempo di maturazione di
3 mesi.
51
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Scopo: Questa colorazione viene eseguita su tutti i tessuti, ed essendo una colorazione topografica,
mi permette di osservare a livello generale i differenti costituenti tessutali.
Procedura:
1. Sparafinare i tagli fino all’acqua corrente
2. Ematossilina di Gill II
6’
3. acqua corrente
5’
4. acqua di Scott
1’
5. acqua corrente
2’
6. Eritrosina 0.5%
10’
7. sciacquare in acqua corrente
8. deidratare e montare
Risultati:
Nuclei:
Citoplasmi:
Muscolatura:
Tessuto di sostegno:
blu
rosa
rosso
rosa-rosso
Soluzioni:
Ematossilina di Gill II
Acqua distillata
Ethylenglycol
-mescolare
Ematossilina
Jodato di Sodio
Aluminiumsulfat
-mescolare
Acido acetico glaciale
-sciogliere 1 ora sull’agitatore
Eritrosina 0.5%
Acqua di Scott
Bicarbonato di Sodio
(Na-hydrogencarbonat)
Solfato di Magnesio
(Magnesiumsulfat)
-mescolare 1:2 per l’uso
(X) ml
(X) ml
(X) gr.
(X) gr.
(X) gr.
(X) ml
(X) %
(X) %
(Citazioni tratte dal corso d’istologia pratica, (18), e tratto secondo le direttive di laboratorio)
52
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
MASSON TRICROMICA
CON BLU DI ANILINA
Fig. 15) Immagine tratta dal libro HISTOTECHNOLOGY A SELF-INSTRUCTIONAL TEXT, (2).
L’immagine mostra una biopsia intestinale evidenziato con la colorazione Masson Tricromie con blu di Anilina.
Principio:
Questa colorazione tricromia crea un’associazione tra la colorazione nucleare ottenuta con
l’Ematossilina ferrica di Weigert, tra la colorazione degli eritrociti con l’Acido picrico, tra la
colorazione citoplasmatica ottenuta da una miscela di coloranti acidi (fucsina acida-ponceau di
xilidina), in concomitanza con una colorazione elettiva del tessuto connettivo ottenuta grazie ad un
colorante acido, il blu di Anilina. La colorazione Masson è di tipo regressivo, e necessita di una
differenziazione (Acido fosfomolibdico). I nuclei vengono colorati con l’Ematossilina di Weigert,
la Fucsina colora i citoplasmi, e dopo aver scolorato; il blu di Anilina evidenzia il tessuto
connettivo.
Scopo:
Indicata per evidenziare il tessuto connettivo, neurofibrille, nevroglia, collageno, cheratina;
differenziandoli dai muscoli. Serve per indicare diagnosi differenziali di tumori di origine fibrosa.
Procedura:
1. sparafinare i tagli fino all’acqua distillata
2. Bouin
30’ a 60°C
3. lavare in acqua finché il giallo sparisce
4. Ematossilina di Weigert
5’
5. acqua corrente
10’
6. Biebrich scarlatto fresco
2’
7. sciacquare in acqua
8. Acido fosfomolibdico +
Acido fosfotungstico fresco
10’
9. blu di Anilina fresco
5’
10. sciacquare in acqua
11. Acido acetico 1% fresco
5’
12. controllare
13. Alcool 95%, 100%, 100%, Xilolo, Xilolo, montare il vetrino
Le soluzioni indicate con il termine fresco indicano che la soluzione può essere utilizzata solo
due volte, dopo di ché va cambiata.
53
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Risultati:
Nuclei:
Muscolatura:
Collageno:
Eritrociti:
neri
rosso
blu
rosso brillante
Soluzioni:
Ematossilina di Weigert
Vedi metodica della colorazione Elastica Van Gieson
Soluzione di Biebrich scarlatto-Fucsina acida
Soluzione di stoccaggio:
-Biebrich scarlatto 1%
-Fucsina acida 1%
Soluzione di lavoro:
-Biebrich scarlatto 1%
(X) ml
-Fucsina acida 1%
(X) ml
-Acido acetico glaciale
(X) ml
Acido Fosfodomolibdico-Acido Fosfotungstico
Acido Fosfomolibdico
(X) gr.
Acido Fosfotungstico
(X) gr.
Acqua distillata
(X) ml
A. Acido acetico 1%
B. Blu di Anilina
Blu di Anilina
(X) gr.
Acqua distillata
(X) ml
Acido acetico glaciale
(X) ml
(Citazioni tratte dal CD-ROM BIO-OPTICA, (30))
54
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
ORCEINA
Fig.20) La foto è tratta da INTERNET http://216.239.39.104/translate_c? (28).
La foto mostra una biopsia epatica colorata all’Orceina.
Principio: L’Orceina è un colorante naturale estratto da alcuni licheni. È possibile farlo reagire con
nell’ammoniaca e l’aria. Il risultato è un miscuglio di principi attivi. È una colorazione regressiva,
l’eccesso di colorante viene eliminato grazie alla fase di differenziazione.
Scopo: Lo scopo è di mettere in evidenza gli epatociti che presentano l’antigene Australia, presente
in una sottopopolazione di epatiti di tipo B. Questi antigeni sono posti sopra la superficie degli
epatociti.
Procedimento:
1. sparafinare i tagli fino all’acqua distillata
2. Permanganato di Potassio acidificato
3. acqua corrente
4. Acido ossalico 5%
5. lavare bene in acqua corrente
6. sciacquare in Alcool 70%
7. Orceina a temperatura ambiente
8. sciacquare in Alcool 70%
9. controllare al microscopio
10. deidratare e montare il vetrino
Risultati:
HBA antigeni:
Fibre elastiche:
Proteine associate al Rame:
Fondo:
5’
rapidamente
10’’
30’
rosso marrone
rosso marrone
rosso marrone
rosa
Soluzioni:
Permanganato di Potassio acidificato
Permanganato di potassio 0.25%
Acido solforico 3%
Acido solforico
Acqua distillata
(X) ml
(X) ml
(X) ml
(X) ml
55
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Acido ossalico 5%
Orceina
Orceina BDH
Alcool 70%
Acido cloridrico 37%
(X) gr.
(X) ml
(X) ml
(Citazioni tratte dal CD-ROM BIO-OPTICA ,(30) e TECHINQUES D’ISTOPATHOLOGIE ET DE CYTOPATHOLOGIE, (4) )
56
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
PAS
PERIODIC ACID SCHIFF
Fig.16) Immagine tratta dal libro HISTOTECHNOLOGY A SELF-INSTRUCTIONAL TEXT, (2).
La fotografia mostra una biopsia renale colorata con il metodo PAS (Periodic Acid Schiff).
Principio:
La particolarità di questa colorazione è basata sull’ossidazione elettiva, mediata dall’Acido
periodico, dei gruppi: 1,2-glicolico; amminico primario (o 1-idrossi-2-aminico); amminico
secondario (o 1-idrossi-2-alchilaminico) e 1-idrossi-2-chetonico. Si ha inoltre ossidazione di alcuni
derivati metossilici e di α-chetoni che non vengono trasformati in aldeidi. La Fucsina solforosa del
reattivo di Schiff, trasforma successivamente i due gruppi aldeidici in un composto colorato
insolubile; simile alla Fucsina solforosa. L’acido periodico come ossidante, blocca la reazione di
ossidazione allo stadio aldeidico.
Scopo:
Questa colorazione evidenzia i componenti tessutali normali o patologici indicati dai gruppi
glicolici e dai gruppi aminoidrossilici adiacenti.
Procedura:
sparafinare i tagli fino all’acqua
Acido periodico 1%
sciacquare in acqua
Schiff
acqua corrente
Ematossilina di Gill II
lavare in acqua
Acqua di Scott
lavare in acqua
deidratare e montare in vetrino
Risultati:
Mucopolisaccaridi neutri:
Glicogeno:
Nuclei:
5’
15’
10’
1’
3’
1’
fucsia
fucsia
blu
Soluzioni:
57
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Acido periodico 1%
Schiff
Pararosanilina idrocloride
(X) gr.
Acqua distillata bollente
(X) gr.
-raffreddare a 50°C
-filtrare e aggiungere Acido cloridrico 1N 160ml
-raffreddare a 25°C
Metabisolfito di Sodio (Natrium Disulfit)
(X) gr.
-lasciare riposare 24 ore al buio
filtrare prima dell’uso
Tenere in frigo
(Citazioni tratte dal CD-ROM BIO-OPTICA ,(30))
58
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
ROSSO CONGO-ROSSO SIRIUS
Fig. 13) Immagine tratta dal CD-Rom BIO-OPTICA, (30).
Mostra un vaso sanguigno con la presenza di amiliode evidenziata dalla colorazione Rosso Congo.
Principio:
Si tratta di una colorazione selettiva, che con l’aggiunta di una contro-colorazione mette in evidenza
la sostanza amiloide presente nel tessuto da colorare. La colorazione Rosso Congo, a dipendenza
del tipo di metodica che si utilizza, può essere vista con un semplice microscopio, o cambiando
metodica e quindi soluzioni, con un microscopio a fluorescenza. Il Congo Rosso è altamente affine
e selettivo per l’amiloide. Questo colorante è in grado di formare con la sostanza, dei ponti idrogeno
non polari. È un fluorocromo, e quindi presenta una fluorescenza rossa dov’è presente
dell’amiloide. Il primo passaggio prevede un’accentuatore (Bromuro d’Ammonio) che prepara il
substrato, in seguito vi è la messa in evidenza dell’amiliode con il Rosso-Congo o Rosso-Sirius
tramite una sovra-colorazione differenziata con alcool 70%. Da ultimo viene fatta una controcolorazione con Ematossilina per migliorar posizionamento geografico dei depositi di amiloide.
Scopo: Mette in evidenza l’amiloide sul tessuto sezionato, per esempio in un amiloidosi.
Procedura:
Questa procedura è indicata per la visione ad un normale microscopio, non a fluorescenza.
1. sparafinare i tagli fino all’acqua
2. Bromuro di Ammonio 5%
(Ammoniumbromid)
3. sciacquare in acqua
4. Rosso Congo - Rosso Sirius
5. sciacquare in acqua
6. differenziare in alcool 100%
solo l’amiloide dev’essere rosso
7. sciacquare in acqua
8. Ematossilina di Gill II
9. acqua corrente
10. Scott
11. acqua corrente
12. deidratare e montare
10’
15’
5’
5’
3’
1’
2’
59
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Risultati:
Amiloide
Tessuto elastico
Nuclei
rosso
arancio
blu
Soluzioni:
A. Bromuro di Ammonio 0.5% (Ammoniumbromid)
B. Cloruro di Sodio 3% (Natriumchlorid)
C. Alcool 100%
Rosso Congo – Rosso Sirius
Soluzione A
(X) ml
Soluzione B
(X) ml
Soluzione C
(X) ml
Acqua distillata
(X) ml
Aggiungere: -Rosso Congo (Kongorot)
(X) gr.
-Rosso Sirius (Directrot)
(X) gr.
Mescolare bene, lasciare riposare una notte a temperatura ambiente.
Decantare il sovranatante che si usa per colorare dopo averlo filtrato.
Un’eccesso di alcool 100% e di cloruro di sodio provoca un aumento di precipitati e rende la
colorazione inefficace.
(Citazioni tratte dal corso d’istologia pratica, (18 )
60
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
IMMUNOISTOCHIMICA
L’immunoistochimica è la combinazione di più scienze; e comprende l’immunologia che descrive
la reazione antigene-anticorpo, l’istologia che studia l’anatomia dei tessuti e la chimica che
interviene nella visualizzazione di una reazione chimica avvenuta. All’occorrenza si possono usare
degli enzimi. Lo scopo è la messa in evidenza di sostanze presente nel tessuto. Vengono sfruttate le
proprietà antigeniche della sostanza sconosciuta, presente nel tessuto all’interno delle cellule o tra
gli organi intracellulari. Di norma l’antigene può essere una proteina, dei polisaccaridi, delle
nucleoproteine o delle lipoproteine. Per ottenere una migliore identificazione è importante che la
sostanza sconosciuta abbiano delle caratteristiche antigeniche, che l’antigene si presenti in forma
pura. In presenza di una sostanza con una piccola massa molecolare; è possibile renderlo antigenico
legandolo ad una proteina di trasporto a massa molecolare elevata. Questi esami vengono effettuati
su tessuti dove si ricercano dei batteri o si sospetta un tumore.
ANTIGENI
Gli antigeni che si determinano, possono anche essere di natura batterica, virale, ormonale, o
qualunque sostanza che presente nel tessuto possa essere evidenziata con un anticorpo. Essi hanno
la capacità di indurre la produzione di anticorpi. Sono generalmente di peso molecolare elevato
(6'000 Dalton), e la reazione che avviene tra antigene e anticorpo è specifica. L’anticorpo si lega
alla superficie dell’antigene chiamato epitopo.
Sono sensibili a diversi fattori come il calore, gli acidi, le basi, dei solventi organici, dei detergenti,
e a cambiamenti di pH. È importante tenere conto che una fissazione ed inclusione del tessuto
possono preservare le strutture morfologiche. La preservazione della struttura dell’antigene, risulta
in seguito critica per le tecniche d’immunoistochimica, perché i fissativi possono bloccare,
modificare mascherare o distruggere l’epitopo. Questo comporta una certa difficoltà nella
formazione del legame antigene-anticorpo. La Formalina ha una buona penetra bene nel tessuto, il
tempo di fissazione è relativamente lungo (3-6 ore) e tende a mascherare gli epitopi. Per “salvare”
gli epitopi esistono differenti trattamenti di smascheramento dell’antigene sul taglio deparafinato
prima del trattamento immunoistochimico che in un certo modo corregge le alterazioni degli epitopi
causate dalla fissazione.
(Citazioni tratte dal modulo COURS D’INTRODUCTION TECNIQHE IMMUNOHISTOCHIMIE, (12), e da
TECNIQUES D’HISTOPATHOLOGIE ET DE CYTOPATOLOGIE, (4) )
SMASCHERAMENTO DELL’ANTIGENE
Gli antigeni posti sulla superficie del tessuto da analizzare, possono essere smascherati con due
modalità : a calore ed enzimatica. Gli enzimi possibili sono i seguenti: (Tripsina, Pepsina, Pronase,
Proteasi VII o Proteinasi K.
Uno smascheramento troppo forte utilizzato con la metodica del calore (temperature elevate), o
utilizzando la Proteasi (concentrazione dell’enzima in eccesso); Può distruggere gli antigeni
presenti sulla superficie della cellula e addirittura distruggere la membrana della cellula facendo
fuori uscire degli enzimi cellulari. Quest’ultimi potrebbero interferire con il risultato.
Al contrario, uno smascheramento debole (temperature troppo basse, o per il metodo enzimatico,
concentrazioni dell’enzima troppo basse); può darmi dei risultati falsamente negativi, essendo una
reazione debole.
61
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Fig.17) Immagine tratta dal manuale DAKO CYTOMATION, (12). Il disegno mostra il metodo Biotina-Avidina. Nella fase 1 l’applicazione
dell’anticorpi primario all’antigene. Segue l’applicazione di un secondo anticorpo, e da ultimo la messa in evidenza del complesso tramite degli
enzimi, la Streptavidina e la Biotina.
ARTEFATTI E RISCHI D’ERRORE NELLE TECNICHE
IMMUNOISTOCHIMICHE
STRUTTURA DEL TESSUTO
Il campione da analizzare deve avere delle dimensioni e dello spessore adeguato, inoltre la scelta
del tessuto non dovrebbe presentare una zona di necrosi dove potrebbero legarsi non
specificatamente degli anticorpi.
FISSATIVI
Gli anticorpi dovrebbero essere adeguatamente fissati per permettere la degradazione proteolitica
e/o la sublimazione degli antigeni tessutali negli interstizi che potrebbero creare dei risultati
falsamente negativi e positivi. Se il materiale non dovesse essere sufficientemente fissato; il tessuto
mostrerebbe una colorazione disomogenea più intensa al centro o ai margini. Tutto questo a
seconda dei reagenti, dell’anticorpo primario e del conseguente smascheramento antigenico usato.
Alcuni anticorpi sono sensibili ai danni causati da un insufficiente fissazione (es. anticorpi
monoclonali per il riconoscimento dei recettori degli estrogeni, e progesterone). Il campione
andrebbe fissato entro 30’ dalla rimozione del pezzo chirurgico. Per le biopsie di dimensioni ridotte,
la fissazione avviene molto più rapidamente e bastano poche ore per rendere al tessuto una buona
fissazione. Un’eccessiva fissazione dei tessuti potrebbe determinare un mascheramento antigenico,
irreversibile, dando una falso negativo nelle reazioni immunoistochimiche. In questo caso si
consiglia di prelevare più biopsie dal caso; e di aumentare progressivamente il tempo di
smascheramento scegliendo poi il miglior vetrino.
METODI DI AMPLIFICAZIONE DEL SEGNALE
È possibile inoltre, aumentare la concentrazione degli anticorpi primari, allungare il tempo
d’incubazione e scegliere sistemi di rivelazione che amplifichino il segnale. Tutte queste indicazioni
potrebbero in un qualche modo, aumentare la colorazione aspecifica del fondo.
Nella scelta delle sezioni da colorare; si consiglia di evitare, quando è possibile, dei campioni
sottoposti a decalcificazione. Questo processo potrebbe alterare la morfologia e ridurre
62
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
l’immunoreattività tessutale, grazie alla presenza di soluzioni decalcificanti, di acidi forti, o Sali
chelanti gli ioni Calcio.
TEMPERATURA
La temperatura troppo elevata della paraffina nella fase di processazione, o dell’acqua del bagno del
termostato, possono indurre una denaturazione del tessuto e quindi degli antigeni. La presenza di
tagli troppo spessi, o di spessore non uniforme possono causare delle colorazioni disomogenee.
Artefatti ed errore possono inoltre verificarsi durante i passaggi fondamentali. Per esempio nella
fase dello smascheramento, che riscaldando la soluzione, permette di rompere legami crociati
formati fra gli amminoacidi delle proteine antigeniche causati nel processo di fissazione. Lo
smascheramento se dovesse essere insufficiente; produrrebbe dei falsi negativi. Contrariamente, un
trattamento eccessivo, o non necessario, indurrebbe tramite l’esposizione dei siti degli amminoacidi
cross-reagenti dei falsi positivi.
ATTIVITÀ ENZIMATICA ENDOGENA
Il blocco dell’attività enzimatica endogena, risulta molto importante in presenza di granulociti,
macrofagi (ricchi di per ossidasi) o di cellule contenenti fosfatasi alcalina (cellule epiteliali
intestinali). Per ridurre la possibilità di ottenere una colorazione non specifica di fondo, oppure dei
risultati falsamente positivi; è importante fare eseguire un’incubazione al blocco contenente un
inibitore dell’attività enzimatica endogena. Le sostanze presenti durante l’incubazione, impediscono
la formazione di legami aspecifici, di natura idrofobia e/o elettrostatica tra anticorpi utilizzati e
antigeni tessutali. Inoltre va tenuto conto dell’importanza di una buona asciugatura della sezione, o
dalla distribuzione non omogenea degli anticorpi. La mal distribuzione può essere dovuta alla
tensione superficiale del tessuto, alla posizione non orizzontale del vetrino, o semplicemente alla
formazione di bolle d’aria tra il tessuto e il vetrino.
ANTICORPI MONOCLONALI/POLICLONALI
Andrà tenuto conto la scelta dell’anticorpo primario, l’utilizzo di anticorpi policlonali o
monoclinali, la scelta di concentrazioni ottimali per gli anticorpi primari. È importante sottolineare
che concentrazioni troppo diluite possono dare dei risultati falsamente negativi e che concentrazioni
troppo elevate, possono indurre risultati falsamente positivi e/o negativi.
CONSERVAZIONE DEGLI ANTICORPI
È importante conservare i vari anticorpi in congelatore, eventualmente in frigorifero con l’aggiunta
di conservanti. Nel nostro laboratorio gli anticorpi vengono conservati a 4°C e con l’aggiunta di
conservanti.
AFFINITÀ NATURALI TRA BIOTINA/AVIDINA E STRUTTURE CELLULARI
Anche il sistema di rivelazione può essere oggetto di artefatti. Alcuni elementi cellulari e tessutali
possono avere una certa affinità naturale per degli enzimi come l’Avidina o la Biotina. Un esempio
lo possono dare i Mastociti che legano naturalmente l’Avidina o le cellule dell’encefalo che
contengono delle sostanze simili alla Biotina.
CROMOGENI
Per l’esecuzione della reazione immunoistochimica, si deve tener conto che alcuni componenti
cellulari che possono interferire con la lettura dei preparati. Sono in commercio diversi preparati
cromogeni che non interferiscono con il tessuto.
CONTROLLI DI QUALITÀ
Il controllo positivo, permette di evidenziare i falsi negativi, ottenendo un controllo della sensibilità.
Va utilizzato per ogni antigene da ricercare, usando una sezione diversa dal caso da testare. Tutti e
due i tagli vengono fissati, processati nello stesso modo e fissati sullo stesso vetrino. Il controllo
deve risultare positivi per quel determinato antigene. Non va comunque dimenticato che un’idonea
fissazione e processazione, ed un corretto allestimento dei vari reagenti; diminuisce notevolmente i
rischi d’errore. Se il controllo positivo non dovesse presentare nessun marcaggio positivo e quindi
specifico per quella determinata colorazione; è opportuno rifare la colorazione, ritagliando il
campione da analizzare e il rispettivo controllo.
(Citazioni tratte dall’articolo, GLI ARTEFATTI E I RISCHI D’ERRORE NELLE TECNICHE ISTOCHIMICHE ED
IMMUNOISTOCHIMICHE, (24) e tratto dal modulo COURS D’INTRODUCTION TECNIQHE IMMUNOHISTOCHIMIE (12))
63
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
DIFFERENTI METODI IMMUNIISTOCHIMICI
Esistono principalmente quattro metodi di reazione Antigene-Anticorpo che possono essere elencate
brevemente:
Diretto
Indiretto
Non marcato, oppure complesso immunoenzimatico solubile
Biotina-Avidina.
METODO DIRETTO
Fig.18) Schema tratto dall’opuscolo DakoCytomastion, COURS D’INTRODUCTION TECNIQHE IMMUNOHISTOCHIMIE (12)
Il metodo diretto prevede l’utilizzo di un anticorpi specifico primario che viene marcato con un
cromoforo fluorescente. In questa metodica, l’anticorpo marcato viene successivamente visto al
microscopio. Possono anche essere usati come marcatori, degli enzimi come la Perossidasi del
rafano, la Fosfatasi alcalina o l’ossidasi di glucosio per una seguente reazione al cromogeno.
(Citazioni tratte dal modulo COURS D’INTRODUCTION TECNIQHE IMMUNOHISTOCHIMIE, vedi bibliografia (12))
METODO INDIRETTO
Fig.19) Schema tratto dall’opuscolo DakoCytomastion COURS D’INTRODUCTION TECNIQHE IMMUNOHISTOCHIMIE , (12 ).
Il metodo indiretto, oltre all’utilizzo di un anticorpo specifico primario, vi è un secondo anticorpo
che coniugato ad un cromofobo fluorescente o ad una molecola di perossidasi; crea un complesso
Antigene-Anticorpo-Anticorpo. In questo caso il primo anticorpo fungerebbe da antigene per il
secondo anticorpo.
(Citazioni tratte dal modulo COURS D’INTRODUCTION TECNIQHE IMMUNOHISTOCHIMIE, (12 ))
64
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
METODO PAP
Fig.20) Schema tratto dall’opuscolo DakoCytomastion COURS D’INTRODUCTION TECNIQHE IMMUNOHISTOCHIMIE, (12).
Il metodo perossidasi anti-perossidasi (complesso immunoenzimatico solubile) utilizza un numero
maggiore di anticorpi. Ed è composto da tre molecole di perossidasi e da due anticorpi antiperossidasi.
(Citazioni tratte dal modulo COURS D’INTRODUCTION TECNIQHE IMMUNOHISTOCHIMIE (12 ))
METODO LSAB
Fig.21) Schema tratto dall’opuscolo DakoCytomastion , COURS D’INTRODUCTION TECNIQHE IMMUNOHISTOCHIMIE (12 ).
L’ultimo metodo riguarda l’utilizza di due enzimi, la Biotina e l’Avidina, un anticorpo specifico
primario che si lega all’antigene, ed un anticorpo secondario marcato con la Biotina, e l’altro si
trova sul kit di detezione (Avidina).
Nel nostro caso viene usato il metodo LSAB.
Come nelle colorazioni, anche nell’immunoistochimica esistono delle metodiche che permettono
all’operatore di eseguire la messa in evidenza dell’antigene.
(Citazioni tratte dal modulo COURS D’INTRODUCTION TECNIQHE IMMUNOHISTOCHIMIE, (12 ))
Come per le colorazioni, anche nell’immunoistochimica esistono alcune procedure che devono
essere rispettate. Anche in questo caso il tessuto dev’essere in precedenza fissato in formalina.
Dopo la fissazione viene processato, i tempo di processazione cambiano a dipendenza delle
dimensioni del tessuto. Qualsiasi tipo e dimensione di tessuto possono essere utilizzati per
l’immunoistochimica. Come per le colorazioni, anche il tessuto al quale verrà ricercato l’antigene;
verrà incluso in paraffina e tagliato al microtomo. I tagli, dopo essere stati immersi in un bagno di
acqua a 45ºC, verranno posti sopra un vetrino con a fianco un controllo positivo per quel
65
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
determinato antigene. Seguirà la fase della deidratazione e poi il vetrino verrà posto all’interno
dell’apparecchio, nel quale seguiranno differenti tape in base al tipo di metodica scelta.
Esistono innumerevoli antigeni che possono essere determinati.
(Procedure sviluppate secondo le direttive di laboratorio)
VISUALIZZAZIONE DELLA REAZIONE ANTIGENE-ANTICORPO
Per poter visualizzare il complesso antigene-anticorpo è stato opportuno sviluppare un sistema che
mi permettesse la messa in evidenza del legame. Esistono degli enzimi che sono in grado di
trasformare alcuni substrati in prodotti che assumono una colorazione insolubile e che si legano alla
reazione immunitaria, colorando i siti dove questo substrato è stato trasformato.
Esempio DAB (tetrachloridrato di 3,3-diaminobenzide, cromogeno per la per ossidasi):
L’enzima reagisce con l’H2O2 aggiunto, il cromogeno agisce come donatore di elettroni, e si forma
un prodotto finale colorato che mantiene una stabilità. Quest’ultimo deve precipitare e rimanere
stabile. I cromogeni utilizzati per la perossidasi sono:
- tetrehydrocloruro di diamino-3,3’-benzidine
- amino-3-etil-9-carbazolo
- cloro-4-naphtol-1
=DAB (marrone)
=AEC (rosso)
=(blu pallido)
(Citazioni tratte dal modulo COURS D’INTRODUCTION TECNIQHE IMMUNOHISTOCHIMIE, (12))
TECNICHE DI MARCAGGIO IMMUNOISTOCHIMICO, ASPETTI PRATICI
Fissazione dei campioni
La qualità del marcaggio dipende soprattutto dalla qualità del campione da analizzare. Ogni
campione contiene una quantità limitata di antigeni. Gli antigeni contenuti nel campione da
analizzare dovrebbero essere
fissati
disponibili
accessibili
Soluzioni possibili per la fissazione:
4% formalina tamponata (fosfato)
Alcool
Acetone
Acetone: Metanolo
Acetone: Metanolo: Formalina
Pre-trattamento degli enzimi
La pre-digestione enzimatica ha come scopo, quello di smascherare gli antigeni che sono stati
precedentemente fissati, rendendo inaccessibile o irriconoscibile l’antigene, impedendo così il
legame con l’anticorpo specifico.
Tripsina 0,1% in cloruro di calcio 0,1%, pH 7.8
Pronase 0,1% in Tampone Tris 0,5M, pH 7.8
Pepsina 0,4% in HCl 0,01N
Proteasi 0,1% in PBS 0,5M, pH 7.6
Incubare a 37°C
Pre-digerire anche i tagli del controllo
Altre tappe del processo
66
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Decalcificazione (tessuti a matrice ossea)
Materiale d’inclusione (paraffina)
Bloccaggio della perossidasi endogena
es. nell’acido nitrico 5%
In funzione del taglio del tessuto. La
decalcificazione dev’essere breve e dolce.
Deve permettere di poter tagliare facilmente
il tessuto al microtomo.
Dev’essere eliminata completamente per
evitare delle colorazioni sul retro del fondo
(background)
3% H2O2 nell’acqua distillata o nel metanolo,
per poterli tagliare in paraffina
0,6% H2O2 nel metanolo per tagliarli al
criostato
Tamponi
Per le tappe del lavaggio, tra le incubazioni in presenta di anticorpi, e quest’ultimo in presenza di
substrato, molteplici tamponi possono essere utilizzati.
Tris-0,05M, pH 7.4 (Tris-hidroximetil-aminométhane)
PBS (tampone fosfato-salino) 0,01M pH 7.3
Miscuglio Tris: soluzione salina fisiologica (1:10)=TBS
Soluzione salina fisiologica (NaCl 0,85%)
Non utilizzare sodio azide durante la reazione alla per ossidasi
Tempo d’incudazione
Soluzione d’anticorpi
Incubazione di 10-30 minuti
può essere prolungato per intensificare la colorazione
a temperatura ambiente: 1-2 ore (in camera umida)
a 37°C: 20 minuti
a 4°C durante la notte (18 ore) (in camera umida)
può essere raccorciato a 5-10 minuti all’occorrenza
Soluzioni tampone
circa 1-5 minuti, può essere prolungato, per esempio durante il mezzogiorno.
Altre soluzioni
H2O2, 5 minuti, il tempo può essere ulteriormente prolungato, ma non ridotto.
Cromogeni, 10 minuti, se la colorazione è troppo scuro può essere ridotto il tempo..
È possibile prolungare il tempo se si desidera intensificare la colorazione.
Camere umide.
Sono necessarie per il tempo d’incubazione prolungato, o di reazioni eseguite durante la notte. Una
camera umida può consistere in una cuvette piatta, munita di un coperchio e rivestita all’interno da
un filtro di carta inumidito.
Agenti adesivi, lamette porta-oggetti.
Per evitare che i tagli non si stacchino durante il pre-trattamento, o durante la colorazione, vengono
utilizzate diverse qualità di lame porta-oggetto.
lama rivestita di poly-L-lisina
lama trattati chimicamente per permettere un adesione migliore del taglio sul vetrino
indicate per il trattamento al micro-onde
lama Super frost plus: indicata per il trattamento al micro-onde
Contro-colorazione
Dopo l’AEC ( solubile nei solventi organici)
Ematossilina di Mayer
In seguito montare per mezzo di un montaggio acquoso (gelatina, glicerina…).
67
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Non impiegare soluzioni contenenti alcool, non disidratare, non immergere i taglio nello xilolo, o
nel toluene.
Per i cromogeni che come il DAB sono insolubili nei solventi organici, le precauzioni sopra citate
possono essere tralasciate.
Controlli
Controlli positivi sicuri
organo-bersaglio o tessuto-bersaglio dell’anticorpo.
Controlli negativi sicuri
tutti gli altri materiali distinti dall’organo-bersaglio e
Sprovvisto con una sicura certezza che non abbia
l’antigene da ricercare.
Porta-oggetto supplementare
al posto dell’anticorpo primario, viene applicata una
contenete un campione sconosciuto
goccia della frazione immunoglobulina di un animale
da considerarsi come un bianco
non immunizzato*. Una colorazione che apparirebbe su
questo taglio, non è specifica e può avere altre cause.
attività della perossidasi endogena
legame non specifico a proteine animali
legame non specifico ad altri reattivi
*(della stessa specie dell’anticorpo primario)
(Citazioni tratte dal modulo COURS D’INTRODUCTION TECNIQHE IMMUNOHISTOCHIMIE, (12 ))
La metodica che segue descrive il metodo con l’utilizzo della perossidasi.
Kit DAKO Universal LSAB® 2/Perossidasi
K0672/AEC oppure K0673/DAB
Utilizzazione:
Questo kit contiene un reattivo marcato con la streptavidina-biotina (LSAB) ed è destinato alla
detezione qualitativa dell’antigene su dei tagli inclusi in paraffina, tagliati al criostato. È possibile
utilizzare dei tessuti fissati con differenti fissativi: Etanolo, B-5, Bouin, o formalina tamponata con
pH neutro.
Principio:
Il metodo DAKO LSAB®/HRP è basato sulla tecnica avidina-biotina, nella quale un anticorpo
secondario; marcato con biotina, reagisce con più molecole do streptavidina coniugata alla
perossidasi. In questa metodica vengono utilizzati anticorpi primari prodotti nei topi (monoclinali) e
nei conigli (policlonali). La tecnica LSAB® da una sensibilità ancora elevata. I tempi ridotto
d’incubazione, permettono di trattare prontamente un numero elevato di tagli. Come cromogeno,
viene utilizzato l’amino-3-etil-9-carbazole (AEC), esso dona un precipitato di colore rosso. Oppure
viene utilizzato il 3,3’-diaminobenzide (DAB) che colora il precipitato in marrone.
Reattivi contenuti nel kit:
Flacone
Quantità
1
1x15 ml
2
1x15 ml
3
1x15 ml
Descrizione
Acqua ossigenata (perossido d’idrogeno)
H2O2 3% in soluzione acquosa
Link (anticorpi secondari)
immunoglobuline biotinizzate, anti-topo
anti-coniglio nel tampone PBS, contiene una
proteina carrier e del sodio azide 15mM.
Streptavidina-perossidasi
per ossidasi del rafano (HRP) coniugata alla
streptavidina nel PBS. Contiene una proteina
68
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
4
1x15 ml
Oppure
4a
1x15 ml
Accessori
carrier e del THImérosal 0.01% (agente conservante).
Substrato cromogeno AEC
Amino-3-etil-9-carbazole 3% presente nel
N,N-dimethilformalideide (DMF)
Substrato, tampone substrato
tampone imidazole-HCl contenete
perossidasi d’idrogeno
Una canula graduata
Delle pipette di plastica
Preparazione dei reattivi
Soluzione di lavaggio
È indicato utilizzare del PBS (Codice n° S3024), del tampone Tris-HCl 0.05M o TBS
(codice n° S3001) pH 7.2-7.6.
Anticorpi primari e controlli negativi
Con il kit DAKO LSAB®2/HRP, è possibile utilizzare degli anticorpi prediluiti pronti all’uso della
serie N. Sono anche presenti degli anticorpi concentrati (dopo una diluizione appropriata).
La diluizione degli anticorpi concentrati deve essere effettuata utilizzando il tampone Tris-HCl
0.05M, pH 7.2-7.6, contenente 1% BSA (siero albumino bovino) o nel tampone S30022 o S2022.
Miscuglio substrato-cromogeno
Il substrato cromogeno AEC è pronto all’uso. Il miscuglio substrato-cromogeno DAB è stabile per
2 settimane se viene conservato a 2-8°C.
Preparazione di 1ml di miscuglio substrato-cromogeno DAB:
(sufficiente per circa 3-5 tagli)
aggiungere 1ml di tampone-substrato (flacone 4a) nella canula graduata.
Aggiungere 1 goccia (20µl) di DAB (flacone 4b) e miscelare bene
Lavare con cura la canula graduata e la pipetta dopo l’utilizzo.
Contro-colorazione
Il prodotto colorato della reazione de AEC è solubile in alcool, di conseguenza possono essere
utilizzate soluzioni di contro-colorazione acquose come l’Ematossilina di Mayer. Il tempo
d’incubazione nella quale l’Ematossilina può essere adattata é funzione dell’intensità della
colorazione voluta. Risciacquare in seguito con acqua d’ammonio o acqua tiepida dal rubinetto.
Montaggio
Non utilizzare degli agenti di montaggio a base acquosa, per esempio Faramount (Codice n°
S3025). Il prodotto colorato della reazione AEC è solubile nell’alcool.
Il prodotto colorato DAB è stabile nell’alcool e può essere montato a base non acquosa
(permanente).
Conservazione
Tutti i reattivi del kit DAKO LSAB®2/HRP dev’essere conservato a 2-8°C, non congelato.
Preparazione dei tagli
A)
Tagli dei blocchi in paraffina
Il tessuto dev’essere fissato in formalina tamponata neutra, della durata non superiore le 24 ore.
Bisogna assolutamente evitare temperature superiori 60°C. Il trattamento alla formalina aziona la
formazione di nuovi legami intramolecolari. Possono risultare delle modificazioni steriche a livello
delle molecole antigeniche.
L’accessibilità o il riconoscimento degli antigeni, può essere parzialmente ristabilito, grazie ad una
digestione enzimatica o ad un pretrattamento al micro-onde. Per evitare che i tagli non si stacchino
69
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
dal vetrino durante il trattamento, ed in particolare al micro-onde, i tagli devono essere stesi su dei
vetrini porta-oggetto trattato chimicamente per evitare la perdita del tessuto,o del tipo superfrost
plus. I tagli devono essere applicati sul vetrino con una leggera essiccatura, la temperatura non deve
superare i 37°C.
Deparaffianamento e reidratazione
Residui di paraffina devono essere completamente eliminati. I residui potrebbero essere la causa di
una colorazione di fondo non specifica. Suscettibili a mascherare la colorazione specifica.
I tagli vengono deparaffinati in questo modo:
2x10 minuti nello Xilolo
2x3 minuti nell’Alcool 100%
2x3 minuti nell’Alcool 95%
1x3 minuti nell’Alcool 70%
30 secondo nel H2O distillata
B)
Tagli al criostato
I tagli al criostato devono avere uno spessore di 5-8µm. Il blocco dev’essere congelato nell’azoto
liquido e lasciato seccare all’aria aperta per 2-24 ore. I tagli possono essere immediatamente
utilizzati dopo la fissazione nell’acetone e conservato a –20°C in un imballaggio ermetico.
I tagli dovranno essere conservati a temperatura ambiente. I tagli possono essere in seguito fissati
10 minuti nell’acetone (equilibrato a 4°C, non riutilizzabile). Lasciate in seguito seccare il taglio
all’aria aperta. Immergete i tagli nel tampone per 5 minuti. In seguito si potrà procedere alla
colorazione.
Tagli con altri materiali
Glia antigeni del midollo osseo, di componenti sanguigni, e di impronte, possono ugualmente essere
rilevati utilizzando il kit presente.
Protocollo di marcaggio
A)
Osservazioni
Prima di utilizzare il kit, è importante leggere attentamente la metodica. I componenti del kit sono
stati ottimizzati per una buona utilizzazione. Devono dunque essere impiegati alla concentrazione
indicata sulle istruzioni.
Equilibrate i reattivi del kit, a temperatura ambiente secondo l’impiego ed effettuate tutte le
incubazioni a temperatura ambiente.
Avvertenze
L’AEC è un potenziale cancerogeno. La soluzione AEC e quella DAB, possono se entrano in
contatto con la pelle, provocare delle irritazioni. In caso di contatto con la pelle, risciacquare
abbondantemente. Bisogna assolutamente evitare che i tagli si secchino durante la colorazione. Se il
tempo d’incubazione dovesse prolungarsi, mettete i tagli in una camera umida. Se il procedimento
del marcaggio dovesse essere interrotto; è possibile fare una pausa dopo l’incubazione con il Link
(tappa 3), lasciando i tagli immersi nel tampone. Un interruzione massima di una durata di 1 ora
non dovrebbe influenzare negativamente sui risultati della colorazione.
La sensibilità del kit DAKO LSAB®2/HRP può ancora essere aumentata prolungando il tempo
d’incubazione fino a 30 minuti per ognuna delle fasi 2,3.
Protocollo
Fase 1 Perossido d’idrogeno (acqua ossigenata)
-sgocciolare l’acqua o il tampone in eccesso sul vetrino e tamponare
leggermente con uno straccio il perimetro del taglio
-incubare 5 minuti nel acqua ossigenata 3%
-con la soluzione di lavaggio (tampone, es. TBS) immergete il tagli nel tampone
(TBS) fresco
70
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Fase 2 Anticorpi primari/controllo negativo
-eliminate il tampone come indicato nella fase 1
-incubare 10 minuti in presenza dell’anticorpo primario o del controllo
negativo
-lavare come indicato nella fase 1
Fase 3 Link (anticorpi secondari)
-eliminare il tampone come nella fase 1
-incubare 10 minuti in presenza del Link = reattivo giallo
-lavare come indicato nella fase 1
Fase 4 Streptavidina-perossidasi
-eliminare il tampone come indicato nella fase 1
-incubare 10 minuti in presenza della Streptavidina-perossidasi= reattivo rosso
Preparare la miscela substrato-cromogeno DAB
-lavare come nella fase 1
Fase 5 Substrato-cromogeno
-eliminare il tampone come indicato nella fase 1
-incubare 10 minuti in presenza del AEC
-oppure 5-10 minuti in presenza del DAB
-lavare in acqua (o nel tampone)
Fase 6 Contro-colorazione (solo se necessario)
-incubare 2-5 minuti in presenza di Ematossilina di Mayer
-lavare nel acqua distillata
-immergerlo circa 10 minuti in un bagno di sol. Ammonio
-posizionarlo verticalmente nell’acqua distillata(oppure immergerlo 7 minuti nel acqua del rubinetto tiepida)
Fase 7 Montaggio
Come i prodotti finali della reazione AEC sono solubili nei solventi organici
I tagli colorati al AEC non devono essere ne disidratati ne montati con dei
prodotti contenenti toluene o xilolo. Di conseguenza utilizzare dei prodotti
acquosi per il montaggio quali il Faramount (Codice n°S3025).
Il prodotto colorato dal DAB è stabile nel alcool e può essere montato a base non
Acquosa (permanente).
Controlli di qualità
A)
Controllo positivo
Al fine di assicurare che tutti i reattivi funzionino correttamente, dovrà essere colorata ogni serie
con l’aggiunta di un controllo sicuramente positivo. Se il controllo non dovesse presentare una
colorazione positiva; è necessario considerare tutti i tagli impiegati in quel momento come
inutilizzabili. E ricominciare un marcaggio da capo.
B)
Controllo negativo
È opportuno utilizzare un reattivo di controllo negativo (siero non immune o immunoglobuline
normali), per identificare le colorazioni non specifiche. Nello stesso tempo, si dovrà includere in
ogni serie da colorare; un taglio negativo per l’antigene da ricercare.
C)
Interpretazione della colorazione
Se i tagli del controllo positivo presentano una colorazione rossa nelle zone dove l’antigene é
presente, il marcaggio può essere indicato corretto. I controlli negativi non dovrebbero presentare
una colorazione, che possa confermare la specificità del marcaggio con la presenza dell’anticorpo.
Le colorazioni non specifiche, quando sono visibili, sono generalmente diffuse.
È possibile mantenere una procedura di valutazione dei tagli da testare. L’intensità della colorazione
positiva deve essere giudicato in rapporto con un eventuale colorazione marrone del fondo sui
71
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
controlli negativi. La presenza del prodotto di una reazione rossa, sopra un taglio; può essere
guardato come risultato positivo, e l’assenza della colorazione, come risultato negativo.
Utilizzare cellule intatte durante l’interpretazione dei risultati. Cellule necrotizzate o degenerate si
colorano soventemente in modo non specifico. Se i tagli dovessero seccare durante il marcaggio,
può formarsi del precipitato colorato. Questo fenomeno è soprattutto visibile sui bordi del
taglio.Durante la contro-colorazione al Ematossilina, i nuclei cellulari possono prendere una
colorazione blue che può essere pallida o intensiva.
D)
Limitazioni
I risultati di marcaggio dipendono dal trattamento dei tessuti prima della colorazione. Una miniera
non corretta della fissazione, della congelazione, della congelazione, del lavaggio, dell’essicamento,
del calore o dei tagli; può produrre degli artefatti o dei risultati falsamente negativi.
Dei risultati falsamente positivi; possono nascere da un legame non specifico. Per prevenire questo
fenomeno, una fase di bloccaggio può essere introdotta prima dell’incubazione in presenza di un
anticorpo primario.
Come soluzione di bloccaggio, si può utilizzare un siero normale di maiale 20% (Codice n°X901)
diluito col tampone Tris-HCl 0.05M, pH 7.2-7.6. Un attività endogena di legame dell’avidina
(EABA= endogenous avidin-binding)è stata scoperta da un taglio di fegato o rene, al criostato
(epitelio tubulare). Invece che tagli al criostato da tessuti linfatici (istiociti paracorticali) fissati in
formalina. L’EABA può essere bloccata dall’incubazione di una durata da 20 minuti nell’avidina
0.1% e nella biotina 0.01% nel Trsi-HCl 0.05M pH 7.2-7.6 prima della fase 1 del protocollo della
colorazione.
Un attività perossidasica o pseudoperossidasica endogena, può manifestarsi per esempio nel case
delle emoglobine, della mioglobina, dei citocromi, della catalasi, e negli eosinofili. Nei tessuti
fissati alla formalina, questa attività può essere trattata con l’incubazione in acqua ossigenata 3%,
tuttavia certi antigeni possono trovarsi denaturati.
Una contro-colorazione eccessiva, o troppo debole può rendere difficile l’interpretazione corretta
dei risultati.
(Citazioni tratte dal modulo COURS D’INTRODUCTION TECNIQHE IMMUNOHISTOCHIMIE, (12 ))
DETECTION DAB PROTOCOLLO
Scopo:
Questo Kit é basato su un metodo immunologico di rilevazione indiretta. Viene sfruttata l’affinità
tra la Biotina e l’Avidina. È stato sviluppato, per individuare la presenza di anticorpi primari
monoclinali di topo di tipo IgM o IgG, o anticorpi policlonali di coniglio. Questo kit può essere
utilizzato su tessuti fissati e inclusi in paraffina, su tessuti congelati, o su preparati cellulari.
Riassunto:
La messa in evidenza degli antigeni ricercati sul tessuto viene subbivisa in due tappe: viene fissato
l’anticorpo sull’antigene. Vengono successivamente visualizzati gli anticorpi fissati con l’aiuto del
sistema Biotina-Avidina indiretto accoppiato ad un prodotto enzimatico. Il kit DAB fa capo a degli
anticorpi secondari marcati con Biotina per individuare gli anticorpi primari fissati. La Biotina
viene in seguito legata ad un coniugato Avidina-enzima, e il complesso ottenuto viene visualizzato
dopo la reazione di precipitazione enzimatica.
Principio:
Il kit permette di identificare in modo specifico, un IgG o un IgM di topo, o un IgG di coniglio
legato ad un antigene localizzato sul tessuto. L’anticorpo è specifico è localizzato grazie ad un
anticorpo secondario universale che riconosce le immunoglobuline di topo e di coniglio legato alla
Biotina. Questa tappa segue l’aggiunta di un coniugato Avidina-enzima che si fissa alla Biotina
presente sull’anticorpo secondario. Il complesso anticorpo specifico-anticorpo secondario- enzimaavidina, viene successivamente visualizzato dopo una reazione di precipitazione enzimatica. Ogni
tappa prevede un’incubazione con temperature e tempo ben determinati. Alla fine di ogni
incubazione, l’apparecchio provvede ad un lavaggio dei tagli per fermare la reazione ed eliminare i
72
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
prodotti non fissati che potrebbero interferire successivamente. Viene poi applicata del liquido
destinato a diminuire l’evaporazione dei reattivi presenti sul campione prima di ogni incubazione.
Preparazione del campione:
Fissazione
Il fissativo più consigliato è una soluzione neutra tamponata di formalina al 10% in quantità 10-20
volte superiore al volume del tessuto. La fissazione può essere eseguita a temperatura ambiente.
Sparaffinare
Immergere il vetrino con il taglio in due bagni di Xilolo per 5’ ciascuno. Continuare con due bagno
di Alcool 100% 3’ ciascuno. Segue un bagno di Alcool 95% per 3’ e un bagno di Alcool 80% per
3’. In seguito immergere il vetrino 10 volte in un bagno contenente dell’acqua Distillata. Poi
immergerli nella soluzione di lavaggio Ventana Medical System. Il vetrino può rimanere nella
soluzione a tempo indeterminato, fin tanto che l’apparecchio Ventana non sia pronto.
(Citazioni tratte dalla metodica Ventana DETECTION DAB (21))
Il protocollo del DAB e della PEROSSIDASI 1 descrivono in generale il principio di
funzionamento. Seguiranno all’interno di questo capitolo le singole metodiche inerenti i vari
anticorpi.
PROTEASE 1 PROTOCOLLO
Scopo:
La Proteasi 1 è un endopeptidasi (proteasi alcalina) della famiglia delle proteasi (sieriniche serine)
Questo enzima è destinato alla digestione enzimatica dei tagli di tessuti o cellule fissate in formalina
ed incluse in paraffina. L’espressione antigenica di un epitopo o una parte di espressione antigenica
può alcune volte essere osservata in cellule neoplastiche. Occasionalmente un’immuoreattività può
essere osservata nello stroma circondato da strutture cellulari fortemente colorate. L’interpretazione
clinica di tutte le colorazioni, o della loro assenza dev’essere completata con uno studio
morfologico e i controlli appropriati. La valutazione dei risultati dev’essere fatta da un patologo.
Riassunto:
Questo metodo presenta una sensibilizzazione accurata di un sistema di detezione utilizzando il
complesso perossidasi-avidina-biotina in rapporto agli anticorpi direttamente marcati da un enzima.
La localizzazione di un antigene nel tessuto, della procedura utilizzata dalla Ventana; implica
inizialmente una fissazione di un anticorpo primario, all’antigene studiato. In un secondo tempo, la
messa in evidenza di questo anticorpo grazi ad un sistema indiretto avidiana-biotina accoppiato ad
un prodotto enzimatico. La digestione enzimatica in aiuto alla Proteasi 1 prima dell’applicazione
degli anticorpi, permette sovente di aumentare l’immunoreattività. La digestione enzimatica segue
l’applicazione dell’anticorpo primario è associato ad un Kit della Ventana Medical Systeme.
Qust’ultimo utilizza un secondo anticorpo biotinizzato, permettendo di individuare la presenza
dell’anticorpo primario legato al suo antigene. Questa tappa è suivie della fissazione di un
coniugato streptavidina-enzima sul radicale biotina. L’insieme del complesso è visibile grazie alla
presenza di un precipitato generato dall’enzima.
Principio:
La Proteasi 1 scinde gli antigeni (proteine) nel taglio del tessuto. Al fine di permettere all’anticorpo
primario di riconoscere il suo epitopo e di legarsi. L’anticorpo primario fissato al suo antigene e
localizzato grazie ad un miscuglio di anticorpi secondari biotinizzati capaci di riconoscere delle
immunoglobuline di coniglio che delle immunoglobuline di topo. Questa tappa è seguita
deproteasi dall’aggiunta di un coniugato avidina fissandosi specificamente alla biotina presente
sull’anticorpo secondario. Il complesso anticorpo primario, anticorpo secondario avidina-enzima
viene visualizzato grazie alla formazione di un precipitato generano dall’enzima. Ogni tappa viene
incubata per una durata ed una temperatura ben precisa. Alla fine di ogni tappa, l’apparecchio
Ventana procederà ad un risciacqua dei tagli alla fine di bloccare la reazione ed eliminare i prodotti
non fissati che potrebbero interferire ulteriormente. Un olio particolare viene aggiunto ad ogni tappa
per minimizzare l’evaporazione dei reattivi sul vetrino portante il campione da analizzare.
Preparazione del campione:
73
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Il tessuto presente sul vetrino dev’essere stato fissato in formalina e processato in precedenza. Si
consiglia l’utilizzo della formalina neutra al 10%. Di regola il volume del fissativo dev’essere 1520 volte superiore al volume del tessuto da fissare. La fissazione può essere effettuata a temperatura
ambiente. Dopo essere stato tagliato il blocchetto; viene posto sopra un vetrino, come avviene nelle
colorazioni. I vetrino dell’immunoistochimica vengono identificati da un barre-code posto sopra un
etichetta che permette all’apparecchio di reperire le varie informazioni necessarie per identificare
quale anticorpo dev’essere ricercato. I tagli posti sui vetrini vengono deparaffinati passando in due
bagni di xilolo per 5 minuti ciascuno. I tagli vengono in seguito bagnati in due bagno di alcool
100%, per tre minuti ognuno. Vengono poi reidratati in un bagno di alcool 95% per tre minuti, in
alcool 80% per tre minuti e in acqua demineralizzata per altrettanti tre minuti. Dopo l’acqua
demineralizzata, i tagli vengono posti in una soluzione tampone di lavaggio della Ventana Medical
System.
(Citazioni tratte dalla metodica Ventana DETECTION PROTEASE 1 (22))
Le metodiche che seguono riguardano i vari anticorpi che sono stati utilizzati durante la ricerca.
Potranno servire al lettore per capire meglio come avviene l’identificazione dell’antigene, leggendo
le varie tappe dell’analisi. Inoltre leggendo le varie metodiche, è possibile identificare quale
anticorpo utilizza il metodo con il calore e quale utilizza il metodo enzimatico.
74
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
PROTOCOLLO#5:CD 3 (02/04/2005)
Procedure: BMK iVIEW DAB Paraffina
BenchMark IHC/ISH Staining Modulo
Istituto cantonale di patologia, Locarno
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
46
**** Selezionare EZ Prep ****
**** Inizio tempi fasi ****
**** Mixers Off ****
Riscaldare il vetrino a 75°C, ed incubare a 4 minuti
Applicare EZPPrep regolando il volume
Incubare per 4 minuti
Risciacquare vetrino
Applicare EZPrep regolando il volume al vetrino
Incubare per 4 minuti
Risciacquare vetrino
Applicare EZPrep regolando il volume al vetrino
Applicare Coverslip
Riscaldare il vetrino a 76°C ed incubare per 4 minuti
Risciacquare vetrino
Applicare Depar regolando il volume al vetrino
Applicare Coverslip
Riscaldare il vetrino a 42°C ed incubare per 2 minuti
**** Mixers On ****
Risciacquare vetrino
Applicare Medium Cell Conditioner #1
Applicare CC Long Coverslip
Riscaldare il vetrino a 95°C ed incubare per 8 minuti
Applicare Medium Cell Conditioner #1
Applicare Coverslip
Riscaldare il vetrino a 100°C ed incubare per 4 minuti
Applicare Coverslip
Applicare Cell Conditioner #1
Incubare per 4 mintuti
Applicare Coverslip
Applicare EZPrep CC regolando il volume al vetrino
Incubare per 4 minuti
Applicare Coverslip
Applicare Medium Cell Conditioner #1
Incubare per 4 minuti
Applicare Coverslip
Applicare Cell Conditioner #1
Incubare per 4 minuti
Disable Slide Heater (fase di riscaldamento)
Incubare per 8 minuti
Risciacquare vetrino
Adattare il volume al vetrino
Applicare Coverslip
**** Selezionare reazione Tampone ****
Riscaldare il vetrino a 42°C ed incubare per 2 minuti
Risciacquare vetrino
Adattare il volume al vetrino
75
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
47
48
49
Applicare una goccia di I-VIEW INHIBITOR, applicare Coverslip ed incubare per 4 minuti
Risciacquare vetrino
Adattare il volume al vetrino
50
Applicare una goccia di [PREP KIT 5] (ANTICORPO), applicare Coverslip ed
incubare per
[32 minuti]
51
Risciacquare vetrino
52
Adattare il volume al vetrino
53
Applicare una goccia di I-VIEW BIOTIN Ig, applicare Coverslip ed incubare per 8 minuti
54
Risciacquare vetrino
55
Adattare il volume al vetrino
56
Applicare una goccia di I-VIEW SA-HRP, applicare Coverslip ed incubare per 8 minuti
57
Risciacquare vetrino
58
Adattare il volume al vetrino
59
Applicare coverslip
60
Risciacquare vetrino
61
Adattare il volume al vetrino
62
Applicare una goccia di I-VIEW DAB e una goccia di I-VIEW H202, applicare Coverslip,
ed incubare per 8 minuti
63
Risciacquare vetrino
64
Adattare il volume al vetrino
65
Applicare una goccia di I-VIEW COPPER, applicare Coverslip ed incubare per 4 minuti
66
Risciacquare vetrino
67
Adattare il volume al vetrino
68
Applicare una goccia di [HEMATOXYLIN] (Counterstain), applicare Coverslip ed incubare
per [2 minuti]
69
Risciacquare vetrino
70
Adattare il volume al vetrino
71
Applicare una goccia di [BLUING REAGENT] (Post Counterstain); applicare Coverslip ed
incubare per [2 minuti]
72
Risciacquare vetrino
Principio: Metodo basato sul calore, non vengono utilizzati enzimi ma la procedura prevede un’innalzamento della
temperatura durante determinate fasi. Viene inoltre utilizzato il metodo DAB, e i reattivi bluing reagent ed hematoxilin.
Scopo: Messa in evidenza di recettori CD3 posti sulla superficie dei linfociti T.
Risultati: Azzurro morfologia del taglio, contro colorazione che serve per differenziare i vari complessi
antigene-anticorpo formati, rispetto al resto del tessuto.
Marrone Complesso antigene-anticorpo.
Note:
Coverslip: olio impiegato per evitare che il preparato durante le fasi di riscaldamento non si secchi, facendo evaporare i
vari reattivi.
Il volume di ogni soluzione che viene posto sul vetrino viene calcolato dalla ditta che fornisce i vetrino. Per ogni marca
differente di vetrino vi sono determinati microlitri da versarvi sopra, vedi citazione adattare il volume al vetrino.
* una goccia per ogni reagente somministrato
Istituto di patologia, Locarno
NexES v9.1
Protocollo
(Tratto dal protocollo PROTOCOL #5:CD 3 procedure iview dab Paraffin (14)
76
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
PROTOCOLLO#77: HELICOBACT. (03/06/2003)
Procedure: BMK iVIEW DAB Paraffina
BenchMark IHC/ISH Staining Module
Istituto cantonale di patologia
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
**** Selezionare EZ Prep ****
**** Inizio tempi fasi ****
**** Mixers Off ****
Riscaldare il vetrino a 75°C, ed incubare a 4 minuti
Applicare EZPPrep regolando il volume al vetrino
Incubare per 4 minuti
Risciacquare vetrino
Applicare EZPrep regolando il volume al vetrino
Incubare per 4 minuti
Risciacquare vetrino
Applicare EZPrep regolando il volume al vetrino
Applicare Coverslip
Riscaldare il vetrino a 76°C ed incubare per 4 minuti
Risciacquare vetrino
Applicare Depar regolando il volume al vetrino
Applicare coverslip
Riscaldare il vetrino a 42°C ed incubare per 2 minuti
**** Mixers On ****
Disable Slide Heater
Risciacquare il vetrino
Adattare il volume al vetrino
Applicare Coversli
**** Selezionare reazione Tampone ****
Riscaldare il vetrino a 42°C ed incubare per 2 minuti
Risciacquare il vetrino
Adattare il volume per il vetrino
Applicare una goccia di I_VIEW INHIBITOR, Apply Coverslip ed incubare per 4 minuti
Risciacquare il vetrino
Adattare il volume al vetrino
Applicare una goccia di [PROTEASE 1](Enzima), applicare Coverslip ed incubare per
[8 minuti]
Risciacquare il vetrino
Adattare il volume al vetrino
Applicare una goccia di [PREP KIT 77] (Anticorpo), applicare coverslip ed incubare per
[32 minuti]
Risciacquare il vetrino
Adattare il volume al vetrino
Applicare un agoccia di I-VIEW BIOTIN Ig, applicare Coverslip ed incubare per 8 minuti
Risciacquare il vetrino
Aggiungere volume al vetrino
Applicare una goccia di I-VIEW SA-HRP, applicare Coverslip ed incubare per 8 minuti
Risciacquare il vetrino
Adattare il volume al vetrino
Applicare coverslip
Risciacquare il vetrino
Adattare il volume al vetrino
77
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
45
46
47
48
49
50
51
52
53
54
55
Applicare una goccia di I-VIEW DAB e una goccia du I-VIEW H202, applicare
Coverslip, ed incubare per 8 minuti
Risciacquare il vetrino
Adattare il volume al vetrino
Applicare una goccia di I-VIEW COPPER, applicare coverslip ed incubare per 4 minuti
Risciacquare il vetrino
Adattare il volume al vetrino
Applicare una goccia di [HEMATOXYLIN] (Counterstein) applicare Coverslip ed incubare
per [2 minuti]
Risciacquare il vetrino
Adattare il volume al vetrino
Applicare una goccia di [BLUING REAGENT] (Post Counterstein), applicare coverslip ed
incubare per [2 minuti]
Risciacquare il vetrino
Principio: Utilizzo di un enzima, Proteasi 1, utilizza il complesso perossidasi-avidina-biotina in rapporto agli anticorpi
direttamente marcati da questo enzima, vedi metodica della Proteasi 1. Viene inoltre utilizzato il metodo DAB, e i
reattivi bluing reagent ed hematoxilin.
Scopo: Verificare la presenza di batteri Helicobacter pilori tramite anticorpi anti-Helicobacter pilori.
Risultati: Azzurro morfologia del taglio, contro colorazione che serve per differenziare i vari complessi
antigene-anticorpo formati, rispetto al resto del tessuto.
Marrone Complesso antigene-anticorpo.
Note:
Coverslip: olio impiegato per evitare che il preparato durante le fasi di riscaldamento non si secchi, facendo evaporare i
vari reattivi.
Il volume di ogni soluzione che viene posto sul vetrino viene calcolato dalla ditta che fornisce i vetrino. Per ogni marca
differente di vetrino vi sono determinati microlitri da versarvi sopra, vedi citazione adattare il volume al vetrino.
* una goccia per ogni reagente somministrato
Istituto di patologia, Locarno
NexES v9.10
(Tratto dal protocollo PROTOCOL #77:HELICOBACT procedure iview dab Paraffin BenchMark (15 ))
78
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
PROTOCOLLO#88: HEP (21/12/2004)
Procedura: BMK iVIEW DAB Paraffina
BenchMark IHC/ISH Staining Module
Istituto cantonale di Patologia
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
**** Selezionare EZ Prep ****
**** Inizio tempi fasi ****
**** Mixers Off ****
Riscaldare il vetrino a 75°C, ed incubare a 4 minuti
Applicare EZPPrep regolando il volume al vetrino
Incubare per 4 minuti
Risciacquare vetrino
Applicare EZPrep regolando il volume al vetrino
Incubare per 4 minuti
Risciacquare vetrino
Applicare EZPrep regolando il volume al vetrino
Applicare Coverslip
Riscaldare il vetrino a 76°C ed incubare per 4 minuti
Risciacquare vetrino
Applicare Depar regolando il volume al vetrino
Applicare coverslip
Riscaldare il vetrino a 42°C ed incubare per 2 minuti
**** Mixers On ****
Risciacquare vetrino
Applicare Medium Cell Conditioner #1
Applicare CC Long Coverslip
Riscaldare il vetrino a 95°C ed incubare per 8 minuti
Applicare Medium Cell Conditioner #1
Applicare Coverslip
Riscaldare il vetrino a 100°C ed incubare per 4 minuti
Applicare Coverslip
Applicare Cell Conditioner #1
Incubare per 4 mintuti
Applicare Coverslip
Applicare EZPrep CC regolando il volume al vetrino
Incubare per 4 minuti
Applicare Coverslip
Applicare Medium Cell Conditioner #1
Incubare per 4 minuti
Applicare Coverslip
Applicare Cell Conditioner #1
Incubare per 4 minuti
Disable Slide Heater
Incubare per 8 minuti
Risciacquare vetrino
Adattare il volume al vetrino
Applicare Coverslip
**** Selezionare reazione Tampone ****
Riscaldare il vetrino a 42°C ed incubare per 2 minuti
Risciacquare vetrino
79
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
46
47
48
49
50
51
52
53
54
55
56
57
58
59
60
61
62
63
64
65
66
67
68
69
70
71
Adattare il volume per il vetrino
Applicare una goccia di I-VIEW INHIBITOR, applicare coverslip ed incubare per 4 minuti
Risciacquare vetrino
Adattare il volume del vetrino
Applicare una goccia di [PREP KIT 88] (Anticorpi), applicare coverslip ed incubare per
[32 minuti]
Risciacquare vetrino
Adattare il volume al vetrino
Applicare una goccia di I-VIEW BIOTIN Ig, applicare coverslip ed incubare per 8 minuti
Risciacquare vetrino
Adattare il volume al vetrino
Applicare una goccia di I-VIEW SA-HRP, applicare coverslip ed incubare per 8 minuti
Risciacquare vetrino
Adattare il volume al vetrino
Applicare coverslip
Risciacquare vetrino
Adattare ilo volume al vetrino
Applicare una goccia di I-VIEW DAB e una goccia di I-VIEW H202. Applicare coverslip
ed incubare per 8 minuti
Risciacquare vetrino
Adattare il volume al vetrino
Applicare una goccia di I-VIEW COPPER, applicare coverslip ed incubare per 4 minuti
Risciacquare vetrino
Adattare il volume al vetrino
Applicare una goccia di [HEMATOXYLIN] (Counterstein) applicare Coverslip ed incubare
per [2 minuti]
Risciacquare vetrino
Adattare il volume al vetrino
Applicare una goccia di [BLUING REAGENT] (Post Counterstein), applicare coverslip ed
incubare per [2 minuti]
Principio: Metodo basato sul calore, non vengono utilizzati enzimi ma la procedura prevede un’innalzamento della
temperatura durante determinate fasi. Viene inoltre utilizzato il metodo DAB, e i reattivi bluing reagent ed hematoxilin.
Scopo: Si utilizzano anticorpi rivolti contro gli antigeni di superficie degli epatociti
Risultati: Azzurro morfologia del taglio, contro colorazione che serve per differenziare i vari complessi
antigene-anticorpo formati, rispetto al resto del tessuto.
Marrone Complesso antigene-anticorpo.
Note:
Coverslip: olio impiegato per evitare che il preparato durante le fasi di riscaldamento non si secchi, facendo evaporare i
vari reattivi.
Il volume di ogni soluzione che viene posto sul vetrino viene calcolato dalla ditta che fornisce i vetrino. Per ogni marca
differente di vetrino vi sono determinati microlitri da versarvi sopra, vedi citazione adattare il volume al vetrino.
* una goccia per ogni reagente somministrato
Istituto di patologia, Locarno
NexES v9.10
(Tratto dal protocollo PROTOCOL 88:HEP procedure iview dab Paraffin BenchMark (16))
80
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
PROTOCOLLO #2 MNF 116 (25/05/2004)
Procedure: BMK iVIEW DAB Paraffina
BenchMark IHC/ISH Staining Module
Istituto cantonale di Patologia
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
41
42
**** Selezionare EZ Prep ****
**** Inizio tempi fasi ****
**** Mixers Off ****
Riscaldare il vetrino a 75°C, ed incubare a 4 minuti
Applicare EZPPrep regolando il volume al vetrino
Incubare per 4 minuti
Risciacquare vetrino
Applicare EZPrep regolando il volume al vetrino
Incubare per 4 minuti
Risciacquare vetrino
Applicare EZPrep regolando il volume al vetrino
Applicare Coverslip
Riscaldare il vetrino a 76°C ed incubare per 4 minuti
Risciacquare vetrino
Applicare Depar regolando il volume al vetrino
Applicare coverslip
Riscaldare il vetrino a 42°C ed incubare per 2 minuti
**** Mixers On ****
Disable slide Heater
Risciacquare vetrino
Adattare il volume al vetrino
Applicare coverslip
**** Selezionare reazione Tampone ****
Riscaldare il vetrino a 42°C ed incubare per 2 minuti
Risciacquare vetrino
Adattare il volume al vetrino
Applicare una goccia di I-VIEW INHIBITOR, applicare coverslip ed incubare
per 4 minuti
Risciacquare vetrino
Adattare il volume al vetrino
Applicare una goccia di [PROTEASE 1] (Enzima), applicare coverslip ed incubare
per [8 minuti]
Riscacquare vetrino
Adattare il volume al vetrino
Applicare una goccia di [PREP KIT 2](Anticorpo), applicare coverslip ed incubare
per [28 minuti]
Risciacquare vetrino
Adattare il volume al vetrino
Applicare una goccia di I-VIEW BIOTIN Ig, applicare coverslip ed incubare per 8 minuti
Risciacquare vetrino
Adattare il volume al vetrino
Aggiungere una goccia di I-VIEW SA-HRP, applicare coverslip ed incubare per 8 minuti
Risciacquare vetrino
Adattare il volume al vetrino
Applicare coverslip
81
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
43
44
45
46
47
48
49
50
51
52
53
54
55
Riscacquare vetrino
Adattare il volume al vetrino
Applicare una goccia di I-VIEW DAB e una goccia di I-VIEW H202. Applicare
coverslip ed incubare per 8 minuti
Risciacquare vetrino
Adattare il volume al vetrino
Applicare una goccia di I-VIEW COPPER, applicare coverslip ed incubare per 4 minuti
Risciacquare vetrino
Adattare il volume al vetrino
Applicare una goccia di [HEMATOXYLIN] (Counterstein) applicare Coverslip ed incubare
per [2 minuti]
Risciacquare vetrino
Adattare il volume al vetrino
Applicare una goccia di [BLUING REAGENT] (Post Counterstein), applicare coverslip ed
incubare per [2 minuti]
Risciacquare vetrino
Principio:
Utilizzo di un enzima, Proteasi 1, utilizza il complesso perossidasi-avidina-biotina in rapporto agli
anticorpi direttamente marcati da questo enzima, vedi metodica della Proteasi 1. Viene inoltre utilizzato il metodo DAB,
e i reattivi bluing reagent ed hematoxilin.
Scopo: Il kit contiene degli anticorpi che si legano alla keratina e a polipeptidi di 45-46-56.6 kD. Delle cellule
epiteliali
Risultati: Azzurro morfologia del taglio, contro colorazione che serve per differenziare i vari complessi
antigene-anticorpo formati, rispetto al resto del tessuto.
Marrone Complesso antigene-anticorpo.
Note:
Coverslip: olio impiegato per evitare che il preparato durante le fasi di riscaldamento non si secchi, facendo evaporare i
vari reattivi.
Il volume di ogni soluzione che viene posto sul vetrino viene calcolato dalla ditta che fornisce i vetrino. Per ogni marca
differente di vetrino vi sono determinati microlitri da versarvi sopra, vedi citazione adattare il volume al vetrino.
* una goccia per ogni reagente somministrato
Istituto di patologia, Locarno
NexES v9.1
(Tratto dal protocollo PROTOCOL 2:MNF 116 procedure iview dab Paraffin BenchMark (17))
82
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
DOCUMENTAZIONE FOTOGRAFICA DEI VARI TAGLI OTTENUTI
DURANTE LA RICERCA
Colorazione He (ematossilina-eritrosina) casi 1069/2741
1069
2741
83
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Tabella valutativa casi 1069/2741
Programmazione
Originale
Test 2
Durata
89 minuti
49 minuti
Colorazione
He (ematossilina-eritrosina)
Tessuto
Fegato
Patologia
Processo infettivo/infiammatorio
Numero
Programmazione Nuclei
Citoplasma
Colore di
fondo
1069
2741
Originale
Test 2
5
5
5
4 (S)
5
5
Eventuale
colorazione
specifica
-
Scala di valutazione
Valutazione
Insufficiente
Sufficiente
Discreto
Buono
Ottimo
Punteggio
1
2
3
4
5
Criteri
Vedi capitolo “materiale e metodi”
Osservazioni
La colorazione HE non è specifica, è per questo motivo che nella citazione “eventuali colorazioni
specifiche” non è segnato un punteggio.
Nota: Colorazione troppo scura (S), troppo chiara (C)
84
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Colorazione Blu di Prussia casi 1069/2741
1069
2741
85
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Tabella valutativa casi 1069/2741
Programmazione
Originale
Test 2
Durata
89 minuti
49 minuti
Colorazione
Blù di Prussia
Tessuto
Fegato
Patologia
Processo infettivo/infiammatorio
Numero
Programmazione Nuclei
Citoplasma
Colore di
fondo
1069
2741
Originale
Test 2
5
5
5
4 (S)
5
5
Eventuale
colorazione
specifica
5
5
Scala di valutazione
Valutazione
Insufficiente
Sufficiente
Discreto
Buono
Ottimo
Punteggio
1
2
3
4
5
Criteri
Vedi capitolo “materiale e metodi”
Nota: Colorazione troppo scura (S), troppo chiara (C)
86
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Colorazione Evg casi 1069/2741
1069
2741
Tabella valutativa casi 1069/2741
87
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Programmazione
Originale
Test 2
Durata
89 minuti
49 minuti
Colorazione
Evg, elastica Van Gieson
Tessuto
Fegato
Patologia
Processo infettivo/infiammatorio
Numero
Programmazione Nuclei
Citoplasma
Colore di
fondo
1069
2741
Originale
Test 2
5
5
5
5
5
5
Eventuale
colorazione
specifica
5
5
Scala di valutazione
Valutazione
Insufficiente
Sufficiente
Discreto
Buono
Ottimo
Punteggio
1
2
3
4
5
Criteri
Vedi capitolo “materiale e metodi”
88
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Colorazione Gömöri casi 1069/2741
1069
2741
89
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Tabella valutativa casi 1069/2741
Programmazione
Originale
Test 2
Durata
89 minuti
49 minuti
Colorazione
Gömöri
Tessuto
Fegato
Patologia
Processo infettivo/infiammatorio
Numero
Programmazione Nuclei
Citoplasma
Colore di
fondo
1069
2741
Originale
Test 2
5
5
5
5
5
5
Eventuale
colorazione
specifica
5
5
Scala di valutazione
Valutazione
Insufficiente
Sufficiente
Discreto
Buono
Ottimo
Punteggio
1
2
3
4
5
Criteri
Vedi capitolo “materiale e metodi”
90
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Colorazione Orceina casi 1069/2741
1069
2741
CQ
91
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Tabella valutativa casi 1069/2741
Programmazione
Originale
Test 2
Durata
89 minuti
49 minuti
Colorazione
Orceina
Tessuto
Fegato
Patologia
Processo infettivo/infiammatorio
Numero
Programmazione Nuclei
Citoplasma
Colore di
fondo
1069
2741
CQ
Originale
Test 2
Originale
5
5
5
5
4 (C)
5
5
5
5
Eventuale
colorazione
specifica
5
5
5
Scala di valutazione
Valutazione
Insufficiente
Sufficiente
Discreto
Buono
Ottimo
Punteggio
1
2
3
4
5
Criteri
Vedi capitolo “materiale e metodi”
Nota: Colorazione troppo scura (S), troppo chiara (C)
92
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Colorazione cab casi 1069/2741
1069
2741
93
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Tabella valutativa casi 1069/2741
Programmazione
Originale
Test 2
Durata
89 minuti
49 minuti
Colorazione
Cab
Tessuto
Fegato
Patologia
Processo infettivo/infiammatorio
Numero
Programmazione Nuclei
Citoplasma
Colore di
fondo
1069
2741
Originale
Test 2
5
4 (S)
5
4 (S)
5
5
Eventuale
colorazione
specifica
5
5
Scala di valutazione
Valutazione
Insufficiente
Sufficiente
Discreto
Buono
Ottimo
Punteggio
1
2
3
4
5
Criteri
Vedi capitolo “materiale e metodi”
Nota: Colorazione troppo scura (S), troppo chiara (C)
94
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Colorazione per la messa in evidenza del anticorpo Hep casi 1069/2741
1069
2741
CQ
95
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Tabella valutativa casi 1069/2741
Programmazione
Originale
Test 2
Durata
89 minuti
49 minuti
Colorazione
Anticorpo Hep
Tessuto
Fegato
Patologia
Processo infettivo/infiammatorio
Numero
Programmazione Nuclei
Citoplasma
Colore di
fondo
1069
2741
CQ
Originale
Test 2
Originale
5
4 (C)
5
5
4 (C)
5
5
5
5
Eventuale
colorazione
specifica
5
5
5
Scala di valutazione
Valutazione
Insufficiente
Sufficiente
Discreto
Buono
Ottimo
Punteggio
1
2
3
4
5
Criteri
Vedi capitolo “materiale e metodi”
Nota: Colorazione troppo scura (S), troppo chiara (C)
96
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Colorazione He (ematossilina-eritrosina) casi 1283/1719/5375
1283
1719
5375
97
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Tabella valutativa casi 1283/1719/5375
Programmazione
Originale
Test 2
Test 6
Durata
89 minuti
49 minuti
9 minuti
Colorazione
He (ematossilina-eritrosina)
Tessuto
Stomaco
Patologia
Processo infiammatorio
Numero
Programmazione Nuclei
Citoplasma
Colore di
fondo
1283
1719
5375
Originale
Test 2
Test 6
5
5
4 (S)
5
4 (C)
4 (S)
5
5
5
Eventuale
colorazione
specifica
-
Scala di valutazione
Valutazione
Insufficiente
Sufficiente
Discreto
Buono
Ottimo
Punteggio
1
2
3
4
5
Criteri
Vedi capitolo “materiale e metodi”
Osservazioni
La colorazione HE non è specifica, è per questo motivo che nella citazione “eventuali colorazioni
specifiche” non è segnato un punteggio.
Nota: Colorazione troppo scura (S), troppo chiara (C)
98
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Colorazione Pas casi 1283/1719/5375
1283
1719
5375
99
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Tabella valutativa casi 128371719/5375
Programmazione
Originale
Test 2
Test 6
Durata
89 minuti
49 minuti
9 minuti
Colorazione
Pas
Tessuto
Stomaco
Patologia
Processo infiammatorio
Numero
Programmazione Nuclei
Citoplasma
Colore di
fondo
1283
1719
5375
Originale
Test 2
Test 6
5
5
4 (C)
5
5
4 (C)
5
5
5
Eventuale
colorazione
specifica
5
5
4 (C)
Scala di valutazione
Valutazione
Insufficiente
Sufficiente
Discreto
Buono
Ottimo
Punteggio
1
2
3
4
5
Criteri
Vedi capitolo “materiale e metodi”
Nota: Colorazione troppo scura (S), troppo chiara (C)
100
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Colorazione Giemsa casi 1283/1719/5375
1283
1719
5375
101
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Tabella valutativa casi 1283/1719/5375
Programmazione
Originale
Test 2
Test 6
Durata
89 minuti
49 minuti
9 minuti
Colorazione
Giemsa
Tessuto
Stomaco
Patologia
Processo infiammatorio
Numero
Programmazione Nuclei
Citoplasma
Colore di
fondo
1283
1719
5375
Originale
Test 2
Test 6
5
5
4 (C)
5
5
4 (C)
5
5
5
Eventuale
colorazione
specifica
5
5
4 (C)
Scala di valutazione
Valutazione
Insufficiente
Sufficiente
Discreto
Buono
Ottimo
Punteggio
1
2
3
4
5
Criteri
Vedi capitolo “materiale e metodi”
Nota: Colorazione troppo scura (S), troppo chiara (C)
102
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Colorazione Giemsa modificato casi 1283/1719/5375
1283
1719
5375
103
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Tabella valutativa casi 1283/1719/5375
Programmazione
Originale
Test 2
Test 6
Durata
89 minuti
49 minuti
9 minuti
Colorazione
Giemsa modificato
Tessuto
Stomaco
Patologia
Processo infiammatorio
Numero
Programmazione Nuclei
Citoplasma
Colore di
fondo
1283
1719
5375
Originale
Test 2
Test 6
5
5
4 (C)
5
5
4()
5
5
4 (C)
Eventuale
colorazione
specifica
5
5
4 (C)
Scala di valutazione
Valutazione
Insufficiente
Sufficiente
Discreto
Buono
Ottimo
Punteggio
1
2
3
4
5
Criteri
Vedi capitolo “materiale e metodi”
Nota: Colorazione troppo scura (S), troppo chiara (C)
104
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Colorazione per la messa in evidenza del anticorpo Helicobat casi 1283/1719/5375
1283
1719
5357
105
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Tabella valutativa casi 128371719/5375
Programmazione
Originale
Test 2
Test 6
Durata
89 minuti
49 minuti
9 minuti
Colorazione
Anticorpo Hep
Tessuto
Stomaco
Patologia
Processo infiammatorio
Numero
Programmazione Nuclei
Citoplasma
Colore di
fondo
1283
1719
5375
CQ
Originale
Test 2
Test 6
Originale
5
5
4 (S)
5
5
5
4 (S)
5
5
5
4 (S)
5
Eventuale
colorazione
specifica
5
5
3 (S)
5
Scala di valutazione
Valutazione
Insufficiente
Sufficiente
Discreto
Buono
Ottimo
Punteggio
1
2
3
4
5
Criteri
Vedi capitolo “materiale e metodi”
Nota: Colorazione troppo scura (S), troppo chiara (C)
106
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Colorazione He (ematossilina-eritrosina) casi 1454/4250/4350
1454
4250
4350
Tabella valutativa casi 1454/4250/4350
107
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Programmazione
Originale
Test 2
Test 6
Durata
89 minuti
49 minuti
9 minuti
Colorazione
He (ematossilina-eritrosina)
Tessuto
Ileo
Patologia
Processo infiammatorio
Numero
Programmazione Nuclei
Citoplasma
Colore di
fondo
1454
4250
4350
Originale
Test 2
Test 6
5
5
5
5
5
4 (C)
5
5
5
Eventuale
colorazione
specifica
-
Scala di valutazione
Valutazione
Insufficiente
Sufficiente
Discreto
Buono
Ottimo
Punteggio
1
2
3
4
5
Criteri
Vedi capitolo “materiale e metodi”
Osservazioni
La colorazione HE non è specifica, è per questo motivo che nella citazione “eventuali colorazioni
specifiche” non è segnato un punteggio.
Nota: Colorazione troppo scura (S), troppo chiara (C)
108
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Colorazione Masson casi 1454/4250/4350
1454
4250
4350
CQ
109
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Tabella valutativa casi 1454/4250/4350
Programmazione
Originale
Test 2
Test 6
Durata
89 minuti
49 minuti
9 minuti
Colorazione
Masson
Tessuto
Ileo
Patologia
Processo infiammatorio
Numero
Programmazione Nuclei
Citoplasma
Colore di
fondo
1454
4250
4350
CQ
Originale
Test 2
Test 6
Originale
5
5
4 (C)
5
5
4 (S)
4 (C)
5
5
5
5
5
Eventuale
colorazione
specifica
5
5
4 (C)
5
Scala di valutazione
Valutazione
Insufficiente
Sufficiente
Discreto
Buono
Ottimo
Punteggio
1
2
3
4
5
Criteri
Vedi capitolo “materiale e metodi”
Nota: Colorazione troppo scura (S), troppo chiara (C)
110
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Colorazione Evg casi 1454/4250/4350
1454
4250
4350
111
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Tabella valutativa casi 1454/4250/4350
Programmazione
Originale
Test 2
Test 6
Durata
89 minuti
49 minuti
9 minuti
Colorazione
Evg Elastica Van Gieson
Tessuto
Ileo
Patologia
Processo infiammatorio
Numero
Programmazione Nuclei
Citoplasma
Colore di
fondo
1454
4250
4350
Originale
Test 2
Test 6
5
5
5
5
5
4 (C)
5
5
5
Eventuale
colorazione
specifica
5
5
4 (C)
Scala di valutazione
Valutazione
Insufficiente
Sufficiente
Discreto
Buono
Ottimo
Punteggio
1
2
3
4
5
Criteri
Vedi capitolo “materiale e metodi”
Nota: Colorazione troppo scura (S), troppo chiara (C)
112
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Colorazione per la messa in evidenza del anticorpo MNF 116 casi 1454/4250/4350
1454
4350
4250
CQ
113
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Tabella valutativa casi 1454/4250/4350
Programmazione
Originale
Test 2
Test 6
Durata
89 minuti
49 minuti
9 minuti
Colorazione
Anticorpo MNF116
Tessuto
Ileo
Patologia
Processo infiammatorio
Numero
Programmazione Nuclei
Citoplasma
Colore di
fondo
1454
4250
4350
CQ
Originale
Test 2
Test 6
Originale
5
5
4 (S)
5
5
5
4 (S)
5
5
5
5
5
Eventuale
colorazione
specifica
5
4 (S)
3 (S)
5
Scala di valutazione
Valutazione
Insufficiente
Sufficiente
Discreto
Buono
Ottimo
Punteggio
1
2
3
4
5
Criteri
Vedi capitolo “materiale e metodi”
Nota: Colorazione troppo scura (S), troppo chiara (C)
114
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Colorazione He(ematossilina-eritrosina) casi 1461/2709/4588
1461
2709
4588
115
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Tabella valutativa casi 1461/2709/4588
Programmazione
Originale
Test 2
Test 6
Colorazione
He (ematossilina-eritrosina)
Durata
89 minuti
49 minuti
9 minuti
Tessuto
Retto
Patologia
Polipi iperplastici
Numero
Programmazione Nuclei
Citoplasma
Colore di
fondo
1461
2709
4588
Originale
Test 2
Test 6
5
5
4 (S)
5
5
4 (S)
5
5
5
Eventuale
colorazione
specifica
-
Scala di valutazione
Valutazione
Insufficiente
Sufficiente
Discreto
Buono
Ottimo
Punteggio
1
2
3
4
5
Criteri
Vedi capitolo “materiale e metodi”
Nota: Colorazione troppo scura (S), troppo chiara (C)
116
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Colorazione Masson casi 1461/2709/4588
1461
2709
4588
CQ
117
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Tabella valutativa casi 1461/2709/4588
Programmazione
Originale
Test 2
Test 6
Durata
89 minuti
49 minuti
9 minuti
Colorazione
Masson
Tessuto
Retto
Patologia
Polipi iperplastici
Numero
Programmazione Nuclei
Citoplasma
Colore di
fondo
1461
2709
4588
CQ
Originale
Test 2
Test 6
Originale
5
5
4 (S)
5
5
5
4 (S)
5
5
5
5
5
Eventuale
colorazione
specifica
5
4 (S)
4 (S)
5
Scala di valutazione
Valutazione
Insufficiente
Sufficiente
Discreto
Buono
Ottimo
Punteggio
1
2
3
4
5
Criteri
Vedi capitolo “materiale e metodi”
Nota: Colorazione troppo scura (S), troppo chiara (C)
118
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Colorazione per la messa in evidenza del anticorpo CD3 casi 1461/2709/4588
1461
2709
4588
CQ
119
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Tabella valutativa casi 1461/2709/4588
Programmazione
Originale
Test 2
Test 6
Durata
89 minuti
49 minuti
9 minuti
Colorazione
Anticorpo CD3
Tessuto
Retto
Patologia
Polipi iperplastic
Numero
Programmazione Nuclei
Citoplasma
Colore di
fondo
1461
2709
4588
CQ
Originale
Test 2
Test 6
Originale
5
5
4 (S)
5
5
5
4 (S)
5
5
5
5
5
Eventuale
colorazione
specifica
5
4 (S)
3 (S)
5
Scala di valutazione
Valutazione
Insufficiente
Sufficiente
Discreto
Buono
Ottimo
Punteggio
1
2
3
4
5
Criteri
Vedi capitolo “materiale e metodi”
Nota: Colorazione troppo scura (S), troppo chiara (C)
120
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Colorazione He (ematossilina-eritrosina) casi 1477-1/5267-1/4354-1
1477-1
5267-1
4354-1
121
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Tabella valutativa casi 1477-1/5267-1/4354-1
Programmazione
Originale
Test 2
Test 6
Durata
89 minuti
49 minuti
9 minuti
Colorazione
He (ematossilina-eritrosina)
Tessuto
Colon
Patologia
Adenoma
Numero
Programmazione Nuclei
Citoplasma
Colore di
fondo
1477-1
5267-1
4354-1
Originale
Test 2
Test 6
5
5
4 (C)
5
5
4(C)
5
5
5
Eventuale
colorazione
specifica
-
Scala di valutazione
Valutazione
Insufficiente
Sufficiente
Discreto
Buono
Ottimo
Punteggio
1
2
3
4
5
Criteri
Vedi capitolo “materiale e metodi”
Nota: Colorazione troppo scura (S), troppo chiara (C)
122
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Colorazione Alcian-blue casi 1477-1/5267-1/4354-1
1477-1
5267-1
4354-1
123
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Tabella valutativa casi 1477-1/5267-1/4354-1
Programmazione
Originale
Test 2
Test 6
Durata
89 minuti
49 minuti
9 minuti
Colorazione
Alcian-ble
Tessuto
Colon
Patologia
Adenoma
Numero
Programmazione Nuclei
Citoplasma
Colore di
fondo
1477-1
5267-1
4354-1
Originale
Test 2
Test 6
5
5
5
5
5
4 (C)
5
5
5
Eventuale
colorazione
specifica
5
5
4 (C)
Scala di valutazione
Valutazione
Insufficiente
Sufficiente
Discreto
Buono
Ottimo
Punteggio
1
2
3
4
5
Criteri
Vedi capitolo “materiale e metodi”
Nota: Colorazione troppo scura (S), troppo chiara (C)
124
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Colorazione per la messa in evidenza del anticorpo MNF 116 casi 1477-1/5267-1/4354-1
1477-1
5267-1
4354-1
CQ
125
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005
Tabella valutativa casi 1477-1/5267-1/4354-1
Programmazione
Originale
Test 2
Test 6
Durata
89 minuti
49 minuti
9 minuti
Colorazione
Anticorpo MNF116
Tessuto
Colon
Patologia
Adenoma
Numero
Programmazione Nuclei
Citoplasma
Colore di
fondo
1477-1
5267-1
4354-1
CQ
Originale
Test 2
Test 6
Originale
5
5
4 (C)
5
5
5
4 (C)
5
5
5
5
5
Eventuale
colorazione
specifica
5
5
4 (C)
5
Scala di valutazione
Valutazione
Insufficiente
Sufficiente
Discreto
Buono
Ottimo
Punteggio
1
2
3
4
5
Criteri
Vedi capitolo “materiale e metodi”
Nota: Colorazione troppo scura (S), troppo chiara (C)
126
Pelloni Michela, lavoro di diploma laboratoristi medici, Locarno 2005