LABORATORIO DI TECNICHE ISTOLOGICHE ED ISTOCHIMICHE
Docente
ROSARIA SCIARRILLO
Anno di corso
SECONDO
Corso di Laurea
SCIENZE BIOLOGICHE
Tipologia)
A SCELTA
Crediti
3
SSD
BIO/06
Anno Accademico
2008/2009
Periodo didattico
PRIMO SEMESTRE
Propedeuticità
NESSUNA
Frequenza
CONSIGLIATA
Modalità di
erogazione
TRADIZIONALE
Modalità di
valutazione
ORALE
Organizzazione della LEZIONI ED ESERCITAZIONI IN LABORATORIO
didattica
Sede
Appelli di esame
Orario di ricevimento
Orario lezioni
Risultati di
apprendimento
previsti
AULA DA DEFINIRE, FACOLTÀ SCIENZE MM.FF.NN., VIA PORT’ARSA 11, 82100 BENEVENTO
19/01/09-18/02/09-19/03/09-25/06/09-23/07/09-22/09/09
LUNEDI-MARTEDI DALLE ORE 10.00 ALLE ORE12.00
DA DEFINIRE
Il corso si propone di fornire agli studenti:
capacità di operare in modo formato e critico nell'allestimento e nell'analisi di preparati per
microscopia
informazioni sulle possibili applicazioni delle tecniche di microscopia nei diversi campi di
indagine, scientifica o tecnologica.
Obiettivi
L’allievo dovrà essere in grado di: allestire preparati per la microscopia ottica, usare i diversi
tipi di microscopi ottici, scegliere le tecniche di allestimento e colorazione più adeguate,
interpretare correttamente i preparati allestiti.
Valutare criticamente i risultati ed il metodo adottato.
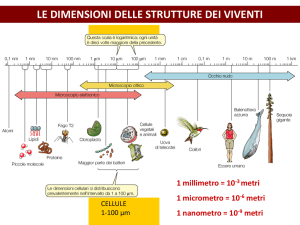
Programma sintetico Analisi descrittiva di preparati istologici al M.O. Polarità e apolarità cellulare. Spessore delle
sezioni. Effetto del piano di sezione. Piani di simmetria e di sezione. Sezioni istologiche e
struttura tridimensionale. Microscopio Ottico binoculare. Condensatore. Diaframma di
apertura. Diaframma di campo. Obiettivi. Oculari. Vite micrometrica. Vite macrometrica.
Apertura numerica. Illuminazione secondo Kohler. Centratura del preparato. Regolazioni
frontali: oculari, distanza interpupillare. Regolazione dell’illuminazione mediante l’uso del
condensatore e del diaframma di campo. Tavolino traslatore. Nonio. Vetrino micrometrico
oculare con retino per misure. Microscopio Ottico Stereoscopico. Obiettivi. Oculari. Differenze
M.O. binoculare/M.O. stereoscopico. Misurazioni al microscopio.Colorazioni. Teoria. Tipi di
colorazioni. Preparati inclusi in paraffina e preparati inclusi in resina. Sezionamento di tessuti
inclusi in paraffina. Microtomi a rotazione e microtomi a slitta. Montaggio delle sezioni su
vetrino. Stesura delle sezioni. Coloranti naturali ed artificiali. Mordenzatura. Lacche.
Colorazioni istochimiche. Viraggio. Colorazioni di contrasto. Reazione P.A.S.-emallume
Colorazioni vitali. Definizioni. Teoria. Scopo. Classificazioni dei coloranti vitali.Uso differenziato
per tecniche istologiche, di fisiologia cellulare, per valutare la quantità di liquido circolante,
per studio dell’embriogenesi. Uso combinato di coloranti vitali, M.O. in fluorescenza, M.O.
confocale, cenni. Microscopia ottica in fluorescenza. Rapporto segnale/fondo. Costruzione e
principi di funzionamento. Tipi di illuminazione. Filtri di eccitamento e di sbarramento.
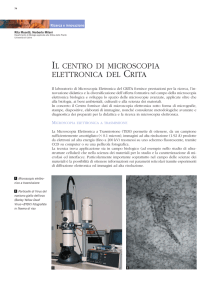
Colorazione con fluorocromi (Nile Red e DAPI). Microscopia elettronica a trasmissione.
Allestimento di sezioni ultrasottili. Contrasto. Fissazione. Disidratazione. Inclusione uso dei
retini. Ombreggiatura con metalli. Colorazione negativa. Microscopia ottica confocale. Laser.
Pinhole. Assi x, y, z. Sezioni ottiche. Ricostruzione tridimensionale.
Testi consigliati e
bibliografia
Materiale didattico
I testi base consigliati per il corso sono:
Dore B. Guida alle esercitazioni di ISTOLOGIA ed all’uso del microscopio. CLU, Torino, 1993.
Bonucci E., Manuale di Istochimica. Lombardo Editore, Roma, 1981.
Scala C., Pasquinelli G., Cenacchi G., Microscopie in biologia e in medicina. CLUEB, Bologna,
1995.
lucidi e materiale eventualmente fornito durante le lezioni
Rosaria Sciarrillo è ricercatore universitario per il settore disciplinare BIO/06 (Anatomia comparata e Citologia)
presso la Facoltà di Scienze Matematiche, Fisiche e Naturali dell’Università degli Studi del Sannio. L’attività scientifica
verte principalmente sulla morfofisiologia delle ghiandole endocrine dei Vertebrati, studiata sia con tecniche
istologiche, immunoistochimiche in microscopia ottica ed elettronica sia con moderne tecniche radioimmunologiche e
HPLC. Tuttavia lo studio della ghiandola tiroidea e adrenale dei rettili rappresenta il principale campo di ricerca.