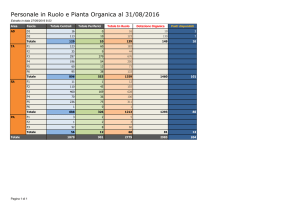
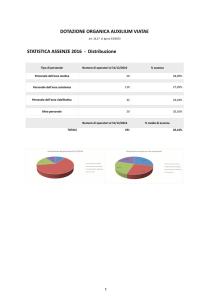
MARINO PETRINI
Data di nascita:
Luogo di nascita:
Cittadinanza:
23 luglio 1956
Loreto, (Ancona)
Italiana
FORMAZIONE
Titolo di Studio
1980
Laurea in Chimica (110/110 e lode) Università di Camerino.
Attività ed Incarichi
2013
Direttore Scuola di Scienze e Tecnologie, Università di Camerino.
2011-13 Delegato del Rettore per le piattaforme tecnologiche europee ed infrastrutture di ricerca.
2010Responsabile Sezione Chimica, Scuola di Scienze e Tecnologie, Università di
Camerino
2008-09 Direttore Dipartimento di Scienze Chimiche Università di Camerino.
2008
Professore ordinario (chimica organica), Facoltà di Farmacia, Università di Camerino
2005
Professore straordinario (chimica organica), Facoltà di Farmacia, Università di
Camerino
2000-04 Membro del Senato Accademico dell’Università di Camerino.
1992
Professore associato (chimica organica), Facoltà di Farmacia, Università di
Camerino
1987-88 Visiting scientist Dipartimento di Chimica, Université de Montréal (Prof. S.
Hanessian)
1983
Ricercatore universitario (chimica organica), Facoltà di Farmacia, Università di
Camerino
1981-83 Borsa di Studio (Ansaldo S.p.A.) Istituto chimico, Università di Camerino.
ATTIVITA’ DIDATTICA
1991-92
Esercitazioni di Tecniche e Sintesi Speciali Organiche, C.L. Chimica
1992-93
2012-13
Chimica Organica 2, C.L. Chimica e Tecn. Farm.
1993-94
2009-10
Chimica Organica 1, C.L. Chimica e Tecn. Farm.
2004-05
2008-09
Basi Chimiche della Vita (chimica organica), C.L. Biologia
2009-10
2012-13
Organic Chemistry, C.L. Biosciences and Biotechnologies
2013-14
Advanced Organic Chemistry, C.L. Chemistry and Advanced Chemical Methodologies
Lezioni monografiche a Scuole Nazionali (XIX e XXXI Corso Estivo di Sintesi Organica
organizzato dalla Società Chimica Italiana, Gargnano, BS, 1994 e 2006) ed Internazionali (X
International Summer School of Green Chemistry, Venezia, 2008).
ATTIVITA’ ORGANIZZATIVA
CISCI 90, Convegno Nazionale della SCI, S.Benedetto del Tronto, 1990
International Advisory Board del 9th International Symposium on Carbanion Chemistry Firenze 2010
XXXIII Congresso Nazionale della Divisione di Chimica Organica della SCI, S. Benedetto
del Tronto, 2010
8th International School of Organometallic Chemistry, Camerino, 2011.
ATTIVITA’ DI RICERCA
L’attività scientifica si è sviluppata principalmente sulle seguenti tematiche:
sintesi e reattività di nitrocomposti alifatici ed aromatici con particolare riferimento al loro
impiego per la sintesi di legami carbonio-carbonio semplici e multipli.
sintesi e reattività di solfoni funzionalizzati per la preparazione di derivati azotati di tipo
amminico.
sintesi di prodotti naturali biologicamente attivi.
I risultati delle ricerche realizzate sono apparsi in oltre 120 pubblicazioni scientifiche, 7 reviews e 3
monografie apparse su riviste a carattere internazionale con i seguenti parametri bibliometrici:
Impact Factor Totale = 527
Impact Factor Medio = 4.11
H–Index = 34 (ISI WoS 1.5.2014)
Visiting Professor presso le Università di Nijmegen (Olanda) e Siviglia (Spagna).
Conferenze su invito
2nd Transmediterranean Colloquium on Heterocyclic Chemistry - Bari, 20-24.6.2002.
1th European Workshop in Drug Synthesis - Siena 14-19.5.2006.
24th Symposium on the Organic Chemistry of Sulfur - Firenze 25-30.7.2010.
a) sintesi e reattività di nitrocomposti alifatici ed aromatici.
I nitrocomposti hanno una notevole importanza nella sintesi organica, dovuta sopratutto alla loro
facile accessibilità, alla possibilità che essi hanno di dare luogo alla formazione di legami carboniocarbonio e alla capacità di poter essere trasformati in altri gruppi funzionali. La elevata capacità
elettronattrattrice del nitrogruppo ha come effetto primario quello di esaltare l'acidità degli idrogeni
che si trovano in posizione alfa. Ciò permette la generazione di specie carbanioniche in condizioni
di reazione relativamente morbide, utilizzando basi di forza limitata.
Mentre la reazione di alchilazione di anioni nitronato risulta essere di minore interesse a causa della
scarsa efficienza di tale processo, la corrispondente reazione con altri substrati elettrofili, come ad
esempio le aldeidi, riveste un importanza fondamentale e permette la sintesi di beta-nitroalcoli
attraverso quella che è comunemente nota come la reazione di Henry. La reazione nitroaldolica è
uno dei processi più studiati per ciò che concerne l’utilizzo dei nitroalcani in sintesi ed è stata
realizzata in un elevato numero di varianti allo scopo di aumentarne l’effiecienza e la selettività. In
particolare questo gruppo di ricerca ha messo a punto una serie di metodologie sintetiche per la
preparazione di beta-nitroalcoli attraverso una reazione in fase eterogenea in assenza di qualsiasi
solvente impiegando quali catalizzatori l’allumina basica e l’Amberlyst A-21, una resina
macroreticolare di tipo anionico.In alternativa sonno state studiate reazioni di tipo Henry che
avvengono in fase acquosa consentendo qundi di evitare l’impiego di solventi con vantaggi di tipo
ambientale facilmente immaginabili.
I nitroalcoli così ottenuti possono essere ulteriormente trasformati in una serie di interessanti
intermedi attraverso una reazione di ossidazione (alfa-nitrochetoni), riduzione del nitrogruppo
(amminoalcoli), rimozione riduttiva del nitrogruppo (alcoli).Di fondamentale importanza da un
punto di vista sintetico risulta essere la reazione di eliminazione di una molecola di acqua dai betanitroalcoli che porta alla formazione dei corrispondenti nitroalcheni.Tale reazione di eliminazione è
stata da noi realizzata in rese elevate in maniera “one-pot” senza la necessità di isolare il
corrispondente nitroalcol intermedio. Il carattere fortemente elettron attrattore del nitrogruppo rende
i nitroalcheni degli ottimi sistemi dienofili in reazioni di cicloaddizione. Inoltre questi nitroderivati
sono dei potenti sistemi elettrofili e quindi subiscono facilmente attacco di specie nucleofile di vario
tipo per dare i corrispondenti prodotti di addizione. Tale processo può essere accoppiato alla
conversione del gruppo nitro a carbonile (reazione di Nef) dal momento che il processo di addizione
si accompagna alla formazione come intermedio di un anione nitronato.E’ importante notare come
recentemente sia stata evidenziata la presenza del sistema nitroolefinico in prodotti naturali
utilizzati da certe specie di insetti a scopo difensivo (Prorhinotermes Simplex). Inoltre il sistema
nitroolefinico è presente anche in importanti farmaci antagonisti del recettore istamina H2 come la
ranitidina.
b) Ammido solfoni in sintesi organica.
Uno dei metodi più comuni per ottenere derivati azotati consiste nella reazione di addizione di
sistemi nucleofili alle immine o loro derivati. Questa procedura risulta però di difficile attuazione
quando vengono utilizzate immine ottenute da aldeidi alifatiche a causa di reazioni di enolizzazione
che competono con il processo di addizione nucleofila. Per questo motivo sono stati sviluppati
diversi sistemi che, pur possedendo una reattività analoga o addirittura superiore a quella delle
immine, possono reagire in maniera efficiente con sistemi nucleofili di diversa forza. Le Nacilimmine presentano una notevole elettrofilicità del doppio legame carbonio-azoto grazie alla
presenza del gruppo acile sull’atomo di azoto. Il loro utilizzo diretto è però reso difficoltoso dalla
instabilità di questi sistemi che ne impedisce la conservazione. Gli alfa-ammidoalchilfenil solfoni in
virtù della elevata capacità del gruppo fenilsolfonile di agire come ottimo gruppo uscente possono
essere considerati degli ottimi precursori di N-acilimmine. Questi possono essere preparati a partire
da un aldeide per reazione con un opportuno carbammato e benzensulfinato sodico. Per azione di
una base , che molto spesso è lo stesso sistema nucleofilo utilizzato per la successiva addizione,
viene eliminato acido benzenesulfinico e quindi viene generata la N-acilimmina. La natura dei
sistemi nucleofili che si possono impiegare nelle reazioni con N-acilimmine è molto ampia; si va da
sistemi carbanionici fortemente stabilizzati come i nitroalcani e sistemi beta-dicarbonilici a enolati
di esteri e nitrili fino a reagenti organometallici di varia natura (reagenti di Grignard, organolitio,
reagenti di Reformatsky). Attraverso questa metodologia sono state sintetizzate vinil e
propargilammine, beta-ammino nitrili, alfa e beta-ammino esteri, enecarbammati ed altri
interessanti composti aventi attività biologica e di notevole interesse pratico.
c) Sintesi di prodotti naturali biologicamente attivi.
Applicando le tecniche sintetiche descritte nei punti precedenti è stato possibile realizzare la sintesi
totale o di intermedi avanzati di prodotti naturali che oltre ad un interesse puramente scientifico
possiedono un importanza a livello industriale e commerciale. Sono state messe a punto due sintesi
totali del grandisolo racemico, uno dei quattro componenti della miscela feromonica (grandlure)
che agisce da attrattivo sessuale sull'Anthonomus grandis Bohemans, un insetto che infesta le
piantagioni di cotone. Le sintesi proposte sono caratterizzate da una notevole praticità, dovuta alle
semplici operazioni di purificazione degli intermedi e dalle alte rese dei processi realizzati. In
entrambe le sintesi lo stadio chiave è rappresentato dalla reazione di fotobiciclizzazione condotta su
un sistema dienico attraverso la quale è possibile costruire una struttura biciclica, per apertura della
quale si ottiene successivamente il sistema ciclobutanico del grandisolo.
La (+)-diidromevinolina è un prodotto naturale appartenente alla classe degli acidi mevinici. Detti
composti sono potenti inibitori dell' idrossimetil glutaril coenzima A riduttasi, un enzima che
controlla lo stadio lento nella biosintesi del colesterolo da parte degli organismi viventi. Per questo
motivo gli acidi mevinici (e loro analoghi sintetici) mostrano una spiccata azione ipocolestemica e
quindi possono trovare un utile impiego come statine negli individui con elevati livelli ematici di
colesterolo. La pirenoforina è un dilattone macrociclico a 16 termini che possiede proprietà
citostatiche e fungicide. E’ un metabolita del Pyrenophora avenae un fungo patogeno per le piante.
Da un punto di vista strutturale la pirenoforina risulta essere costituita da due unità chetoidrossi
acide accoppiate che sono state sintetizzate in maniera efficiente attraverso la reazione chiave di
apertura ossidativa dell’anello furanico.L’anisomicina è un prodotto della fermentazione di varie
specie di streptomiceti e manifesta una potente attività nei confronti di protozoi e funghi patogeni.
Essa viene utilizzata nella terapia delle vaginiti da tricomonas e nella dissenteria amebica. Per la sua
sintesi ci siamo avvalsi di un intermedio di tipo nitronico che grazie alla sua caratteristica elettrofila
si presta ad una reazione efficiente con i reagenti di Grignard. Il nitrone chirale ciclico necessario
per la sintesi è stato preparato a partire da acido L-tartarico che possiede i due gruppi ossidrilici di
adatta configurazione. La lentiginosina è un alcaloide a nucleo indolizidinico proveniente dalle
foglie dell’Astragalus lentiginosus. Analogamente ad altri alcaloidi dello stesso tipo come la
castanospermina e la swainsonina essa possiede una spiccata attività inibitrice delle glicosidasi e
quindi è una potenziale molecola anti-HIV. Le caratteristiche stereochimiche della lentiginosina
suggeriscono l’impiego dello stesso nitrone ciclico impiegato per la sintesi della anisomicina.