© Springer-Verlag 2002
Pathologica (2002) 94:325-330
I S T O PAT O L O G I A
M. Ungari · W. Pellegrini · E. Borlenghi · D. Marocolo · A. Ubiali · C. Agazzi · A. Pich · V. Franco · F. Facchetti
LAT (linker for activation of T cells): un utile marcatore per l’identificazione
di megacariociti in biopsie osteomidollari
LAT (linker for activation of T cells): a useful marker for megakaryocyte evaluation
on bone marrow biopsies
Riassunto L’identificazione di megacariociti (MGC) patologici in corso di malattie mieloproliferative (MPC), mielodisplastiche (MDS) e leucemie acute è facilitata dall’impiego di
marcatori immunoistochimici quali Ulex europaeus agglutinina-1 (UEA-1), CD31, CD61 e fattore di von Willebrand/antigene correlato al fattore VIII (FVW/FVIII-RA).
Quest’ultimo è attualmente considerato il più sensibile marcatore immunoistochimico di megacariociti. Recentemente è
stata descritta l’espressione in MGC e piastrine di LAT (linker
for activation of T cells), una proteina transmembrana coinvolta nell’attivazione dei linfociti T e nell’aggregazione piastrinica. In questo studio abbiamo comparato l’immunoreattività di FVW/FVIII-RA e LAT con MGC in 64 biopsie osteomidollari incluse in paraffina, comprendenti 12 controlli normali (CN), 18 MDS, 21 MPC e 13 leucemie acute megacariocitiche (LMA-M7). Le sezioni sono state colorate con anticorpi policlonali anti-FVW/FVIII-RA e anti-LAT e l’immunoreattività è stata valutata contando il numero di cellule positive/10 campi microscopici ad alto ingrandimento; i valori
ottenuti sono stati confrontati mediante il test t di Student per
dati appaiati. Sia LAT che FVW/FVIII-RA colorano prevalentemente il citoplasma dei MGC, sebbene LAT sia localizzato anche a livello di membrana. Nella maggior parte dei ca-
M. Ungari • W. Pellegrini • E. Borlenghi • D. Marocolo • A. Ubiali
C. Agazzi • F. Facchetti ()
Anatomia Patologica “, Università degli Studi di Brescia,
Spedali Civili Brescia, P.le Spedali Civili 1, I-25124 Brescia,Italia
e-mail: [email protected]
Tel.: +39-030-3995-426
Fax +39-030-3995-053
A. Pich
Servizio di Anatomia Patologica,
Università degli Studi di Torino, Italia
V. Franco
Servizio di Anatomia Patologica,
Università degli Studi di Palermo, Italia
si l’immunoreattività per i due anticorpi era simile. In tutti i
gruppi esaminati non sono state apprezzate differenze statisticamente significative fra i valori medi di megacariociti
FVW/FVIII-RA+ e LAT+. Tuttavia in 22 casi (5 CN, 5MDS,
6 MPC, 6 LMA-M7) i megacariociti LAT+ risultavano essere almeno il 30% più numerosi rispetto al numero di megacariociti FVW/FVIII-RA+, mentre solo in 3 casi si osservava un
quadro opposto. In particolare, in 3 casi di LMA-M7 i megacariociti LAT+ erano marcatamente più numerosi rispetto agli
elementi FVW/FVIII-RA+ e in 5 casi si osservava una intensità di reazione per LAT nettamente superiore. I dati permettono di concludere che LAT rappresenta un valido marcatore
immunoistochimico per l’identificazione di megacariociti in
condizioni normali e patologiche; esso sembra identificare un
numero più elevato di MGC rispetto al FVW/FVIII-RA, specie in casi associati a scarsa differenziazione dei MGC, quali
LMA-M7. L’impiego di anti-LAT in associazione con altri
marcatori di MGC appare utile nello studio di biopsie osteomidollari in corso di malattie ematologiche.
Parole chiave LAT • Fattore di von Willebrand • Megacariociti • Immunoistochimica • Midollo osseo
Key words LAT • Von Willebrand factor • Megakaryocytes •
Immunohistochemistry • Bone marrow
Introduzione
L’applicazione di tecniche immunoistochimiche nella diagnostica ematologica ha largamente facilitato lo studio delle biopsie osteomidollari, trovando ampia applicazione nell’analisi dei processi linfo- e mieloproliferativi [1, 2]. In
questi ultimi ha consentito di individuare con precisione la
natura di cellule altrimenti non definibile in base alle sole
caratteristiche cito-morfologiche. In particolare, è noto che
in corso di diverse forme mielodisplastiche e mieloprolife-
326
rative può risultare assai difficoltosa l’identificazione di megacariociti (MGC) patologici e la distinzione di micro-megacariociti da elementi immaturi mieloidi ed eritroidi, così
come da macrofagi o cellule linfoidi. L’identificazione degli
elementi megacariocitari è facilitata dall’impiego di marcatori quali Ulex europaeus agglutinina-1 (UEA-1), glicoproteina IIIa (CD61), CD31 e fattore di von Willebrand/antigene correlato al fattore VIII (FVW/FVIII-RA) [3-9]. Ognuno
di questi marcatori presenta limiti applicativi: UEA-1 appare scarsamente specifico, identificando diverse altre popolazioni midollari; inoltre, analogamente a CD61 e a CD31,
UEA-1 mostra una ridotta sensibilità di reazione nei megacariociti proprio in condizioni patologiche [5, 6, 10]. CD61
è considerato il marcatore più specifico di megacariociti [7,
8]; tuttavia, esso può presentare una reattività estremamente
variabile in biopsie e la sua espressione risulta particolarmente ridotta o assente in sezioni fissate in B5 [10-12], oppure in campioni bioptici sottoposti a decalcificazione con
sostanze acide [Prof. Thiele J., Colonia, Germania, comunicazione personale]. Studi comparati hanno identificato il
FVW/FVIII-RA come il marcatore più sensibile di megacariociti normali e patologici [6, 10].
Recentemente è stata riportata la reattività dell’anticorpo
policlonale anti-LAT (linker for activation of T cells) su sezioni fissate e incluse in paraffina non solo nei confronti di
cellule T, ma anche di megacariociti [12]. LAT è una proteina transmembrana di 36-38 kDa che assume un ruolo fondamentale nella regolazione dell’attivazione dei linfociti T e
dell’aggregazione piastrinica, fungendo da substrato per le
tirosin chinasi ZAP70 e Syk [13-17].
In questo studio abbiamo comparato l’immunoreattività
di anticorpi diretti contro FVW/FVIII-RA e LAT verso megacariociti in biopsie osteomidollari in condizioni di normalità e in differenti disordini ematologici.
Materiali e metodi
Sono state analizzate 64 biopsie osteomidollari comprendenti 12 controlli normali (CN), ottenuti da pazienti in corso di
stadiazione per linfoma, 18 casi di mielodisplasia (MDS), 21
casi di sindrome mieloproliferativa cronica (MPC) e 13 casi
di leucemia acuta megacariocitica (LMA-M7). Alcuni casi di
LMA-M7 provenivano dagli archivi di due Coautori (A.P. e
F.V.); la restante parte dei campioni apparteneva all’archivio
del 2° Servizio di Anatomia Patologica degli Spedali Civili di
Brescia. I campioni bioptici sono stati fissati in B5 (54), formalina (2), formalina acida (4), liquido di Bouin (4), decalcificati in EDTA per 4-5 ore e inclusi in paraffina. La colorazione immunoistochimica è stata condotta con il coloratore automatico Techmate 500 (Dako, Milano), utilizzando il
metodo immunoperossidasico indiretto streptavidina-biotina;
gli anticorpi policlonali anti-FVW/FVIII-RA (Dako) e antiLAT (L. Samelson, Bethesda, MD, USA) sono stati applicati alla diluizione di 1:3000. L’immunoreattività è stata valu-
M. Ungari et al.: LAT e megacariociti
tata contando il numero di cellule positive (escludendo elementi di piccola taglia di aspetto linfoide) in 10 campi microscopici ad alto ingrandimento (×40), equivalenti a 2 mm2
di tessuto; i valori ottenuti sono stati confrontati applicando
il test t di Student per dati appaiati.
La specificità dell’anticorpo anti-LAT utilizzato e la sua
espressione in piastrine sono state testate mediante Western
blot: una sospensione contenente piastrine purificate è stata
sottoposta a centrifugazione a 300× g per 20 min; il pellet è
stato risospeso in un volume di 200 ml di soluzione ipotonica (KCl 10 mM), per lisare le piastrine, e il contenuto proteico è stato quantificato allo spettrofotometro (λ=280 nm).
In gel acrilamidico al 10% si sono caricate 20 µg di proteine, sottoposte a corsa elettroforetica a 100 V costanti per 1
ora; accanto al campione è stato fatto correre un marker di
pesi molecolari (Bio-Rad Rainbow Full Range Protein
Marker, Bio-Rad, Hercules, CA, USA). Il contenuto del gel
è stato trasferito su foglio di nylon tramite applicazione di
campo elettrico per 30 min e la membrana è stata sottoposta
a ibridazione con anticorpo primario anti-LAT (1:2000) per
una notte, lavata in tampone e quindi trattata con soluzione
di latte in polvere, allo scopo di saturare tutti i siti aspecifici. Dopo tre lavaggi per 10 min in tampone e trattamento con
anticorpo secondario coniugato a perossidasi (goat anti-rabbit IgG, Pierce, Pierce Biotechnology, Rockford, IL, USA)
(1:20000 in latte vaccino), per 1 ora il segnale è stato rivelato mediante applicazione di substrato chemiluminescente
(Chemiluminescent Probe, Pierce) e successiva autoradiografia, con tempo di esposizione di 15 sec.
Risultati
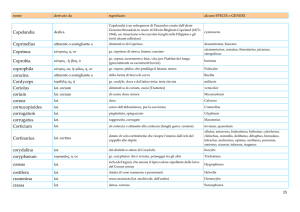
La specificità dell’anticorpo anti-LAT utilizzato è comprovata da Western blot, che dimostra la presenza nel lisato piastrinico di una banda del peso molecolare di 32 KDa (Fig. 1).
Nelle colorazioni immunoistochimiche la positività sia
per FVW/FVIII-RA che per LAT si localizza a livello citoplasmatico; FVW/FVIII-RA si localizza in forma omoge-
Fig. 1 Western blot di lisato piastrinico con anticorpo anti-LAT dimostra la presenza della proteina nelle piastrine, corrispondente alla banda del peso molecolare di 32 kDa. A sinistra sono riportati pesi molecolari di riferimento (Rainbow Full Range Protein Marker)
M. Ungari et al.: LAT e megacariociti
neamente diffusa nel citoplasma, mentre LAT presenta una
maggiore disomogeneità, essendo assente a livello di piccoli vacuoli citoplasmatici; inoltre, in alcune cellule è eviden-
327
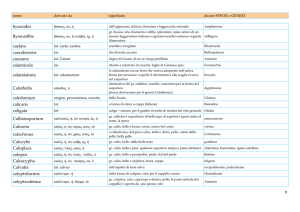
te l’espressione di LAT anche a livello della membrana cellulare, mancando nel citoplasma immediatamente sottostante la membrana (Fig. 2a, b); oppure, specie in condizioni pa-
Fig. 2 Espressione di LAT in megacariociti normali (a e b) e confronto dell’espressione di FVW/FVIII-RA e LAT in condizioni patologiche
(c, f). In a è illustrata la variabile espressione di LAT nel citoplasma dei megacariociti e sulla loro membrana plasmatica. L’aspetto granulare e
disomogeneo della distribuzione della proteina nel citoplasma è ben evidente in b, dove sono riconoscibili piccoli vacuoli non colorati. Sia in
a che b sono infine identificabili piastrine LAT+. Sezioni seriate di un caso di malattia mieloproliferativa cronica mostrano un numero di megacariociti LAT+ (d) lievemente superiore rispetto a quello dei megacariociti FVW/FVIII-RA+ (c); in questo particolare caso, l’intensità di reazione per LAT appare anche superiore. I riquadri e e f illustrano sezioni seriate di un caso di LMA-M7, dove rari megacariociti sono identificati con anti-FVW/FVIII-RA (e), mentre la totalità di essi risulta LAT+ (f). Si noti in e l’intensa espressione nei vasi di FVW/FVIII-RA
328
M. Ungari et al.: LAT e megacariociti
tologiche, LAT risulta espresso solo nelle porzioni periferiche del citoplasma. In tutte le biopsie di controllo e nella
maggior parte dei casi patologici l’immunoreattività per i
due antigeni è risultata ugualmente intensa; non è sembrato
pertanto esistere un particolare influsso dei diversi fissativi
sulla immunoreattività, sebbene il numero dei casi analizzato per ciascun fissativo non è tale da permettere una valutazione adeguata.
In tutti i casi esaminati, oltre ai megacariociti FVW/
FVIII-RA e LAT coloravano intensamente anche le piastrine (Fig. 2a, b). L’identificazione di megacariociti patologici
immunoreattivi per FVW/FVIII-RA e LAT da altre cellule
potenzialmente reattive per gli stessi marcatori, quali mastociti (per FVW/FVIII-RA e LAT) [18, 19] e linfociti T (LAT)
[13-17] appariva agevole sulla scorta delle dimensioni cellulari, dell’aspetto dei nuclei e della distribuzione prevalentemente citoplasmatica dell’immunoreazione.
I risultati del confronto dell’espressione dei due marcatori nei megacariociti sono riportati nella Tabella 1. Comples-
sivamente non sono state apprezzate differenze statisticamente significative fra i valori medi ottenuti con i due marcatori nelle diverse condizioni. Tuttavia in 22 casi (5 CN, 5
MDS, 6 MPC, 6 LMA M7) i megacariociti LAT+ erano almeno il 30% più numerosi rispetto al numero di elementi
FVW/FVIII-RA+; mentre solamente in 3 casi (2 MDS e 1
MPC) si osservava un quadro inverso (Fig. 2c, d). Un dato
particolarmente interessante è emerso dall’analisi delle leucemie acute megacariocitiche (LMA-M7), che comprendevano 11 casi di tipo differenziato e 2 casi di tipo indifferenziato [20] (Tab. 2). Infatti, 5/13 casi presentavano una intensità
di reazione per LAT nettamente superiore rispetto al
FVW/FVIII-RA. Inoltre, in 3 casi il numero di megacariociti LAT+ era marcatamente superiore rispetto a quelli
FVW/FVIII+ (881 vs. 25, 649 vs. 50, 1300 vs. 278/10 campi
×40) (Fig. 2e, f). Come evidente dai dati riportati nella
Tabella 2, nei casi di AML-M7 non si è osservata correlazione fra espressione dei due marcatori di megacariociti, grado
di differenziazione, conta piastrinica e anomalie cariotipiche.
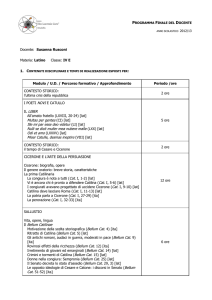
Tabella 1 Valori medi (± deviazione standard) dei megacariociti
positivi per LAT e FVW/FVIII-RA nelle diverse categorie
Discussione
Categoria
FVW/FVIII-RA
LAT
p (t test)
Normale
MDS
MPC
LMA-M7
44.50± 28.68
115.22±121.09
139.71± 65.27
393.69±310.27
47.00± 23.86
114.61±101.26
148.62± 66.35
578.31±322.59
ns
ns
ns
ns
MDS, mielodisplasia; MPC, sindrome mieloproliferativa cronica;
LMA-M7, leucemia acuta megacariocitica; ns, non significativo
Nello studio di malattie mieloproliferative e mielodisplastiche, l’analisi della biopsia osteomidollare è in grado di fornire fondamentali informazioni che, correlate ai dati ottenuti con l’esame dell’aspirato midollare, permettono un esatto
inquadramento delle malattie nelle loro diverse manifestazioni [8, 17, 21, 22]. In particolare, lo studio della morfologia dei megacariociti appare decisamente superiore sulla
biopsia rispetto all’aspirato, essendo apprezzabili con mag-
Tabella 2 Megacariociti positivi per LAT e FVW/FVIII-RA nei 13 casi di leucemia acuta megacarioblastica (LMA-M7), cariotipo e dati
relativi alla conta piastrinica al momento della biopsia
Caso
Tipo
LMA-M7
FVW/FVIIIRA/LATa
Piastrine
(109/l)
Citogenetica
1
2
3
4
5
6
7
8
D
I
D
D
D
D
D
D
317/306
1065/935
25/881b
314/259b
50/649b
175/270
426/649b
378/558
nd
nd
nd
37
253
62
333
4
9
10
11
12
13
13
D
D
D
D
I
I
838/660
205/235
290/258b
278/1300
757/558
757/558
653
9
nd
35
710
710
nd
nd
nd
46,XY,t(1;16)(q12;q21)
46,XX
nd
48,XY,+14,+22
47,XYY[5]/47,XYY,?inv(5)(q?),
inv(6)(p25q25)[8]/48,XYY,+14[6]
45,XX,-7
45,XY,del(3)(q?),-5[2]/46,XY[15]
nd
46,XY,t(9;22)(q34;q11)
46,XY,t(9;22)(q34;q11)
46,XY,t(9;22)(q34;q11)
D, differenziata; I, indifferenziata; nd, non determinato
Numero di megacariociti positivi/10 campi ad alto ingrandimento (2 mm2 di tessuto); b Caso con maggiore intensità di espressione di
LAT vs. FVW/FVIII-RA
a
M. Ungari et al.: LAT e megacariociti
giore accuratezza non solo dettagli citologici, ma anche
aspetti della distribuzione topografica e dell’aggregazione
nelle lacune. La disponibilità di marcatori immunoistochimici per megacariociti utilizzabili in sezioni di midollo fissate, decalcificate e incluse in paraffina ha enormemente facilitato questo processo diagnostico [4, 6, 10, 11, 23].
In questo studio abbiamo confrontato l’immunoreattività
dei megacariociti per FVW/FVIII-RA, il marcatore di megacariociti più diffuso e da molti considerato il più sensibile [10, 24] e LAT (linker for activation of T-cell), molecola
recentemente riportata essere espressa da megacariociti e
piastrine, oltre che dai linfociti T [12, 16, 17]. La specificità
dell’anticorpo anti-LAT verso le piastrine è stata dimostrata
mediante Western blot.
I risultati ottenuti hanno evidenziato che LAT rappresenta un ottimo marcatore immunoistochimico di megacariociti in biopsie fissate e incluse in paraffina; infatti, il numero
medio di cellule identificate dal relativo anticorpo è risultato statisticamente sovrapponibile a quello ottenuto con antiFVW/FVIII-RA, sia in condizioni normali che in diverse
condizioni patologiche. Inoltre, confrontando i valori ottenuti in singole biopsie è emerso che in 22 casi (5 normali, 5
mielodisplasie, 6 sindromi mieloproliferative croniche e 6
leucemie acute megacariocitiche) il numero di megacariociti LAT+ era evidentemente superiore, differendo di più del
30% rispetto ai megacariociti FVW/FVIII-RA+. Differenze
particolarmente significative si sono riscontrate nei 13 casi
di leucemia acuta megacariocitica, tre dei quali presentavano un numero di megacariociti LAT+ rispettivamente 36, 13
e 5 volte superiore rispetto al numero di megacariociti
FVW/FVIII-RA+. Inoltre, anche l’intensità di reazione risultava superiore in 5/13 casi. La disponibilità di marcatori
immunoistochimici nell’identificazione della natura megacariocitica in casi di AML-M7 è una procedura diagnostica
particolarmente utile, in quanto in questa condizione il midollo è spesso caratterizzato da fibrosi [20], che preclude la
possibilità di utilizzare tecniche basate sulla immunofenotipizzazione dell’aspirato midollare.
La maggiore frequenza con la quale il FVW/FVIII-RA
risulta meno espresso in condizioni patologiche e, in particolare, in forme di leucemia acuta megacariocitica, potrebbe essere in relazione con una immaturità dei megacariociti
stessi [24] e una conseguente ridotta sintesi di granuli α. È
noto infatti che il FVW/FVIII-RA risiede nei granuli α e che
una minore produzione e formazione di tali strutture è caratteristica dei megacariociti immaturi [6, 11, 20, 25]. I dati
ottenuti in questo studio sembrano indicare che questo processo non sempre si accompagni alla sdifferenziazione
morfologica dei megacariociti, come indicato dalla mancanza di correlazione fra espressione di FVW/FVIII-RA e tipo
di leucemia megacariocitica. Rimane difficile da spiegare la
persistenza negli stessi casi di espressione di LAT, in quanto è stato dimostrato che tale proteina gioca un ruolo importante nella aggregazione piastrinica secondaria a stimolo
trombinico o collagene [16, 17]. È possibile che LAT nei
329
megacariociti non sia localizzato nei granuli α, come farebbe pensare la sua disomogenea distribuzione nel citoplasma,
osservata in questo studio; oppure, LAT potrebbe non essere direttamente correlato alla differenziazione cellulare e risultare funzionalmente ridondante. A supporto di questa ipotesi, vi è l’osservazione che, a differenza dei topi “knockout” per proteine leganti LAT quali Syk e SLP-76 che mostrano severe emorragie sin dalla nascita, topi difettivi di
LAT non esibiscono alcuna alterazione della emostasi nel
decorso della loro vita, mentre esibiscono marcate anomalie
dei linfociti T [13].
In conclusione, i dati ottenuti in questo studio indicano
che l’anticorpo anti-LAT rappresenta un marcatore particolarmente sensibile per i megacariociti, specie in condizioni
patologiche. In uno studio precedente è stato possibile dimostrare l’utilità di anti-LAT nell’analisi di processi linfoproliferativi, risultando questo marcatore sostanzialmente
identico ad anti-CD3 nell’identificazione di linfomi T/NK e
addirittura superiore ad esso nella tipizzazione dei linfomi
anaplastici a grandi cellule [12]. Similmente ai processi
linfoproliferativi, dove la possibilità di una perdita di antigeni di differenziazione impone la necessità di utilizzare
pannelli immunofenotipici ampi per una più precisa diagnosi e classificazione, appare evidente che anche in emopatie nelle quali i megacariociti sono coinvolti può essere
utile l’applicazione associata di più marcatori di differenziazione.
Ringraziamenti Si ringraziano Dr. L.E. Samelson, Section on
Lymphocyte Signaling, The Cell Biology and Metabolism Branch,
NIH, Bethesda, MD, per aver fornito l’anticorpo anti-LAT; il
Professor F. Donato, Cattedra di Igiene dell’Università di Brescia,
per la revisione dei test statistici; Luisa Breda per l’esecuzione delle numerose sezioni seriate e Luisa Benerini, per l’assistenza tecnica nella realizzazione del Western-blot.
Summary Detection of atypical megakaryocytes in bone
marrow biopsies, especially in cases of myelodysplastic syndromes (MDS), chronic myeloproliferative disorders (CMPD)
and acute leukemias, is facilitated by staining for markers
such as Ulex europaeus agglutinin (UEA)-1, CD31, CD61
and von Willebrand factor (VWF), the latter being considered the most sensitive. Recently, LAT (linker for activation
of T cells), a molecule involved in T-cell activation and
platelet aggregation, was found to be expressed by
megakaryocytes and platelets in tissue sections. We compared VWF and LAT immunoreactivity on megakaryocytes in
64 bone marrow biopsies from 12 normal controls (NC), and
from patients with MDS (n=18), CMPD (n=21) and acute
megakaryocytic leukemia (AML-M7, n=13). Immunostaining was performed on paraffin sections with polyclonal antibodies against VWF and LAT. Immunoreactivity was evaluated by counting positive megakaryocytes in 10 high-power fields, and values were compared using Student’s t test for
paired data. Both VWF and LAT predominantly stained the
330
cytoplasm of megakaryocytes, although LAT was also recognizable on the cell membrane. In most biopsies, the immunoreactivity of the two antibodies was quite similar. No
significant differences were noticed between the mean values of VWF+ and LAT+ megakaryocytes. However, in 22
cases (5 NC; 5 MDS; 6 CMPD; 6 AML-M7), the number of
LAT+ megakaryocytes was at least 30% higher than VWF+
cells, while in 3 cases opposite findings were found. In 3
AML-M7 cases, anti-LAT antibodies stained numerous
megakaryocytes, but anti-VWF staining was practically negative; in another 5 AML-M7 cases, anti-LAT labeling was
much stronger than anti-VWF staining. LAT represents a
useful immunohistochemical marker for megakaryocytes in
normal and pathological conditions. It seems to be expressed by megakaryocytes more than VWF in most cases
and, particularly, in conditions associated with poorly differentiated megakaryocytes, such as acute megakaryocytic
leukemias. The use of LAT staining should be recommended
in association with other megakaryocyte markers in the
study of bone marrow biopsies in cases of hematopoietic
disorders.
Parte di questo studio è stata presentata al XI Meeting of the
European Association for Haemapatopathology, Siena, 26-30
Maggio 2002.
Bibliografia
1. van der Valk P, Mullink H, Huijgens PC et al (1989)
Immunohistochemistry in bone marrow diagnosis. Value of a
panel of monoclonal antibodies on routinely processed bone
marrow biopsies. Am J Surg Pathol 13:97-106
2. Pileri SA, Roncador G, Ceccarelli C et al (1997) Immunohistochemistry of bone-marrow biopsy. Leuk Lymphoma 26
[Suppl 1]:69-75
3. Liu SM, Li CY (1996) Immunohistochemical study of Ulex
europaeus agglutinin 1 (UEA-1) binding of megakaryocytes:
demonstration of heterogeneity in staining pattern reflecting
the stages of differentiation. Hematopathol Mol Hematol
10:99-109
4. Gatter KC, Cordell JL, Turley H et al (1988) The immunohistological detection of platelets, megakaryocytes and
thrombi in routinely processed specimens. Histopathology
13:257-267
5. Calapso P, Vitarelli E, Crisafulli C et al (1992) Immunocytochemical detection of megakaryocytes by endothelial markers: a comparative study. Pathologica 84:215-223
6. Thiele J, Krech R, Wienhold St et al (1987) The use of the anti-factor VIII method on trephine biopsies of the bone marrow
for the identification of immature and atypical megakaryocytes in myeloproliferative diseases and allied disorders.
Virchows Arch B 54:89-97
M. Ungari et al.: LAT e megacariociti
7. Thiele J, Quintman H, Wagner S et al (1991) Dysmegakaryopoiesis in myelodysplastic syndromes (MDS): an immunomorphometric study of bone marrow trephine biopsy
specimens. J Clin Pathol 44:300-305
8. Brown DC, Gatter KC (1993) The bone marrow trephine biopsy: a review of normal histology. Histopathology 22:411-422
9. Ivanyi JL, Kiss A, Telek B et al (1993) Megakaryocyte markers in myeloproliferative disorders. Acta Histochem 95:79-88
10. Chuang SS, Young YC, Li CY (2000) Von Willebrand factor
is the most reliable immunohistochemical marker for
megakaryocytes of myelodysplastic syndrome and chronic
myeloproliferative disorders. Am J Clin Pathol 113:506-511
11. Chuang SS, Li CY (1997) Useful panel of antibodies for the
classification of acute leukemia by immunohistochemical
methods in bone marrow trephine biopsy specimens. Am J
Clin Pathol 107:410-418
12. Facchetti F, Chan JKC, Zhang W et al (1999) Linker for activation of T cells (LAT), a novel immunohistochemical marker for T cells, NK cells, mast cells, and megakaryocytes. Am
J Pathol 154:1037-1046
13. Zhang W, Sommers CL, Burshtyn DN et al (1999) Essential
role of LAT in T cell development. Immunity 10:323-332
14. Cantrell D (1998) The real LAT steps forward. Trends Cell
Biol 8:180-182
15. Zhang W, Trible RP, Samelson LE (1998) LAT palmitoylation: its essential role in membrane microdomain targeting
and tyrosine phosphorylation during T cell activation.
Immunity 9:239-246
16. Gibbins JM, Briddon S, Shutes A et al (1998) The p85 subunit of phosphatidylinositol 3-kinase associates with the Fc
receptor gamma-chain and linker for activitor of T cells
(LAT) in platelets stimulated by collagen and convulxin. J
Biol Chem 273:34437-34443
17. Sarkar S (1998) Tyrosine phosphorylation and traslocation of
LAT in platelets. FEBS Lett 441:357-360
18. Kindblom LG (1982) Factor VIII related antigen and mast
cells. Acta Pathol Microbiol Immunol Scand [A] 90:437-439
19. Zhang W, Sloan-Lancaster J, Kitchen J et al (1998) LAT: the
ZAP-70 tyrosine kinase substrate that links T cell receptor to
cellular activation. Cell 92:83-92
20. Brunning RD, McKenna RW (1994) Atlas of tumor pathology. Tumors of the bone marrow. Third series, fascicle 9. AFIP,
Washington
21. Lambertenghi-Deliliers G, Annaloro C, Oriani A et al (1993)
Prognostic relevance of histological findings on bone marrow
biopsy in myelodysplastic syndromes. Ann Hematol 66:85-91
22. Winfield DA, Polacarz SV (1992) Bone marrow histology 3:
value of bone marrow core biopsy in acute leukemia,
myelodysplastic syndromes, and chronic myeloid leukemia. J
Clin Pathol 45:855-859
23. Fox SB, Lorenzen J, Heryet A et al (1990) Megakaryocytes in
myelodysplasia: an immunohistochemical study on bone marrow trephines. Histopathology 17:69-74
24. Huang M, Li CY, Nichols WL et al (1984) Acute leukemia
with megakaryocytic differentiation: a study of 12 cases identified immunocytochemically. Blood 64:427-439
25. Koike T (1984) Megakaryoblastic leukemia: the characterization and identification of megakaryoblasts. Blood 64:683-692