M i n i s t e r o d e l l ’ i s t r u z i o n e , d e l l ’ u n i v e rs i t à e d e l l a r i c e r c a
Liceo Scientifico Statale “M. G. Agnesi”
Liceo Scienze Applicate – Liceo Linguistico
Via dei Lodovichi 10 – 23807 Merate (LC)
Tel: 039 9906676-039 9902139 Fax: 039 9900230
e-mail uffici: [email protected]
P R O G R A M M A S V O L T O anno scolastico 2014 /2015
Materia SCIENZE NATURALI
Classe
Docente prof.ssa Belotti Lorena
1 DS Liceo Scientifico
CHIMICA
La chimica della natura
Premi Nobel italiani assegnati per la fisiologia, medicina, chimica e fisica. Scoperte e date
dell’assegnazione del premio.
Finalità della Chimica e suoi ambiti di studio.
Dall’alchimica alla chimica. Chimica e sostenibilità ambientale.
La chimica studia la materia e le sue trasformazioni.
Misure e grandezze
Le grandezze sono proprietà misurabili
Il Sistema Internazionale: grandezze fondamentali e derivate. Grandezze intensive ed
estensive.
Volume, massa, peso, densità, mole, temperatura: scala Celsius e Kelvin.
Concetto di energia: definizione di energia potenziale, cinetica e calore.
Il metodo scientifico e l’analisi dei dati
Il metodo sperimentale e le sue fasi: studio controllato dei fenomeni; ipotesi, verifica
sperimentale, legge, teoria, modello e fatto scientifico.
La relazione di laboratorio.
Sensibilità e portata degli strumenti di misura. Misura ed errori accidentali e sistematici. Valor
medio, errore assoluto, intervallo dei valori attendibili, errore relativo.
Notazione scientifica e ordine di grandezza.
Le trasformazioni fisiche della materia
Sistema (aperto, chiuso e isolato) e ambiente.
Gli stati di aggregazione della materia: aeriforme (gas e vapore), liquido e solido. Definizione di
plasma.
Natura particellare della materia: l’interpretazione degli stati di aggregazione.
Definizione di fase. Sistemi fisicamente omogenei ed eterogenei. Sistemi chimicamente omogeni
ed eterogenei. Le sostanze pure.
Miscugli eterogenei e miscugli omogenei (soluzione, solvente e soluto). I colloidi.
I cambiamenti di stato: relazione fra temperatura e passaggi di stato; relazione fra pressione e
passaggi di stato. Variazione del volume e della densità durante un passaggio di stato.
La curva di riscaldamento e di raffreddamento di una sostanza e di una soluzione.
Interpretazione particellare delle curve di riscaldamento
Tecniche di separazione di un miscuglio: decantazione, centrifugazione, filtrazione, utilizzo di un
imbuto separatore, utilizzo della calamita, estrazione con solventi, cristallizzazione, sublimazione,
distillazione, distillazione frazionata, cromatografia su carta.
Trasformazioni chimiche della materia
Trasformazioni chimiche e fisiche a confronto. Le reazioni chimiche.
Le sostanze pure: elementi e composti.
Classificazione degli elementi chimici. La Tavola periodica. Metalli, non metalli e
semimetalli.
Le teorie della materia
Concetto di atomo. Le leggi ponderali della chimica: Lavoisier e Proust. Teoria atomica di
Dalton.
Teoria atomica e proprietà della materia.
Formule chimiche di elementi e composti. Composti molecolari e ionici.
Gli atomi, i legami, le reazioni
Particelle subatomiche, numero atomico e numero di massa. Isotopi.
Modelli atomici: Dalton; Thomson; esperimento e modello di Rutherford. Concetto di orbita
(cenni al modello atomico di Bohr) e concetto di orbitale.
La disposizione degli elettroni negli atomi: configurazione elettronica e configurazione
elettronica esterna.
I legami chimici: la regola dell'ottetto. Legame ionico e legame covalente puro e polare.
Equazioni chimiche e loro bilanciamento.
SCIENZE DELLA TERRA
La terra come sistema integrato
Il sistema Terra. Le sfere della Terra: atmosfera, idrosfera, litosfera, biosfera: caratteristiche
generali ed interazione tra di esse.
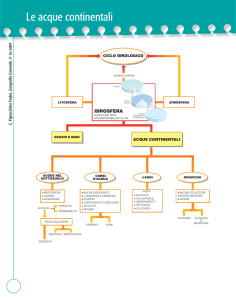
La sfera dell’acqua: le acque continentali
Il ciclo dell’acqua. Il bilancio idrologico globale e regionale. Distribuzione dell’acqua sul pianeta:
acque superficiali e sotterranee.
Acque di ruscellamento e forme di erosione.
Fiumi e torrenti: caratteristiche generali; bacino idrografico e idrogeologico. Azione di
modellamento delle acque fluviali: azione erosiva (gole, marmitte, valli a V e cascate) di trasporto
e di deposito (conoide di deiezione e pianura alluvionale). Forme miste di erosione e trasporto:
meandri, terrazzi e foci fluviali.
I laghi: caratteristiche generali; classificazione in base all’origine, evoluzione.
I ghiacciai: ghiacciai alpini, calotte glaciali, ghiacciai marini e meccanismi di formazione.
Movimento di un ghiacciaio. Modellamento di origine glaciale della superficie terrestre: forme di
erosione e di deposito.
Le acque sotterranee: porosità e permeabilità delle rocce; il suolo; falde freatiche e artesiane;
sorgenti e risorgive.
Approfondimento:
Le grandi dighe. Il dissesto idrogeologico. La risorsa acqua: deficit idrico e inquinamento. Il
passaggio a Nord – Ovest.
La sfera dell’acqua: idrosfera marina
La acque marine: salinità e presenza di gas, densità, pressione, temperatura, trasparenza, colore.
Oceani e mari. Morfologia dei fondali oceanici.
I moti delle acque marine: onde, maree, correnti superficiali e profonde. Cenni all’erosione
costiera.
L’inquinamento delle acque marine. L’ecosistema marino.
Approfondimento:
L’inquinamento delle acque marine.
La Terra come corpo celeste
Il sistema solare: origine. Leggi di Keplero e legge della gravitazione universale.
Pianete terrestri e pianeti gioviani. Asteroidi, comete e meteoroidi.
Forma e dimensioni della Terra. Definizione di ellissoide e geoide.
I sistemi di riferimento sulla superficie terrestre: reticolato geografico e coordinate geografiche.
Moto di rotazione e alternarsi del dì e della notte. Moto di rivoluzione e alternarsi delle stagioni.
Testo in adozione
G. Valitutti A. Tifi A. Gentile:
La Chimica della Natura
Zanichelli ed.
M. Crippa M. Fiorani
Sistema Terra
Edizione: A. Mondadori Scuola
LABORATORIO
Normativa sulla sicurezza in laboratorio
Misura della densità dell'avventurina: calcolo dell'errore assoluto e dell'intervallo di valori
attendibili.
Proprietà additiva verificata per massa e volume di due liquidi miscibili: acqua e alcool
etilico.
Estrazione di pigmenti clorofilliani da foglie di spinaci (estrazione; filtrazione)
Osservazione della fluorescenza dei pigmenti clorofilliani
Separazione per cromatografia dei pigmenti colorati presenti nell’ inchiostro di pennarello
Distillazione del vino
Separazione per filtrazione e cristallizzazione di un miscuglio eterogeneo: acqua, sale e
carbonato di calcio in polvere
Separazione di un miscuglio formato da limatura di ferro e polvere di zolfo con calamita
Sublimazione e brinamento dello iodio
Curva di riscaldamento del tiosolfato di sodio
Merate
28 / 5 / 2015
Il docente
Belotti Lorena
I rappresentanti di classe