Domenico Galli
Digitally signed by Domenico Galli
DN: c=IT, o=INFN, ou=Personal
Certificate, l=Bologna, cn=Domenico Galli
Date: 2012.04.19 13:43:05 +02'00'
Quesiti di Fisica Generale
2. Temodinamica
prof. Domenico Galli, prof. Umberto Marconi
27 marzo 2012
I compiti scritti di esame del prof. D. Galli propongono 4 quesiti, sorteggiati —
individualmente per ogni studente — da questa lista, nella versione disponibile sul
Web 15 giorni prima della data della prova scritta.
Il “punteggio” riportato a fianco di ogni quesito è calcolato sulla base di tutti
i precedenti risultati su tale quesito nelle prove di esame, in modo da rendere
il secondo terzile della distribuzione dei voti, su ogni singolo quesito, pari a 3/3. In
altre parole il punteggio assegnato al singolo quesito è tale da assicurare che un terzo
degli studenti che hanno affrontato il quesito ottenga la massima valutazione.
I “punteggi” dei quesiti riportati in questa lista sono indicativi. Essi si modificano dinamicamente a ogni appello di esame, in modo da divenire una valutazione
sempre più precisa dell’effettiva difficoltà del quesito (all’aumentare della statistica
sperimentale l’errore di misura diminuisce).
1
Termodinamica
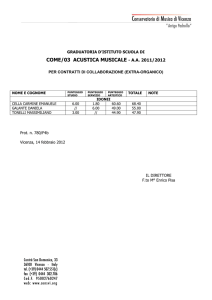
1. t_df_01 (Punteggio: 3.00)
(a ) In quali condizioni un sistema termodinamico si dice essere in stato di equilibrio termodinamico? (b ) Quali condizioni di equilibrio sono necessarie per aversi
l’equilibrio termodinamico?
2. t_df_02 (Punteggio: 3.00)
In quali condizioni due sistemi termodinamici, entrambi in stato di equilibrio
termodinamico, si dicono in equilibrio termico tra loro?
3. t_df_03 (Punteggio: 5.20)
Descrivere il procedimento di misura della temperatura del termometro a gas
perfetto.
4. t_df_04 (Punteggio: 3.00)
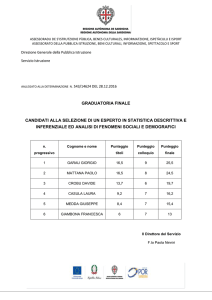
(a ) Come si definisce un gas perfetto? (b ) Quali proprietà soddisfano i suoi
parametri di stato? (c ) Quali proprietà soddisfa la sua energia interna?
5. t_df_05 (Punteggio: 3.00)
(a ) Definire il punto triplo. (b ) Qual è la temperatura del punto triplo dell’acqua? (c ) Al punto triplo dell’acqua è associata una ben definita pressione o si
può avere il punto triplo a pressioni diverse?
6. t_df_06 (Punteggio: 3.00)
(a ) Come si definisce un termostato (altrimenti detto serbatoio di calore o sorgente di calore a temperatura costante o ancora bagno di calore)? (b ) Come si
può realizzare in pratica, con buona approssimazione, un termostato?
7. t_df_07 (Punteggio: 4.50)
(a ) Definire l’energia interna di un sistema termodinamico. (b ) L’energia interna è una funzione di stato? Motivare esaurientemente quest’ultima risposta.
1
8. t_df_08 (Punteggio: 3.25)
(a ) Definire il calore. (b ) Il calore è una funzione di stato? Motivare esaurientemente quest’ultima risposta.
9. t_df_09 (Punteggio: 4.35)
(a ) Definire una mole. (b ) Definire il calore molare.
10. t_df_10 (Punteggio: 4.50)
Definire lavoro tecnico ed entalpia e descriverne l’utilità pratica.
11. t_df_11 (Punteggio: 3.53)
(a ) Quando una trasformazione termodinamica si dice quasi-statica? (b ) Quando una trasformazione termodinamica si dice reversibile? (c ) Quando una
trasformazione quasi-statica risulta essere reversibile?
12. t_df_12 (Punteggio: 6.00)
Definire operativamente la temperatura termodinamica assoluta.
13. t_df_13 (Punteggio: 3.00)
(a ) Definire la funzione di Helmholtz. (b ) Definire la funzione di Gibbs. (c )
Mostrarne la relazione che lega le due funzioni.
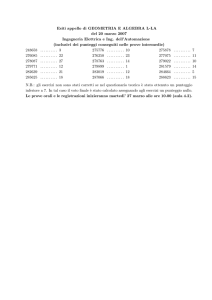
14. t_tc_01 (Punteggio: 3.80)
Come di descrive in un modello microscopico la pressione che un gas esercita
sulle pareti del recipiente che lo contiene? Che relazione esiste tra la pressione
e la velocità delle molecole?
15. t_tc_02 (Punteggio: 5.77)
Come si concilia la reversibilità meccanica microscopica con l’irreversibilità
termodinamica macroscopica?
16. t_tc_03 (Punteggio: 6.00)
Nella descrizione microscopica dei gas come si spiega che l’espansione libera
avviene spontaneamente, mentre il suo processo inverso non ha luogo?
17. t_tc_04 (Punteggio: 6.00)
(a ) Scrivere e commentare l’equazione di stato di Van der Waals. In particolare
spiegare il significato (b ) del covolume molare e (c ) della pressione interna e (d )
2
giustificare l’espressione a Vn 2 di quest’ultima.
18. t_vp_01 (Punteggio: 3.00)
(a ) Tracciare nel diagramma di Clapeyron l’isoterma di un gas perfetto e scriverne l’equazione. (b ) Tracciare nel diagramma di Clapeyron l’isoterma di un
vapore in equilibrio col proprio liquido e scriverne l’equazione (tracciare soltanto
il tratto dell’isoterma in cui il vapore è in equilibrio col proprio liquido).
19. t_vp_02 (Punteggio: 3.00)
Un sistema è costituito di acqua e vapore acqueo in equilibrio. Comprimendo a
temperatura costante tale sistema, specificare se la pressione: (a ) aumenta; (b )
rimane costante; (c ) diminuisce. Motivare esaurientemente la risposta.
20. t_vp_03 (Punteggio: 3.00)
(a ) Definire la temperatura critica di una sostanza. (b ) Quanto vale approssimativamente la temperatura critica dell’acqua?
21. t_vp_04 (Punteggio: 4.29)
(a ) Che cosa contengono le bolle di una pentola d’acqua in ebollizione? (b )
Perché l’acqua, in condizioni standard, bolle proprio a quella data temperatura
(100 ◦ C nella scala Celsius) e non bolle a temperatura più bassa? Motivare
esaurientemente la risposta.
22. t_vp_05 (Punteggio: 4.50)
In alta montagna, l’acqua bolle a una temperatura inferiore, uguale o superiore
a 100 ◦ C? Motivare esaurientemente la risposta?
2
23. t_vp_06 (Punteggio: 3.00)
(a ) L’acqua può evaporare a temperatura inferiore a 100 ◦ C? (b ) Quale condizione fisica causa l’ebollizione dell’acqua a 100 ◦ C? Motivare esaurientemente
le due risposte.
24. t_vp_07 (Punteggio: 3.00)
Nella pentola a pressione, l’acqua bolle a una temperatura inferiore, uguale o
superiore a 100 ◦ C? Motivare esaurientemente la risposta?
25. t_vp_08 (Punteggio: 3.00)
Quanto vale approssimativamente la pressione di vapor saturo dell’acqua a
100 ◦ C? Motivare esaurientemente la risposta.
26. t_vp_09 (Punteggio: 3.00)
Che cosa accade se si scalda l’acqua a 100 ◦ C entro un recipiente non poroso?
Motivare esaurientemente la risposta.
27. t_vp_10 (Punteggio: 3.00)
(a ) Come mai si forma la “condensa” sulle bottiglie di vetro estratte dal frigorifero? (b ) Da dove proviene tale condensa? Motivare esaurientemente le
risposte.
28. t_vp_11 (Punteggio: 3.00)
Il “fumo” che si osserva uscire da una pentola di acqua in ebollizione è costituito da vapore acqueo o da piccole goccioline di acqua liquida? Motivare
esaurientemente la risposta.
29. t_vp_12 (Punteggio: 3.00)
Si può avere, a pressione atmosferica, l’equilibrio tra le fasi liquida, solida e
gassosa dell’acqua? Motivare esaurientemente la risposta.
30. t_vp_13 (Punteggio: 3.00)
Spiegare il principio di funzionamento di una camera a bolle.
31. t_vp_14 (Punteggio: 3.00)
(a ) Indicare di quali, delle seguenti tre sostanze, possono essere costituite le
nuvole (è ammessa una risposta multipla): (i) di vapore acqueo; (ii) di goccioline
di acqua liquida; (iii) di cristallini di acqua solida? (b ) Come mai le nuvole non
“cadono”? Motivare esaurientemente le risposte.
32. t_1p_01 (Punteggio: 3.18)
(a ) Enunciare, nella sua formulazione matematica, il primo principio della termodinamica, spiegando accuratamente il significato dei simboli. (b ) Con che
modalità si può trasferire energia da un sistema termodinamico a un altro?
33. t_1p_02 (Punteggio: 3.00)
Un gas perfetto subisce: (a ) un’espansione adiabatica quasi-statica; (b ) un’espansione libera adiabatica. In entrambi i casi dire se la sua temperatura subisce
variazioni e in caso affermativo specificare se la temperatura finale è superiore
o inferiore a quella iniziale motivando esaurientemente le risposte sulla base del
primo principio della termodinamica e delle proprietà dei gas perfetti.
34. t_1p_03 (Punteggio: 6.00)
(a ) Quale curva rappresenta, nel diagramma di Clapeyron, un’espansione isoterma quasi-statica di un gas perfetto? (b ) Quale curva rappresenta, nel diagramma di Clapeyron, un’espansione adiabatica quasi-statica di un gas perfetto?
Specificare le equazioni delle due curve descrivendo accuratamente il significato
dei simboli.
35. t_1p_04 (Punteggio: 3.00)
Se si mette in funzione un ventilatore in una stanza racchiusa da pareti adiabatiche, la temperatura della stanza: (a ) diminuisce, (b ) aumenta o (c ) rimane
costante? Spiegarne esaurientemente il motivo?
3
36. t_1p_05 (Punteggio: 6.00)
L’aria mossa da un ventilatore diminuisce effettivamente la temperatura della
pelle dell’uomo o si tratta soltanto di un’illusione? Motivare esaurientemente la
risposta.
37. t_2p_01 (Punteggio: 6.00)
(a ) Enunciare il secondo principio della termodinamica nella formulazione di
Kelvin-Planck. (b ) Enunciare il secondo principio della termodinamica nella
formulazione di Clausius.
38. t_2p_02 (Punteggio: 4.50)
Si può rappresentare una trasformazione irreversibile nel diagramma di Clapeyron? Motivare esaurientemente la risposta.
39. t_2p_03 (Punteggio: 4.50)
Descrivere (a ) il moto perpetuo di prima specie e (b ) il moto perpetuo di seconda
specie, chiarendo il motivo per cui essi risultano impossibili e i principi che essi
violano.
40. t_2p_04 (Punteggio: 4.50)
Il passaggio diretto di calore da un corpo più caldo a un corpo più freddo (senza
modificazioni dell’ambiente circostante) è un processo reversibile? Motivare
esaurientemente la risposta.
41. t_2p_05 (Punteggio: 6.00)
La trasformazione di energia meccanica in energia termica eseguita da un mulinello di Joule in un recipiente adiabatico è un processo reversibile? Motivare
esaurientemente la risposta.
42. t_2p_06 (Punteggio: 4.50)
(a ) Si può realizzare una macchina termica ciclica che compia lavoro positivo
scambiando calore con un solo termostato senza altri effetti? (a ) Si può realizzare una macchina termica non ciclica che compia lavoro positivo scambiando
calore con un solo termostato senza altri effetti? Motivare esaurientemente le
risposte.
43. t_2p_07 (Punteggio: 6.00)
Perché il calore ceduto da una macchina termica all’ambiente non può essere
convertito in energia meccanica con buona efficienza? Motivare esaurientemente
la risposta.
44. t_2p_08 (Punteggio: 3.23)
(a ) Si può trasferire calore da un corpo più freddo a un corpo più caldo? In che
modo? (b ) È possibile effettuare tale trasferimento senza modificare lo stato
dell’ambiente? Motivare esaurientemente quest’ultima risposta.
45. t_2p_09 (Punteggio: 3.00)
Qual è il numero minimo di termostati di cui ha bisogno una macchina termica
ciclica per operare? Motivare esaurientemente la risposta sulla base del secondo
principio della termodinamica e delle proprietà della macchina di Carnot.
46. t_2p_10 (Punteggio: 4.50)
(a ) Qual è la massima efficienza di conversione dell’energia meccanica in energia
termica? (b ) Qual è la massima efficienza di conversione dell’energia termica
in energia meccanica, date le temperature massima, TH , e minima, TC , dei
termostati cui si dispone? Motivare esaurientemente le due risposte.
47. t_2p_11 (Punteggio: 6.00)
Specificare (a ) dimensioni (in termini delle dimensioni fondamentali del S.I.) e
(b ) unità di misura nel Sistema Internazionale delle seguenti grandezze: (i) energia, (ii) calore, (iii) calore molare, (iv) calore specifico, (v ) lavoro, (vi) lavoro
tecnico, (vii) capacità termica, (viii) entalpia, (ix) entropia, (x) pressione.
4
48. t_2p_12 (Punteggio: 6.00)
Mettendo in funzione un frigorifero con la porta aperta in una stanza racchiusa
da pareti adiabatiche, la temperatura della stanza (a ) diminuisce, (b ) aumenta
o (c ) rimane costante? Motivare esaurientemente la risposta.
49. t_en_01 (Punteggio: 3.00)
Come si calcola la variazione di entropia di un sistema termodinamico conseguente a una trasformazione irreversibile?
50. t_en_02 (Punteggio: 3.00)
(a ) Enunciare il principio dell’aumento dell’entropia. (b ) Può diminuire l’entropia di un sistema? (c ) Può diminuire l’entropia dell’ambiente esterno? (d ) Può
diminuire l’entropia dell’universo (sistema + ambiente)? Motivare esaurientemente le risposte.
51. t_en_03 (Punteggio: 3.72)
Un gas perfetto subisce un’espansione isoterma quasi-statica. Dire se è positiva,
negativa o nulla: (a ) la variazione di entropia del sistema; (b ) la variazione
di entropia dell’ambiente; (c ) la variazione di entropia dell’universo. Motivare
esaurientemente le risposte.
52. t_en_04 (Punteggio: 4.50)
Un gas perfetto subisce una compressione isoterma quasi-statica. Dire se è positiva, negativa o nulla: (a ) la variazione di entropia del sistema; (b ) la variazione
di entropia dell’ambiente; (c ) la variazione di entropia dell’universo. Motivare
esaurientemente le risposte.
53. t_en_05 (Punteggio: 3.72)
Un gas perfetto subisce un’espansione libera adiabatica. Dire se è positiva,
negativa o nulla: (a ) la variazione di entropia del sistema; (b ) la variazione
di entropia dell’ambiente; (c ) la variazione di entropia dell’universo. Motivare
esaurientemente le risposte.
54. t_en_06 (Punteggio: 4.50)
Un gas perfetto subisce una compressione isobara quasi-statica. Dire se è positiva, negativa o nulla: (a ) la variazione di entropia del sistema; (b ) la variazione
di entropia dell’ambiente; (c ) la variazione di entropia dell’universo. Motivare
esaurientemente le risposte.
55. t_en_07 (Punteggio: 4.50)
Un gas perfetto subisce un’espansione isobara quasi-statica. Dire se è positiva,
negativa o nulla: (a ) la variazione di entropia del sistema; (b ) la variazione
di entropia dell’ambiente; (c ) la variazione di entropia dell’universo. Motivare
esaurientemente le risposte.
56. t_en_08 (Punteggio: 3.70)
Un sistema termodinamico a temperatura più alta viene messo a contatto con
un sistema termodinamico a temperatura più bassa. Dire se è positiva, negativa
o nulla: (a ) la variazione di entropia del sistema a temperatura più alta; (b ) la
variazione di entropia del sistema a temperatura più bassa; (c ) la variazione di
entropia complessiva dei due sistemi. Motivare esaurientemente le risposte.
57. t_di_01 (Punteggio: 6.00)
Ricavare l’espressione della pressione di un gas sulla parete di un recipiente che
lo contiene, in funzione del valor medio della componente perpendicolare alla
parete della velocità molecolare.
58. t_di_02 (Punteggio: 5.23)
Calcolare, descrivendo il procedimento seguito, il valor medio del tempo di attesa
necessario affinché una mole di gas si comprima spontaneamente entro la metà
del recipiente che lo contiene (tempo di Poincaré).
5
59. t_di_03 (Punteggio: 6.00)
Dimostrare che il lavoro compiuto da un fluido in una trasformazione quasi/L = p dV .
statica è pari a d
60. t_di_04 (Punteggio: 3.00)
Ricavare le 3 formule di Poisson, relative all’espansione adiabatica, quasi-statica
di un gas perfetto.
61. t_di_05 (Punteggio: 6.00)
Ricavare la relazione tra dU e dT per un gas perfetto.
62. t_di_06 (Punteggio: 6.00)
Ricavare la relazione tra dH e dT per un gas perfetto.
63. t_di_07 (Punteggio: 6.00)
Ricavare la relazione tra la capacità termica a pressione costante Cp , la capacità
termica a volume costante CV e la quantità di sostanza (misurata in moli) n
per un gas perfetto.
64. t_di_08 (Punteggio: 3.00)
Dimostrare che in una trasformazione isocora quasi-statica Q = ∆U .
65. t_di_09 (Punteggio: 6.00)
Dimostrare che in una trasformazione isobara quasi-statica Q = ∆H.
66. t_di_10 (Punteggio: 6.00)
Dimostrare — a partire dal primo principio della termodinamica, dalla defini/L
zione di capacità termica a volume costante CV e dall’espressione del lavoro d
compiuto in
una
trasformazione
quasi-statica
—
che
per
un
gas
generico
si
ha
CV = ∂U
,
dove
U
è
l’energia
interna.
Consiglio:
considerare,
come
variabili
∂T V
termodinamiche indipendenti, il volume V e la temperatura T .
67. t_di_11 (Punteggio: 3.95)
Dimostrare — a partire dal primo principio della termodinamica, dalle definizioni di capacità termica a pressione costante Cp e di entalpia H e dall’espressione
/L compiuto in una trasformazione quasi-statica — che per un gas gedel lavoro d
nerico si ha Cp = ∂H
∂T p . Consiglio: considerare, come variabili termodinamiche
indipendenti, la pressione p e la temperatura T .
68. t_di_12 (Punteggio: 6.00)
Dimostrare — a partire dal primo principio della termodinamica, dalla defini/L compiuto in una trasforzione di entalpia H e dall’espressione del lavoro d
∂U
mazione quasi-statica — che, per un gas generico, si ha ∂H
∂V p = p + ∂V p ,
dove U è l’energia interna del sistema. Consiglio: considerare, come variabili
termodinamiche indipendenti, la pressione p e il volume V .
69. t_di_13 (Punteggio: 6.00)
Dimostrare — a partire dal primo principio della termodinamica, dalla defini/L compiuto
zione di entalpia H e dall’espressione del lavoro d
Ä ä in una Ätrasforä
∂U
mazione quasi-statica — che, per un gas generico, si ha ∂H
∂p V = V + ∂p V ,
dove U è l’energia interna del sistema. Consiglio: considerare, come variabili
termodinamiche indipendenti, la pressione p e il volume V .
70. t_di_14 (Punteggio: 6.00)
Dimostrare l’equivalenza degli enunciati di Kelvin-Planck e di Clausius del
secondo principio della termodinamica.
71. t_di_15 (Punteggio: 3.81)
Dimostrare che il ciclo della macchina di Carnot (definita come macchina ciclica reversibile che scambia calore con due soli termostati) non può che essere
costituito da due trasformazioni isoterme quasi-statiche e due trasformazioni
adiabatiche quasi-statiche.
6
72. t_di_16 (Punteggio: 4.46)
Dimostrare che il rendimento di una macchina di Carnot a gas perfetto, operante
con due termostati a temperatura T1 e T2 (con T1 > T2 ), vale η = 1 − TT21 .
73. t_di_17 (Punteggio: 6.00)
Dimostrare il teorema di Carnot (sul rendimento delle macchine termiche cicliche reversibili e non reversibili).
74. t_di_18 (Punteggio: 6.00)
Dimostrare il teorema di Clausius (essendo noto il teorema di Carnot).
75. t_di_19 (Punteggio: 6.00)
Dimostrare che l’entropia è una funzione di stato a partire dal Teorema di
Clausius.
76. t_di_20 (Punteggio: 6.00)
Dimostrare il principio dell’aumento dell’entropia a partire dal Teorema di
Clausius.
77. t_di_21 (Punteggio: 6.00)
Ä ä
∂p
∂U
=
T
Dimostrare l’equazione dell’energia interna: ∂V
∂T V −p, a partire dal
T
primo principio della termodinamica e dal fatto che il differenziale dell’entropia,
dS, è un differenziale esatto.
78. t_di_22 (Punteggio: 6.00)
Ä ä
∂V
Dimostrare l’equazione dell’entalpia: ∂H
∂p T = V −T ∂T p , a partire dal primo
principio della termodinamica e dal fatto che il differenziale dell’entropia, dS, è
un differenziale esatto.
79. t_di_23 (Punteggio: 6.00)
Ä ä
∂p
Dimostrare le 2 equazioni del TdS: T dS = ncV dT + T ∂T
dV e T dS =
V
∂V
ncp dT − T ∂T p dp, a partire dal primo principio della termodinamica, dalla
∂H
definizione di entalpia, dalle due relazioni CV = ∂U
∂T V e Cp =
∂T p per
le capacità termiche,Ädalla
Ä dell’energia
ä definizione di entropia, dalla equazione
ä
∂p
∂H
∂U
=
T
−
p
e
dall’equazione
dell’entalpia
interna ∂V
∂T V
∂p T = V −
T
T ∂V
∂T p .
80. t_di_24 (Punteggio: 6.00)
Dimostrare che la variazione della funzione di Helmholtz tra due stati è pari al
massimo lavoro che il sistema può compiere in una trasformazione che collega
tali stati.
81. t_di_25 (Punteggio: 6.00)
Dimostrare che il minimo della funzione di Helmholtz per un sistema a volume
costante rappresenta uno stato di equilibrio stabile.
82. t_di_26 (Punteggio: 6.00)
Dimostrare che il minimo della funzione di Gibbs per un sistema a pressione
costante rappresenta uno stato di equilibrio stabile.
83. t_di_27 (Punteggio: 6.00)
∂F
Dimostrare che in un sistema termodinamico vale la relazione p = − ∂V
T
dove F è la funzione di Helmholtz, mentre p, V e T sono rispettivamente la
pressione, il volume e la temperatura.
84. t_di_28 (Punteggio: 6.00)
Ä ä
Dimostrare che in un sistema termodinamico vale la relazione V = ∂G
∂p T , dove
G è la funzione di Gibbs, mentre p, V e T sono rispettivamente la pressione, il
volume e la temperatura.
7
85. t_di_29 (Punteggio: 6.00)
Dimostrare che in un sistema termodinamico vale la relazione S = − ∂F
∂T V ,
dove S è l’entropia, F è la funzione (o potenziale termodinamico) di Helmholtz,
T è la temperatura assoluta e V è il volume.
86. t_di_30 (Punteggio: 6.00)
Dimostrare che in un sistema termodinamico vale la relazione S = − ∂G
∂T p ,
dove S è l’entropia, G è la funzione (o potenziale termodinamico) di Gibbs, T
è la temperatura assoluta e p è la pressione. .
87. t_di_31 (Punteggio: 6.00)
Dimostrare che in un sistema termodinamico vale la relazione U = F −T ∂F
∂T V ,
dove U è l’energia interna, T è la temperatura (assoluta), F è la funzione (o
potenziale termodinamico) di Helmholtz e V è il volume.
88. t_di_32 (Punteggio: 6.00)
Dimostrare che in un sistema termodinamico vale la relazione H = G−T ∂G
∂T p ,
dove H è l’entalpia, T è la temperatura (assoluta), G è la funzione (o potenziale
termodinamico) di Gibbs e p è la pressione.
89. t_di_33 (Punteggio: 4.29)
Ä 2 ä
Dimostrare che in un sistema termodinamico vale la relazione CV = −T ∂∂TF2
V,V
dove CV è la capacità termica a volume costante, T è la temperatura (assoluta),
F è la funzione (o potenziale termodinamico) di Helmholtz e V è il volume.
90. t_di_34 (Punteggio: 6.00)
Ä 2 ä
Dimostrare che in un sistema termodinamico vale la relazione Cp = −T ∂∂TG2
p,p
dove Cp è la capacità termica a pressione costante, T è la temperatura (assoluta),
G è la funzione (o potenziale termodinamico) di Gibbs e p è la pressione.
8
,