Lezione di Endocrinologia del 11/10/13
Prof.De Bellis
L’ipofisi controlla le ghiandole surrenaliche. L’ipotalamo attraverso il rilascio di
CRH stimola il rilascio di ACTH. Esiste anche un’altra via attraverso l’ ADH
secreto dall’ipotalamo che oltre a depositarsi agisce con azione sinergica al CRH.
Il surrene è costituito da una zona midollare (interna) e una zona corticale
(esterna), a sua volta divisa in fascicolata (secernente glicocorticoidi), glomerulare
( secernente mineralcorticoidi) e reticolare (secernente glicocorticoidi e ormoni
steroidei). L’ACTH agisce stimolando la secrezione degli ormoni surrenalici. Le
concentrazioni di cortisolo possono risultare elevate o per motivi legati alla
ghiandola surrenale o per somministrazione di sostanze esogene a lungo termine,
questo cortisolo esogeno andrà ad agire sul feedback ipotalamo-ipofisario come il
colesterolo endogeno. Quindi se ad un paziente somministriamo cortisolo a scopo
terapeutico per lungo tempo la regola sarebbe quella di ridurre le quantità di
cortisolo in modo graduale evitando di passare in modo repentino da livelli
estremamente elevati a livelli estremamente bassi. Questo perché, dopo
somministrazione di cortisolo esogeno, la ghiandola si “abitua” a secernere
quantità molto basse; quindi venendo a mancare la somministrazione di cortisolo
esogeno potremmo avere livelli ematici troppo bassi.
Attraverso l’attivazione di una cascata enzimatica si arriva alla produzione di
colesterolo, esso rappresenta una molecola fondamentale poiché costituito da uno
scheletro di ciclopentanoperidrofenantrene dal quale derivano:
Cortisolo
Aldosterone
Steroidi
17-idrossiprogesterone
Ipercorticosurrenalismo
L’ ipercorticosurrenalismo può essere:
Primario in cui la noxa patogena è a carico del surrene Sindrome di Cushing
Secondario in cui vi è disfunzione a livello ipotalamo-ipofisario con ipersecrezione
di ACTH Morbo di Cushing
Talvolta possiamo avere produzione di ormoni da parte di organi normalmente
non secernenti, questo avviene in seguito a sviluppo di neoplasie per esempio il
microcarcinoma bronchiale secerne ACTH.
Manifestazione patologiche
Obesità centripeta soprattutto a livello del tronco con deposizione di grasso anche
a livello superiore della spalla, al volto (facies lunare) ; non vi è mai presenza di
grasso al livello degli arti.
Ipertensione
Ridotta tolleranza ai carboidrati quindi diabete. Il cortisolo è un ormone
iperglicemizzante, permette l’utilizzo del glucosio proveniente dal glicogeno
WWW.SUNHOPE.IT
epatico, attivazione della neoglucogenesi a discapito della componente proteica,
gli arti risultano assottigliati quindi avremo sproporzione tra arti e tronco.
Strie rubre per l’assottigliamento dei vasi dovuto a deposizione di proteine
Assottigliamento della cute
Ostioporosi
Edemi
Disturbi psichici
Agendo a livello della ciclicità di LH FSH può portare alla sterilità, nella donna
può causare anche amenorrea
Diagnosi
Dosaggio dell’ACTH e del cortisolo alle 7-8 del mattino da ripetere nel tardo
pomeriggio. Il ritmo di secrezione del cortisolo dovrebbe seguire il ritmo di
secrezione dell’ACTH.
Valutazione del cortisolo urinario; necessaria la raccolta delle urine nelle 24 ore.
La concentrazione del cortisolo ci permetterà di valutare le quantità di cortisolo
plasmatica anche dei giorni precedenti.
Test al desametasone, nel quale viene somministrato 1 mg di desametasone per
via orale tra le 23 e le 24 e viene misurato il cortisolo plasmatico tra le 7 e le 8 del
mattino successivo. Dopo questo test la maggior parte dei soggetti normali
sopprime il proprio cortisolo plasmatico del mattino, mentre la maggior parte dei
pazienti con sindrome di Cushing non ipofisaria mostra un livello di cortisolo
plasmatico del mattino piu alto. La somministrazione orale di 0,5 mg di
desametasone ogni 6 h per 2 giorni ("bassa dose") ai soggetti normali provoca
l'inibizione della secrezione di ACTH. Di conseguenza, il cortisolo libero urinario
generalmente diminuisce al 50% o meno rispetto ai valori precedenti al
trattamento. Nei pazienti con morbo di Cushing, la secrezione ipofisaria di ACTH
è relativamente resistente alla soppressione, pertanto il cortisolo libero urinario
non diminuisce in maniera normale. Quando la dose orale di desametasone viene
aumentata a 2 mg ogni 6 h per 2 giorni ("alta dose"), il cortisolo libero urinario
solitamente diminuisce almeno del 50% rispetto ai valori di partenza nei pazienti
con morbo di Cushing, il quale è dipendente dall'ACTH ipofisario.
Nei pazienti con tumori surrenalici la produzione di cortisolo è indipendente
dall'ACTH, pertanto il desametasone non ha effetti soppressivi. Nei pazienti con
sindrome da ACTH ectopico, la produzione di ACTH da parte del tumore non
ipofisario non viene quasi mai modificata dal desametasone, quindi gli steroidi
urinari rimangono invariati.
Test al CRH, viene somministrato CRH in seguito eseguiamo in dosaggio di ACTH
per per controllare la responsività. Se non vi è stata variazione delle
concentrazioni di ACTH vuol dire che esso è prodotto ectopicamente.
Ipocorticosurrenalismo
L’ipocorticosurrenalismo può essere:
Primario (Morbo di Addison) che si manifesta con iperpigmentazione
cutanea e mucosa(dovuta alla eccessiva quantità di ACTH che rappresenta
WWW.SUNHOPE.IT
un derivato della pro-opiomelanocortina) questa caratteristica può
scomparire in terapia
Secondario non si verifica iperpigmentazione poiché le concentrazioni di
ACTH sono basse.
Fattori che stimolano la secrezione di ACTH:
Corticotropina
Pasto abbondante
Ipoglicemia
Vasopressina
Fattori che inibiscono la secrezione di ACTH:
Cortisolo
Glucocorticoidi di sintesi
Dopammina
GABA
La terapia è uguale per la cura dell’ipocorticosurrenalismo sia di tipo primario
che secondario e consiste nella somministrazione di cortisolo.
TIROIDE
L’ipotalamo secerne TRH che stimola la secrezione di TSH, questo a sua volta
stimola la liberazione degli ormoni tiroidei T₃ e T₄. La maggior parte di questi
viaggiano nel plasma legati alle proteine plasmatiche, ma forma biologicamente
attiva è rappresentata dalle forme libere.
Il TSH è presente in concentrazioni che vanno dai 0,5 fino a 4 μU/ml.
Se un paziente presenta un valore pari a 5 μU/ml andiamo ad eseguire
un’ecotiroide che ci da informazioni sulla grandezza della tiroide, sull’eventuale
presenza di noduli. Se vi è presenza di noduli possiamo sospettare una tiroidite,
andiamo quindi ad effettuare la ricerca di anticorpi anti-tireoglobulina e antitireoperossidasi.
Se il nodulo è maggiore di un centimetro andiamo ad effettuare un ago aspirato
per eseguire l’esame citologico. Questo può permetterci di differenziare un gozzo
nodulare da una neoplasia. Il paziente che presenta gozzo nodulare viene trattato
con l’Eutirox, questa terapia è di tipo semisoppressivo per evitare l’attività di
fattori di crescita.
Ipotiroidismo centrale
Deficit di secrezione di TSH dovuto ad alterazioni a livello dell’ipofisi
Forme congenite dovute a difetti maturativi della ghiandola, agenesia, ipofisi
ectopica (posta più posteriormente con mancanza del collegamento all’ipotalamo)
Forme acquisite da trauma cranico, neoplasia, adenomi secernenti, ipofisite
In casi limite si verifica in zone a grave carenza iodica tipo Alto Adige, con forme
asintomatiche o paucisintomatiche. Il paziente avvertirà stanchezza , sonnolenza
presenterà edema e stipsi.
Nelle forme eclatanti avremo letargia, intolleranza al freddo, fragilità dei capelli,
costipazione, bradicardia (mancata stimolazione del sistema simpatico quindi con
WWW.SUNHOPE.IT
prevalenza dell’attività parasimpatica), mixedema (infarcitura dei tessuti con
mucopolisaccaridi e acqua).
Attualmente è difficile che si verifichi una insufficienza tiroidea nel neonato
poiché vengono fatti test di screening, diversamente dal passato in cui vi era un
elevato numero di nascite non ospedaliere. Se la madre si presenta con
ipotiroidismo intorno al primo mese di gravidanza il bambino avrà problemi di
tipo intellettivo. Se la madre sviluppa ipotiroidismo dopo il secondo mese di
gravidanza il bambino presenterà stanchezza, letargia, mixedema che condiziona
la respirazione (segno patognomonico). Se il bambino non viene curato avrà
problemi di accrescimento, bassa statura disarmonica.
GONADOTROPINE
Nei casi di ipogonadismo bisogna andare ad indagare per capire se si tratta di
ipogonadismo ipotalamico o ipofisario. Nella donna avremo amenorrea , nell’uomo
riduzione della libido e della spermatogenesi.
Ipogonadismo ipogonadotropo
Avremo bassi livelli di FSH e LH, di estrogeni nella donna, di testosterone
nell’uomo. Se si verifica nella fase prepubere non si avrà lo sviluppo dei caratteri
sessuali secondari.
Nella Sindrome di Kallmann all’ ipogonadismo ipogonadotropo si associa anosmia
dovuta a mancata migrazione delle cellule olfattive. Vi è un difetto dei geni Kal1 e
Kal2
Ipogonadismo ipergonadotropo
Nella donna in menopausa avremo elevati livelli di gonadotropine con bassi livelli
di estrogeni. Può essere causa di pubertà precoce che è lo sviluppo sessuale in
età non fisiologica ( fino ad 8 anni, dagli 8 anni in poi si parla di pubertà
anticipata). Gli individui si presentano più alti. Con una ecopelvica nella bambina
si evidenzia un utero con conformazione simile a quella della donna
adulta(dilatato nella parte alta) che ci dimostra la già avvenuta azione degli
estrogeni. La terapia viene fatta con somministrazione di Decapeptyl ogni 28
giorni. Questa terapia va fatto fino al raggiungimento dei 10 anni di età.
Diabete insipido
Inadeguata o assente produzione di ADH. Avremo poliuria, polidipsia, urine
insipide (negli anni precedenti le urine venivano “assaggiate”). Esso può essere di
origine centrale (neurogeno) o periferica (nefrogeno), nella forma congenita o
acquisita. Per fare diagnosi viene dosato l’ ADH, se è in difetto si esegue il
dosaggio di AMPc.
Si può avere anche una ipersecrezione di ADH o secrezione in sede ectopica
Possiamo avere malformazione ad esempio
Sella vuota vediamo i contorni vuoti poiché l’ipofisi molto piccola poggia
direttamente sul pavimento della sella
Ipofisite linfocitaria
Ipopituitarismi da radiazioni
WWW.SUNHOPE.IT
ENDOCRINOLOGIA
Prof.ssa De Bellis
18/10/2013
Amoroso Mariangela
I surreni sono una coppia di ghiandole situate sopra i reni. Sono organi importanti per la
sopravvivenza.
Ogni surrene è costituito prevalentemente da due parti : MIDOLLARE (20%) e CORTICALE (80%).
La midollare produce e secerne catecolammine, che sono svincolate dall’ipofisi, essendo ormoni
del SNC.
La corticale è suddivisibile in tre zone :
- GLOMERULARE : secernente aldosterone
- FASCICOLATA: cortisolo
- RETICOLARE: steroidi sessuali
Il corticosurrene secerne oltre 50 tipi di ormoni tra attivi, non attivi e derivati. Diversi per struttura
chimica e attività funzionale . Noi analizziamo solo i più importanti .
Il più importante è il cortisolo.
Gli ormoni steroidei derivano da un precursore comune : il colesterolo . Sono liposolubili . In
parte sono legati alle biding-protein , tale parte è la quota biologicamente non attiva ( funzione di
deposito in caso di richiesta ).
Sempre per scissione della molecola principale che è il colesterolo, attraverso tre vie si giunge :
1. All’aldosterone
2. Al cortisolo
3. Agli androgeni
Analizziamoli, un gruppo alla volta.
ACTH e CORTISOLO
L’ACTH prodotto a livello ipofisario agisce sulla ZONA CORTICALE (fascicolata). Questo implica che
in caso di carenza la terapia viene effettuata solo con CORTISONE, non anche con ormoni mineral
attivi.
A livello ipotalamico abbiamo ormoni che stimolano il rilascio di ACTH :
1.CRH
2.VASOPRESSINA
Inoltre vi sono altri fattori che stimolano tale rilascio :
- bioritmo giornaliero
- feedback retroattivi
- stress e altri fattori corticali e ipotalamici
- pulsatilità
Che ritmo ha la secrezione di cortisolo ? Circadiano.
WWW.SUNHOPE.IT
Durante tutta la giornata il cortisolo diminuisce per risalire a mezzanotte ( circa ) ed essere
elevato la mattina ( alle 8.00 circa). Questo ricordatelo perché ci serve per capire la ragione dei
test diagnostici.
Ora, cosa influenza la secrezione di ACTH ? In un soggetto dove l’asse Ipotalamo-ipofisario è
completamente integro , il cortisolo stesso.
Quindi cosa influenza la secrezione di cortisolo ?
STRESS di ogni tipo
- stress fisico
- ipoglicemia : questo dato è importante perché viene utilizzato in diagnosi . Si somministra 0,1 mg
di insulina per kg di peso corporeo e si valuta la glicemia
- traumi
- esposizioni a basse temperature
- eccessivi sforzi fisici
- stress psicologici ( ansia acuta, anticipazione di eventi pesanti come sostenere esami universitari)
Quali sono le principali azioni del cortisolo ? il cortisolo è essenziale per la vita !
- Potente antiinfiammatorio
- Forte immuno soppressivo
- necessario per la maturazione del feto
- aumento della lipolisi
- aumento catabolismo muscolare ( quindi liberazioni di amminoacidi )
- aumento glicemia
- inibizione formazione delle ossa
- mantenimento del tono vasale
ALDOSTERONE e AZIONE
L’aldosterone è un ormone mineralattivo
Insieme al altri ormoni mineralattivi è deputato:
- al controllo della pressione arteriosa
- alla omeostasi del Sodio ( aumento del Sodio a livello del tubulo renale e consequenziale
aumento della volemia ) e del Potassio ( aumento escrezione tubulare )
- al controllo del volume dei fluidi extracellulari.
Adenomi funzionanti che producono esclusivamente aldosterone ( ALDESTERINOMI) , causano
crisi ipertensive( ipertensione stabile ) . L’iperaldosterismo non porta segni specifici a differenza
dell’ipercorticossurrenalismo .
Dovete sapere poi che esiste un prodotto che induce livelli alti di aldosterismo. Sapete qual è ? La
liquirizia .
WWW.SUNHOPE.IT
Questo è utile ricordarlo nella vostra carriera di medici perché è una curiosità che va domandata al
paziente in quanto non di rado può permettervi di fare diagnosi .
STEROIDI SESSUALI
( Andreogeni surrenalici – deidropiandrosterone DHEA, DHEAS e androstenedione)
Sono deputati alla determinazione e mantenimento dei caratteri sessuali secondari. Hanno
importanza in mancanza di ormoni sessuali prodotti a livello ovarico e testicolare ,in tentativo di
compenso .
Riescono a produrre una piccola quantità di estrogeni,ma non capace di equilibrare l’asse.
Nell’uomo hanno azione ancora più debole.
Una iperproduzione di androgeni può essere osservata in : tumori ovarici,ovaio micropolicistico (
le cisti ovariche producono androgeni ).
Notate bene che nei soggetti in postmenopausa per valutare il grado di osteoporosi o osteopenia
si effettua non solo la MOC, ma anche altre indagini come :
- calciuria
- valutazione livelli ematici di vitamina D
- calcemia
- livelli di fosforo
IPERCORTISOLISMI : CLASSIFICAZIONE
a)
b)
c)
d)
e)
-
Patologia ipofisaria (80% adenoma) associata a
iperplasia surrenalica diffusa
iperplasia surrenalica micro nodulare
iperplasia surrenalica macronodulare
iperplasia corticotropa primaria
Produzione ectopica di ACTH
Produzione ectopica di CRF
Somministrazione esogena di ACTH
Patologia surrenalica:
tumori surrenalici:
adenoma singolo
adenomi multipli
carcinoma
- displasia nodulare primitiva (autoimmune)
f) Somministrazione esogena di steroidi
g) S. da pseudocushing (depressione, alcolismo)
Nella donna si osserva una distribuzione maschile dei peli.
Forme iatrogene :
forma pseudocushing : fasi avanzate di depressione e fase avanzata di alcolismo
SINDROME DI CUSHING .
Definizione : quadro clinico sostenuto da eccesso cronico di glicocorticoidi.
In sostanza, aumento cronico di livelli ematici di cortisolo.
E’ una condizine molto rara ( 8-10 casi conclamati su un milione, più frequente nelle donne che
negli uomini).
Spesso diagnosticato come INCIDENTALOMA : Formazione che si riscontra occasionalmente in
corso di indagini al altri livelli . Chiaramente pensate al fatto che la donna fa indagini più
frequentemente a livello addominale, rispetto ad un uomo, ad esempio per la valutazione delle
WWW.SUNHOPE.IT
ovaie o dell’utero. In queste occasioni è facile che venga fatta una diagnosi di patologia
surrenalica.
Quando sospettare ipercortisolismo ?
a) In caso di ipertensione arteriosa
b) In caso di diabete mellito
c) Osteoporosi/rachialgia
d) Disturbi dell’umore
e) Alterazione ciclo mestruale
f) Comparsa di irsutismo/acne
g) Riduzione della libido
Notate bene che il cortisolo ha azione diabetogena, anti insulinica . Ciò va a discapito di lipidi e
amminoacidi. Questo è un dato importante per comprendere alcuni segni di tale patologia come
l’obesità tronculare e l’ipotrofia muscolare.
Altri segni sono le strie rubre, e ancora la fragilità vasale che può portare ad ecchimosi , varici e
ulcere.
Il quadro clinico della S. Cushing è caratterizzato da una estrema variabilità
I segni ed i sintomi sono di entità variabile e variamente associati fra di loro
Tale variabilità dipende:
• Dall’entità dell’ipercortisolismo
• Dalla durata dell’ipercortisolismo
• Dalla sensibilità individuale al cortisolo
• Dalle secrezioni steroidee associate
Riassumendo , valutiamo i SEGNI e SINTOMI ( frequenza )
-
Obesita tronculare( 90 %)
Facies lunare (88%)
Ipertensione arteriosa( 80%)
Irsutismo (80%)
Ipogonadismo (amenorrea, impotenza)( 75%)
Osteoporosi (65%)
Astenia (65%)
Ridotta tolleranza ai carboidrati (65%)
Strie purpuree (60%)
Fragilita vasale (60%)
Acne (55%)
Rachialgie (50%)
Alterazioni psichiche( 45%)
Scompenso di circolo (22%)
Iperpigmentazione ( solo nelle forme ACTH-dipendenti) (6%)
Quali sono gli esami di screening ?
1. Valutazione ritmo circadiano ore8.00 e ore16.00 . Orario comodo per i laboratori che
solitamente accettano entro questo orario. Ma se il soggetto è ospedalizzato, è preferibile
effettuare la valutazione su prelievo alle ore 21.00 circa
2. Cortisolo libero urinario sulle 24 ore: modalità di esecuzione . Il pz è invitato a raccogliere
la quantità totale di urine di tutta la giornata . Valutare il quantitativo totale nelle 24 ore.
Portare solo un vasetto di urine come campione , ma riferire il quantitativo totale in modo
WWW.SUNHOPE.IT
tale che il laboratorio possa calcolare la concentrazione sul totale . Questo è un esame
fondamentale anche perché ci permette di valutare informazioni anche sul tempo indietro
al giorno della raccolta e della valutazione .
3. Test al desametasone ( agonista del cortisolo) : effettuato specialmente per uno screening
differenziale. Somministrazione di 1 mg di desametasone alle ore 23.00. La mattina stessa
della somministrazione effettuare un prelievo inziale per valutare i livelli basali di cortisolo .
Valutazione di livelli alle ore 9.00 del mattino seguente a digiuno.
Corretta inibizione del cortisolo: 140 nmoli/litro
40 nmoli/litro
4. Esami strumentali : RMN ipofisaria,TC surrenalica
Riassumendo, quindi, osserviamo le linee guida del PROTOCOLLO DIAGNOSTICO
1. Definire l’entità dell’ipercortisolemia e valutare i livelli di ACTH
2. Valutare la conservazione del bioritmo ACTH,cortisolo
3. Valutare la capacità del desametazone di
sopprimere la sintesi del cortisolo
Test soppressione con
desametazone (1-2-mg)
4. Valutare l’integrità di secrezione dell’ACTH Test CRF
5. Esaminare la morfologia dell’ipofisi e del surrene( Rx, TC,RMN)
7. Valutare eventuali risposte abnormi dell’ACTH :
- a stimoli non specifici
- ad agenti dopaminergici
- ecc.
Valutate bene i segni di laboratorio per la diagnosi di Cushing :
a) Forma primitiva : ACTH diminuito
b) Forma secondaria : ACTH aumentato
E’ inoltre raccomandabile effettuare una TC torace per evidenziare eventuali microcitomi o micro
tumori causanti produzione ectopica dell’ormone
Ritornando al test al desametasone valutiamo due diverse metodologia diagnostiche :
1. Test a basse dosi( test di Liddle a basse dosi) : 0,5 mg ogni 6 ore per 2 giorni
2. Alte dosi( test di Liddle ad alte dosi) : 2 mg ogni 6 ore per 2 giorni . Soppressione del 50%
nel normale e nella malattia di Cushing. Soppressione non significativa nella S. ACTH
ectopico e nel Cushing surrenalico.
Successiva valutazione del cortisolo libero urinario.
TERAPIA
SINDROME DI CUSHING
1) Adenoma surrenalico :
-CHIRURGICA : surrenectomia mono e bilaterale
2) Carcinoma surrenalico :
- Chirurgica: surrenectomia bilaterale
- Medica : mitotano
WWW.SUNHOPE.IT
3) Sindrome da ACTH ectopico :
-Chirurgica : spesso palliativa
-medica : chemioterapia,metirapone ecc
-radiante : convenzionale
MALATTIA DI CUSHING :
1) Terapia medica : risulta essere poco utile
2) Terapia radiante : convenzionale o con particelle pesanti
3) Chirurgica : ipofisectomia tran sfenoidale ( entrata d’accesso chirurgico: narici ).
WWW.SUNHOPE.IT
LEZ 21/10/13
PROF. SINISI
IPOTIROIDISMO
Oggi parleremo della Tiroide, in particolare dell’ipotiroidismo. L’endocrinologia non significa solo tiroide,
ma, nella pratica clinica e nella preparazione alla medicina generalista vedrete nei vostri milleottocento
pazienti patologie diverse, ma la maggior parte sarà tiroide. Ipotiroidismo è un argomento introduttivo per
tutte le altre patologie e vi serve anche per richiamare alcuni aspetti di fisiopatologia.
L’ipotiroidismo cos’è? Se noi vogliamo seguire un po’ l’argomento dobbiamo cercare di guardare il
problema spiegando cos’è l’ipotiroidismo, come possiamo fare la diagnosi, quali sono le cause e come
possiamo trattare questo ipotiroidismo. Normalmente se chiediamo al nostro vicino che non è medico, che
idea ha dell’ipertiroidismo risponderà: sono tutti gli aumenti di peso, può essere un handicap mentale ….
sono delle frasi comuni e quello su cui vi invito a ragionare è che dovete diventare tecnici e non fermarmi
ai luoghi comuni. La patologia va inquadrata nella sua complessità, anche se poi è monosintomatica o
anche se poi l’ipotiroidismo viene all’osservazione perché è sovrappeso, perché ha sempre freddo, perché
il bambino va male a scuola …... non dobbiamo escludere queste possibilità, ma come medici dobbiamo
conoscere tutte la sintomatologia , tutto il quadro clinico( Domanda d’esame).
L’ipotiroidismo è una mancata produzione degli ormoni tiroidei, per assenza della ghiandola tiroide o
perché la ghiandola non funziona. Può essere ipotiroideo perché l’arrivo ai tessuti e la trasformazione ai
tessuti, cioè il metabolismo periferico, non funziona. Può esser ipotiroideo perché questi ormoni sono
prodotti, sono trasportati, non entrano nella cellula e quindi noi abbiamo una difficoltà a raggiungere il
target; perché non entrano nella cellula oppure ci entrano ma i recettori non sono funzionanti, quindi una
mancata azione. Quindi se uno vi chiede un ipotiroideo lo diventa perché ? perché non ha la ghiandola,
perché la ghiandola non funziona, ce l’ha ma non funziona …. ma l’altra possibilità è che possono essere
prodotti gli ormoni, ma non raggiungono la periferia, perché il metabolismo periferico è alterato o perché i
recettori non ci sono. Ovviamente questo tipo di problema (mancanza degli ormoni tiroidei) è quello più
frequente. Le altre forme sono meno frequenti.
Allora vediamo il meccanismo di sintesi degli ormoni tiroidei.
Sono prodotti dalla Tiroide, prima in quantità principali sotto forma di T4, tiroxina, meno di T3. La T3 è
l’ormone attivo, che deriva dalla T4, ma può essere direttamente sintetizzato dalla tiroide. Questa sintesi
avviene per l’azione di alcuni enzimi, ma richiede inizialmente l’intervento del TSH e dello ioduro, come
primo elemento inorganico che entra nella ghiandola e deve essere poi inserito nella processo di sintesi.
Quindi sono indispensabili questi due attori (TSH e Ioduro), se no la ghiandola non funziona. Gli ormoni una
volta liberati, si legano alle proteine Albumina e TBG e vengono veicolati ai tessuti. Qui si staccano, entrano
nelle cellule e qui, trovati i recettori, sono utilizzati per tutti i processi. L’utilizzazione nei tessuti è
controllata da alcuni enzimi: D1, D2, D3. Questi enzimi sottraggono lo iodio agli ormoni, attivandoli,
trasformando T4 in T3, o disattivandoli, trasformando T3 in T2 o T4 in R-T3.
La tiroide è localizzata in superficie. Insieme al testicolo, è una ghiandola endocrina accessibile, visitabile e
questo è uno dei motivi per cui entra nelle patologie molto frequenti e le patologie a suo carico sono
particolarmente evidenti.
E’ una ghiandola superficiale, sotto la cartilagine tiroidea, davanti i primi 3 anelli tracheali. Dietro il lobo
sinistro c’è l’esofago, quindi un ingrandimento della tiroide comporta compressione tracheale ed esofagea.
Questo spaccato istologico (cfr slides) fa vedere la struttura della tiroide. I follicoli sono dei pozzetti, unità
funzionali tappezzati di cellule cuboidi, che sono delle cellule tiroidee, le quali racchiudono la colloide. La
colloide è un fluido fatto da liquidi, che sono elaborati dalla cellule tiroidee e che contengono gli ormoni
tiroidei. Tra questi follicoli, vedete anche le cellule parafollicolari. Queste derivano dalla cresta neurale cioè
WWW.SUNHOPE.IT
sono delle cellule neuro endocrine, diverse dalla cellule epiteliali tiroidee. Producono calcitonina, che
quindi è un ormone neuroendogeno. Queste ci interessano quando c’è una patologia tumorale delle
piccole cellule, calcinoma midollare…..(???).
L’unità funzionale tiroidea è fatta da una seria di attività e strutture che servono a captare lo ioduro dal
sangue, a trasportare lo ioduro all’interno, che poi diviene ione organico ad opera della perossidasi tiroidea,
e poi inserito nelle tirosine, cioè nei residui amminoacidici, proteici, della tireoglobulina. Poi diventano T3 e
T4. Queste vengono disperse insieme al materiale colloideo in vesciole che poi si aprono nella colloide.
Quindi c’è questo meccanismo di trasporto, di sintesi, di immissione di materiale colloideo, poi la cellula
capta le vescicole, le idrolizza e rilascia gli ormoni nel sangue. Quindi c’è questa specie di ricircolo continuo.
La struttura degli ormoni tiroidei deriva dal residuo tirosinico, che è un amminoacido, il quale viene
poliiodato e viene combinato con un altro residuo a formare la tiroxina, la quale ha 4 atomi di iodio. La T3
ha un atomo di iodio in meno in posizione 5. La T3 è l’ormone attivo e viene formato ad opera di una
deiodasi, che stacca l’atomo di iodio in più. La R-T3 è simile alla T3, però lo ioduro sta in posizione 5’, ma
manca in posizione 5. Questa si chiama Reverse T3 ed è spettrale alla T3 ed è inattiva. La R-T3 si forma in
periferia, quando abbiamo la necessità di ridurre la quantità di ormone tiroideo. Per esempio in malattie
croniche, in malattie cardiovascolari, infartuali … hanno una Reverse T3 più alta e una T3 più bassa.
L’organismo si difende producendo una sostanza inattiva . Questo è dovuto all’azione di una deiodasi.
Bisogna ricordare queste molecole principalmente per la loro funzione.
E’ importante il NIS, cioè il simporter Na - Ioduro, la proteina che ha la funzione di captare lo ioduro e di
portarlo dentro la cellula. Perché ci deve stare questa proteina? Perché la cellula tiroidea è ricchissima di
iodio di per sé. Se noi dobbiamo introdurre altro iodio, che è iperconcentrato nella cellula, dobbiamo
spingerlo dentro utilizzando una forza attiva. E questa è l’azione del NIS, cioè far concentrare quanto più è
possibile lo iodio nella cellula e tutto ciò è indispensabile perché il meccanismo di sintesi degli ormoni
funzioni.
Il meccanismo funziona, oltre che per la presenza di ioduro, principalmente perché stimolato dal TSH.
Questo è l’ormone tireotropo prodotto dall’ipofisi e sotto il controllo dell’ipotalamo, sotto il controllo del
TRH. Il TSH regola tutta l’attività del tireocita, ma essenzialmente la captazione dello ioduro (NIS) e la sua
organificazione, cioè l’attività della perossidasi. Quando lo ioduro è stato perossidato, tutto il processo a
valle va per conto suo.
Come in tutta l’endocrinologia, gli ormoni periferici liberati vanno a controllare, attraverso un meccanismo
a feedback negativo, la secrezione del TRH e del TSH. Quindi abbiamo un circuito dove l’ormone viene
prodotto sotto lo stimolo di un ormone superiore, TSH, e quello stesso ormone periferico va a
autocontrollarsi. Questo si chiama asse ipotalamo-ipofisi-ghiandola bersaglio e ci spiega una cosa molto
semplice, che quando la tiroide non funziona abbiamo un incremento del TSH. Però possiamo avere un non
funzionamento dell’ipotalamo e avremo carenza degli ormoni tiroidei, ma anche dell’ormone centrale.
Avremo i due prototipi dell’ipotirodismo, quello centrale, dove il TSH è basso, e quello periferico dove il TSH
è alto.
La struttura del TSH è fatta da due catene polipeptidiche: alfa e beta. La fusione di queste due catene, da’
una molecola attiva. Però l’alfa è comune al LH, al FSH e al HCG, che stanno ad indicare gli ormoni trofici
per le gonadi. La subunità Beta invece è propria e permette al TSH di agire sui suoi recettori. Però la
somiglianza strutturale fa si che un eccesso di TSH può andare a stimolare i recettori di questi ormoni
gonadici o un eccesso di questi ultimi, soprattutto HCG, che si produce durante il primo mese di gravidanza
o durante una neoplasia, può determinare una stimolazione eccessiva della tiroide.
WWW.SUNHOPE.IT
Nell’organismo ci sono circa 9g (8,850mg) di iodio. Di questi, 8 g sono presenti nella tiroide. Questo ioduro
lo prendiamo dall’alimentazione, principalmente dall’acqua. Lo eliminiamo, ogni giorno, attraverso le
urine, circa 500 microg, e le feci, 150 microg. Con l’alimentazione dobbiamo ripristinare almeno questi 500
microg, altrimenti abbiamo un progressivo impoverimento della quantità presente nel corpo, che quando è
scesa al disotto di un certo livello, soprattutto lo ioduro nella tiroide, si blocca la biosintesi. Questo vi spiega
perché noi dobbiamo apportare attraverso l’alimentazione lo ioduro. L’utilizzo del sale iodato è l’unico
modo per garantire un apporto costante di ioduro, altrimenti, visto che non conosciamo quello che c’è
negli alimenti, come succedeva nella arie di endemia gozzigena, la ghiandola non riceve abbastanza iodio, si
bloccava e, stimolata dal TSH, si gonfiava. Lo ioduro, attraverso la pioggia e il ciclo dell’acqua, arriva al mare
e dal sale marino noi lo rintroduciamo attraverso gli alimenti, attraverso l’acqua. Se noi viviamo in una
zona autonoma dal punto di vista idrico e quella zona è carente di iodio, noi abbiamo un apporto di iodio
minimo e diventiamo una zona di endemia gozzigena. Naturalmente questo è più difficile oggi per la
diffusione del sale e perché mangiamo cibi provenienti da un po’ tutto il mondo.
Il fabbisogno di iodio varia a seconda dell’età….
Adult
150 mg/day
Pregnancy
220 mg/day
Lactation
290 mg/day
Children
1-3 yrs
70 mg/day
4-6 yrs
90 mg/day
7-10 yrs
120 mg/day
Newborns
40 mg/day
…. Nella gravidanza, il fabbisogno deve essere aumentato di un terzo, perché il fabbisogno ghiandolare
aumenta e c’è anche il feto da rifornire, lo stesso nell’allattamento. Nei bambini la quantità di iodio è
minore.
Quindi se io non apporto sufficiente iodio, nelle condizioni di deficienza iodica, succede che la tiroide
produrrà poca T4, quindi aumenta il TSH, il quale stimola la tiroide, che diventa grossa e si chiama gozzo,
termine che sta ad indicare l’ingrandimento semplice o nodulare della tiroide. Dare iodio significa ridurre
questo fenomeno, ridurre l’endemia gozzigena.
Sul trasporto bisogna ricordare che la TBG è la proteina, la globulina più importante del trasporto, perché
ha la massima affinità con l’ormone tiroide, però altre proteine sono coinvolte nel trasporto: la trantireina,
che è una pre-albumina, e l’albumina. Quest’ultima è quantitativamente importante. Quindi quando
abbiamo una discrasia ematica, per esempio una cirrosi, la proteine più importante che si abbassa è
sicuramente l’albumina e questo ha sicuramente un’implicazione notevole sulla quantità di ormone che
viene trasportato. Il 99,9% della T4 è legata, cioè solo lo 0,1% è libero, ciò significa che noi abbiamo un
meccanismo tale che tiene a freno l’ormone tiroideo. A noi basta una minima quantità, che raggiunge i
tessuti. Quindi la quota libera (0,1%) è quella libera dalla TBG o dalla albumina.
Questa quota libera viene trasportata all’interno delle cellule ad opera di trasportatori, tra cui c’è la MCT8,
che quando è mutata da’ una forma di ipotiroidismo. Questi trasportatori portano all’interno l’ormone
tiroideo, T3 o T4, che raggiunge il nucleo e, una volta che la T4 è diventata T3, va ad attivare il recettore.
WWW.SUNHOPE.IT
Questi è un recettore nucleare, che quindi agisce sul Dna attraverso un legame su una parte accettrice del
Dna e richiede la cooperazione di un altro recettore, RXR, che è un recettore per l’acido cis-retinoico.
Questo significa che l’ormone, per agire, deve legarsi al proprio recettore , il quale deve dimerizzarsi con
RXR, e facendo questo è capace di attaccarsi sul sito di binding del Dna e di indurre la trascrizione.
Qua si inserisce il discorso delle Desiodasi. Quando la T4 entra nella cellula, viene trasformata ad opera di
queste due desiodasi, D1 e D2, ma in particolare la D2, in T3. Perché noi possiamo stare bene dobbiamo
avere la ghiandola che produce l’ormone, la proteina che lo trasporta alla cellula target, la proteina che lo
trasporta dentro la cellula target, e poi l’ormone deve essere attivato e diventa T3 ad opera della
Desiodasi2. Se invece interviene la D3 sulla T4, abbiamo la R-T3, l’ormone inattivo, quindi il gioco che
avviene nella cellula è mediato dalla quantità di D2 e D3 che abbiamo. Se nella cellula c’è molta D2, allora
questa è una cellula che può attivare l’ormone, se ha D3 lo inattiva. …. La D3 è la desiodasi inattivante
sempre, sia se agisce sulla T4, che diventa RT3, sia sulla T3, che diventa T2.
L’azione della T3 sulla cellula target determina la trascrizione genica, controllando la crescita e lo sviluppo
del SNC (ecco perché se abbiamo carenza ormonale nel feto avremo cretinismo e il deficit intellettivo), va
ad agire sul sistema cardiovascolare, va ad agire sul metabolismo, sul colesterolo, sulla glicolisi e sull’azione
dell’insulina. Questi effetti sono legati ai recettori alfa e delta. Possono avere una localizzazione diversa, ma
agiscono con lo stesso meccanismo, cioè quello di legare la T3 al recettore, attacco ad un altro recettore
RXR, quindi si forma un dimero, e poi l’attacco al Responsive Element, che si chiama TRE (non è la marca
telefonica…….), cioè l’elemento responsivo per il recettore tiroideo.
Gli effetti sono condizionati dall’espressione dei singoli recettori. Se i vari recettori sono espressi in maniera
quantitativa diversa a seconda del fegato, del sistema uditivo, gusto, del cervello, dell’osso e del cuore ….
Per esempio nel cervello c’è molto alfa. Questo significa che la risposta dei tessuti poi non è dovuta solo a
quanto ormone arriva, ma anche a quanto e che tipo di recettore c’è. Questo l’abbiamo capito studiando le
mutazioni dei recettori, cioè se una mutazione in beta, può determinare una mutazione più di tipo
metabolico, che non cardiaco, il paziente aveva tachicardia ma non aveva insufficienza epatica … le
manifestazioni cliniche non sono sempre le stesse, ecco perché il paziente non ha sempre la stessa
sintomatologia. C’è quello che ingrassa di più, quello che ha problemi cardiovascolari… Tutto ciò dipende,
oltre che dal suo strato genetico, anche dalla distribuzioni differenziale di questi recettori.
Classificazione Ipotiroidismi:
L’ipotiroidismo lo chiamiamo primario, quando il danno riguarda la tiroide, ma primario è anche il deficit
periferico, dovuto alla mancata azione degli ormoni, perché è alterato il metabolismo o perché non ci sono i
recettori. E poi abbiamo la forma secondaria, cioè un danno ipotalamo-ipofisario in cui c’è un deficit del
TSH. Tra queste due forme quella che prevale è il deficit primitivo della tiroide, che rappresenta più del 90%
dei pazienti ipotiroidei.
L’ipotiroidismo primario sarà caratterizzato da T3/T4 bassi e TSH elevato. Noi utilizzeremo il termine T3 e
T4 come “unicum”, ma in realtà nella pratica utilizziamo le Frazioni libere, FT3 e FT4, per quello che
abbiamo detto prima, cioè lo 0,1% che è libero è quello che ci interessa.
Nelle forme secondarie T3 e T4 lo stesso sono bassi, perché permane la carenza funzionale, però il TSH sarà
basso, perché è compromessa la secrezione centrale.
Il primario più frequente, il deficit tiroideo, è dovuto alla tiroidite autoimmune, alla chirurgia con
trattamento con radioiodio. Poi ci possono essere una serie di situazione particolari, per esempio le
malattie infiltrative, l’eccesso di iodio, i farmaci che bloccano l’attività tiroidea, la deficienza grave di iodio
ed errori congeniti della sintesi e del metabolismo dell’azione degli ormoni tiroidei, che sono errori basati
su mutazioni genetiche degli enzimi e dei trasportatori per cui il sistema non funziona. Quest’ultime è
responsabili delle forme congenite, che però sono una parte minima delle forme patologiche. Tra le
WWW.SUNHOPE.IT
malattie infiltrative abbiamo la tiroidite di riedel, la cistinosi, emocromatosi, malattie granulomatose che
localizzandosi nella tiroide ne provocano la distruzione.
Un accenno, perché è importante che lo conosciate, anche se materialmente ne incontrerete pochissimi
casi è la forma da resistenza periferica. Che è una forma di ipotiroidismo perché l’ormone non agisce.
Normalmente l’ormone agisce bloccando il TSH. Possiamo avere la resistenza globale, GRTH, resistenza
globale agli ormoni tiroidei, dove gli ormoni non agiscono sul tessuto periferico e non agiscono sulla ipofisi.
Quindi non c’è il feedback negativo e nemmeno l’azione periferica. La conseguenza è che il TSH non è
frenato ed è prodotto in grandi quantità. Cosi avremo il gozzo, che è la prima manifestazione, avremo T3 e
T4 elevati, perché la tiroide viene stimolata e funziona, ma, mancando il feedback, non si realizza quel
circolo di inibizione e avremo il paradosso che T3/T4 sono elevati e TSH è elevato. In periferia T3 e T4 non
fanno niente, perché mancano i recettori e quindi avremo il paziente ipotiroideo con i sintomi
dell’ipotiroidismo un po’ variegati, ma soprattutto al dosaggio troveremo sia T3/T4 sia TSH alti. Quindi
ricordate questo paradigma se no rischiate che tutte le volte, che vi capita una cosa del genere direte che
ha sbagliato il laboratorio.
Nell’altra forma parziale manca l’azione sull’ipofisi quindi non c’è freno di tipo feedback, quindi il TSH sarà
prodotto in grandi quantità, la tiroide si allarga, T3/T4 ci sono in giro, ma quando c’è il blocco l’ormone
agisce in periferia. Quindi le forme parziali sono dovuto alla mancanza del recettori alfa 1 sull’ipofisi, per cui
l’ipofisi non risponde, così abbiamo l’ipertiroidismo. Non è ipotiroidismo, ma la forma di resistenza è una
forma di ipertiroidismo, ma particolare, perché caratterizzata dall’incremento di TSH e di T3/T4. Quindi non
sempre il TSH elevato significa ipotiroidismo e non sempre l’ipotiroidismo è caratterizzato da T3/T4 bassi.
Le manifestazioni cliniche per le forme da resistenza sono differenziate rispetto alla forma classica, perché
abbiamo essenzialmente alterazioni cardiovascolari, comportamentali … sono bambini che hanno la cosi
detta sindrome iperattiva.
L’ipotiroidismo secondario può essere dovuto ad adenoma ipofisario, chirurgia ipofisaria, distruzione
ipofisaria per cui avremo una carenza degli ormoni ipofisari e quindi l’ipotiroidismo. Possiamo avere una
forma monotropinica, con deficit solo di TSH, o più spesso abbiamo carenza di più trofine. Il terziario si
considerava una volta, oggi rientra nel secondario ed è dovuto a deficit del TRH, anche se non si conosce.
La prevalenza nella popolazione generale dell’ipotiroidismo è di 0,25-1%, è un numero che dice molto e
non dice niente. A priori vi dico, che è abbastanza frequente e che dopo i 60 anni viene quadruplicata la
prevalenza. Raffrontando i valori con quelli del diabete, che colpisce il 3-5% della popolazione, e
dell’ipocorticosolismo, 1-2/100000 abitanti, una molto frequente e una molto rara, l’ipotiroidismo si
avvicina al diabete, soprattutto dopo i 60. Quindi è frequente perché colpisce 1% della popolazione totale
giovanile o pediatrica e il 2% nell’età anziana. Possiamo avere il 10% degli anziani con un TSH elevato, nelle
forme subcliniche. La gran parte dell’ipotiroidismo primario è dovuta alla tiroidite autoimmune, perché
questa colpisce il 15% nell’età scolare. Se noi prendiamo i bambini, dalla prima alla quinta elementare, e ci
facciamo un prelievo, il 15% avrà anticorpi anti tiroide, diciamo tiroidite. Questa tiroidite può restare silente
tutta la vita o evolvere verso l’ipotiroidismo nell’1% della popolazione. L’ipotiroidismo è una malattia
frequente, la principale causa è la tiroidite di Hashimoto ed è proprio l’elevata prevalenza della tiroidite di
Hashimoto a spiegarci perché l’ipotiroidismo è cosi frequente e peggiora la prevalenza con gli anni. Ci
spiega anche perché la malattia colpisce più le donne che gli uomini, 4:1, perché l’Hashimoto ha questa
differente distribuzione legata al sesso.
Gli ormoni tiroidei agiscono sul metabolismo energetico, aumentano il metabolismo basale, il consumo
d’energia e determinano la produzione di calore. Agiscono sul metabolismo lipidico, sul metabolismo
glucidico, sul sistema cardiovascolare, effetto cronotropo e inotropo positivo, aumentano la pressione
venosa differenziale, agiscono sul sistema nervoso centrale, sono importanti perché fanno differenziare i
neuroni e creano interconnessioni e hanno altri effetti sul sistema riproduttivo. Quindi la carenza di questi
WWW.SUNHOPE.IT
ormoni avrà effetti pleiotropici su tutto l’organismo ma soprattutto avrà manifestazioni importanti sul
sistema nervoso nel momento in cui abbiamo un danno congenito.
L’ipotiroideo avrà una sindrome da deficienza degli ormoni tiroidei e cosi un rallentamento di tutti i
processi metabolici. Gli effetti saranno diversi a seconda che compaiano in epoca embrionale, in epoca
neonatale o pediatrica, o nell’età infantile o nell’età adulta. Se il danno è congenito avremo come principale
compromissione quella dello sviluppo del SNC. Se invece è nell’età infantile, l’effetto lo vedremo sulla
crescita, i bambini che presentano ritardo di crescita o tendenza all’obesità sono bambini che possono
avere un deficit degli ormoni tiroidei. In età adulta prevarranno gli effetti metabolici, gli effetti sul sistema
cardiovascolare e poi l’altro fenomeno è il gonfiore, il mixedema.
La clinica sarà un difetto di crescita nel neonato o nel bambino/a in età pediatrica, sarà un problema
nell’orientamento delle proprie capacità, nelle proprie performance fisiche e mentali e sopratutto il
mixedema nell’età adulta.
Nel neonato vediamo il cretinismo, termine che oggi non si usa più. Il neonato che nasce ipotiroideo
presenta un aspetto particolare, con una lingua grossa, per questo ha difficoltà a gridare, piangere e a
succhiare, la cicatrice ombelicale ritarderà a rimarginarsi, presenta un ittero persistente, regge male la
testa. Questo bambino, se non è trattato, crescerà con un aspetto caratterizzato da bassa statura, faccia
inespressiva, che faceva definire questi soggetti “cretini”, ma che rispecchia un ritardo mentale evidente.
Questo fenomeno, a partire dagli anni 70’, non si vede più, perché abbiamo la diagnosi neonatale, che
permette di identificare l’ipotiroidismo e di trattarlo, evitando questa evoluzione.
La diagnosi è basata sul dosaggio di TSH, che sarà elevato, e FT4 basso. L’esame viene fatto sulla goccia di
sangue prelevata dal tallone alla nascita su cui si fa lo screening per la fenilchetonuria e l’ipotiroidismo. Il
laboratorio in 24 - 48 ore fa la diagnosi, invia al neonatologo questo referto, ma il neonatologo accorto, che
conosce questo quadro, avrà già iniziato il trattamento: quando arriva il referto dice “ok stavo sulla strada
giusta , continuo”, se invece il referto ci dice che non è ipotiroidismo, vuol dire che sarà un’altra patologia,
che mima questo aspetto e poi se ne parla. E’ importantissimo intervenire subito, cosi che avremo una
categoria di ipotiroidei che non hanno problemi, tranne qualche piccolo deficit intellettivo.
L’ipotiroidismo da difetto congenito, che è formato in età pediatrica oppure si sviluppa in epoca pediatrica,
può essere dovuto all’aplasia/emigenesia della tiroide, talora è associato a gozzo, quindi c’è la tiroide gonfia
perché c’è un’alterazione della sintesi degli ormoni tiroidei, può associarsi alla sordità, e questo si chiama
sindrome pendrinica …. che è dovuta alla mutazione di un gene, che si chiama pendrina, importante per il
processo di liberazione dell’ormone tiroideo, ma che è anche espresso nella coclea, per cui sono bambini
sordo-muti.
La carenza di iodio si definisce in base all’escrezione urinaria della molecola:
DEFICIT I
-
ESCREZIONE URINARIA I
ug/L
NO
100-200
BASSO
50-99
MODERATO
20-49
SEVERO
<20
Il deficit, nelle forme severe, è caratterizzato da gozzo.
WWW.SUNHOPE.IT
Le manifestazioni dell’ipotiroidismo infantile sono il deficit intellettivo, meglio definito come deficit di
performance scolastica, bambini che vanno male a scuola. Se il deficit di resa è immotivato, è giusto
chiedere il dosaggio degli ormoni tiroidei. Un altro elemento caratterizzante è il rallentamento della
crescita, la bassa statura. Possono avere anche attivazioni gonadiche: le donne hanno una pubertà
ritardata, i maschietti una pubertà precoce. La causa più comune, in età infantile, resta sempre la tiroidite
di Hashimoto, seguita da deficit di iodio e asportazione della tiroide, che però sono molto più rare. Altro
elemento caratterizzante è l’obesità in età infantile. Quindi obesità, bassa statura e scarsa resa scolastica,
fate sempre il TSH e FT4.
Possiamo avere dei quadri sindromici, per esempio la sindrome di Down, la sindrome di Turner, la sindrome
di Klinefelter, dove il quadro è dominato dalle manifestazioni di queste sindromi e c’è anche
l’ipotiroidismo. Naturalmente un bambino ipotiroideo va anche inquadrato per escludere queste particolari
sindromi.
Le manifestazioni dell’ipotiroidismo nell’adulto sono : sintomi generali, quali intolleranza al freddo,
aumento di peso; i capelli sono radi, secchi, fragili; la voce diventa rauca cronicamente, non perché ha
parlato o fumato, per un ispessimento mixedematoso delle corde vocali . Al collo possiamo trovare il gozzo.
All’apparato cardiovascolare troviamo bradicardia, toni ridotti, ipertensione con aumento della diastolica. I
muscoli sono deboli, hanno riflessi ridotti. L’apparato gastroenterico è dominato da stipsi. Alterazioni del
ciclo e problemi in gravidanza per le donne. Le mani sono fredde, le unghie fragili, le palme delle mani
hanno un aspetto giallastro, carotenoide, per l’accumulo nel palmo. Possono avere la sindrome del tunnel
carpale, dolore alla mano dovuto ad alterazioni di tipo neurogeno e neuromuscolare. È più importante
andare a evidenziare il mixedema, nella regione tibiale, ma anche al viso, con aspetto particolarmente
gonfio e giallastro, amimico. Posso avere la sindrome cardiaca allargata, l’aia cardia del cuore è aumentata,
perché anche le fibre cardiache sono infiltrare di queste sostanze polisaccaridiche e possono avere
addirittura versamenti, con pericardite. Ciò si traduce in un ECG con ridotta frequenza, bradicardia, e
ridotta altezza del voltaggio a livello delle derivazioni precordarli. Il paziente ipotiroidei può essere
diagnosticato anche solo con il tracciato elettrocardiografico.
La tiroidite di Hashimoto è la principale causa dell’ipotiroidismo. E’ un’infiammazione cronica che va ad
infiltrare le plasmacellule e va rendendo atrofici i follicoli. Si chiama autoimmune, perché c’è un attacco
contro antigeni della tiroide, infiltrazione da parte di queste plasmacellule, distruzione dei follicoli, per cui si
ha l’ipotiroidismo . Si può avere una prima fase d’ipertiroidismo transitorio, che però non genera sintomi
sul paziente. Sono maggiormente predisposte le donne, i pazienti con sindrome di Down e di Turner, i
pazienti che hanno fatto uso d’interferone, che è un immuno-modulante, il quale attiva i processi
autoimmuni. Ovviamente il punto di attacco parte dall’espressione di antigeni che non vengono riconosciuti
come self. Tra questi antigeni contro cui si sviluppano gli anticorpi, ci sono quelli della tireossidasi, della
tireoglobulina, il recettore TSH. Mentre gli anticorpi contro i primi due antigeni, TPO e TG, non hanno un
ruolo patogeno, ma bensì di marcatori di indizio di tiroidite, come conseguenza della patologia, l’anticorpo
anti recettore TSH può avere anche un ruolo patogeno. Infatti, quest’ultimo può bloccare l’azione, la
funzione recettoriale, provocando l’ipofunzione della ghiandola, portandola all’atrofia e quindi
all’ipotiroidismo.
L’anticorpo anti recettore non lo cerchiamo mai nella tiroidite di Hashimoto o nell’ipotiroidismo, cerchiamo
solo gli anti-TG e anti- TPO, per identificare la patologia. Non lo cerchiamo, perché se ritroviamo la
positività al recettore, non sappiamo se è bloccante o stimolante (in questo caso darà l’ipertiroidismo). Per
questo, sul piano clinico, per decidere che fare, è inutile. Sapere che esistono 3 tipi di anticorpi non significa
doverli prescrivere tutti e tre con una spesa maggiore inutile.
WWW.SUNHOPE.IT
La tiroidite di Hashimoto è la causa dell’ipotiroidismo, ma non è sinonimo di ipotiroidismo, perché
addirittura potremmo avere una fase di ipertiroidismo, fase di normo -funzione o ipotiroidismo perché la
ghiandola si distrugge per ¾, oppure perché gli anticorpi anti recettori mi bloccano la funzione.
La tiroidite di Hashimoto è isolata se non c’è ipotiroidismo con ingrandimento della ghiandola. Questo tipo
di problema può associarsi ad altre manifestazioni autoimmuni, sia endocrine, che esocrine. Per esempio
ipofisite, malattia di Haddison, insufficienza ovarica precoce.
La principale manifestazione è l’infiltrazione di leucociti, che si vede all’ecografia. La ghiandola si mostra
disomogenea con macchie scure ipoecogena e non si distingue dal muscolo. Normalmente la tiroide è
isoecogena, di colore grigiastro. E poi la vediamo incrementata nell’apparato vascolare, con vasi molto
spessi .
E’ presente anche un’associazione con altre malattie autoimmuni non endocrine, per esempio l’artrite
reumatoide, il retto colite ulcerosa, l’alopecia o vitiligo. Quindi c’è una predisposizione nei pazienti con
queste patologie ad avere l’ipotiroidismo e viceversa.
E’ possibile anche la manifestazione dell’esoftalmo, perché deriva da un processo autoimmune.
La Diagnosi si basa principalmente sulla clinica, ma non basta, perché l’obeso, il bambino ritardato a scuola
o il marito che si sente un po’ gli occhi gonfi, non è detto che sia ipotiroideo.
Quindi si fa il dosaggio del TSH e del FT4 e FT3, gli esami routinari . Dosaggio degli anticorpi anti TPO e anti
TG, per sapere se c’è la tiroidite di hashimoto, che è una delle principali cause. L’ecografia ci fa vedere i
quadri tipici della tiroidite. Ovviamente se la causa è una tireoctomia, che il paziente non sa riferire, non
troveremo la tiroide. La scintigrafia, oggi, non si usa quasi più per la diagnosi, la possiamo fare in un
bambini che sviluppa l’ipotiroidismo e non ha gli anticorpi. Potrebbe avere la disgenesia della tiroide, per
esempio una tiroide sublinguale.
Il dosaggio ormonale principe per fare la diagnosi di ipotiroidismo è FT4 e TSH, perché c’è una relazione
stretta tra questi due ormoni, di tipo inversa. Gli americani fanno fare solo il TSH. E’ sbagliato perché
possiamo avere le forme secondarie e non lo sappiamo. Facendo tutti e due abbiamo la possibilità di
scoprire FT4 basso e TSH elevato, ipotiroidismo primario, FT4 basso e TSH normale o basso, ipotiroidismo
secondario. Quando però non c’è questa regola, questa concordanza, non ritenete l’esame laboratoristico
sbagliato, ma rinviate il paziente ad un osservatore più attento, perché potrebbe avere un quadro di
resistenza agli ormoni o una mutazione di alcuni geni, che vanno a compromettere la funzione degli
ormoni.
Il dosaggio del FT3 non serve quasi mai, lasciamolo agli specialisti e molti specialisti non sanno neanche
utilizzarlo.
Gli anticorpi da cercare sono gli anti-TPO e gli anti-TG. L’anticorpo anti recettoriale fatelo solo quando
sospettate l’ipertiroidismo.
La diagnostica per l’infanzia è suggerita da rallentamento della crescita, ritardo intellettivo, pieno se il
bambino non è stato trattato, ma più spesso è un ritardo scolastico, ritardo puberale, anticipato per i
maschi, FT4 basso e TSH elevato. Quindi ricerca degli anticorpi, che saranno positivi. Faremo l’ecografia
tiroidea per vedere se la tiroide c’è ed è ipoecogena. Se non c’è, faremo la scintigrafia con iodio 125 perché
potrebbe essere un’agenesia o una disgenesia, cioè una tiroide delocalizzata.
L’anticipo puberale nel maschio è dovuto alla comunione di una delle subunità del TSH con le
gonadotropine. Quindi un eccesso di TSH andrà a stimolare il testicolo, che è suscettibile alla stimolazione
anche a 2 anni. L’ovaio invece no, che comincia ad essere stimolabile alla pubertà.
La diagnosi nell’adulto è caratterizzata da sospetto clinico, con astenia, aumento ponderale, sonnolenza,
rallentamento intellettivo, anemia, ipertensione. Sono tutti segnali aspecifici che bisogna confermare con il
dosaggio di TSH e FT4.
Anomalie ematochimiche: glicemia e sodiemia ridotte, anemia, colesterolo elevato, movimento di CPK,
LDH, GOT e GPT, dovuti alla mancata azione degli ormoni su fegato e muscolo, prolattina aumentata,
omocisteina urinaria aumentata, proteinuria.
WWW.SUNHOPE.IT
Ci può essere anche un ipotiroidismo transitorio, quindi la diagnosi non è definitiva e questo avviene nelle
forme subacute, nella tiroidite post partum, nelle forme da farmaci, nelle forme da anticorpi bloccanti il
recettore, che possono scomparire.
Nel feto può essere dovuta all’ingestione materna di farmaci, per eccesso di iodio nella madre, per
presenza di anticorpi anti recettore materni, una TSHemia transitoria. Ricordiamo che ci possono essere
queste forme transitorie. La diagnosi neonatale significa la terapia, ma non è detto che il neonato sia
ipotiroideo a vita. Il bambino va rivalutato dopo un certo periodo di trattamento. In genere si fa nella prima
infanzia, verso i 2 o 3 anni, si sospende per poco tempo la tiroxina e si vede se la sua secrezione è attiva.
L’ipotiroidismo subclinico è caratterizzato da un TSH> di 4,5-5 uU/ml, che è il limite massimo, ma FT4 è
normale, non ci sono segni clinici, però questi normalmente sono ambigui. Immaginate una donna obesa
che dice “ ho il TSH a 5, sono ipotiroidea, perciò sono grassa, voglio la tiroxina”, questa è un’ipotiroidea
subclinica che non merita di essere trattata, perché la causa della sua obesità non è il TSH, ma è
semplicemente un fenomeno che va monitorato. Invece se noi andiamo a prendere i trattati per
ipotiroidismo, troviamo un 30% di over- treatment che non è giustificato. Più del 10% degli anziani hanno il
TSH elevato, ma FT4 normale. Questi non bisogna trattarli. Si dice in genere che quando il TSH è uguale a
10, non va trattato. Va trattato solo quando supera i 10 o quando la donna è incinta. In gravidanza è
importante trattare anche un ipotiroidismo lieve, perché è importante per la salute del feto . negli anziani
bisogna fare attenzione perché se diamo l’ormone tiroideo, facciamo più male che bene.
La Terapia è basata sulla tiroxina, ormone tiroideo di sintesi. Diamo la tiroxina, T4, e non l’ormone attivo, la
T3, perché quest’ultima ha un’emivita rapida e quindi bisognerebbe somministrarla ogni 6 ore. Se il
paziente si scoccia, visto che è una terapia cronica, non se lo prende o se salta qualche somministrazione,
avrà degli alti e bassi. Dando la T4, una volta che ho saturato le proteine di trasporto, creo una base, una
riserva, che progressivamente viene trasformata in T3 nei tessuti e quindi se il paziente dimentica un giorno
la somministrazione, non corre il rischio di diventare ipotiroideo. Tant’è vero che possiamo somministrare
la tiroxina anche in maniera discontinua, quello che è importante è la dose settimanale e darlo a digiuno al
mattino, perché l’assorbimento viene condizionato dall’acidità gastrica e dal cibo.
Il monitoraggio della salute del nostro paziente, prima di tutto, è la clinica. Il paziente ci dice che sta meglio,
è dimagrito, ha perso il gonfiore al viso. Testare il paziente dopo circa 6 mesi. L’altro test che fate è il
semplice dosaggio ormonale del TSH, che ci monitora la ripresa del controllo e della secrezione a livello
ipofisario. In altre forme secondarie, dove il TSH non si produce, monitoro FT4.
WWW.SUNHOPE.IT
ENDOCRINOLOGIA 28/10/13 (Prof.ssa De Bellis)
Ginevra D’Onofrio
MORBO DI ADDISON
Il morbo di Addison è una condizione legata alla distruzione bilaterale dei due surreni. Tale lesione è
responsabile dell’inadeguata produzione di ormoni corticosurrenalici. Il morbo di Addison è stato scoperto da
un chirurgo dell’800 Thomas Addison, che dopo aver perso un pz durante un intervento, notò in campo
autoptico che tale pz aveva entrambi i corticosurreni atrofici o ipotrofici. Del morbo di Addison esiste una
forma acuta e una forma cronica. Quella acuta si instaura rapidamente rispetto a quella cronica che si
verifica in un lasso di tempo maggiore. Tra i sintomi dell’iposurrenalismo abbiamo astenia, adinamia,
ipotensione, stanchezza, ipoglicemia a cui si aggiunge in caso di età prepuberale mancato accrescimento.
L’iperpigmentazione cutanea distingue l’insufficienza surrenalica primaria da quella secondaria.
INSUFFICIENZA SURRENALICA PRIMARIA ACUTA(crisi surrenalica)
Dovuta a emorragia ,necrosi, infezioni ,in particolare da meningococco, coagulopatie, terapia
anticoagulante, patologie autoimmuni. Il neonato può avere, in seguito a parto difficoltoso, traumi e ipossia
che possono portare emorragia massiva al surrene. Nei pazienti che hanno subito un intervento chirurgico e
che sviluppano una CID si può avere un infarto emorragico delle surrenali. In corso di batteriemia, si può
avere una massiva emorragia surrenalica, che delinea la cosiddetta sindrome di Waterhouse-Friderichsen
Questa sindrome è caratterizzata da:
- Diffusa setticemica, che poi si propaga anche al corticosurrene più spesso causata da meningococchi, ma
occasionalmente anche da gonococchi, pneumococchi e stafilococchi
- Ipotensione rapidamente ingravescente, fino allo shock
- CID con porpora cutanea disseminata
-Insufficienza corticosurrenalica acuta associata a emorragia massiva corticosurrenalica bilaterale.
INSUFFICIENZA SURRENALICA PRIMARIA CRONICA (M. ADDISON)
Il m di Addison è molto raro. L’eziologia era riconducibile, fino al dopoguerra, alla patologia tubercolare e le
forme di natura non tubercolare erano considerate idiopatiche. Oggi si sa che l’eziopatogenesi prevalente è
quella autoimmune (oltre il 70 %) con una frequenza di casi maggiore nelle femmine ,come accade per la
maggior parte delle malattie autoimmuni probabilmente per effetto protettivo del testosterone negli uomini.
L’esordio solitamente è verso i 30 anni, anche se può talvolta verificarsi in giovane età associato a sindromi
poliendrocrine.
Cause del morbo di Addison primitivo:
congenito:
-Deficit congeniti della steroidogenesi surrenalica
-Deficit familiare isolato per i glucocorticoidi
-Ipoplasia surrenalica congenita
-Adrenoleucodistrofia
acquisito:
-Iatrogeno (dopo terapia protratta con steroidi ,la sospensione può determinare un iposurrenalismo iatrogeno.
WWW.SUNHOPE.IT
Per evitarlo la sospensione degli steroidi deve essere graduale e progressiva ) :
Post-chirurgico
Post terapia radiante
Post- terapia con inibitori enzimatici
Post- terapia con agenti citotossici
-Tumori primitivi o metastatici
-Ischemia, ipossia, emorragia
-Malattie infettive :
Miceti
Tubercolare
In corso di AIDS
Adrenalite da CMV,da micobatteri atipici e da miceti
Infiltrazione surrenalica da sarcoma di Kaposi
Mutazioni recettore ACTH
Esistono delle mutazioni a carico del recettore dell’ACTH responsabili del mancato riconoscimento e legame
con l’ACTH. Poichè il recettore non può trasdurre il segnale si ha un ipocorticosurrenalismo a valle. Queste
mutazioni sono trasmesse con meccanismo autosomico recessivo ed il paziente può essere omozigote per la
mutazione o eterozigote per due diverse mutazioni .
Ipoplasia congenita surrene
Una rara condizione familiare che si può verificare già in epoca neonatale oppure infantile in cui la corteccia
presenta un arresto dello sviluppo. Possiamo avere una forma sporadica oppure autosomico recessivo o X
linked associata a ipogonadismo o X-linked associata a deficit della glicerokinasi.
Quando si verifica nell’infanzia è più grave, talvolta però può anche presentarsi nel tempo,questo quando per
un periodo il corticosurrene riesce a sopperire al deficit. L’ipoplasia surrenalica congenita interessa sia il
surrene sia le gonadi,con ipogonadismo ipogonadotropo e ipocorticosurrenalismo.Il gene mutato è il DAX-1,
malattia X-linked e quindi si verifica nei maschi.
Deficit familiare isolato per i glucocorticoidi (IDG)
Legato a mutazioni del recettore dell’ ACTH oppure a difetti post-recettoriali come le mutazioni del gene
ALADIN, che caratterizzano la sindrome delle tre “A” che consiste nell’ associazione di insufficienza surrenalica
(Adrenal insufficiency), Acalasia e xeroftalmia (Alacrimia), talvolta Atassia. Malattia X-linked con un quadro
clinico simile all’insufficienza surrenalica con livelli di cortisolo bassi e di ACTH elevati, ma normale asse
renina-aldosterone
Adrenoleucodistrofia
Malattia X-linked, si verifica nei maschi mentre le donne sono portatrici. Il surrene va incontro ad una
progressiva ipotrofia che termina con atrofia. Si ha insufficienza corticosurrenalica. La malattia è dovuta ad
accumulo di acidi grassi a catena molto lunga che non vengono scissi perchè mancano gli enzimi che li
idrolizzano. Questi si accumulano a livello del surrene, del SNC e gonadi. Gli acidi grassi a catena lunga si
WWW.SUNHOPE.IT
ammassano a livello delle fibre mieliniche del SNC determinando così deficit motori,visivi,uditivi. Terapie
geniche e olio di lorenzo che può rallentare di poco il tempo di degenerazione.
MORBO DI ADDISON POST-TUBERCOLOSI
Prove alla tubercolina per stabilire se il soggetto ha contratto infezione a cui si aggiunge TAC addome e RM per
osservare microcalcificazioni da reliquati al surrene.
DEFICIT DI MINERALCORTICOIDI
Iposodiemia, iperkaliemia, ipotensione arteriosa (ortostatica), lipotimia
DEFICIT DI GLUCORTICOIDI
Astenia, adinamia, anoressia, nausea, vomito, calo ponderale, ipoglicemia, anemia, eosinofilia, linfocitosi
↑CRH ↑ACTH → Iperpigmentazione cutanea (Aree più esposte al sole,aree esposte a più pressione
(giunture), pliche palmari, periungueali, areole mammarie,mucose perivaginali e perianali, buccale, gengivale)
WWW.SUNHOPE.IT
A sinistra in alto abbiamo un surrene normale,accanto un surrene che appare ipotrofico in seguito a patologia
autoimmune,in basso a sinistra un surrene con piccole calcificazioni tubercolari e accanto un surrene con
accumulo di ferro dove la ghiandola appare più grande perché infarcita di ferro ma scompaginata all’interno.
In caso di Addison subclinico abbiamo un mantenimento a riposo di livelli di ormoni cortisolosurrenalici buoni.
Si fa il test dell’ACTH esogeno(ACTH per via im) e poi si valuta il cortisolo a tempo 0 30 60.In condizioni normali
abbiamo il picco del cortisolo al contrario in condizioni di insufficienza il cortisolo resta piatto.
ESAMI DI PRIMO LIVELLO
Glucosio
Bicarbonato
Sodio
Cloro
Cortisolo
17-chetosteroidi
17-irdossicorticosteroidi
Potassio
ACTH
PRA
(Attività Reninica Plasmatica)
ESAMI STRUMENTALI
•
La risonanza magnetica nucleare (RM) o la tomografia computerizzata (TC) addominale per la forma
primaria
•
La risonanza magnetica nucleare (RM) o la tomografia computerizzata (TC) dell’ipofisi o del
diencefalo nelle forme secondarie e terziarie
ADDISON AUTOIMMUNE
L’ endocrinologo Schimdt descrisse il primo caso di morbo di Addison autoimmune. Non esistendo ancora gli
anticorpi antitireoglobulina e antiperossidasi, la diagnosi fu fatta grazie all’autopsia e biopsia sull’osservazione
dell’infiltrato linfocitario a livello del corticosurrene. Questi stessi linfociti furono riscontrati anche a livello della
tiroide( forma non isolata ma associata ad altre malattie autoimmuni).Negli stessi anni fu descritto il caso di una
ragazza deceduta per appendicectomia ,l’intervento era stato fatto 5 mesi dopo il parto. All’autopsia fu
riscontrata atrofia surrenalica senza infiltrato leucocitario,atrofia della tiroide, atrofia/ipotrofia dell’ipofisi.
Questa ragazza aveva avuto una sindrome di Sheehan da emorragia da parto.( Uno dei primi segni che si
evidenzia è la mancanza della montata lattea). Il Morbo di Addison autoimmune è una malattia plurifattoriale
indotta da fattori genetici, ambientali ed immunologici. È riscontrabile all’interno di un nucleo familiare come
WWW.SUNHOPE.IT
accade anche nella tiroidite autoimmune. Concorrono all’autoimmunità sia l’immunità umorale sia quella
cellulare. Gli antigeni degli autoanticorpi contro il corticosurrene sono rappresentati da 3 enzimi .Il più
importante è la 21 idrossilasi,ma abbiamo anche la 17 idrossilasi e anticorpi contro le cellule steroido
secernenti. La forma autoimmune può evolvere lentamente nel tempo e quindi è stata impostata una stadi
azione dell’addison preclinico.
STORIA NATURALE DEL MORBO DI ADDISON
AUTOIMMUNE
S
t
a
d
i
o
ACA
PRA
Aldosterone
Cortisolo
dopo
ACTH
ACTH
Cortisolo
Segni
clinici
0
Positivi
1
Positivi
Normale
Normale
Normale
Normale
Normale
Assenti
Elevata
Normale/basso
Normale
Normale
Normale
Assenti
2
Positivi
Elevata
Normale/basso
Basso
Normale
Normale
Assenti
3
Positivi
Elevata
Normale/basso
Basso
Elevato
Normale
Assenti
4
Positivi
Elevata
Basso
Basso
Elevato
Basso
Presenti
Stadio 0 anticorpi normali
Stadio 1 anticorpi presenti ,alterazione asse renina aldosterone
Stadio 2 cortisolo dopo ACTH resta basso
Stadio 3 ACTH si alza ,il cortisolo apparentemente normale non riesce a mantenere il feedback costante
Stadio 4 abbiamo tutte le caratteristiche cliniche ed ematologiche del m di addison
Il morbo di Addison può presentarsi isolato o associato:
WWW.SUNHOPE.IT
SPA 1 : è l’unica dovuta a mutazione. Il gene mutato è AIRE che regola la tolleranza verso il self.Si verifica in
epoca neonatale caratterizzata da candidiasi cronica che può portare anche a morte se non presa in tempo.
Intorno a 5 anni compare l’ipoparatiroidismo sempre autoimmune (grave ipocalcemia).A 10 anni si verifica il m.
di addison
SPA 2 : si verifica in età adulta,verso 30-40 anni,questo consente la differenza con la SPA1. Il soggetto può
avere altre patologie autoimmuni (malattie autoimmuni della tiroide, diabete mellito tipo 1,addison)
SPA 4 : abbiamo addison associato a malattie autoimmuni diverse da quelle della SPA2
SPA 3 : non è mai presente l’Addison.
TERAPIA
La terapia varia in base alla stadio. Se abbiamo uno stadio iniziale vanno solo osservati i titoli anticorpali dei pz
per vedere se aumentano più indagini basali. Se stanno in una fase più avanzata viene fatta una terapia
semisostitutiva con cortisone. La dose va comunque modificata in base alle esigenze del pz( ad es in casi di
stress, gravidanza, interventi chirurgici bisogna aumentare la dose)
Cortisone Acetato dose:30-40 mg/die
Modalità di somministrazione: 2/3 della dose al risveglio 1/3 nel pomeriggio
Fludrocortisone
dose: 0.05-0.1mg/die
Modalità di somministrazione: Somministrazione unica
Il fludrocortisone è un farmaco usato per migliorare la situazione idroelettrolitica (primitivo)
WWW.SUNHOPE.IT
Nella fase acuta bisogna dare calcio gluconato e bicarbonato per migliorare l’ingresso di potassio nelle cellule e
poi dare il cortisone
WWW.SUNHOPE.IT
LEZ 21/10/13
PROF. SINISI
IPOTIROIDISMO
Oggi parleremo della Tiroide, in particolare dell’ipotiroidismo. L’endocrinologia non significa solo tiroide,
ma, nella pratica clinica e nella preparazione alla medicina generalista vedrete nei vostri milleottocento
pazienti patologie diverse, ma la maggior parte sarà tiroide. Ipotiroidismo è un argomento introduttivo per
tutte le altre patologie e vi serve anche per richiamare alcuni aspetti di fisiopatologia.
L’ipotiroidismo cos’è? Se noi vogliamo seguire un po’ l’argomento dobbiamo cercare di guardare il
problema spiegando cos’è l’ipotiroidismo, come possiamo fare la diagnosi, quali sono le cause e come
possiamo trattare questo ipotiroidismo. Normalmente se chiediamo al nostro vicino che non è medico, che
idea ha dell’ipertiroidismo risponderà: sono tutti gli aumenti di peso, può essere un handicap mentale ….
sono delle frasi comuni e quello su cui vi invito a ragionare è che dovete diventare tecnici e non fermarmi
ai luoghi comuni. La patologia va inquadrata nella sua complessità, anche se poi è monosintomatica o
anche se poi l’ipotiroidismo viene all’osservazione perché è sovrappeso, perché ha sempre freddo, perché
il bambino va male a scuola …... non dobbiamo escludere queste possibilità, ma come medici dobbiamo
conoscere tutte la sintomatologia , tutto il quadro clinico( Domanda d’esame).
L’ipotiroidismo è una mancata produzione degli ormoni tiroidei, per assenza della ghiandola tiroide o
perché la ghiandola non funziona. Può essere ipotiroideo perché l’arrivo ai tessuti e la trasformazione ai
tessuti, cioè il metabolismo periferico, non funziona. Può esser ipotiroideo perché questi ormoni sono
prodotti, sono trasportati, non entrano nella cellula e quindi noi abbiamo una difficoltà a raggiungere il
target; perché non entrano nella cellula oppure ci entrano ma i recettori non sono funzionanti, quindi una
mancata azione. Quindi se uno vi chiede un ipotiroideo lo diventa perché ? perché non ha la ghiandola,
perché la ghiandola non funziona, ce l’ha ma non funziona …. ma l’altra possibilità è che possono essere
prodotti gli ormoni, ma non raggiungono la periferia, perché il metabolismo periferico è alterato o perché i
recettori non ci sono. Ovviamente questo tipo di problema (mancanza degli ormoni tiroidei) è quello più
frequente. Le altre forme sono meno frequenti.
Allora vediamo il meccanismo di sintesi degli ormoni tiroidei.
Sono prodotti dalla Tiroide, prima in quantità principali sotto forma di T4, tiroxina, meno di T3. La T3 è
l’ormone attivo, che deriva dalla T4, ma può essere direttamente sintetizzato dalla tiroide. Questa sintesi
avviene per l’azione di alcuni enzimi, ma richiede inizialmente l’intervento del TSH e dello ioduro, come
primo elemento inorganico che entra nella ghiandola e deve essere poi inserito nella processo di sintesi.
Quindi sono indispensabili questi due attori (TSH e Ioduro), se no la ghiandola non funziona. Gli ormoni una
volta liberati, si legano alle proteine Albumina e TBG e vengono veicolati ai tessuti. Qui si staccano, entrano
nelle cellule e qui, trovati i recettori, sono utilizzati per tutti i processi. L’utilizzazione nei tessuti è
controllata da alcuni enzimi: D1, D2, D3. Questi enzimi sottraggono lo iodio agli ormoni, attivandoli,
trasformando T4 in T3, o disattivandoli, trasformando T3 in T2 o T4 in R-T3.
La tiroide è localizzata in superficie. Insieme al testicolo, è una ghiandola endocrina accessibile, visitabile e
questo è uno dei motivi per cui entra nelle patologie molto frequenti e le patologie a suo carico sono
particolarmente evidenti.
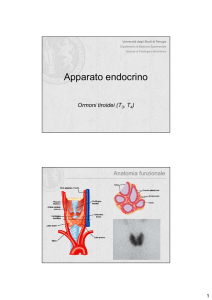
E’ una ghiandola superficiale, sotto la cartilagine tiroidea, davanti i primi 3 anelli tracheali. Dietro il lobo
sinistro c’è l’esofago, quindi un ingrandimento della tiroide comporta compressione tracheale ed esofagea.
Questo spaccato istologico (cfr slides) fa vedere la struttura della tiroide. I follicoli sono dei pozzetti, unità
funzionali tappezzati di cellule cuboidi, che sono delle cellule tiroidee, le quali racchiudono la colloide. La
colloide è un fluido fatto da liquidi, che sono elaborati dalla cellule tiroidee e che contengono gli ormoni
tiroidei. Tra questi follicoli, vedete anche le cellule parafollicolari. Queste derivano dalla cresta neurale cioè
WWW.SUNHOPE.IT
sono delle cellule neuro endocrine, diverse dalla cellule epiteliali tiroidee. Producono calcitonina, che
quindi è un ormone neuroendogeno. Queste ci interessano quando c’è una patologia tumorale delle
piccole cellule, calcinoma midollare…..(???).
L’unità funzionale tiroidea è fatta da una seria di attività e strutture che servono a captare lo ioduro dal
sangue, a trasportare lo ioduro all’interno, che poi diviene ione organico ad opera della perossidasi tiroidea,
e poi inserito nelle tirosine, cioè nei residui amminoacidici, proteici, della tireoglobulina. Poi diventano T3 e
T4. Queste vengono disperse insieme al materiale colloideo in vesciole che poi si aprono nella colloide.
Quindi c’è questo meccanismo di trasporto, di sintesi, di immissione di materiale colloideo, poi la cellula
capta le vescicole, le idrolizza e rilascia gli ormoni nel sangue. Quindi c’è questa specie di ricircolo continuo.
La struttura degli ormoni tiroidei deriva dal residuo tirosinico, che è un amminoacido, il quale viene
poliiodato e viene combinato con un altro residuo a formare la tiroxina, la quale ha 4 atomi di iodio. La T3
ha un atomo di iodio in meno in posizione 5. La T3 è l’ormone attivo e viene formato ad opera di una
deiodasi, che stacca l’atomo di iodio in più. La R-T3 è simile alla T3, però lo ioduro sta in posizione 5’, ma
manca in posizione 5. Questa si chiama Reverse T3 ed è spettrale alla T3 ed è inattiva. La R-T3 si forma in
periferia, quando abbiamo la necessità di ridurre la quantità di ormone tiroideo. Per esempio in malattie
croniche, in malattie cardiovascolari, infartuali … hanno una Reverse T3 più alta e una T3 più bassa.
L’organismo si difende producendo una sostanza inattiva . Questo è dovuto all’azione di una deiodasi.
Bisogna ricordare queste molecole principalmente per la loro funzione.
E’ importante il NIS, cioè il simporter Na - Ioduro, la proteina che ha la funzione di captare lo ioduro e di
portarlo dentro la cellula. Perché ci deve stare questa proteina? Perché la cellula tiroidea è ricchissima di
iodio di per sé. Se noi dobbiamo introdurre altro iodio, che è iperconcentrato nella cellula, dobbiamo
spingerlo dentro utilizzando una forza attiva. E questa è l’azione del NIS, cioè far concentrare quanto più è
possibile lo iodio nella cellula e tutto ciò è indispensabile perché il meccanismo di sintesi degli ormoni
funzioni.
Il meccanismo funziona, oltre che per la presenza di ioduro, principalmente perché stimolato dal TSH.
Questo è l’ormone tireotropo prodotto dall’ipofisi e sotto il controllo dell’ipotalamo, sotto il controllo del
TRH. Il TSH regola tutta l’attività del tireocita, ma essenzialmente la captazione dello ioduro (NIS) e la sua
organificazione, cioè l’attività della perossidasi. Quando lo ioduro è stato perossidato, tutto il processo a
valle va per conto suo.
Come in tutta l’endocrinologia, gli ormoni periferici liberati vanno a controllare, attraverso un meccanismo
a feedback negativo, la secrezione del TRH e del TSH. Quindi abbiamo un circuito dove l’ormone viene
prodotto sotto lo stimolo di un ormone superiore, TSH, e quello stesso ormone periferico va a
autocontrollarsi. Questo si chiama asse ipotalamo-ipofisi-ghiandola bersaglio e ci spiega una cosa molto
semplice, che quando la tiroide non funziona abbiamo un incremento del TSH. Però possiamo avere un non
funzionamento dell’ipotalamo e avremo carenza degli ormoni tiroidei, ma anche dell’ormone centrale.
Avremo i due prototipi dell’ipotirodismo, quello centrale, dove il TSH è basso, e quello periferico dove il TSH
è alto.
La struttura del TSH è fatta da due catene polipeptidiche: alfa e beta. La fusione di queste due catene, da’
una molecola attiva. Però l’alfa è comune al LH, al FSH e al HCG, che stanno ad indicare gli ormoni trofici
per le gonadi. La subunità Beta invece è propria e permette al TSH di agire sui suoi recettori. Però la
somiglianza strutturale fa si che un eccesso di TSH può andare a stimolare i recettori di questi ormoni
gonadici o un eccesso di questi ultimi, soprattutto HCG, che si produce durante il primo mese di gravidanza
o durante una neoplasia, può determinare una stimolazione eccessiva della tiroide.
WWW.SUNHOPE.IT
Nell’organismo ci sono circa 9g (8,850mg) di iodio. Di questi, 8 g sono presenti nella tiroide. Questo ioduro
lo prendiamo dall’alimentazione, principalmente dall’acqua. Lo eliminiamo, ogni giorno, attraverso le
urine, circa 500 microg, e le feci, 150 microg. Con l’alimentazione dobbiamo ripristinare almeno questi 500
microg, altrimenti abbiamo un progressivo impoverimento della quantità presente nel corpo, che quando è
scesa al disotto di un certo livello, soprattutto lo ioduro nella tiroide, si blocca la biosintesi. Questo vi spiega
perché noi dobbiamo apportare attraverso l’alimentazione lo ioduro. L’utilizzo del sale iodato è l’unico
modo per garantire un apporto costante di ioduro, altrimenti, visto che non conosciamo quello che c’è
negli alimenti, come succedeva nella arie di endemia gozzigena, la ghiandola non riceve abbastanza iodio, si
bloccava e, stimolata dal TSH, si gonfiava. Lo ioduro, attraverso la pioggia e il ciclo dell’acqua, arriva al mare
e dal sale marino noi lo rintroduciamo attraverso gli alimenti, attraverso l’acqua. Se noi viviamo in una
zona autonoma dal punto di vista idrico e quella zona è carente di iodio, noi abbiamo un apporto di iodio
minimo e diventiamo una zona di endemia gozzigena. Naturalmente questo è più difficile oggi per la
diffusione del sale e perché mangiamo cibi provenienti da un po’ tutto il mondo.
Il fabbisogno di iodio varia a seconda dell’età….
Adult
150 mg/day
Pregnancy
220 mg/day
Lactation
290 mg/day
Children
1-3 yrs
70 mg/day
4-6 yrs
90 mg/day
7-10 yrs
120 mg/day
Newborns
40 mg/day
…. Nella gravidanza, il fabbisogno deve essere aumentato di un terzo, perché il fabbisogno ghiandolare
aumenta e c’è anche il feto da rifornire, lo stesso nell’allattamento. Nei bambini la quantità di iodio è
minore.
Quindi se io non apporto sufficiente iodio, nelle condizioni di deficienza iodica, succede che la tiroide
produrrà poca T4, quindi aumenta il TSH, il quale stimola la tiroide, che diventa grossa e si chiama gozzo,
termine che sta ad indicare l’ingrandimento semplice o nodulare della tiroide. Dare iodio significa ridurre
questo fenomeno, ridurre l’endemia gozzigena.
Sul trasporto bisogna ricordare che la TBG è la proteina, la globulina più importante del trasporto, perché
ha la massima affinità con l’ormone tiroide, però altre proteine sono coinvolte nel trasporto: la trantireina,
che è una pre-albumina, e l’albumina. Quest’ultima è quantitativamente importante. Quindi quando
abbiamo una discrasia ematica, per esempio una cirrosi, la proteine più importante che si abbassa è
sicuramente l’albumina e questo ha sicuramente un’implicazione notevole sulla quantità di ormone che
viene trasportato. Il 99,9% della T4 è legata, cioè solo lo 0,1% è libero, ciò significa che noi abbiamo un
meccanismo tale che tiene a freno l’ormone tiroideo. A noi basta una minima quantità, che raggiunge i
tessuti. Quindi la quota libera (0,1%) è quella libera dalla TBG o dalla albumina.
Questa quota libera viene trasportata all’interno delle cellule ad opera di trasportatori, tra cui c’è la MCT8,
che quando è mutata da’ una forma di ipotiroidismo. Questi trasportatori portano all’interno l’ormone
tiroideo, T3 o T4, che raggiunge il nucleo e, una volta che la T4 è diventata T3, va ad attivare il recettore.
WWW.SUNHOPE.IT
Questi è un recettore nucleare, che quindi agisce sul Dna attraverso un legame su una parte accettrice del
Dna e richiede la cooperazione di un altro recettore, RXR, che è un recettore per l’acido cis-retinoico.
Questo significa che l’ormone, per agire, deve legarsi al proprio recettore , il quale deve dimerizzarsi con
RXR, e facendo questo è capace di attaccarsi sul sito di binding del Dna e di indurre la trascrizione.
Qua si inserisce il discorso delle Desiodasi. Quando la T4 entra nella cellula, viene trasformata ad opera di
queste due desiodasi, D1 e D2, ma in particolare la D2, in T3. Perché noi possiamo stare bene dobbiamo
avere la ghiandola che produce l’ormone, la proteina che lo trasporta alla cellula target, la proteina che lo
trasporta dentro la cellula target, e poi l’ormone deve essere attivato e diventa T3 ad opera della
Desiodasi2. Se invece interviene la D3 sulla T4, abbiamo la R-T3, l’ormone inattivo, quindi il gioco che
avviene nella cellula è mediato dalla quantità di D2 e D3 che abbiamo. Se nella cellula c’è molta D2, allora
questa è una cellula che può attivare l’ormone, se ha D3 lo inattiva. …. La D3 è la desiodasi inattivante
sempre, sia se agisce sulla T4, che diventa RT3, sia sulla T3, che diventa T2.
L’azione della T3 sulla cellula target determina la trascrizione genica, controllando la crescita e lo sviluppo
del SNC (ecco perché se abbiamo carenza ormonale nel feto avremo cretinismo e il deficit intellettivo), va
ad agire sul sistema cardiovascolare, va ad agire sul metabolismo, sul colesterolo, sulla glicolisi e sull’azione
dell’insulina. Questi effetti sono legati ai recettori alfa e delta. Possono avere una localizzazione diversa, ma
agiscono con lo stesso meccanismo, cioè quello di legare la T3 al recettore, attacco ad un altro recettore
RXR, quindi si forma un dimero, e poi l’attacco al Responsive Element, che si chiama TRE (non è la marca
telefonica…….), cioè l’elemento responsivo per il recettore tiroideo.
Gli effetti sono condizionati dall’espressione dei singoli recettori. Se i vari recettori sono espressi in maniera
quantitativa diversa a seconda del fegato, del sistema uditivo, gusto, del cervello, dell’osso e del cuore ….
Per esempio nel cervello c’è molto alfa. Questo significa che la risposta dei tessuti poi non è dovuta solo a
quanto ormone arriva, ma anche a quanto e che tipo di recettore c’è. Questo l’abbiamo capito studiando le
mutazioni dei recettori, cioè se una mutazione in beta, può determinare una mutazione più di tipo
metabolico, che non cardiaco, il paziente aveva tachicardia ma non aveva insufficienza epatica … le
manifestazioni cliniche non sono sempre le stesse, ecco perché il paziente non ha sempre la stessa
sintomatologia. C’è quello che ingrassa di più, quello che ha problemi cardiovascolari… Tutto ciò dipende,
oltre che dal suo strato genetico, anche dalla distribuzioni differenziale di questi recettori.
Classificazione Ipotiroidismi:
L’ipotiroidismo lo chiamiamo primario, quando il danno riguarda la tiroide, ma primario è anche il deficit
periferico, dovuto alla mancata azione degli ormoni, perché è alterato il metabolismo o perché non ci sono i
recettori. E poi abbiamo la forma secondaria, cioè un danno ipotalamo-ipofisario in cui c’è un deficit del
TSH. Tra queste due forme quella che prevale è il deficit primitivo della tiroide, che rappresenta più del 90%
dei pazienti ipotiroidei.
L’ipotiroidismo primario sarà caratterizzato da T3/T4 bassi e TSH elevato. Noi utilizzeremo il termine T3 e
T4 come “unicum”, ma in realtà nella pratica utilizziamo le Frazioni libere, FT3 e FT4, per quello che
abbiamo detto prima, cioè lo 0,1% che è libero è quello che ci interessa.
Nelle forme secondarie T3 e T4 lo stesso sono bassi, perché permane la carenza funzionale, però il TSH sarà
basso, perché è compromessa la secrezione centrale.
Il primario più frequente, il deficit tiroideo, è dovuto alla tiroidite autoimmune, alla chirurgia con
trattamento con radioiodio. Poi ci possono essere una serie di situazione particolari, per esempio le
malattie infiltrative, l’eccesso di iodio, i farmaci che bloccano l’attività tiroidea, la deficienza grave di iodio
ed errori congeniti della sintesi e del metabolismo dell’azione degli ormoni tiroidei, che sono errori basati
su mutazioni genetiche degli enzimi e dei trasportatori per cui il sistema non funziona. Quest’ultime è
responsabili delle forme congenite, che però sono una parte minima delle forme patologiche. Tra le
WWW.SUNHOPE.IT
malattie infiltrative abbiamo la tiroidite di riedel, la cistinosi, emocromatosi, malattie granulomatose che
localizzandosi nella tiroide ne provocano la distruzione.
Un accenno, perché è importante che lo conosciate, anche se materialmente ne incontrerete pochissimi
casi è la forma da resistenza periferica. Che è una forma di ipotiroidismo perché l’ormone non agisce.
Normalmente l’ormone agisce bloccando il TSH. Possiamo avere la resistenza globale, GRTH, resistenza
globale agli ormoni tiroidei, dove gli ormoni non agiscono sul tessuto periferico e non agiscono sulla ipofisi.
Quindi non c’è il feedback negativo e nemmeno l’azione periferica. La conseguenza è che il TSH non è
frenato ed è prodotto in grandi quantità. Cosi avremo il gozzo, che è la prima manifestazione, avremo T3 e
T4 elevati, perché la tiroide viene stimolata e funziona, ma, mancando il feedback, non si realizza quel
circolo di inibizione e avremo il paradosso che T3/T4 sono elevati e TSH è elevato. In periferia T3 e T4 non
fanno niente, perché mancano i recettori e quindi avremo il paziente ipotiroideo con i sintomi
dell’ipotiroidismo un po’ variegati, ma soprattutto al dosaggio troveremo sia T3/T4 sia TSH alti. Quindi
ricordate questo paradigma se no rischiate che tutte le volte, che vi capita una cosa del genere direte che
ha sbagliato il laboratorio.
Nell’altra forma parziale manca l’azione sull’ipofisi quindi non c’è freno di tipo feedback, quindi il TSH sarà
prodotto in grandi quantità, la tiroide si allarga, T3/T4 ci sono in giro, ma quando c’è il blocco l’ormone
agisce in periferia. Quindi le forme parziali sono dovuto alla mancanza del recettori alfa 1 sull’ipofisi, per cui
l’ipofisi non risponde, così abbiamo l’ipertiroidismo. Non è ipotiroidismo, ma la forma di resistenza è una
forma di ipertiroidismo, ma particolare, perché caratterizzata dall’incremento di TSH e di T3/T4. Quindi non
sempre il TSH elevato significa ipotiroidismo e non sempre l’ipotiroidismo è caratterizzato da T3/T4 bassi.
Le manifestazioni cliniche per le forme da resistenza sono differenziate rispetto alla forma classica, perché
abbiamo essenzialmente alterazioni cardiovascolari, comportamentali … sono bambini che hanno la cosi
detta sindrome iperattiva.
L’ipotiroidismo secondario può essere dovuto ad adenoma ipofisario, chirurgia ipofisaria, distruzione
ipofisaria per cui avremo una carenza degli ormoni ipofisari e quindi l’ipotiroidismo. Possiamo avere una
forma monotropinica, con deficit solo di TSH, o più spesso abbiamo carenza di più trofine. Il terziario si
considerava una volta, oggi rientra nel secondario ed è dovuto a deficit del TRH, anche se non si conosce.
La prevalenza nella popolazione generale dell’ipotiroidismo è di 0,25-1%, è un numero che dice molto e
non dice niente. A priori vi dico, che è abbastanza frequente e che dopo i 60 anni viene quadruplicata la
prevalenza. Raffrontando i valori con quelli del diabete, che colpisce il 3-5% della popolazione, e
dell’ipocorticosolismo, 1-2/100000 abitanti, una molto frequente e una molto rara, l’ipotiroidismo si
avvicina al diabete, soprattutto dopo i 60. Quindi è frequente perché colpisce 1% della popolazione totale
giovanile o pediatrica e il 2% nell’età anziana. Possiamo avere il 10% degli anziani con un TSH elevato, nelle
forme subcliniche. La gran parte dell’ipotiroidismo primario è dovuta alla tiroidite autoimmune, perché
questa colpisce il 15% nell’età scolare. Se noi prendiamo i bambini, dalla prima alla quinta elementare, e ci
facciamo un prelievo, il 15% avrà anticorpi anti tiroide, diciamo tiroidite. Questa tiroidite può restare silente
tutta la vita o evolvere verso l’ipotiroidismo nell’1% della popolazione. L’ipotiroidismo è una malattia
frequente, la principale causa è la tiroidite di Hashimoto ed è proprio l’elevata prevalenza della tiroidite di
Hashimoto a spiegarci perché l’ipotiroidismo è cosi frequente e peggiora la prevalenza con gli anni. Ci
spiega anche perché la malattia colpisce più le donne che gli uomini, 4:1, perché l’Hashimoto ha questa
differente distribuzione legata al sesso.
Gli ormoni tiroidei agiscono sul metabolismo energetico, aumentano il metabolismo basale, il consumo
d’energia e determinano la produzione di calore. Agiscono sul metabolismo lipidico, sul metabolismo
glucidico, sul sistema cardiovascolare, effetto cronotropo e inotropo positivo, aumentano la pressione
venosa differenziale, agiscono sul sistema nervoso centrale, sono importanti perché fanno differenziare i
neuroni e creano interconnessioni e hanno altri effetti sul sistema riproduttivo. Quindi la carenza di questi
WWW.SUNHOPE.IT
ormoni avrà effetti pleiotropici su tutto l’organismo ma soprattutto avrà manifestazioni importanti sul
sistema nervoso nel momento in cui abbiamo un danno congenito.
L’ipotiroideo avrà una sindrome da deficienza degli ormoni tiroidei e cosi un rallentamento di tutti i
processi metabolici. Gli effetti saranno diversi a seconda che compaiano in epoca embrionale, in epoca
neonatale o pediatrica, o nell’età infantile o nell’età adulta. Se il danno è congenito avremo come principale
compromissione quella dello sviluppo del SNC. Se invece è nell’età infantile, l’effetto lo vedremo sulla
crescita, i bambini che presentano ritardo di crescita o tendenza all’obesità sono bambini che possono
avere un deficit degli ormoni tiroidei. In età adulta prevarranno gli effetti metabolici, gli effetti sul sistema
cardiovascolare e poi l’altro fenomeno è il gonfiore, il mixedema.
La clinica sarà un difetto di crescita nel neonato o nel bambino/a in età pediatrica, sarà un problema
nell’orientamento delle proprie capacità, nelle proprie performance fisiche e mentali e sopratutto il
mixedema nell’età adulta.
Nel neonato vediamo il cretinismo, termine che oggi non si usa più. Il neonato che nasce ipotiroideo
presenta un aspetto particolare, con una lingua grossa, per questo ha difficoltà a gridare, piangere e a
succhiare, la cicatrice ombelicale ritarderà a rimarginarsi, presenta un ittero persistente, regge male la
testa. Questo bambino, se non è trattato, crescerà con un aspetto caratterizzato da bassa statura, faccia
inespressiva, che faceva definire questi soggetti “cretini”, ma che rispecchia un ritardo mentale evidente.
Questo fenomeno, a partire dagli anni 70’, non si vede più, perché abbiamo la diagnosi neonatale, che
permette di identificare l’ipotiroidismo e di trattarlo, evitando questa evoluzione.
La diagnosi è basata sul dosaggio di TSH, che sarà elevato, e FT4 basso. L’esame viene fatto sulla goccia di
sangue prelevata dal tallone alla nascita su cui si fa lo screening per la fenilchetonuria e l’ipotiroidismo. Il
laboratorio in 24 - 48 ore fa la diagnosi, invia al neonatologo questo referto, ma il neonatologo accorto, che
conosce questo quadro, avrà già iniziato il trattamento: quando arriva il referto dice “ok stavo sulla strada
giusta , continuo”, se invece il referto ci dice che non è ipotiroidismo, vuol dire che sarà un’altra patologia,
che mima questo aspetto e poi se ne parla. E’ importantissimo intervenire subito, cosi che avremo una
categoria di ipotiroidei che non hanno problemi, tranne qualche piccolo deficit intellettivo.
L’ipotiroidismo da difetto congenito, che è formato in età pediatrica oppure si sviluppa in epoca pediatrica,
può essere dovuto all’aplasia/emigenesia della tiroide, talora è associato a gozzo, quindi c’è la tiroide gonfia
perché c’è un’alterazione della sintesi degli ormoni tiroidei, può associarsi alla sordità, e questo si chiama
sindrome pendrinica …. che è dovuta alla mutazione di un gene, che si chiama pendrina, importante per il
processo di liberazione dell’ormone tiroideo, ma che è anche espresso nella coclea, per cui sono bambini
sordo-muti.
La carenza di iodio si definisce in base all’escrezione urinaria della molecola:
DEFICIT I
-
ESCREZIONE URINARIA I
ug/L
NO
100-200
BASSO
50-99
MODERATO
20-49
SEVERO
<20
Il deficit, nelle forme severe, è caratterizzato da gozzo.
WWW.SUNHOPE.IT
Le manifestazioni dell’ipotiroidismo infantile sono il deficit intellettivo, meglio definito come deficit di
performance scolastica, bambini che vanno male a scuola. Se il deficit di resa è immotivato, è giusto
chiedere il dosaggio degli ormoni tiroidei. Un altro elemento caratterizzante è il rallentamento della
crescita, la bassa statura. Possono avere anche attivazioni gonadiche: le donne hanno una pubertà
ritardata, i maschietti una pubertà precoce. La causa più comune, in età infantile, resta sempre la tiroidite
di Hashimoto, seguita da deficit di iodio e asportazione della tiroide, che però sono molto più rare. Altro
elemento caratterizzante è l’obesità in età infantile. Quindi obesità, bassa statura e scarsa resa scolastica,
fate sempre il TSH e FT4.
Possiamo avere dei quadri sindromici, per esempio la sindrome di Down, la sindrome di Turner, la sindrome
di Klinefelter, dove il quadro è dominato dalle manifestazioni di queste sindromi e c’è anche
l’ipotiroidismo. Naturalmente un bambino ipotiroideo va anche inquadrato per escludere queste particolari
sindromi.
Le manifestazioni dell’ipotiroidismo nell’adulto sono : sintomi generali, quali intolleranza al freddo,
aumento di peso; i capelli sono radi, secchi, fragili; la voce diventa rauca cronicamente, non perché ha
parlato o fumato, per un ispessimento mixedematoso delle corde vocali . Al collo possiamo trovare il gozzo.
All’apparato cardiovascolare troviamo bradicardia, toni ridotti, ipertensione con aumento della diastolica. I
muscoli sono deboli, hanno riflessi ridotti. L’apparato gastroenterico è dominato da stipsi. Alterazioni del
ciclo e problemi in gravidanza per le donne. Le mani sono fredde, le unghie fragili, le palme delle mani
hanno un aspetto giallastro, carotenoide, per l’accumulo nel palmo. Possono avere la sindrome del tunnel
carpale, dolore alla mano dovuto ad alterazioni di tipo neurogeno e neuromuscolare. È più importante
andare a evidenziare il mixedema, nella regione tibiale, ma anche al viso, con aspetto particolarmente
gonfio e giallastro, amimico. Posso avere la sindrome cardiaca allargata, l’aia cardia del cuore è aumentata,
perché anche le fibre cardiache sono infiltrare di queste sostanze polisaccaridiche e possono avere
addirittura versamenti, con pericardite. Ciò si traduce in un ECG con ridotta frequenza, bradicardia, e
ridotta altezza del voltaggio a livello delle derivazioni precordarli. Il paziente ipotiroidei può essere
diagnosticato anche solo con il tracciato elettrocardiografico.
La tiroidite di Hashimoto è la principale causa dell’ipotiroidismo. E’ un’infiammazione cronica che va ad
infiltrare le plasmacellule e va rendendo atrofici i follicoli. Si chiama autoimmune, perché c’è un attacco
contro antigeni della tiroide, infiltrazione da parte di queste plasmacellule, distruzione dei follicoli, per cui si
ha l’ipotiroidismo . Si può avere una prima fase d’ipertiroidismo transitorio, che però non genera sintomi
sul paziente. Sono maggiormente predisposte le donne, i pazienti con sindrome di Down e di Turner, i
pazienti che hanno fatto uso d’interferone, che è un immuno-modulante, il quale attiva i processi
autoimmuni. Ovviamente il punto di attacco parte dall’espressione di antigeni che non vengono riconosciuti
come self. Tra questi antigeni contro cui si sviluppano gli anticorpi, ci sono quelli della tireossidasi, della
tireoglobulina, il recettore TSH. Mentre gli anticorpi contro i primi due antigeni, TPO e TG, non hanno un
ruolo patogeno, ma bensì di marcatori di indizio di tiroidite, come conseguenza della patologia, l’anticorpo
anti recettore TSH può avere anche un ruolo patogeno. Infatti, quest’ultimo può bloccare l’azione, la
funzione recettoriale, provocando l’ipofunzione della ghiandola, portandola all’atrofia e quindi
all’ipotiroidismo.
L’anticorpo anti recettore non lo cerchiamo mai nella tiroidite di Hashimoto o nell’ipotiroidismo, cerchiamo
solo gli anti-TG e anti- TPO, per identificare la patologia. Non lo cerchiamo, perché se ritroviamo la
positività al recettore, non sappiamo se è bloccante o stimolante (in questo caso darà l’ipertiroidismo). Per
questo, sul piano clinico, per decidere che fare, è inutile. Sapere che esistono 3 tipi di anticorpi non significa
doverli prescrivere tutti e tre con una spesa maggiore inutile.
WWW.SUNHOPE.IT
La tiroidite di Hashimoto è la causa dell’ipotiroidismo, ma non è sinonimo di ipotiroidismo, perché
addirittura potremmo avere una fase di ipertiroidismo, fase di normo -funzione o ipotiroidismo perché la
ghiandola si distrugge per ¾, oppure perché gli anticorpi anti recettori mi bloccano la funzione.
La tiroidite di Hashimoto è isolata se non c’è ipotiroidismo con ingrandimento della ghiandola. Questo tipo
di problema può associarsi ad altre manifestazioni autoimmuni, sia endocrine, che esocrine. Per esempio
ipofisite, malattia di Haddison, insufficienza ovarica precoce.
La principale manifestazione è l’infiltrazione di leucociti, che si vede all’ecografia. La ghiandola si mostra
disomogenea con macchie scure ipoecogena e non si distingue dal muscolo. Normalmente la tiroide è
isoecogena, di colore grigiastro. E poi la vediamo incrementata nell’apparato vascolare, con vasi molto
spessi .
E’ presente anche un’associazione con altre malattie autoimmuni non endocrine, per esempio l’artrite
reumatoide, il retto colite ulcerosa, l’alopecia o vitiligo. Quindi c’è una predisposizione nei pazienti con
queste patologie ad avere l’ipotiroidismo e viceversa.
E’ possibile anche la manifestazione dell’esoftalmo, perché deriva da un processo autoimmune.
La Diagnosi si basa principalmente sulla clinica, ma non basta, perché l’obeso, il bambino ritardato a scuola
o il marito che si sente un po’ gli occhi gonfi, non è detto che sia ipotiroideo.
Quindi si fa il dosaggio del TSH e del FT4 e FT3, gli esami routinari . Dosaggio degli anticorpi anti TPO e anti
TG, per sapere se c’è la tiroidite di hashimoto, che è una delle principali cause. L’ecografia ci fa vedere i
quadri tipici della tiroidite. Ovviamente se la causa è una tireoctomia, che il paziente non sa riferire, non
troveremo la tiroide. La scintigrafia, oggi, non si usa quasi più per la diagnosi, la possiamo fare in un
bambini che sviluppa l’ipotiroidismo e non ha gli anticorpi. Potrebbe avere la disgenesia della tiroide, per
esempio una tiroide sublinguale.
Il dosaggio ormonale principe per fare la diagnosi di ipotiroidismo è FT4 e TSH, perché c’è una relazione
stretta tra questi due ormoni, di tipo inversa. Gli americani fanno fare solo il TSH. E’ sbagliato perché
possiamo avere le forme secondarie e non lo sappiamo. Facendo tutti e due abbiamo la possibilità di
scoprire FT4 basso e TSH elevato, ipotiroidismo primario, FT4 basso e TSH normale o basso, ipotiroidismo
secondario. Quando però non c’è questa regola, questa concordanza, non ritenete l’esame laboratoristico
sbagliato, ma rinviate il paziente ad un osservatore più attento, perché potrebbe avere un quadro di
resistenza agli ormoni o una mutazione di alcuni geni, che vanno a compromettere la funzione degli
ormoni.
Il dosaggio del FT3 non serve quasi mai, lasciamolo agli specialisti e molti specialisti non sanno neanche
utilizzarlo.
Gli anticorpi da cercare sono gli anti-TPO e gli anti-TG. L’anticorpo anti recettoriale fatelo solo quando
sospettate l’ipertiroidismo.
La diagnostica per l’infanzia è suggerita da rallentamento della crescita, ritardo intellettivo, pieno se il
bambino non è stato trattato, ma più spesso è un ritardo scolastico, ritardo puberale, anticipato per i
maschi, FT4 basso e TSH elevato. Quindi ricerca degli anticorpi, che saranno positivi. Faremo l’ecografia
tiroidea per vedere se la tiroide c’è ed è ipoecogena. Se non c’è, faremo la scintigrafia con iodio 125 perché
potrebbe essere un’agenesia o una disgenesia, cioè una tiroide delocalizzata.
L’anticipo puberale nel maschio è dovuto alla comunione di una delle subunità del TSH con le
gonadotropine. Quindi un eccesso di TSH andrà a stimolare il testicolo, che è suscettibile alla stimolazione
anche a 2 anni. L’ovaio invece no, che comincia ad essere stimolabile alla pubertà.
La diagnosi nell’adulto è caratterizzata da sospetto clinico, con astenia, aumento ponderale, sonnolenza,
rallentamento intellettivo, anemia, ipertensione. Sono tutti segnali aspecifici che bisogna confermare con il
dosaggio di TSH e FT4.
Anomalie ematochimiche: glicemia e sodiemia ridotte, anemia, colesterolo elevato, movimento di CPK,
LDH, GOT e GPT, dovuti alla mancata azione degli ormoni su fegato e muscolo, prolattina aumentata,
omocisteina urinaria aumentata, proteinuria.
WWW.SUNHOPE.IT
Ci può essere anche un ipotiroidismo transitorio, quindi la diagnosi non è definitiva e questo avviene nelle
forme subacute, nella tiroidite post partum, nelle forme da farmaci, nelle forme da anticorpi bloccanti il
recettore, che possono scomparire.
Nel feto può essere dovuta all’ingestione materna di farmaci, per eccesso di iodio nella madre, per
presenza di anticorpi anti recettore materni, una TSHemia transitoria. Ricordiamo che ci possono essere
queste forme transitorie. La diagnosi neonatale significa la terapia, ma non è detto che il neonato sia
ipotiroideo a vita. Il bambino va rivalutato dopo un certo periodo di trattamento. In genere si fa nella prima
infanzia, verso i 2 o 3 anni, si sospende per poco tempo la tiroxina e si vede se la sua secrezione è attiva.
L’ipotiroidismo subclinico è caratterizzato da un TSH> di 4,5-5 uU/ml, che è il limite massimo, ma FT4 è
normale, non ci sono segni clinici, però questi normalmente sono ambigui. Immaginate una donna obesa
che dice “ ho il TSH a 5, sono ipotiroidea, perciò sono grassa, voglio la tiroxina”, questa è un’ipotiroidea
subclinica che non merita di essere trattata, perché la causa della sua obesità non è il TSH, ma è
semplicemente un fenomeno che va monitorato. Invece se noi andiamo a prendere i trattati per
ipotiroidismo, troviamo un 30% di over- treatment che non è giustificato. Più del 10% degli anziani hanno il
TSH elevato, ma FT4 normale. Questi non bisogna trattarli. Si dice in genere che quando il TSH è uguale a
10, non va trattato. Va trattato solo quando supera i 10 o quando la donna è incinta. In gravidanza è
importante trattare anche un ipotiroidismo lieve, perché è importante per la salute del feto . negli anziani
bisogna fare attenzione perché se diamo l’ormone tiroideo, facciamo più male che bene.
La Terapia è basata sulla tiroxina, ormone tiroideo di sintesi. Diamo la tiroxina, T4, e non l’ormone attivo, la
T3, perché quest’ultima ha un’emivita rapida e quindi bisognerebbe somministrarla ogni 6 ore. Se il
paziente si scoccia, visto che è una terapia cronica, non se lo prende o se salta qualche somministrazione,
avrà degli alti e bassi. Dando la T4, una volta che ho saturato le proteine di trasporto, creo una base, una
riserva, che progressivamente viene trasformata in T3 nei tessuti e quindi se il paziente dimentica un giorno
la somministrazione, non corre il rischio di diventare ipotiroideo. Tant’è vero che possiamo somministrare
la tiroxina anche in maniera discontinua, quello che è importante è la dose settimanale e darlo a digiuno al
mattino, perché l’assorbimento viene condizionato dall’acidità gastrica e dal cibo.
Il monitoraggio della salute del nostro paziente, prima di tutto, è la clinica. Il paziente ci dice che sta meglio,
è dimagrito, ha perso il gonfiore al viso. Testare il paziente dopo circa 6 mesi. L’altro test che fate è il
semplice dosaggio ormonale del TSH, che ci monitora la ripresa del controllo e della secrezione a livello
ipofisario. In altre forme secondarie, dove il TSH non si produce, monitoro FT4.
WWW.SUNHOPE.IT
30-10-2013
Endocrinologia
Prof.Sinisi
PATOLOGIA NODULARE BENIGNA E CARCINOMA DELLA TIROIDE
Già parlando a proposito di ipotiroidismo e ipertiroidismo abbiamo nominato i termini gozzo, gozzo
nodulare e abbiamo parlato di adenomi e gozzi multinodulari tossici. Quello che cercheremo di evidenziare nel
nostro discorso è sostanzialmente la terapia del gozzo multinodulare, la frequenza di incidentaloma della
tiroide, come fare diagnosi del gozzo. Il primo concetto abbastanza ovvio è che in genere noi definiamo un
nodulo sulla base della clinica; per la tiroide il nodulo rientra tra tutti gli aumenti del volume, per cui il
termine più appropriato è quello di definire l’aumento di volume della ghiandola come gozzo e parlare di
gozzo nodulare semplice, definendo la condizione di aumento diffuso della ghiandola (la ghiandola è
ingrandita) come gozzo diffuso. Se individuiamo alla palpazione uno o più noduli abbiamo un gozzo uni o
multi nodulare. Possiamo parlare di gozzo cistico quando abbiamo un’indagine strumentale, l’ecografia, che ci
permettere di dire che quel nodulo ha una componente cistica. La terminologia generale è quella di parlare di
“patologia nodulare semplice”, semplice per identificare tutte le forme che non sono associate a ipertiroidismo,
ipotiroidismo, che non sono associate alla tiroidite, che non sono associate a cancro. La diagnosi è una
diagnosi di esclusione, che viene alla fine del processo, dell’iter diagnostico
Perche diciamo che il gozzo è nodulare anche quando è diffuso? Perché facendo l’ecografia anche i gozzi
diffusi, cioè quelli che alla palpazione non offrono a considerare noduli, hanno dei noduli magari piccoli, di
pochi millimetri, intraparenchimali. Una volta stabilito che non è cancro, non è tiroidite, non è ipertiroidismo,
quel gozzo sarà un gozzo nodulare semplice, semplice sta per :non è cancro, non è tiroidite, non è
iperfunzione!!
Abbiamo noduli benigni e maligni; ovviamente la diagnosi non è solo clinica ma è il risultato di un approccio
completo, anche strumentale.
I noduli benigni sono:
pseudonoduli, che si hanno nel corso di tiroiditi (tiroidite di Hashimoto, batterica, subacuta) che
determinano dei gonfiori, dei rigonfiamenti della tiroide, ma non sono dei noduli, non sono
l’espressione di una proliferazione cellulare ma sono il frutto dell’infiltrazione infiammatoria. Sono
comunque percepibili alla palpazione come dei noduli;
iperplasia compensatoria: ad esempio in un paziente che viene operato di emitiroidectomia l’altro
lobulo si ingrandisce e lo palpiamo come un nodulo;
gozzo nodulare sporadico, dove troviamo dei veri e proprio noduli;
cisti;
adenomi follicolari;
adenomi a cellule di Hurthle;
I noduli maligni sono tutte le cose di cancro, linfoma, cancro metastatico. Quando noi diciamo “noduli delle
tiroide” possiamo distinguere un grande gruppo di pseudonoduli , un grande gruppo di patologie
neoplastiche/maligne ma nella stragrande maggioranza dei casi si tratta di noduli nell’ambito di gozzo
nodulare sporadico o gozzo nodulare semplice. Naturalmente al primo approccio questa diagnosi non la
possiamo fare, non possiamo dire a un paziente che arriva con uno o più noduli “non vi preoccupate”, ma
dobbiamo dire che se escludiamo cancro-tiroidite-disfunzione, sarà sicuramente un gozzo nodulare semplice.
Il gozzo nodulare semplice può essere : diffuso, uni nodulare, multi nodulare, cistico. Quando la prevalenza tra
i 6 e i 12 anni è superiore del 5%, parliamo di gozzo endemico. Dove lo troviamo? Dove c’è una carenza
iodica, in quelle aree blu della cartina che vi ho fatto vedere il primo giorno, aree dove c’è una carenza di
apporto di iodio alimentare. Questa situazione in Italia fortunatamente sta scomparendo. Però se andiamo a
fare l’ecografia a tutti i parenti non arriviamo al 5%, perché c’è ancora una forte prevalenza di gozzo. Quando
la prevalenza è inferiore del 5% nell’ambito della popolazione scolare ,parliamo di gozzo sporadico, compare a
WWW.SUNHOPE.IT
caso, non è dovuto a carenza di iodio nella popolazione, può essere un problema di un singolo soggetto, di una
singola comunità. Dovete imparare la terminologia, quando uno vi chiede “che cosa è il gozzo endemico?”
dovete rispondere “è la presenza di gozzo nella popolazione scolare al di fuori del 5%. Il gozzo sporadico è la
presenza di un aumento di volume nodulare o non della tiroide trovato a caso nell’ambito della popolazione
scolare”.
Sono frequenti questi noduli nella popolazione globale? SI! Il 5-10% nella popolazione adulta presenta
clinicamente il nodulo. Significa che su 100, 5 di voi avranno alla palpazione un nodulo (non è obbligatorio,
capite che la terminologia è così. È trovabile su numeri sufficienti: non 100 ma almeno su 1000 persone il 510% ha un nodulo palpabile clinicamente. È una cosa molto frequente). Aumenta con l’età:1%nei giovani e
5-10% negli adulti. Se facciamo l’ecografia più del 50% ha dei noduli ecografici. Quando vi arriva il paziente
o la mamma del paziente e dicono “dottore, all’ecografia è uscito che ha un nodulo. È un tumore?” dobbiamo
spiegare che 1 su 2 dopo i 15-18 anni ha un nodulo all’ecografia, ed è un fatto assolutamente benigno
oltretutto.
Il rapporto donna/uomo è 4:1. L’incidenza del cancro alla tiroide è 0.004%, rispetto all’1% clinico, ma molto
più alto ecografico. Di questi noduli, la stragrande maggioranza sono benigni, solo qualcuno di questi può
essere maligno. Su questa base si fonda il nostro comportamento tranquillizzante, so che raramente è un
cancro. Ovviamente questo non significa non fare l’iter diagnostico, ma è importante come approccio al
paziente.
La frequenza di malignità tra gli incidentalomi (noduli che non si vedono, si trovano all’ecografia,
“incidentali”, si trovano per caso). Sono piccoli però potremmo sempre pensare che sono maligni o benigni:
hanno lo stesso comportamento dei noduli grandi, una frequenta di malignità del 3-6%.
Quando abbiamo un cancro occulto, ed andiamo a fare l’ago aspirato su quel nodulo perché siamo sicuri che è
cancro , se lo lasciamo stare, non lo togliamo, come progredisce? soltanto l’ 1/15 dei cancri occulti
progredisce verso uno stato clinico. I noduli sia grandi che piccoli hanno un basso rischio di essere maligni. Se
trascuriamo il nodulo incidentale, piccolo,<1cm, che è un cancro, che rischio corriamo che diventi
aggressivo?cioè, se io non lo scopro, non lo controllo,che rischio ho che tra 20 anni diventi maligno? è un
rischio molto basso. L’approccio deve essere quindi cauto, non aggressivo, da qui deriva la necessità di non fare
screening,che si fa nel carcinoma della cervice, nel cancro alla prostata…
L’eziologia del nodulo è data da fattori ambientali (fumo, farmaci, goitrogeni naturali nella dieta, stress,
infezioni) che si sommano a fattori genetici,cioè una predisposizione genetica e abbiamo il gozzo nodulare ,
naturalmente anche fattori endogeni e tra questi gli ormoni, soprattutto gli estrogeni, insieme con il tsh
(fattore di conrollo e produzione degli ormoni tiroidei) creano le condizioni per la crescita dei noduli. Le
cellule si modificano: dopo una carenza di iodio, c’è poco FT4 , aumento del tsh, questo stimola l’espansione
delle cellule nel tentativo di sopperire alla carenza. Una cellula può essere particolarmente predisposta a
proliferare, quindi alla fine possiamo avere la crescita di tutta la ghiandola tiroidea e il nodulo. Nell’ambito di
questa crescita possiamo avere una proliferazione delle cellule che porta al GNS o ai noduli multipli; possiamo
avere delle mutazioni attivanti la proliferazione : una cellula si selezione ed ha una mutazione del recettore del
TSH, che può essere ereditaria, e quindi avremo adenoma e gozzo multi nodulare tossico; possiamo avere
mutazioni trasformanti (BRAF, RET ecc..) e quindi andare incontro a trasformazione di tipo neoplastico ,
carcinoma differenziato oppure a carcinoma indifferenziato. Nell’ambito di questo processo proliferativo ci
sono dei (X) che intervengono che sono o casuali o ambientali , per esempio nella zona Chernobyl: i ragazzi
di Chernobyl hanno avuto lo sviluppo di carcinoma papillifero più frequentemente associato a mutazione del
gene RET o anche altre mutazioni. Questo processo di proliferazione che poteva portare alla formazione di
gozzo nodulare in un’area a forte endemia gozzigena, ha portato per effetto delle radiazioni ionizzanti alla
trasformazione di una cellula nella direzione di un carcinoma; quindi il processo è complesso e ovviamente
differente nelle diverse situazioni.
Una volta fatta la diagnosi di GNS, cioè quando abbiamo fatto una valutazione funzionale, anticorpale e
citologica facciamo un ago aspirato per vedere se è benigno o maligno. Quando abbiamo scoperto un nodulo
può verificarsi un aumento del volume, sintomi da compressione ed inestetismo. Possiamo avere alterazione di
funzione: un gozzo nodulare può diventare iperfunzionante o ipofunzionante. Naturalmente il nodulo può
WWW.SUNHOPE.IT
diventare cancro. Oggi non abbiamo gli strumenti molecolari per fare un profilo molecolare della cellula o del
nodulo. Un nodulo, o più in generale un gozzo ha una crescita variabile nel tempo, può essere che in un anno
cresce poi si ferma e non cresce più. Non abbiamo parametri specifici di predizione per potere affermare che
un nodulo è più a rischio rispetto ad un altro. Il volume del nodulo cambia negli anni: può aumentare,
diminuire o restare stabile. Trovare un nodulo non significa assolutamente terrorizzare un paziente, è chiaro
che se il nodulo è già di 4cm e già comprime la gola lo vado ad operare non aspetto che il paziente soffochi.
Per quanto riguarda i noduli non palpabili, noi li chiamiamo incidentalomi. Questo tipo di nodulo è diverso
rispetto a un nodulo grande clinico? No: la malignità è simile, 3-6% e l’1/15 progredisce ad uno stadio
clinico, anche se e un carcinoma occulto. Quando facciamo diagnosi (è una diagnosi di esclusione!!) di un
nodulo,quindi GNS, dobbiamo decidere se il paziente deve essere solo monitorato o trattato prima che il
gozzo cresca. Da quello che vi ho detto il trattamento contro un nodulo piccolo non ha senso; quando siamo
sicuri che non c’è cancro va monitorato soltanto.
Oggi abbiamo a disposizione la iodazione, strumento importante per prevenire la crescita, l’ecografia, per
monitorare l’evoluzione del volume, forma e dimensione del nodulo, e Fnc con ago sottile che ci permette di
monitorare la citologia.
NB. La scelta di dare TIROXINA per abbassare il tsh è fisiologicamente corretta, perché abbiamo visto che il
tsh è coinvolto nell’eziologia del nodulo; ma è corretto utilizzarlo quando c’è effettivamente un ipotiroidismo.
Ma se il nostro paziente è normotiroideo e gli diamo tiroxina per abbassare il tsh, portiamo il paziente ad un
ipertiroidismo subclinico che è una della cose più brutte perché stai bene poi a 50 anni hai problemi al cuore .
Io mi voglio curare la tiroide non il cuore. È una terapia folle ma diffusa.
Davanti a un nodulo tiroideo:
Facciamo la palpazione, valutiamo il tsh, l’ecografia ed eventualmente la scintigrafia.
Se il tsh si è abbassato, alla scintigrafia il nodulo è caldo abbiamo un adenoma pre tossico perché
ancora non è iperfunzionante o tossico. Dobbiamo dare lo iodio radioattivo, possiamo fare il followup
oppure lo facciamo operare. Parliamo di adenoma di Plummer o adenoma tossico.
Valutazione clinica: se c’è un sospetto di malignità ricorriamo alla chirurgia. Se non abbiamo elementi
di sospetto dobbiamo fare un FNAB (ago aspirato). Esso potrebbe non essere diagnostico, cioè non ci
permette di dire se è benigno o maligno, va ripetuto possibilmente eco-guidato. Se il FNAB è
diagnostico, cioè abbiamo un carcinoma maligno,dobbiamo operare. Se però non è diagnostico ma c’è
una proliferazione aumentata, cellule iperplastiche, anomalie nucleari, anche in questo caso dobbiamo
operare. Quindi si opera se c’è un adenoma tossico, se è maligno, se ripetutamente non riusciamo a
fare diagnosi. Si opera se abbiamo il sospetto consolidato all’istologia che è un cancro. Se il nodulo
alla citologia è benigno, facciamo il followup. Se il nodulo cresce e diventa compressivo, trattarlo con
la chirurgia. Non facciamo il trattamento con LT4 (tiroxina), perche vogliamo evitare che un nodulo
semplice cresca, quindi non ha senso. In ogni caso regolatevi sempre caso per caso.
Cancro della tiroide.
Cercheremo di definire : come si identifica; quali sono i markers che utilizziamo per il followup; terapia.
Come per tutte le cellule le neopleasie della tiroide vanno distinte in benigne e maligne. Nelle benigne
comprendiamo gli adenomi ma possono essere anche di origine non parenchimale, ad esempio un lipoma,di
origine vascolare (angioma) o un teratoma.Le neoplasia maligne sono gli adenocarcinomi che derivano dalle
cellule epiteliali follicolari (abbiamo il papillare, il follicolare,il carcinoma a cellule alte..); il midollare che
origina dalle cellule parafollicolari (nella prima lezione le vedemmo, erano marcate in blu tra i follicoli) che
producono calcitonina; è un tumore neuroendocrino. Carcinoma indifferenziato o aplastico, che rappresenta lo
stesso estremo del carcinoma, aggressivo ma molto raro. Altri tumori maligni sono: sarcomi (di origine
interstiziali), linfomi e tumori metastatici. Non è infrequente che facendo un ecografia della tiroide e troviamo
uno strapunto che coinvolge anche i linfonodi; pensiamo a un problema tiroideo ma è in realtà è un linfoma e
la diagnosi differenziale si pone sempre con la Tiroidite di Hashimoto in quanto nel linfoma molti pazienti
WWW.SUNHOPE.IT
hanno una forte attivazione immunologica (presenza di anticorpi). Diagnosi molto pericolosa ma per fortuna
molto rara.
Tumori benigni:
adenoma follicolare, caratterizzato dalla capsula (sono quei noduli che noi vediamo all’ecografia con
un alone periferico). Sono gli adenomi che possono diventare un adenoma tossico di Plummer, se è
iperfunzionante.
Tumori maligni
follicolare, pappillare, midollare. Il papillare è caratterizzato da differenziazione follicolare con
strutture papillari; il follicolare da differenziazione follicolare con angioinvasione e invasione della
capsula. Solo all’istologia vediamo l’invasione della capsula e dei vasi.
Indifferenziato, con cellule indifferenziate
Midollare, tumore neuroendocrino delle cellule parafollicolari
Possono essere anche secondari se sono tumori primitivi non della tiroide (es. mammella) che possono andare
a localizzarsi nelle cellule tiroidee.
Carcinoma tiroideo
Rappresenta l’1-2% di tutti i tumori, relativamente raro,incidenza 0.5-10 ogni 100000 abitanti, picco tra i
35-40 nella donne 72-73 nell’uomo (controllare dalle slide perché non si capisce) ; questo dato è importante:
se ho un uomo, ultracinquantenne,che non ha mai avuto problemi e che sviluppa un nodulo potrebbe essere un
cancro.
È raro sotto i 16 anni. Facciamo diagnosi più tardivamente, nonostante il tumore stia 10-12 anni in situ non
ha dato problemi. Non ha cambiato la storia del paziente. Mortalità di 0.4-2.8 ogni 100000 abitanti. Tutto
questo significa che raramente si muore per cancro alla tiroide, è un cancro raro e benevolo. (controllare slide
per i numeri precisi).
Fattori di rischio:esposizione alle radiazioni precedentemente, familiarità, preesistente patologia nodulare,
cambiamenti umorali, apporto di iodio, mutazione genetiche documentate.
L’incidenza del carcinoma nei noduli in clinica è il 4-5%. Se prendiamo le casistiche chirurgiche, mentre la
diagnosi d’ingresso è nodulo,all’istologia l’8-20% risulta un cancro .L’incidenza in cancro nella patologia
benigna all’istologia è più elevata di quella che facciamo quando facciamo la diagnosi (con ago aspirato o
ecografia)che è 4-5%. Quando passiamo all’istologia che è più accurata il valore si quadruplica. L’incidenza
nelle autopsie è 4-45%. Il carcinoma occulto, quindi esiste ed è molto frequente. La frequenza morti/anno per
carcinoma è 0.5-1 su 100000.
La frequenza approssimata dei tumori della tiroide è : CA papillare 75%-CA follicolare 16% (quindi 91% dei
cancri può essere o papillifero o follicolare; il 91% sono carcinomi differenziati, sono quelli che vanno meglio
perciò si muore poco. Quando si muore? Quando i carcinomi diventano indifferienzati e aggressivi, sono dei
killer, ma per fortuna molto rari.)- CA midollare 5%- CA indifferenziato 3%.
Perché diciamo che il papillifero e il follicolare sono cancri differenziati? Hanno l’organizzazione citoistologica della tiroide conservata. Ricordano il tessuto tiroideo. Il differenziato è un tumore fatto da cellule
che non solo hanno conservato l’aspetto/struttura ma anche la funzione delle cellule tiroidee: hanno ancora il
recettore per il TSH, sintetizzano la tireoglobulina e captano iodio. Questo ci permette ad esempio di poter
bloccare la crescita andando a bloccare il tsh; il fatto che producono ancora tireoglobulina significa la
possiamo utilizzare come marker della presenza del tumore; per poter distruggere le cellule che rimangono
posso utilizzare lo iodio marcato. Per tutti questi motivi possiamo controllare meglio questo tipo di tumore.
Quali sono i tumori differenziati? Papillifero e Follicolare.
Perché?conservano la cito-architettura della tiroide. Hanno il recettore per il tsh, captono lo iodio e
producono tireoglobulina
WWW.SUNHOPE.IT
La frequenza di nuove diagnosi è in crescita. (Questa cosa è abbastanza ovvia , se abbiamo detto che il 45%
nelle autopsie ha un carcinoma differenziato significa che oggi con l’ecografia facciamo quello che i nostri
antenati non facevano). Esistono due isotipi: il papillifero e il follicolare. Il follicolare è considerato più
aggressivo per la sua tendenza a metastatizzare. La gestione, la prognosi e il risultato finale sono simili per
entrambi i cancri, per pazienti della stessa età, sesso e stadio della malattia. In realtà quando diciamo che il
follicolare è un po’ peggio, alla fine 100 casi di papillifero e 100 casi di follicolare in 200 donne della stessa
età e allo stesso stadio, sopravvivono alla stessa maniera. È più aggressivo.
Carcinoma papillifero
Il papillifero è il più comune. Frequenza del 75% (…) prognosi ottima al di sotto dei 40 anni (leggi la slide)
Se lo troviamo nei maschi è un fattore prognostico negativo (nell’uomo si scopre più tardi ed è più pericoloso
quindi siate più aggressivi e allarmati).
Come si presenta? È un nodulo fermo, solitario, freddo alla scintigrafia, solido all’ecografia (ipoecogeno
rispetto al tessuto circostante), può presentarsi come pseudo cistico. Esiste anche una forma occulta, più
piccolo, meno di 1cm. La lesione cresce lentamente, non è capsulata, può essere invasiva e superare le regioni
del collo e i linfonodi regionali ma può anche rimanere silente per anni. Esistono però dei casi più aggressivi.
Fattori di allarme sono: familiarità, sesso, età, crescita rapida, aspetto ipoecogeno o pseudo cistico. Sono
segnali di allarme non di diagnosi, come anche il fatto che alla scintigrafia sia freddo (se è caldo difficilmente è
un cancro). All’esame istologico può essere unico, multicentrico. Le varianti sono : follicolare, sclerosante
(struttura fibrotica), a cellule alte (prognosi peggiore).
Perché viene? A causa di : mutazione dell’oncogene RET-PTC, overespressione di chinasi, ipermetilazioni,
alterazioni di geni che controllano il ciclo cellualare. Tra questa la più studiata è la BRAF che è una mutazione
della via MAPK che controlla la proliferazione. Si ritrova nel 29-83% dei carcinomi alla tiroide. Alla base del
tumore c’è un’alterazione molecolare che rende le cellule più proliferanti. Le forme familiari ci sono
nell’attivazione di Ret/ptc e associate a poliposi familiare adenomatosa (s. di Gardner, s di Cowden, dove c’è
perdita di PTEN).
Carcinoma follicolare
Rappresenta il 10%, colpisce dai 52 anni in su,da metastasi, più frequente dove c’è carenza di iodio. (leggi
slide)
Appare con struttura follicolare alterata. Ci sono piccoli follicoli con scarsa colloide (elemento diagnostico) .
La diagnosi è possibile solo se si dimostra l’invasione della capsula e dei vasi perché l’aspetto follicolare lo
troviamo anche negli adenomi che però non hanno l’invasione della capsula e dei vasi. Quando facciamo l’ago
aspirato preleviamo un po’ di cellule. Di queste cellule possiamo vedere l’aspetto papillifero, vediamo se ci
sono i nuclei, anisocitosi delle cellule, ma non possiamo vedere se le cellule stanno nella capsula o nei vasi
perché per vedere questo dobbiamo prendere un pezzo di tessuto,fissarlo, colorarlo e analizzarlo. Il follicolare
sulla citologia lo posso diagnosticare o no?no! quando abbiamo l’aspetto nodulare con l’alone periferico del
nodulo ipercaptante, il citologo dopo ago aspirato ci dice è una neoplasia di tipo follicolare, non posso dire
che è un cancro. Colpisce in età più avanzata,il sottotipo a cellule di Hurthle è quello più invasivo,freddo alla
scintigrafia, tende a metastatizzare alle ossa con un decorso clinico più sfavorevole. Anche qui abbiamo delle
mutazioni per esempio pax/ppargamma, galectina3, alterazione di microerray, cioè una serie di alteraioni a
carico di geni che controllano la proliferazione
Il tumore può essere a basso rischio: paziente<40anni, donna, non c’è diffusione locale, nessuna invasione
della capsula, non ci sono metastasi,>2cm, ben differenziato.
Il tumore può essere ad alto rischio :uomo, più di 40 anni, se invade la capsula, se ci sono metastasi,>2cm,
scarsamente differenziato-intervento chirurgico e trattamento con radio iodio perché può dare facilmente
recidive.
Carcinoma indifferenziato o aplastico
Tumori a piccole cellule, a cellule giganti o affusolate. Colpisce gli anziani con una lunga storia di gozzo, con
incremento improvviso delle dimensioni. Comparsa improvvisa di sintomi compressivi,(donna o uomo di una
certa età che aveva un gozzo e stava bene che all’improvviso ha un senso di costrizione, non alza la voce
WWW.SUNHOPE.IT
dovrebbe essere operata), disfagia, paralisi delle corde vocali. Perdita di p53, controllore del ciclo, rende le
cellule prive di controllo, metastasi a polmoni, pleura, ossa e cervello. Ad esempio, un giovane che durante il
pranzo di una ricorrenza ingoia un boccone e si affoga. Va in ospedale. Si fa la tac. Si trova una massa che ha
già invaso il mediastino Nel giro di pochi giorni viene operato ma il tumore ha già invaso tutto il mediastino e
il polmone.
Dal punto di vista pratico quando abbiamo un nodulo, se scoperto accidentalmente >1cm se isolato, <1.5cm
in GMS dobbiamo sempre fare l’ago aspirato. Un nodulo di >4cm è bene toglierlo. Nell’ambito del GMN va
aspirato il nodulo dominante a meno che non vi sia stata irradiazione esterna. La scintigrafia è utile quando
abbiamo adenoma ipercaptante. L’eco non distingue un nodulo benigno da uno maligno a meno che non
abbiamo una forma cistica ed anche lì possiamo sbagliare. I noduli macrofollicolari <4cm possono essere
seguiti in followup 1 o 2 anni. La terapia soppressiva non serve. I pazienti con esposizione durante l’infanzia o
l’adolescenza a radiazioni vanno seguiti attentamente. Le radiazioni possono essere anche dovute a trattamenti
medici ad esempio chi ha avuto un linfoma in età infantile può essere a rischio.
Elementi clinici a rischio:
età inferiore a 20, superiore a 40; il sesso maschile più di quello femminile; irradiazione testa e collo;familiarità
per il carcinoma midollare o papillifero; nodulo singolo;rapido accrescimento (qualcuno dice sotto terapia con
T4),fissità, consistenza dura, sintomi locali da compressione, linfadenopatia.
Diagnosi
Esame obiettivo e rilevamento di un nodulo che è palpabile.
Primo approccio, indagini ormonali per escludere la disfunzione: FT3,FT4,TSH
L’unico marcatore che possiamo utilizzare è la calcitonina per la diagnosi di carcinoma midollare. Altri
marcatori pre non ci sono: la tireoglobulina non è un marcatore di cancro alla tiroide, ma cerca il nodulo in
circolo.(la tireoglobulina a 200 non significa assolutamente che c’è un cancro).
La clinica, l’ecografia, la scintigrafia ci fanno fare una diagnosi di presenza di uno o più noduli. Possiamo già
dire che c’è o non c’è cancro? NO! Dobbiamo fare l’ago aspirato. L’ago aspirato ha una sensibilità del 9095%, specificità dell’85%. Facciamo diagnosi quasi sicura del papillifero (è fondamentale). Per il follicolare è
solo indicativo di neoplasia, ovvero di proliferazione follicolare non di cancro. La proliferazione può essere
benigna o maligna.
FNA: puntura con un ago 23 sul nodulo, aspiriamo le cellule si colorano e il citologo fa la diagnosi
Tabella.
Thyr1: le cellule non bastano, non sono sufficienti per la diagnosi, c’è troppo sangue. Bisogna rifarlo.
Thyr2: non ci sono cellule neoplastiche, nodulo benigno. È un elemento istantaneo, potrebbe cambiare.
Thyr3:lesione follicolare, neoplasia follicolare. Può essere un adenoma o un carcinoma. Si consiglia
l’asportazione. Per fare diagnosi istologica che ci dirà se è invasivo o non invasivo.
Thyr4 : elevato sospetto di malignità
Thyr5:diagnosi di malignità. Asportare!
Domanda: va asportata la tiroide o il nodulo?
Prof: Se c’è thyr5 togli la tiroide; se c’è thyr4 senza altri noduli togli mezza tiroide; se c’è thyr3 senza altri
noduli togli mezza tiroide ma devi spiegare al paziente che lo stai facendo a scopo diagnostico.
Che cosa si fa nell’intervento.
Tiroidectomia totale e esame istologico;
Terapia ablativa con I131 per eliminare i residui;
Terapia soppressiva con LT4, si riduce il TSH e il rischio di recidiva
Follow up: TSH, TG ; perché la tireoglobulina nel followup? Perché il carcinoma differenziato
produce la TG. Se la sopprimiamo vuol dire che abbiamo bloccato le cellule. Se non c’è aumento della
TG vuol dire che non ci sono cellule autonome che proliferano. Per stimolare la TG, sospendiamo T4
WWW.SUNHOPE.IT
e aspettiamo 40 giorni. Se la Tg passa da 0 a più di 2 vuol dire che ci sono cellule tiroidee. In
alternativa per evitare di far stare il paziente 40 giorni senza terapia possiamo usare il TSH
ricombinante: due somministrazioni e dopo 72 ore facciamo un prelievo per valutare la TG, se passa
da 0 a 2 il pazienta ha cellule circolanti. Durante il followup facciamo anche TBS (total body
scanner), la facciamo nei pazienti dubbi che hanno metastasi e anticorpi anti Tg , Eco, Pet/tc.
Monitoraggio a lungo termine
1 giorno: fiala da 0.9mg di tsh ricombinate
II giorno: fiala da 0.9mg di tsh ricombinante
III giorno: I131 e TSH
V giorno: Tsh, tg e scan con I131.
Questo se viene fatto a un anno dall’intervento ci può dire se il paziente è guarito. Il soggetto ad alto rischio lo
ripetiamo dopo un anno per 5 anni. Se dopo 5 anni non abbiamo recidiva è guarito.
Dosaggi della TG (slide)
Tg 0.5: non c’è rischio
Tg 0.6-2: bisogna controllarla
Tg>2: sospetto di recidiva; bisogna fare una nuova valutazione.
Dopo l’intervento diamo l’eutirox, la tiroxina, per compensare l’ipotiroidismo e tenere il TSH basso. Se il
paziente è giovane possiamo indurre ipertiroidismo subclinico per 5 anni, poi se abbiamo la certezza che è
guarito possiamo ridurre la tiroxina, far salire il TSH fino a 0.5 per evitare l’ipotiroidismo subclinico che è
pericoloso.
WWW.SUNHOPE.IT
Lezione endocrinologia 18/11/2013
Oggi cambiamo ghiandola e parleremo delle gonadi e in particolare
dell'ipogonadismo. La differenza rispetto alle altre ghiandole endocrine è che
quando parliamo di gonadi dobbiamo tener presente il dimorfismo sessuale .
Per quello che riguarda alcuni meccanismi regolatori di base c' è una
somiglianza , però poi ..per quanto riguarda gli aspetti fenotipici abbiamo delle
differenze legate al sesso. Quando parliamo di ipogonadismo lo dobbiamo
differenziare al maschile e al femminile .Introdurremo della parte femminile
perchè per quello che riguarda l asse regolatorio è sovrapponibile .
Ci proponiamo di vedere un pò i principi della regolazione ipotalamoipofisaria e gonadica , la funzione testicolare e ipogonadismo maschile. Tutto
nasce livello ipotalamico . ( guardando la slide ) questi sono i ventricoli
laterali , questo il terzo ventricolo il territorio che sta intorno è sede di neuroni
che producono una sostanza fondamentale per la regolazione di quest asse .cioè
il GNRH. Questa sostanza attraverso il peduncolo ipofisario , si accumula
nell'eminenza mediana e raggiunge l ipofisi . L ipofisi produce l FSH e l LH che
avranno un ruolo regolatorio sulle gonadi maschile e femminile . Quindi tutto
ciò che riguarda questo aspetto è sovrapponibile nei due sessi .
La differenza comincia nella struttura della gonade che è differente nel maschio
rispetto alla donna . Il testicolo produce come ghiandola endocrina testosterone
ed estradiolo, che sono steroidi sessuali però produce anche sostanze di natura
proteica cioè ormoni proteici cioè l ormone antimulleriano cioè l AMH, l
inibina B ( inhb) e l insulin like factor (INSL3 ) Che è un ormone gonadico con
una struttura molto simile all'insulina , ma è prodotto dal testicolo. nella gonade
femminile abbiamo gli stessi ormoni , estradiolo , testosterone inibina B quindi
sostanzialmente i prodotti sono gli stessi però vedremo gli effetti sono diversi .
Quindi noi ci occuperemo essenzialmente adesso della gonade maschile. Il
Gnrh si chiama cosi perchè GN sta per gonadotropin releasing hormon , perchè
l effetto principale è di rilasciare LH e meno sull FSH . Questi vengono
rilasciati in maniera pulsatile ,cioè c 'è un rilascio discontinuo nel tempo . Ogni
90 -120 min abbiamo c è la secrezione .questo corrisponde perfettamente alla
secrezione pulsatile del gnrh . se noi mettiamo in circolo costantemente un
ormone proteico questo va ad occupare costantemente i propri recettori e li
blocca. Questa è la regola generale degli ormoni proteici. : quando devono
agire devono agire in maniera discontinua, occupare il recettore e poi
disoccuparlo altrimenti non possiamo lavorare. Le gonadotropine , vi ricordo ,
sono ormoni proteici fatti da catene polipeptidiche .sono fatti da due catene
polipeptidiche alpha e beta . La differenza tra fsh e lh è legata alla subunità beta
che è specifica .quindi l ipofisi , le cellule ipofisarie gonadotrope hanno la
capacita di produrre alpha subunità, assemblano l alpha subunità alla beta
specifica quindi avranno una serie di meccanismi tali che portano alla
WWW.SUNHOPE.IT
produzione della gonadotropina. Ricordardiamo anche che la connessione tra
ipotalamo e ipofisi non è fatta direttamente dalle fibre cioè non sono i neuroni
che derivano direttamente dalle cellule gnrh produttori che arrivano
direttamente all'ipofisi ma questi neuroni si fermano all'eminenza mediana . Il
secreto cioè ilgnrh e il releasing factor specifico arriva all'ipofisi attraverso il
sangue refluo dall' eminenza mediana .c è un circolo venoso cosiddetto portale
che è un circolo venoso che diventa un circolo arterioso per un altro organo e
per altre cellule . Quindi il sangue refluo dall' eminenza mediana , raccoglie i
secreti delle cellule neuronali che producono il releasing factor arrivano
all'ipofisi anteriore e danno in questo caso lo stimolo alla produzione di fsh e lh
. Quindi se noi interrompiamo il peduncolo avremo un deficit di produzione
delle gonadotropine .Le cellule che producono il gnrh sono regolate
Certamente dai geni che stanno all'interno , ma la produzione discontinua, la
quantità che deve essere rilasciata ogni tanto sono regolate da in primis un
sistema di feedback negativo ,cioè la quantità di ormone periferico va a
determinare l attività di queste cellule che in questo caso per il testicolo l
ormone principale è Il testosterone. Il testosterone regola in maniera inibitoria
la secrezione ipotalamica di gnrh ,ma anche un effetto diretto sull ipofisi quindi
quanto più testosterone mettiamo in circolo meno LH c'è .lL altro ormone
regolatorio è l inibina B .l inibina è una proteina prodotta nel testicolo la quale
ha – il nome lo dice -un effetto inibitorio sull fsh, quindi l fsh è regolato
essenzialmente dall'inibina e l'inibina
agisce sull'ipofisi direttamente non sull'ipotalamo,mentre il testosterone agisce
sull'ipotalamo e sull'ipofisi e regola essenzialmente l lh. Quindi se noi togliamo
il testicolo a un soggetto abbiamo un incremento immediato delle
gonadotropine quindi lh e fsh . E questo rientra nel feedback negativo ma non
basta questa regolazione .C è una regolazione centrale che è data da questo
insieme di neuroni, ognuno porta una sigla per es . Sistema NE che sarebbe
neuroni di tipo catecolaminergico, il Gaba, il glutammato, le endorfine ,la
kisspeptina sono tutti neuroni che producono sostanze di tipo neuromodulatorio
,sono anche neurotrasmettitori ( il glutammato, il gaba le endorfine ) che hanno
effetto chi positivo chi negativo sul gnrh .ad es le endorfine hanno effetto
negativo , il glutammato positivo , il gaba negativo e cosi via . Importante
gruppo di neuroni che ha un ruolo centrale nel rilascio di gnrh è questo del
neurone kiss , neurone bacio , cosi chiamato per enfatizzare il ruolo della
riproduzione ma in realtà è un neurone che ha anche altri effetti .La
kisspeptina è una proteina prodotta da questi neuroni la quale va ad agire su i
recettori e va ad agire stimolando la produzione di gnrh .è considerato oggi il
principale regolatore della secrezione di gnrh . Sarebbe quello che dà la
secrezione di gnrh in pubertà quando noi dobbiamo sviluppare. e nella donna ha
un ruolo fondamentale nella modulazione nel mantenimento della produzione
discontinua di gonadotropine. Anche questo sistema può essere condizionato
WWW.SUNHOPE.IT
dagli ormoni periferici, molto evidente l' effetto dell'estradiolo prodotto
dall'ovaio sulla kisspeptina ma c' è anche un effetto nel maschio .Quindi il
principale fattore di regolazione dell'asse è il gnrh , quest'ultimo è regolato a
feedback negativo dai prodotti della gonade ,e a sua volta è modulato dal
sistema centrale . Anche lo stress la nutrizione l esercizio i cambiamenti
stagionali ambientali vanno attraverso queste vie centrali , il sistema sensoriale
attraverso la modulazione corticale ad agire sulla secrezione gonadotropinica
.Questo vi spiega perchè noi possiamo avere un amenorrea o un ipogonadismo
nel maschio per esempio in gravi condizioni di defedamento ,cambiamenti di
funzione legati allo stress possiamo avere cambiamenti di funzione legati
anche a momenti di tipo psicologico . Uno dei meccanismi nuovi è quello della
regolazione .in pratica il meccanismo è attraverso un recettore che ha a che fare
con la leptina , sapete che la leptina è un ormone prodotto dalle cellule adipose
per cui la quantità di grasso presente nell'organismo può andare ad a influenzare
il rilascio di gnrh . Anche per es le malattie croniche attraverso la modulazioe
delle citochine per es l IL -6 , IL-8 vanno ad agire poi sul sistema del gnrh e
vanno a modulare il rilascio. Questo spiega l ipogonadismo in caso di malattia
cronica oppure ipogonadismo nella grande obesità, nel grande obeso si può
avere un eccesso di leptina che va a inibire la produzione di gnrh .
Apparato riproduttivo maschile. parliamo del testicolo inteso come didimo cioè
la struttura che contiene i tubuli seminferi le cellule di leydig . E l epididimo
che è la struttura tubulare che trasporta poi il il prodotto dai testicoli ai deferenti
vescichette seminali prostata uretra e apparato penieno che permette la
riproduzione. L App. Gen. Maschile ha la funzione riproduttiva , maturazione
degli spermatozoi quindi sviluppo fisico che permette l'interazione sessuale e la
maturazione dell'apparato genitale. Il testicolo si forma nell'addome vicino l
abbozzo renale e scende verso il 2 ^-3^ mese nel canale inguinale e nell ultimo
trimestre si va a posizionare nello scroto all'esterno . un 6-8%dei bambini ha il
testicolo ritenuto poi dopo un anno scende . Il testicolo deve stare all'esterno
perchè la produzione di testosterone la funzionalità delle cellule di leydig è
possibile solo a una T di 34,5° ,inferiore a quella corporea .Mentre l ovaio non
ha questa necessità ,l ovaio funziona per la sua steroidogenesi a T corporea .La
gran parte della struttura testicolare è fatta dai tubuli seminiferi . Quando
parliamo di volume del testicolo ci riferiamo al patrimonio dei tubuli cioè alla
capacita di produrre spermatozoi perchè nei tubuli ci sono tutta una serie di
cellule che portano a produzione del testosterone ,pero poi nel testicolo da
clinici da medici includiamo anche l epididimo che in relata è una ghiandola
accessoria . I tubuli sono strutture circonvolute ,ogni tubulo è avvolto in un
lobulo ogni lobulo sbucain un dotto retto a livello della rete testis , la rete testis
continua nell'epididimo che è un unico tubulo circonvoluto che continua col
deferente , struttura tubulare che passa attraverso la prostata arriva all'uretra che
porta fuori le secrezioni del testicolo , più altre secrezioni sia dell'epididimo che
WWW.SUNHOPE.IT
delle vescichette seminali che della prostata .Il tubulo è rivestito da cellule ,
all'estremità ci sono gli spermatozoi e le cellule immature sono varie
componenti della linea spermatogenetica e tra una linea di cellule in
maturazione ci sono cellule molto grosse sono le cellule di sertoli .queste
ultime tappezzano il tubulo fanno da architrave del tubulo ,sono quelle che
sostengono il tubulo . Tra i tubuli affacciati ci sono le cellule interstiziali cosi
chiamate perchè situate tra i tubuli e l interstizio oltre che fatto da fibroblasti
cellule miotiche è fatto da cellule di tipo rotondeggiante , le cellule di leydig
sono le cellule steroidogenetiche del testicolo . Sono vere e proprie componenti
endocrine del testicolo .il tubulo produce essenzialmente spermatozoi pero oggi
sappiamo che il tubulo produce anche l inibina B ,produce l AMH ( INSL 3
sempre prodotto dalle c.di leydig ). quindi la componente endocrina è l
interstizio ,la componente esocrina è rappresentata dal tubulo .le cellule di
Sertoli hanno funzione nutritizia , fanno la barriera emato-testicolare
,esprimono il recettore x l fsh .quindi tutta la regolazione della spermatogenesi
sotto il controllo dell' fsh avviene per le cellule di sertoli .le cellule di leydig
sono le cellule steroidosecernenti che producono testosterone estradiolo ( in
minore quantità rispetto all'ovaio ) ha il recettore per lh .e produce l INSL 3 che
è un ormone proteico coinvolto nella regolazione della spermatogenesi .
Qua vedete bene come le cellule spermatogenetiche si intromettono tra le
cellule di leydig e le cellule della spermatogenesi mature e alla fine verso il
lume del tubulo troviamo gli spermatozoi che vengono rilasciati . Questa
ovviamente è una sezione di tubulo maturo cioè di un soggetto post pubere ,
nella pre pubertà non troviamo gli spermatozoi .è importante ricordare che noi
partiamo dallo spermatogonio che l è la cellula staminale , lo spermatogonio
diventa spermatocita primario e questo è lo stadio in cui fermano gli
spermatozoi fino alla pubertà .con la pubertà comincia la trasformazione in
spermatociti secondari che hanno contenuto aploide , e da questi deriveranno gli
spermatidi , e infine gli spermatozoi.
Tra una cellula di sertoli e l 'altra ci sono le giunzioni strette che realizzano la
barriera ematotesticolare .Gli spermatogoni sono il punto di partenza la materia
prima.
se abbiamo un insulto che distrugge il patrimonio non saremo in grado di
ricostruirlo perchè le staminali sono fuori della barriera ematoesticolare .
Questo è un concetto da ricordare perchè da adulto se c è stato un insulto
nell'epoca pre puberale possiamo non poter ripristinare la riproduzione . Lo
spermatocita staminale diventa pallido, più chiaro ed è quello committed che
passa all interno della cellula di sertoli che sarà quello capace di diventare
spermatocita e poi spermatozoo .quindi dobbiamo avere un patrimonio
sufficiente di queste cellule . Ognuno di questi alla pubertà si riproduce dando
cellule figlie da queste origineranno spermatociti di tipo 2 , aploidi ,ognuno di
loro darà 2 spermatidi e quindi due spermatozoi quindi da una cellula pallida
WWW.SUNHOPE.IT
avremo 4 spermatozoi . Nella donna c 'è un patrimonio fisso di ovociti che
viene consumato dalla pubertà fino alla menopausa, nel maschio questo
processo produttivo di cellule è continuo. Quando però un insulto distrugge
questo sistema oppure prima della nascita l accumulo delle cellule madri è
compromesso la spermatogenesi è ridotta . Altro elemento che riduce la
spermatogensi è il numero di cellule di sertoli . Queste sono cellule terminali .
Abbiamo un piccolo incremento alla pubertà .i determinanti del numero degli
spermatozoi sono due il numero di cellule di sertoli e il numero di cellule
pallide ( quindi spermatociti primari ) che riesco ad accumulare fino alla
pubertà. Alla pubertà scatta un meccanismo ,per cui non posso più utilizzare la
moltiplicazione .il processo maturativo che abbiamo descritto avviene tutto nel
tubulo . Ed è regolato da Fsh in primis perchè è quello che determina la
moltiplicazione dei cicli e l lh che agisce sulla cellula di sertoli .l Altro
elemento è il testosterone , il testosterone agisce sempre attraverso la cellula di
sertoli ma è il testosterone prodotto dalla cellule di leydig ,quindi avviene una
cooperazione nel testicolo, non è il testosterone circolante. Quindi se io ho un
uovo a cui tolgo le cellule di leydig e gli do testosterone dall'esterno ..non ho la
possibilità di far maturare gli spermatozoi perchè il testosterone circolante non
Entra nella barriera ematotesticolare a livelli tali da determinare questo
processo . È una regolazione paracrina cioè un sistema dove una cellula
un'attività in loco agisce su un altra attività in loco . Quindi il testosterone è un
ormone ma è anche una sostanza paracrina della produzione degli spermatozoi .
Questa spiega perchè quando devo fare la terapia per indurre la spermatogenesi
negli ipogonadici noi dobbiamo dare non il testosterone ma l fsh che
stimola le cellule di leydig l hcg o lh ( perchè l hcg è simile all lh di cui
disponiamo a livello terapeutico - abbiamo un lh ricombinante ma non si usa ).
L hcg che va a stimolare la funzione del testosterone determinando la funzione
spermatogenetica. Ricordiamo che la produzione di testosterone che avviene
nella cellula di leydig , processo di steroidogenesi estremamente complesso,
ricordo che si parte dal colesterolo ,taglio della catena laterale e intervento
della 17 idrossilazione fino alla produzione del testosterone .il testosterone è un
prodotto che passa attraverso una serie di vie metaboliche che sono comunque
comuni alla produzione dell'estradiolo ,comuni alla produzione del
progesterone che voi sapete è un ormone tipico della donna , in gravidanza
soprattutto. Produzione di sostanza intermedie fino alla produzione del 17 a
diidrossi testosterone , tipici del surrene . Quindi la steroidogenesi è un
processo comune all'ovaio al surrene e vedremo alla placenta quindi certi
meccanismi sono uguali. Nel testicolo abbiamo una specificità della 17 beta
deidrodedrogenasi di tipo 3 che toglie converte i prodotti intermedi in
testosterone . Quindi abbiamo la capacità di produrre grandi quantità di
testosterone .il testosterone ha un destino importante per la produzione di
spermatozoi. il testosterone viene trasformato ad opera dell aromatasi cyp 19 in
WWW.SUNHOPE.IT
estradiolo ( LA struttura è molto simile ), poi ad opera della 5 alpha reduttasi in
DHT . IL DHT non ha questo doppio legame nell'anello uno ed è un ormone
androgeno più potente che abbiamo , è quello che fa crescere la peluria, fa
sviluppare i genitali esterni in senso maschile . La crescita della prostata ,la
crescita della cute inteso come crescita dei follicoli, è condizionata dal DHT .
Invece l estradiolo ha effetto sulle ossa ,sulla differenziazione sessuale del
cervello , cioè sull'orientamento sessuale maschile sono condizionati dalla
conversione del DHT in estradiolo .l' estradiolo ha importanza anche in alcuni
processi metabolici per es quelli dei lipidi , nell'aterosclerosi .il testosterone
serve anche per es per la forza muscolare , il controllo della quantità di g .rossi,
emopoiesi , il testosterone serve per una serie complessa di fenomeni maturativi
. Es nel maschio inibizione della mammella che non si sviluppa. L'attività
dell'asse ipotalamo ipofisi testicolo è molto attivo nel terzo trimestre crolla alla
nascita , nell'infanzia è disattivato alla pubertà comincia a riattivarsi e diventa
reattivo nella maturità . Nel maschio, mentre nella donna c'è un crollo nella
menopausa, nell'invecchiamento c è un calo progressivo . Abbiamo la
differenziazione e la discesa dei testicoli perchè per questo ci vuole molto lh
molto testosterone, molto INSL3 ; abbiamo la maturazione dei caratteri sessuali
somatici , poi c'è la pubertà abbiamo bisogno di un sacco di testosterone INSL 3
e inibina B per la spermatogenesi . Nell' adulto idem,nell invecchiamento il
testosterone comincia a scendere , non è che non ne abbiamo bisogno è l
adattamento del sistema per evitare danni ad altri organi ,è una protezione
.Qualcuno ha messo in mezzo la storia dell'andropausa dicendo siccome il
vecchietto dopo una certa eta comincia a somigliare all'ipogonadico allora si
dice “ mah , sarà perchè perde testosterone “ allora diamogli testosterone e
questo diventa arzillo e giovane e campa più a lungo , proprio la settimana
scorsa una segnalazione su jama diceva di fare attenzione perchè le persone che
hanno avuto un infarto sono proprio quelle che fanno testosterone rispetto a
quelli che non lo fanno , quindi attenzione . Se noi abbiamo che i livelli di
testosterone si abbassano per un meccanismo di protezione , non è una
patologia quindi vuol dire che il sistema è fatto cosi e lo dobbiamo rispettare .
A cosa serve tutto quel testosterone dal terzo trimestre fino alla nascita ? serve
a far crescere il volume testicolare ,a far crescere lo scroto e l asta .questo
sistema è importante ed è proprio quello con cui cresce il volume del testicolo ,
cioè noi ci creiamo un patrimonio che serve per la spermatogenesi e la
maturazione dei genitali esterni ovviamente questa maturazione riprenderà alla
pubertà. Ma è nei primi anni di vita , che si raddoppia la crescita . Quindi se
ho perso la crescita fetale e quella del primo anno questo recupero non potrà
più avvenire. lo stesso vale per i genitali intesi sia come volume del testicolo sia
come dimensioni dell'asta .è importantissimo questo concetto per tutta una
ricaduta di tipo terapeutico ma proprio di basi .bisogna partire da queste basi e
non dire al pz guarda sei fregato non puoi fare più niente .ci sono una serie di
WWW.SUNHOPE.IT
cose che si possono fare ma tranquillizzare il pz è importante. Perchè nel terzo
trimestre abbiamo un pò di testosterone in più ? Nella prima fase il testosterone
è condizionato dal hcg della placenta , nella seconda fase è condizionata dall lh
,fsh ipotalamo ipofisario .ricordo una cosa molto importante che alla nascita noi
abbiamo nei maschi questo incremento dell'inibina dell'fsh dell' lh che
assomiglia, se andiamo a vedere ai livelli di testosterone di un adulto , cioè il
bambino nel primo trimestre ha testosterone come un adulto .Esso serve per la
crescita del testicolo e del asta questo fenomeno si chiama minipubertà poi si
azzera entro i 6 mesi .Quindi dosando i livelli di testosterone in questa fase
possiamo fare diagnosi di ipogonadismo , molto utile se abbiamo un bambino
con micropene , cioè con l asta molto piccola ,criptorchide, posso vedere in
questa fase e dire guarda è ipogonadico e poi trattarlo . È in questa fase che il
pene raddoppia di dimensioni , un pò come la statura . Invece il numero delle
cellule di sertoli cresce durante il periodo neonatale poi si ferma e cresce un
altro poco alla pubertà . Quindi anche il nostro patrimonio spermatogenetico è
condizionato da tre meccanismi . Noi ci prendiamo il patrimonio alla nascita lo
aumentiamo un pochino alla pubertà però poi non possiamo fare più niente .
Testosterone e dht agiscono attraverso recettori nucleari , si legano a un dimero
fatto da due recettori , poi a un androgen responsive element . È importante
conoscere il meccanismo perchè se alterato il sistema non funziona . Ultimo
concetto è che il testosterone viene veicolato dalla shbg in gran parte, e
dall'albumina quindi quello disponibile è rappresentato da quello libero , questo
legato alla shbg è veicolato ma non interagisce con i tessuti .l shbg è il
conservatore principale del testosterone .quando dosiamo il testosterone noi
dosiamo il totale non sappiamo quello biodisponibile , altrimenti dovremmo
dosare per dialisi quello free cioè lo 0,5 -3 per cento .questa tecnica di
dosaggio non è una tecnica disponibile attualmente, per cui si utilizza un
testosterone libero .vale la pena chiedere il dosaggio della shbg e c'è una
formula( a questo sito :www.issam.ch). Quello che dovete ricordare che la shbg
diminuisce nell'obeso ,nel diabete mellito ,nella sindrome nefrosica perchè si
perdono le proteine , utilizzo di glucocorticoidi ,di progestinici o androgeni ,
nell'ipotiroidismo, nell'acromeglaia , nei deficit familiari . Aumenta con l
invecchiamento , nel vecchio troviamo un testosterone tot apparentemente più
elevato perchè aumenta l'shbg e si riduce il libero , nella cirrosi ,nelle epatiti , l
uso degli estrogeni .questo spiega perchè nelle donne diamo la pillola (per
cercare di bloccare il testosterone )nell ipertiroidismo , gli anticonvulsiavanti
,nell HIV. In queste condizioni il dosaggio di testosterone tot potrebbe essere
fasullo. È importante calcolarsi in queste condizioni in particolare nell'obeso e
nell'ipertiroideo calcolarsi il testosterone libero partendo dall'shbg e dal
testosterone tot . Per es la chiusura epifisaria fatta dal testosterone quando
diventa estradiolo . Se noi abbiamo un deficit di aromatasi abbiamo carenza di
estrogeni , e ci allunghiamo, diventiamo molto alti.
WWW.SUNHOPE.IT
L' ipogonadico è quello che non ha il testosterone , ma avrà un deficit parziale
o totale con compromissione della spermatogenesi . Dividiamo l'ipogonadismo
in : ipogonadotropo e ipergonadotropo . Il danno può essere centrale a livello
ipotalamo ipofisario oppure periferico e quindi mancare il feedback negativo .
Qual è la differenza ? Sostanzialmente biochimica perchè la forma primaria
abbiamo un incremento di fsh e lh ,mentre la forma secondaria avremo una
carenza di fsh e lh e quindi di conseguente il quadro periferico è sovrapponibile
alla primaria ma la differenza la fa il livello di gonadotropine .i due
ipogonadismi sono uguali in termini periferici ma cambieranno nei livelli delle
gonadotrropine , nell' uno alte nell' altro basse rispettivamente.
Un 'altra classificazione più tile sul piano clinico è quella sul tempo di
comparsa . Distinguiamo la forma classica a
comparsa precoce caratterizzata dall'ambiguità dei genitali perche viene
compresso il periodo maturativo dell'ultimo trimestre di gravidanza, forma
classica a comparsa in epoca adolescenziale che compromette l attività sessuale
nella fase in cui si deve utilizzare , e forma non classica a comparsa tardiva
che riguarda il vecchietto la persona che supera i 65anni dove ci si aspetta che
la persona vada in declino . In quella fase della vita il calo riguarda alcuni
aspetti funzionali .
Se il calo avviene duranti il periodo maturativo è qualcosa di congenito
,congenito non significa genetico ma probabilmente genetico,invece quello
nell'età adulta avviene dopo che la maturazione genitale è già avvenuta
quindi non c'è micropene , il ragazzo però non matura resta prepubere , l
adulto non ha la spermatogenesi , non ha l efficienza sessuale . Invece il
soggetto anziano che ha già avuto la pubertà , fatto figli,avrà una riduzione
della capacità sessuale riduzione della spermatogenesi avrà alterazione della
composizione corporea , Alterazioni metaboliche connesse all'età.
Nelle forme classiche che ci aspettiamo che il pz abbia o un' ambiguità dei
genitali o un volume testicolare ridotto o ritardo o assenza dello sviluppo
puberale . Quindi noi abbiamo di fronte un pz con ipospadia criptorchidismo,
micropene ,ambiguità dei genitali oppure a 16 anni non ha sviluppato pensiamo
ad un ipogonadismo precoce o molto precoce . Se invece viene una persona di
60 anni con diminuzione di rughe , di peli al viso , aumento della massa grassa,
osteoporosi , disfunzione erettile , perdita della libido pensiamo a un
ipogonadismo tardivo da stabilire se primario o secondario , e questo lo
facciamo dosando le gonadotropine se sono basse è secondario se no primario .
Ipogonadismo centrale ,quindi danno ipotalamo ipofisario caratterizzato da
bassi livelli di fsh e lh dovuta a una forma congenita che comprende la
sindrome di kallman e l ipogonadismo congenito isolato normosmico.
Le forme acquisite, tumori ipofisari ,malattie granulomatose , emosiderosi , i
talassemici portano a un incremento del Fe , ipogonadismo ,radiazione al cranio
( es nella leucemia ), sempre più soggetti che hanno avuto irradiazione del
WWW.SUNHOPE.IT
cranio per la leucemia infantile e hanno sviluppato ipogonadismo .Le forme
funzionali possono essere dovute a malattie sistemiche , fibrosi cistica, anemia ,
disalimentazione , sport intenso ,morbo di cushing .Tutte queste malattie
provocano un crollo della secrezione delle gonadotropine attraverso un
cambiamento dei modulatori . Sono funzionali perchè non c' è difetto
anatomico .
L ipogonadismo ipogoandotropo congenito isolato è rappresentato dalla
sindrome di kallman . È molto raro 1:10000-80000 è colpito molto più l'uomo ,
può essere familiare o sporadico :l altezza è normale , le proporzioni
scheletriche sono enucoidi cioè l apertura alare delle braccia supera di 5 cm l
altezza e se noi misuriamo l altezza seduta dal vertice al posizione assisa cioè al
coccige questa è inferiore a quella dal pube a terra . Il pz spogliato ha manoni
che scendono fino alle ginocchia ,e si capisce che è un a forma congenita , alla
nascita . Nella sindrome di kallman c è l anosmia invece nell'altra no .c'è la
questione dell'olfatto , perchè nel bambino l organo vomero nasale è anche la
sede di neuroni staminali che migrano e vanno a localizzarsi nell'encefalo .
Oggi anzi ci sono evidenze che nelle nostre mucose nasali che ci sono cellule
potenzialmente trasformabili in neuroni , qualcuno dice se abbiamo bisogno di
neuroni se li perdiamo li prediamo dal naso – ma io non ci credo . Questi
neuroni migrano attraverso la lamina cribrosa dell'etmoide attraverso il bulbo
olfattivo e raggiungono l ipotalamo .
nel bambino con la sindrome di kallman si fermano nell'organo vomero nasale
qui avremo una condizione di anosmia che i nostri non passano la lamina non
attraversano il bulbo non si localizzano nell'ipotalamo e non generano la sintesi
delle gonadotropine . In tutto questo sono coinvolti una serie di geni che sono
coinvolti nella migrazione dei neuroni e sono kall 1 ,chv 7 ,.il primo gruppo
darà la kallmann, l'altro l'ipogonadismo ipogonadotropo .queste due condizioni
rispecchiano l alterazione di uno stesso fenomeno . Alcuni di questi geni sono in
comune nelle due sindromi . Una stessa mutazione può provocare o la forma
normosmica o l altra anosmica .Alcuni geni danno sempre l anosmia , es kal1
,altri no . Un'altra cosa da sottolineare noi copriamo un 35 % dei casi quindi c'è
un 70 % che ha questo problema . Alcuni di questi pz hanno anche alterazioni
di tipo motorio perchè sono alterati i neuroni motori , il sistema generale viene
compromesso .la sindrome di kallman è rara può essere autosomico dominante
o recessiva assenza dello sviluppo puberale , alla puberta non sviluppano ,
avranno : micropene, testicoli piccoli ,altezza normale ,lh fsh bassi anomalie
del bulbo alla rm .possono presentare anche discinesie , agenesia del rene ,
labiopalatoschisi , agenesia dentale anomalie dell'orecchio , ciò vuol dire che
quei geni sono coinvolti nella morfologia di altri organi .chi ha fcf 8mutato
hanno labiopalatoschisi .il kallman si presenta con testicoli piccoli , questo
ricorda che lo sviluppo dei testicoli comincia a undicianni . In un soggetto dove
il processo non parte sarà un ipogonadismo e sarà un kallamn perchè andremo
WWW.SUNHOPE.IT
a fare un test olfattivo, andremo a vedere se sente gli odori .nella sindrome di
kallman il gnrh viene prodotto con picchi bassi durante la notte o zero picchi .
Altro elemento caratterizzante è l aplasia dei bulbi alla RM . Altro elemento è
il meccanismo delle sincinesie , si chiede al pz di toccare con il pollice le altre
dita a scalare ma solo a una mano , lui lo farà anche con l altra .C'è una
gradazione di questo fenomeno . Noi abbiamo questo fenomeno perchè al area
motoria di sn comanda quella di dx e viceversa , perchè le parte delle fibre
corticospinali decussano e altre no sono dirette , si pensa che ci sia una
decussazione sbagliata . Ma c'è un altro fenomeno che vede l integrazione delle
due aree motorie cioè se attiviamo il dx si attiverà anche il sn. Dovuto a
decussazione parziale del fascio corticospinale e difetto di inibizione
transcallosa dell'area motoria primaria e supplementare . Questo scambio di
informazione è alterato . Alterazione della connessione interemisferica .
Ipogonadismo ipogonadotropo , solo tubulare . Maschio perfetto ma non
produce gli spermatozoi ,sono gli uomini infertili sono gli ipogonadici isolati
.,possiamo avere un soggetto che ha attività steroidogentica bassa quindi
produce poco testosterone avràun ipogonadismo parziale .incremento fsh lh
testosterone basso . Quella che descrivermeo è la Sindrome di klinefelter .
Dovuta a aneuploidia dell 'X. Doppio X nel maschio , quindi XXY. La
prevalenza prenatale è 1:667 maschi e quella postnatale 40:80000maschi . Il 2-3
% dei maschi infertili sono affetti dalla sindrome ,condizione compatibile con la
vita di relazione e sociale .Dal punto di vista clinico il pz affetto presenta
testicolo piÙ piccolo, infertilita, ginecomastia, arti allungati . Da bambini
queste differenze non si vedono ,il bambino può avere un ritardo nel linguaggio
, dislessia , difficoltà di apprendimento , problemi psicosociali o
comportamentali . Se ne accorgono le maestre .
Se supportiamo questi ragazzi con adeguato supporto molte delle difficoltà
vengono superate .
La diagnosi come si fa , dosiamo il cariotipo , lh fsh , se nasce un bambino con
micropene dobbiamo dosare gli ormoni , si deve misurare il pene tirato dalla
sinfisi pubica si parla di micropene se inferiore ai 2,5cm. La differenza tra un
ritardo puberale kallman o klinefeleter si va a fare l analisi del cariotipo. Si farà
una analisi genetica dopo aver fatto il test olfattivo . Vi ricordo che verranno i
genitori dicendo che il bambino non ha sviluppato .la pubertà comincia a 11
mezzo , fino a13e mezzo . La differenza di presentazione tra un bambino e un
ipogonadico non esiste tranne che non sente gli odori. È importante sapere
quando si sviluppa normalmente .
Ipogonadismo a comparsa tardiva . Non esiste l andropausa nel maschio
.Nell'uomo c'è un calo di testosterone dopo i 60 % .si accompagna all'aumento
del grasso viscerale , disfunzione erettile , insorgenza di malattie
cardiovascolare , calo della libido ,testicoli piccoli e molli , tendenza
all'osteoporosi ,ma sono tipici dell'anziano. Come facciamo diagnosi ?
WWW.SUNHOPE.IT
dobbiamo tenere conto del valore di testosterone , valore soglia 2,3 ng xml.
Terapia ,per la fertilità diamo hcg e fsh , se invece vogliamo la
normalizzazione dell'attività sessuale diamo il testosterone , ma cosi non
abbiamo la spermatogenesi .
WWW.SUNHOPE.IT
ENDOCRINOLOGIA
28/11/2013
Prof.re Sinisi
Borrelli Carola
IPOGONADISMI FEMMINILI
L’argomento di oggi sono gli ipogonadismi femminili. Noi abbiamo parlato già dell’ipogonadismo al
maschile, vi ho spiegato che l’asse ipotalamo-ipofisi-gonade ha questa peculiarità, cioè di essere diverso a
seconda del sesso,però la sostanza nella regolazione,cioè i meccanismi fondamentali ,sono gli stessi, per cui
nel nostro discorso alcune cose sono facilitate. Vi ricordo che ,quando parliamo di gonade al
femminile,intendiamo l’ovaio,che ha una funzione endocrina,ovvero produce estrogeni e androgeni,come
il testicolo; la differenza sta nel fatto che nell’ovaio la produzione degli estrogeni è superiore a quella
maschile e a quella degli androgeni,l’inverso si ha invece nel sesso maschile. L’altra funzione dell’ovaio
maturo,cioè della donna che è arrivata alla pubertà, è quella ovulatoria, cioè di produrre i gameti e la
differenza rispetto al maschio qual è? È che la produzione del gamete nella donna è discontinua
apparentemente, cioè avviene un’ovulazione al mese,ad ogni ciclo, mentre nell’uomo abbiamo una
produzione di spermatozoi, cioè di gameti, continua.In realtà anche la produzione dell’ovocita è continua,
nel senso che, durante tutto il periodo riproduttivo della donna, ci sono ovociti che vanno in maturazione,
però uno solo diventa dominante ed è quello che viene utilizzato nella fecondazione. Quali sono le
condizioni che poi dirigono queste due funzioni? Intanto la differenziazione sessuale,cioè la possibilità che
il feto,che ha il suo imprinting genetico per diventare femmina,diventi realmete femmina;la maturazione
puberale, cioè al momento dello sviluppo, a una certa fase della vita del soggetto,avviene la maturazione
dei caratteri sessuali secondari e nella donna abbiamo l’altra peculiarità (oltre ai genitali femminili) che è la
crescita della mammella e della peluria, localizzata solo al triangolo inferiore,il tutto si accompagna a delle
modifiche corporee diverse da quelle del maschio (basti pensare al differente spessore della muscolatura o
alla quantità di osso),dipendenti dagli estrogeni. Un altro effetto degli estrogeni è quello sistemico (voi non
dovete pensare che la gonade,questo vale per entrambi i sessi,abbia effetti solo sulla riproduzione, solo
sull’apparato genitale o su alcuni aspetti del morfotipo) come a livello cardiovascolare o della stessa salute
ossea o a livello della funzione cerebrale, tant’è vero che sembra che le carenze estrogeniche del periodo
post-menopausale siano la base di una maggiore prevalenza di disordini cerebrali,tipo l’Alzheimer, o della
comparsa di alterazioni cardiovascolari, come infarto e aterosclerosi (proprio per il venir meno dell’effetto
protettivo di questi ormoni).Tali ormoni sono quindi utili, oltre che alla riproduzione, anche per il benessere
generale. La regolazione dell’ovaio come avviene? Avviene attraverso un meccanismo che è sovrapponibile
a quello del mashio:il GnRH che va a indurre, a livello dell’ipofisi ,la secrezione di gonadotropine (FSH e LH)
, che vanno a regolare entrambe la funzione dell’ovaio,dove promuovono la crescita del follicolo fino alla
maturazione dell’ovocita e all’ovulazione, poi inducono la produzione di estradiolo e progesterone. A cosa
servono questi ormoni? Servono a regolare la crescita dell’endometrio,cioè della mucosa uterina, per
favorire l’attecchimento dell’ovocita,qualora questo sia stato fecondato e si sia formato l’embrione. Gli
ormoni circolanti hanno anche un ruolo di autoregolazione del sistema, attraverso un meccanismo di
feedback negativo:abbiamo visto che nell’uomo testosterone e estradiolo regolavano l’FSH e l’LH,
attraverso un’azione sul GnRH o sull’ipofisi…lo stesso avviene nella donna, anche qui con coinvolgimento di
sostanze come activina e inibina,quindi la periferia,l’ovaio,frena le produzioni centrali, per cui quando
avremo un danno ovarico,ci sarà l’incremento delle gonadotropine e quando avremo un danno centrale, ci
sarà scarsa funzione periferica: questo è un paradigma identico a quello dell’uomo. Chiaramente c’è la
differenza del fatto che, come tutti sapete, le ragazze,raggiunta la pubertà, iniziano ad avere il ciclo
mestruale, espressione di una ciclicità del sistema, cioè il sistema non è continuo ,come nell’uomo, ma ha
una sua periodicità, vista nell’accezione più pratica nella comparsa della mestruazione(di solito ogni 28
WWW.SUNHOPE.IT
giorni) o dell’ovulazione( che avviene intorno al 14° giorno). Per realizzare questo fenomeno il nostro
sistema di regolazione ha delle peculiarità: una di queste riguarda queste frecce con il + ( indica la slide),
che rappresentano l’effetto stimolatorio sulla centralina di regolazione ipofisaria. Quindi nella donna c’è
anche questo meccanismo a feedback positivo, cioè l’aumento progressivo degli ormoni circolanti invece di
bloccare, a un certo punto del sistema, ha un’azione stimolante, di rilascio ed è proprio questo il
meccanismo per cui, a metà ciclo, c’è il picco ovulatorio dell’FSH e dell’LH, c’è lo scoppio del follicolo, c’è
l’ovulazione e quindi tutta una serie di conseguenze.
Domanda: consideriamo feedback positivo anche l’incremento degli ormoni ipofisari che si ha quando
quelli periferici sono bassi o assenti (tipo del TSH in caso di ipotiroidismo primario)?Risposta: Le definizioni
sono una questione semantica, togliendo gli ormoni tiroidei abbiamo sì un effetto positivo sul TSH, ma è il
frutto, in realtà, del venir meno di un meccanismo negativo (feedback negativo),cioè ,nel momento in cui
tu ammetti che il livello dell’ormone tiroideo circolante blocca il TSH,sarà di conseguenza automatico il
concetto che, se tolgo gli ormoni tiroidei,il TSH aumenta.
Quando aumenta progressivamente l’estradiolo, ci aspetteremmo che l’LH e l’FSH si azzerino, coma mai hai
invece il picco? Per spiegarci questo si è ipotizzato un effetto positivo, di cui oggi ci sono evidenze
molecolari ed è tipico della maturazione puberale della donna,non c’è nella bambina: se tu prendi una
bambina e le dai gli estrogeni azzeri le gonadotropine, se invece la prendi appena inizia a presentare il ciclo
mestruale hai un effetto inibitorio, perché il feedback ancora non è maturo; matura nel tempo, tant’è vero
che voi sapete che è frequente che l’adolescente non ovuli, ma questo non è vero sempre (se andiamo per
esempio in una comunità Rom è facile trovare ragazze di 14 anni che hanno già due figli!esiste quindi una
variabilità individuale nei tempi di maturazione, statisticamente su 100 ragazze di 14 anni, il 50% non ha
ovulazione). Quando il sistema a feedback positivo è giunto a maturazione si hanno le ovulazioni e la donna
diventa fertile;se c’è un’alterazione di questo sistema, la donna diventa anovulante: si tratta della patologia
dell’anovulazione in cui la donna ha il ciclo mestruale di 28 giorni, ma non ovula perché non ha il picco
dettato dal feedback positivo. Lo capiremo adesso…gli estrogeni e il progesterone a che servono? Servono a
far crescere la mucosa uterina e questo a che serve? A far annidare l’ovocellula fecondata, per cui noi
distinguiamo due momenti del ciclo (che è di 28 giorni per convenzione):l’endometrio prolifera nei primi 14
giorni sotto l’effetto dell’estradiolo, poi diventa secretorio,cioè produce secrezioni,si inspessiscono le
ghiandole, sotto l’effetto del progesterone, negli ultimi 14 giorni. Quando il progesterone crolla (dopo il
24°-25° giorno) l’endometrio non si mantiene più e abbiamo la mestruazione. Quindi noi possiamo
ricondurre il ciclo a due momenti: una fase proliferativa o follicolare e una secretoria o luteale; e i due
momenti da cosa sono caratterizzati: il primo momento dall’incremento progressivo dell’estradiolo e il
secondo dall’aumento progressivo del progesterone. Allora la regola è: l’ovaio produce nei primi 14 giorni
estradiolo, poi lo continua a produrre ma di meno e si attiva a produrre soprattutto progesterone. Ma chi è
che nell’oviaio fa questo?allora vediamo…(riferendosi alla slide) questo è il follicolo primario,il follicolo
immaturo,che hanno tutte le donne dopo la seconda metà della gestazione,cioè si forma già nell’embrione;
alla nascita le donne hanno circa 400000 follicoli, alla pubertà ne hanno 4000, di questi 4000 a ogni ciclo ne
spendono apparentemente uno, in realtà una decina, ma solo uno diventa ovocita dominante, quindi se
una donna ha una vita riproduttiva di 40 anni, 40 x 10, perché non tutti i cicli sono ovulatori, spende 400
follicoli,ne aveva 4000,alla menopausa ne ha 0, ciò vuol dire che non spende ogni ciclo un follicolo ma una
decina in modo tale che quella coorte che parte diventi attiva, ma uno solo dei follicoli progredisca, gli altri
vanno in apoptosi. ( il calcolo non mi è per niente chiaro,penso che avrebbe dovuto dire “40x12” cioè gli
anni di attività riproduttiva per i mesi dell’anno e poi confrontare il numero,480, con i 4000 a
disposizione)Che cosa voglio dire con questo? La donna parte con un patrimonio follicolare di una certa
maniera,a ogni ciclo una decina di follicoli comincia a attivarsi (ah che bello mo diventiamo ovociti!!!), alla
WWW.SUNHOPE.IT
fine solo uno lo diventa,perché si verifica? Perché uno di questi follicoli cresce progressivamente e nella sua
crescita produce l’estradiolo, determinando la crescita dei valori di estradiolo e a metà ciclo, per una serie
di eventi,che adesso diciamo,si rompe questo meccanismo,l’estradiolo non si produce più, si rompe il
follicolo e si libera l’ovocita che, se ha la fortuna di incontrare lo spermatozoo,forma l’embrione e si
impianta sull’endometrio, se no va a farsi fottere pure lui! Le cellule follicolari che rimangono dopo
l’ovulazione che fanno? Diventano cellule biancastre (per questo si chiama corpo luteo) e producono
progesterone e sono biancastre proprio perché si accumula grasso ( il progesterone,che è un metabolita
intermedio del metabolismo degli steroidi, ma anche un ormone,deriva dal colesterolo). La finalità è quella
di far crescere l’endometrio, di mantenerlo per l’eventuale impianto dell’ovocita fecondato; quando non
avviene l’impianto e quindi non c’è la produzione di hCG,che sostiene il corpo luteo,quest’ultimo
regredisce,va in atrofia e il conseguente crollo del progesterone porta alla mestruazione. A comandare
tutta questa storia chi è? Sono le gonadotropine, i famosi LH e FSH. L’FSH aumenta nella prima fase,poi
scende,poi torna a risalire a metà ciclo,poi scende e poi progressivamente ricresce poco prima della
mestruazione e quindi del nuovo ciclo,poiché,per convenzione,ogni ciclo inizia al primo giorno di
mestruazione. Che significa tutto questo? Significa che l’FSH è il regolatore della crescita del follicolo,è
quello che fa aumentare progressivamente i follicoli, a metà ciclo contribuisce allo scoppio del follicolo,poi
la sua caduta favorisce la formazione del corpo luteo,alla fine la nuova crescita dell’FSH che significato
ha?Significa che si sta attivando un nuovo ciclo e questo FSH serve per preparare di nuovo i follicoli per il
prossimo ciclo. Questo è il motivo per cui dicevo che non è vero che nella donna abbiamo la discontinuità,
anche le donne hanno un continuum,hanno ovociti che stanno continuamente allertati,pronti per andare
avanti, però solo uno riesce a farlo nel corso di un mese, gli altri muoiono. Quindi anche le donne
hanno,come gli uomini con gli spermatozoi,gameti che si fanno avanti in questa arrampicata sociale però
solo uno ce la fa e tutto è regolato dall’FSH. E allora l’LH che fa? È basso all’inizio, aumenta poi
all’ovulazione,in corrispondenza della quale abbiamo un picco enorme di LH e questo coincide con la
rottura del follicolo, quindi capite già come la rottura del follicolo è opera dell’LH ( è uno “scassambrello”
,arriva e scassa tutto), che poi blocca la produzione di estradiolo,promuovendo quella di progesterone ed è
proprio il crollo dell’estradiolo che fa sì che tutto il sistema si reverta in questa situazione; successivamente
i suoi livelli scendono, ma ce ne vuole comunque un po’, in quanto l’LH è quello che controlla la
steroidogenesi, anche se per produrre l’estradiolo il ruolo dominante è quello dell’FSH. Riassumendo, il
ciclo mestruale che cos’è? È un cambiamento ciclico delle gonadotropine; ecco la differenza rispetto
all’uomo:se noi prendiamo l’uomo e gli facciamo i prelievo ogni giorno, per 28 giorni e così per sei mesi, le
sue gonadotropine oscillano nell’arco della giornata ma le quote cumulative giornaliere dono le stesse ogni
giorno. Nella donna non è così, perché se fate il prelievo al 14° giorno ,voi trovate l’LH a 80 e l’FSH a 2, se lo
fate al 3° giorno troverete l’FSH a 8 e l’Lh a 2, invertiti ( non sono certa di questi valori!) oppure, riferendoci
al progesterone, è basso i primi sette giorni,dal 14° al 21° giorno lo trovate alto. C’è quindi questa ciclicità,
dovuta,lo ricordiamo, all’effetto del feedback positivo, tutto ciò allo scopo di produrre l’ovocita e preparare
l’endometrio all’annidamento,è finalizzato cioè alla riproduzione. L’ovaio ,se lo vediamo in istologia, è fatto
da una porzione corticale costituita dai follicoli: quelli primari, con una sola linea di cellule follicolari e
l’ovocita ancora immaturo al centro,poi l’ovocita cresce, circondandosi nel frattempo di un maggior
numero di cellule follicolari, quindi si inspessisce la parete, tanto che ad un certo punto si comincia a
cavitare perché produce un liquido all’interno e la cavità circonda l’ovocita, sostenuto dal cumulo ooforo,fin
quando arriva a un diametro di 20 mm e scoppia.(Riferendosi a un grafico sulla slide) in questo schema
vedete un altro concetto: qua sta scritto -70 day, qua 0,qua 14; io vi ho detto che il ciclo per convenzione
comincia il day one, cioè al primo giorno della mestruazione, ma in realtà l’inizio della mestruazione è un
evento tardivo, l’ovulazione comincia 70 giorni prima e anche in questo la donna è simile all’uomo, in cui il
ciclo della spermatogenesi dura circa 70 giorni,durante i quali lo spermatozoo matura in vari passaggi; lo
WWW.SUNHOPE.IT
stesso lo abbiamo nella donna in cui però vediamo un ovocito o al massimo due, invece dei milioni di
spermatozoi dei maschi (noi maschietti siamo più dispendiosi, nun c n mbort, buttiamo spermatozoi da
tutte le parti). Le donne sono quindi più parsimoniose, dal momento che hanno un patrimonio
discreto,preciso di follicoli e se ne consumassero a migliaia per ogni ciclo andrebbero subito in menopausa
ed è quello che avviene nella menopausa precoce, la POF-ovarian failure prematura-,cioè queste donne a
16-17 anni avranno l’FSH elevato perchési sono consumati tutti i follicoli ( non è colpa loro) a causa di un
processo genetico, una malformazione ecc. Abbiamo detto che l’ovaio produce gli estrogeni e questo
avviene nel follicolo, grazie al complesso enzimatico dell’aromatasi,che trasforma gli androgeni in
estrogeni. Ma chi produce gli androgeni? Le cellule che circondano il follicolo,ovvero le cellule stromali,
come avviene per le cellule di Laydig nel testicolo, quindi queste sono cellule simili a quelle di Laydig, poi
questi androgeni passano nel follicolo e diventamo estrogeni, ma chi regola questo sistema? Le
gonadotropine: l’FSH fa moltiplicare queste cellule e stimola l’aromatasi,quindi aumenta la secrezione di
estradiolo e capite perché nella prima fase del ciclo l’FSH sale. L’LH che fa? Di LH ne serve poco perché
serve a produrre nelle cellule stromali gli androgeni,substrati dell’aromatasi, quindi le due gonadotropine
devono cooperare. Ricordate nel testicolo cosa avviene: c’è la cellula di Laydig e il tubulo, la prima è
regolata dall’LH, il secondo dall’FSH: abbiamo cioè la stessa cosa anche nella donna visto che
fondamentalmente i due sistemi sono uguali, cambiano dei dettagli, anche se importanti. Ovviamente su
questo sistema intervengono altri fattori, come le citochine, la leptina, l’insulina, l’IGF-1,l’IGF-2 e questo
spiega perché patologie dell’alimentazione o metaboliche possano determinare un’alterazione del ciclo
come la PCO,sindrome dell’ovaio policistico.Questo è lo schema di sintesi sia degli steroidi sessuali,sia del
cortisolo(glucocorticoidi): già vi ho spiegato,parlando del testicolo che i pathway sono comuni, a partire dal
colesterolo abbiamo la sintesi ,come androgeni ,del DHEA, dell’androstenedione,dai quali deriva il
testosterone; gli androgeni poi sono i precursori che, per opera dell’aromatasi, diventano estrogeni, quindi
anche nell’ovaio abbiamo tutto il patway che porta alla sintesi del DHEA e dell’androstenedione e del
testosterone però è molto attiva l’aromatasi, per cui di testosterone in circolo ce ne è meno della decima
parte rispetto al maschio e invece abbiamo più di dieci volte i livelli di estradiolo. Ricordiamo che queste vie
sono comuni anche alla sintesi degli ormoni surrenalici e questo spiega come alcune patologie
surrenaliche,come le iperplasie surrenali congenite,possano dare un incremento degli androgeni.Il
progesterone, come abbiamo detto, è l’ormone dominante nella seconda fase del ciclo ed è rodotto dal
corpo luteo, però è in realtà un metabolita intermedio nello schema di sintesi e allora quando noi abbiamo
la trasformazione a metà ciclo del follicolo in corpo luteo,cioè un organo che produce estradiolo diventa un
organo che produce progesterone,che significa? Significa che abbiamo bloccato questo pathway, cioè alla
p450 e C17, che è un enzima che si chiama anche 17-idrossilasi, noi abbiamo bloccato la sintesi di tutti gli
steroidi a valle e quindi il sistema si ferma al progesterone, l’unico che può essere sintetizzato, per questo il
sistema accumula colesterolo, conferendo l’aspetto luteo, bianco, alle cellule. Il corpo luteo è quindi un
organo endocrino incompleto,mozzo, fa solo progesterone, però è funzionale a quel periodo del ciclo, in cui
in effetti serve solo quello.
Domanda :ma non avevamo detto che l’estradiolo comunque veniva a essere prodotto? Risposta: certo,
quello che noi descriviamo è l’evento principe, di ovaie ce ne sono due e contengono 4000 follicoli o
comunque nella donna di 30 anni ce ne saranno 2000,questi follicolini piccoli funzionano, producono 1
picogrammo di estradiolo ognuno ma lo producono e questo dimostra sempre il fatto che il sistema è
continuo, non è che voi spegnete il motorino ogni 28 giorni e poi lo riaccendete; addirittura è stato
documentato che nelle bambine l’estradiolo è presente in piccolissime quantità (rilevate solo da sistemi di
dosaggio molto sensibili), poi alla pubertà i suoi livelli salgono, ma non perché ci sia un follicolo singolo ma
perché ce ne sono tanti in fase di crescita, che poi matureranno quando si attiva il feedback positivo, quindi
WWW.SUNHOPE.IT
c’è sempre un minimo di secrezione che serve per gli effetti generali. Vi faccio un altro esempio: se voi
pendete una donna di 30 anni con fibroma uterino e, come facevano molti dei nostri ginecologi, le togliete
oltre all’utero anche le ovaie( tanto non può avere figli e la proteggiamo dal tumore alle ovaie) l’avete
castrata questa donna a 30 anni!Lasciando stare l’ovulazione,che non le sarebbe comunque servita( non
avendo l’utero), l’avete privata di quei pochi ormoni (androgeni e estrogeni) necessari per il benessere
cerebrale,osseo e cardiovascolare, facendola diventare una donna peggiore di una in menopausa, nella
quale c’è ancora una minima produzione di androgeni e estrogeni. Tutto questo sembra banale ( detto così
è l’uovo di colombo!) ma pensate che ci sono voluti anni per capirlo; adesso c’è l’evidenza che, se noi diamo
alla donna in menopausa estrogeni, facciamo più male che bene e quindi non li diamo più , ma se la donna
è castrata (ha avuto questo intervento a 30 anni), dovremmo darle non tanto gli estrogeni ma un po’ di
testosterone,perché l’azione generale è dovuta alla trasformazione negli organi dell’estradiolo, quindi devi
dare il precursore per avere la massima efficacia; chiaramente questo è ancora molto discusso, perché se io
do anche una minima quantità di testosterone, potrei avere degli effetti collaterali ( a questa poverina
incomincia a crescere la peluria dove applico il gel di testosterone), quindi ci dobbiamo andare cauti.
Ricordate che nella donna gli androgeni sono prodotti dall’ovaio,visto il loro ruolo di precursori, dal surrene
e dalla placenta durante la gravidanza, quindi patologie da eccesso di androgeni non sono necessariamente
legate all’ovaio; è importante ricordare che una quota di questi, come il DHT, è di origine periferica, deriva
dalla trasformazione di precursori in periferia, quindi se riusciremo a dire qualcosa sull’irsutismo dovremmo
tener presente della periferia, non solo della produzione del testosterone. Infatti a contribuire alla quota di
testosterone circolante nella donna c’è l’ovaio con il 25%, il surrene con un altro 25% e il restante 50%
deriva dalla trasformazione periferica di preormoni, per esempio il DHEA, che è un ormone
lieve,leggero,poco potente, in periferia può diventare testosterone o DHT, quindi ricordatevi questi
concetti. Questo schema ve lo presento perché ribadisce la dualità del compartimento ovarico, cioè
abbiamo il compartimento follicolare che, regolato dall’FSH, ha capacità aromatasica e quindi di produzione
degli estrogeni e poi il compartimento stromale(al di fuori ma adiacente al follicolo),che è regolato dll’LH e
che dà gli steroidi sessuali di tipo androgenico,che poi vanno nel follicolo dove vengono aromatizzati a
estradiolo. Questa compartimentazione stretta,regolata dall’FSH e LH (dall’ipofisi),permette a tutto il
sistema di funzionare,quando poi si crea il feedback positivo il sistema manifesta la sua ciclicità. Passiamo
alla parte clinica perché ora vi ho proprio rotto le ovaie! Dell’alterazione della differenziazione sessuale
non ne parliamo, perché dovremmo dedicarci una lezione intera,noi facciamo un’ADE con il professore
Papparella e la professoressa Petrone su questo argomento.Le alterazioni della maturazione puberale
costituiscono anch’esse un argomento interessante, ma non ne parleremo,farà parte sempre dell’ADE e in
qualche maniera vi sarà presentato anche in ambito pediatrico. Alterazioni della ciclicità, tumori,
iperandrogenismo,alterazioni sistemiche da carenze di ormoni sessuali: vedete quante possibili patologie
noi possiamo avere nell’ambito delle alterazioni ovariche. Le alterazioni della ciclicità sono però una
specificità della donna per cui noi possiamo avere una manifestazione,che è un sintomo, un epifenomeno,
non è la malattia: l’amenorrea,l’assenza di ciclo, è una manifestazione di un qualcosa che non va nell’ovaio.
La stessa cosa vale per l’anovulazione,sintomo di un sistema che non sta funzionando. Quindi quando noi
parliamo di ipogonadismo al femminile, noi possiamo riferirci alla mancanza di differenziazione sessuale,
alla mancanza di pubertà (come nell’uomo) oppure alla fase post-adolescenziale e quindi irregolarità del
ciclo, amenorrea o assenza dell’ovulazione. Per capirci sui termini , cosa intendiamo per amenorrea?
Intendiamo l’essenza di mestruazioni e quindi non è sinonimo di ipogonadismo; ci può essere
un’amenorrea primaria: questa donna non ha mai avuto mestruazioni(non ha avuto il menarca), cosa che
può coincidere con ipogonadismo ,ma non sempre ,poi vedremo perché. Se viene da voi la ragazza di 18
anni e la mamma dice “ dotto’ questa è arrivata a 18 anni e non ha mai avuto le mestruazioni, sono molto
preoccupata”, allora la prima cosa che voi dite è che ha un’amenorrea primaria e poi cercate di capire il
WWW.SUNHOPE.IT
perché. L’altra definizione è quella di amenorrea secondaria, cioè assenza di mestruazioni in una donna che
le ha avute precedentemente (ha avuto le prime, quelle successive o anche solo il menarca) e che da
almeno tre mesi non ha più il flusso; quindi se viene la ragazza quattordicenne e la mamma dice “ha avuto
le prime mestruazioni un anno fa e poi non ha avuto più niente” ,si tratta di amenorrea secondaria; lo
stesso vale se viene una ragazza di 18 anni e la madre dice “aveva il flusso fino all’anno scorso, poi si è
diplomata, è andata all’università e ha perso le mestruazioni”; se viene invece una ragazza e dice “io ho il
ciclo che anziché venire ogni 28 giorni,mi viene ogni 40 giorni” non è un’amenorrea ma un allungamento
del ciclo,è una spaniomenorrea, può essere un’oligomenorrea se si riduce a un giorno, ma non è
amenorrea! Quindi ricordatevi che, a differenza del termine “secondario” che utilizziamo in endocrinologia
riferendoci alle forme centrali, qua “secondaria” (riferito all’amenorrea) significa che le mestruazioni non
vengono a una donna che già le ha avute; rimane però anche nella donna il concetto di ipogonadismo
primario e ipogonadismo secondario.
Domanda : che età di solito si aspetta per fare diagnosi di amenorrea primaria? Riposta: devi aspettare,
come nell’uomo, l’età massima di comparsa della pubertà: nella donna la pubertà compare un po’ prima,tra
8 anni e mezzo e 13 anni ,nell’uomo tra 9,2 e 13,7,quindi nell’uomo tu aspetti i 14 anni e dici “guarda,non
dico che è ipogonadico, ma ha un ritardo puberale”, nella donna invece a 14 anni dico che ha un ritardo
puberale, a 16 che è ipogonadica,parleremo di amenorrea primaria con certezza dopo i 16 anni, dai 14 ai 16
si tratta di ritardo puberale,se questa ragazza,oltre a non avere il flusso,non presenta i segni della pubertà
(crescita della mammella,crescita della peluria e morfogenesi corporea di tipo femminile).
Ora perché noi abbiamo detto che l’amenorrea primaria può coincidere con ipogonadismo, più spesso
secondario, ma non sempre?tra le cause abbiamo in effetti: alterazioni ipotalamo-ipofisarie (ipogonadismo
ipogonadotropo),malformazioni utero-vaginali ( il sistema utero-vaginale non è ben formato, per esempio
nell’atresia vaginale o sindrome di Rokitansky),in cui la donna non è ipogonadica,ha tutte le sue
componenti ormonali a posto,solo che non ha l’endometrio oppure questo c’è ma ha un’ostruzione a livello
della vagina (sono queste condizioni, seppur rarissime, che ci fanno dire che amenorrea non significa
ipogonadismo), danno gonadico e cioè ipogonadismo primario ipergonadoptropo, endocrinopatie,patologie
sistemiche, che però agiscono sempre attraverso l’ipotalamo-ipofisi. Quindi come nel maschio solo che in
più c’è questa malformazione,un po’ come se si avesse un’alterazione dell’escrezione di spermatozoi. Tra le
cause ipotalamo-ipofisarie ricordiamo la sindrome di Kallmann con ipogonadismo ipogonadotropo,identica
a quella del maschio per cui non spendiamo nessuna parola salvo il fatto che, mentre nel maschio ci
aspettiamo che alla pubertà gli cresca il pisello (un “non ce la faccio” di sottofondo,pienamente
condiviso!),nella donna aspettiamo la crescita della mammella,l’ovaio e la peluria con il triangolino rivolto
verso il basso. Tumori ipofisari, traumi,anoressia nervosa…nella donna le cause funzionali,cioè dovute al
basso peso,all’anoressia ecc sono molto frequenti perché la donna è più sensibile e il meccanismo
femminile, proprio perché ha questa ciclicità, è più sensibile alla possibilità che un evento generale, quale
può essere un calo ponderale o alterazione degli store di grasso,alteri il ciclo. La gravidanza isterica è
un’esempio dell’alterazione dei modulatori centrali,quelli che regolano il rilascio del GnRH, ci può essere
l’anovulazione da stress in concomitanza di eventi stressanti,quali l’esame di endocrinologia,che è una
condizione alquanto frequente. Se poi uno ha un tumore ipofisario è ovvio che avrà un’alterazione nella
produzione di gonadotropine e allo stesso modo nella sindrome di kallmann.quindi ricordate le stesse cose
che abbiamo visto nel maschio. Ovviamente cosa avremo sul piano clinico?( Ecco la differenza dove sta)
l’assenza dello sviluppo puberale nelle forme congenite,l’amenorrea primaria, l’ovaio piccolo e a differenza
del maschio, dove noi clinicamente possiamo andare a testare il problema,valutando all’ispezione il volume
testicolare ridotto (anche fino a 3cm), nella donna dobbiamo fare un’ecografia, perché se no l’ovaio come
lo vediamo? I ginecologi di una volta facevano l’esplorazione digitale,dicendo “ho visto l’ovaio
WWW.SUNHOPE.IT
piccolo,l’ovaio grosso”…tutte cazzate!non sentivano niente,ci sarebbe dovuto essere un ovaio di 8-9 cm per
poterlo sentire! Oggi il problema si è risolto con l’ecografia. C’è poi la possibilità di utero ipoplasico, questo
è un altro problema caratteristico della donna, e associazioni con anomalie cranio-facciali come l’anosmia
(sindrome di kallmann), l’FSH e l’LH sono bassi, l’estradiolo è basso( tipico comportamento delle forme
centrali,che abbiamo descritto anche nel maschio). Se invece noi abbiamo un ipogonadismo primario,cioè
gonadico, ovarico, l’LH sarà aumentato,perché viene meno il feedback, gli estrogeni sono bassi, quindi la
caratteristica di queste forme sarà l’ipergonadotropinismo. Qual è la causa principale di questo? Le forme
congenite: disgenesia gonadica o sindrome di Turner, femminilizzazione testicolare, deficit di 17-idrossilasi
(ricordate che trasformava il progesterone), agonadismo (assenza delle ovaie), anche l’ovaio policistico
(PCO) ma questo causa più spesso amenorrea secondaria. Queste forme in bianco(femminilizzazione
testicolare, ovaio policistico,deficit 17-idrossilasi) danno generalmente pseudoermafroditismo, ma non ne
parleremo. Parleremo essenzialmente della sindrome di Turner, non perché sia estremamente frequente
ma perché è il prototipo dell’ipogonadismo femminile ipergonadotropo ,cioè primario, con gonadotropine
aumentate, che è un po’ l’equivalente nella donna della sindrome di Klinefelter: sono due cose del tutto
diverse, cosa hanno di simile? Che sono congenite, sono dovute ad alterazioni cromosomiche,sempre
numeriche e sempre della X ( nel caso della donna Turner è una X in meno),hanno, entrambe, le
gonadotropine elevate. Cosa caratterizza la sindrome di Turner sul piano clinico, cioè le bambine,le ragazze
con questa sindrome che hanno?hanno una statura inferiore a 143 cm (sono corte!), possono avere
malformazioni fisiche,hanno amenorrea primaria però qualche volta anche secondaria,quindi ricordatevi
che se viene una ragazza e dice “io ho avuto tre flussi,poi non ne ho avuti più”, però è bassa e ha qualche
malformazione,che adesso vedremo,non possiamo escludere la diagnosi di Turner solo perché ha avuto
qualche mestruazione,è possibile lo stesso che sia una Turner. Addirittura possiamo avere un’ovulazione
(meno del 5%), le ovaie sono atrofiche,non sono solo piccole, come nelle bambine(<20 mm), ma delle vere
e proprie banderelle,striscioline atrofiche; i follicoli sono meno del 5%, l’FSH è elevato perché non ci sono i
follicoli, perché non c’è l’inibina, perché non c’è l’estradiolo. Qual è l’aspetto genetico basilare di questa
sindrome? Il cariotipo con una sola X, cioè 45,X ( nella donna normale è invece 46,XX). Questa è la ragazza
con sindrome di Turner: è bassa, non ha i segni dello sviluppo puberale (mammella, peluria pubica),ma cosa
ha questa? Certamente, lo vedete, è bruttulell però ha delle malformazioni, cioè torace a scudo con
mammelle molto distanziate, cubito valgo,cioè l’asse dell’omero e quello dell’ulna formano un angolo
aperto, le mani arrivano a metà coscia, quindi hanno un aspetto eunucoide ( l’eunucoidismo non è presente
solo nel maschio, anche nella donna,perché? Perché è congenito),il collo è tozzo, corto e poi ha questa
palmatura,questa plica un po’ laterale. Questo è l’aspetto caratteristico,tipico, ma non sempre è così, vi
farò vedere che ci sono anche ragazze perfette, bassine ma perfette, fortunatamente per loro, perché già
uno ha i suoi problemi, poi quando si aggiunge la malformazione( non che vogliamo esaltare
l’estetismo,però…) questo rappresenta un grande handicap psicologico. Possiamo avere alla nascita o prima
della nascita qualche informazione? Ovviamente il cariotipo: se noi facciamo alla mamma l’amniocentesi
possiamo scoprire occasionalmente questo, ma possiamo sospettarlo nel feto? Sì, nel feto possiamo vedere
l’idroma cistico,cioè un incremento dimensionale della cavità del sacco amniotico,dopo il cui riscontro
l’ecografista cosiglia generalmente di approfondire le indagini,facendo un’amniocentesi. Quando nasce
questa bambina presenterà delle malformazioni ( visto che le alterazioni staturali saranno evidenti solo alla
pubertà)? Presenta questo segno: il linfedema ai piedi, che appaiono rigonfi: questo potrebbe spingere il
neonatologo a pensare a una malattia renale o a problemi idroelettrolitici o a una discrasia proteica, in
realtà ha un linfedema, cioè una malformazione dovuta al fatto che qua si formano male i vasi linfatici. Da
adulte queste donne avranno delle gambette spesse,sembra che abbiano sempre l’edema ( diagnosi
differenziale con edema causato da problemi venosi). Quindi nella neonata possiamo avere il linfedema e
poi nessun altro segno fino alla pubertà, e a questo punto come ce ne accorgiamo? Le bambine restano
WWW.SUNHOPE.IT
basse, non crescono, quindi il primo motivo per cui le mamme portano le figlie dal medico, dal pediatra è
“quest nun cresc!”, hanno la pubertà ritardata,quindi arrivano a 13-14 anni senza aver avuto il
menarca,mancano i caratteri sessuali secondari (perché non è che non ha solo le mestruazioni, manca
proprio lo sviluppo!) e poi può presentare degli aspetti peculiari:cubito valgo, pliche laterali al collo, quarto
metacarpo corto ( se le fate piegare le nocche ha il quarto metacarpo che se ne entra dento,cioè una sorta
di cavità, ve ne accorgete subito). L’altro elemento importante, visibile alla laparoscopia (?), è l’aspetto
della gonade,che appare come una strisciolina biancastra, perché costituita da materiale fibroso, non ci
sono follicoli e si chiama “streak gonad”. Se noi abbiamo tutti questi elementi, è facile dire “ cara signora,
porti sua figlia dal genetista perché deve fare il cariotipo”, che sarà di solito 45,X oppure può essere un
mosaico 45,X 46,XX oppure avere anomalie strutturali della X, la seconda X c’è ma è anomala, per esempio
c’è solo in braccio corto (Xp), è un isocromosoma, fatto o solo dal braccio corto o solo dal braccio lungo (Xi)
oppure un cromosoma ad anello, a ring (Xr) (sono sigle che si usano a livello internazionale). Nella
precedente diapositiva avete visto un altro caso in cui c’era una bassa statura, meno malformazioni ( ci
sono il cubito valgo e le braccia allungate eunucoidi, ma il collo è abbastanza allungato e sembra meno
compromessa sul piano fisico). Quest’altra presenta le tipiche caratteristiche con piccoli abbozzi delle
mammelle,non cresciute, la streak gonad e il cromosoma di questa che è ad anello (Xr). Però possiamo
avere anche situazioni peggiori del quadro clinico: vedete questa bimba che già dall’aspetto non sembra
particolarmente intelligente, qui c’è anche un handicap mentale, altezza 112-113 cm, presenta assenza di
sviluppo puberale,ipertrofia clitoridea e alla laparoscopia una gonade mista (strutture follicolari insieme ad
altre tubulari come quelle testicolari e presenza delle trombe) quindi una disgenesia gonadica mista ,perché
presenta un frammento del cromosoma Y (uguale a quello del padre, è stato anche confrontato) e quando
noi troviamo un frammento di Y o addirittura tutta la Y ,il paziente presenta questa mistura, quindi la
gonade si sviluppa parzialmente anche come testicolo e si può presentare una virilizzazione parziale. Quindi
la sindrome di Turner si interpone tra la donna nomale, quella 46,XX, la donna 45,X con ipogonadismo e al
centro ci può essere disgenesia gonadica mista, che è uno spettro del fenotipo, dove c’è anche una
componente mascolinizzata. Qual è il problema di queste forme? Che sono particolarmente preoccupanti
perché creano ambiguità dei genitali, possono essere associate a un maggiore handicap mentale e quando
c’è la Y o frammenti di essa è maggiore il rischio che la gonade diventi un tumore, cioè che si sviluppi nella
gonade un gonadoblastoma. Questi sono altri due fenotipi, questo per sottolineare l’importanza della
presentazione clinica, non sempre dovete aspettarvi il quadro paradigmatico: vedete che questa è una
ragazza apparentemente normale, ma di bassa statura, 140 cm,anche caruccia, equilibrata, senza nessun
segno malformativo, ha anche uno sviluppo delle mammelle, quindi è possibile un iniziale sviluppo della
pubertà con dei cicli mestruali, addirittura un’ovulazione, addirittura delle gravidanze, in alcuni casi. Io ho
visto una volta una ragazza di sei anni (adesso ha 40 anni), che venne per il morbo di Basedow, perché,
come vi dirò, queste ragazze hanno più frequentemente malattie autoimmuni; io l’ho vista e ho detto alla
signora “ dal morbo di Basedow guarirà, ma purtroppo sua figlia non crescerà in altezza e non avrà le
mestruazioni”, mi sbilanciai, poi facemmo il cariotipo e aveva effettivamente un 45,X, fui però smentito in
pieno perché questa non guariva mai dall’ipertiroidismo, perché aveva una forma resistente, e arrivata a 12
anni cominciò a mestruare… questo per dire che non è detto che tutte le donne con la sindrome di Turner
non possono avere le mestruazioni, lei le ha avute, non ha mai avuto figli ma ancora oggi ha il ciclo, non è in
menopausa, perché ha una riserva ovarica conservata. Alla base della sindrome di Turner che c’è? C’è
questo famoso problema, che è l’assenza di un cromosoma o la mancanza di alcuni geni legati a quel
cromosoma, cosa che fa accelerare la perdita dei follicoli dal momento in cui si sono formati( seconda metà
della gestazione) alla nascita, per cui alla nascita invece di avere 4000 follicoli già ce ne hanno 400, quando
arrivano alla pubertà non hanno più niente, hanno quell’ovaio a strisciolina, però alcune, forse per la
ridondanza dei meccanismi di controllo o perché c’è una X dispersa da qualche parte, o sono dei mosaici,
WWW.SUNHOPE.IT
conservano questa potenzialità,per cui alla fine arrivano alla pubertà con un certo patrimonio e possono
avere i cicli. Vi dico un’altra cosa: questa forma qua può essere uno spettro delle famose POF, cioè delle
cosiddette menopause precoci, in realtà la sindrome di Turner è una menopausa precocissima, poi ci sono
altre donne che vanno in menopausa precoce peraltri motivi a 16, 25, 30 anni, però non vi voglio
confondere le idee, è solo per dirvi che tutte le cose hanno una certa variabilità, non vedete mai bianco o
nero. Ricordate ,come abbiamo detto anche per la sindrome di Klinefelter, il ritardo mentale che si
presenta in alcuni quadri, non è una peculiarità della sindrome di Turner: può essere presente perché c’è
un quadro malformativo supponente, per cui in una famiglia peculiare, questa bimba viene isolata, non
viene mandata a scuola o la scolarizzazione è un problema, perché immaginate quanto possa diventare
vittima di sfottò e prima addirittura, nella cultura medio-piccolo borghese, la figlia malformata si teneva in
casa, nascosta: quindi alla fine il problema non è legato ai cromosomi ma allo scombino che facciamo noi,
salvo alcuni casi in cui in effetti le malformazioni sono più imponenti, legate a una pluralità di alterazioni
cromosomiche, e possono accompagnarsi anche a un problema di tipo intellettivo. Riassumendo il segno
presente nel 100% dei casi è la bassa statura, vi possono essere poi alterazioni endocrine e metaboliche
come l’intolleranza al glucosio, il diabete, le tiroiditi, l’ipotiroidismo; perché hanno le malattie autoimmuni
più frequentemente? Perché quando abbiamo parlato delle malattie autoimmuni della tiroide, abbiamo
detto che una delle potenziali cause era un’alterazione del cromosoma X, perché sul cromosoma X ci sono i
geni che modulano la tolleranza al self, così come sul cromosoma 21, tant’è vero che i pazienti con la
sindrome di Down (trisomia 21) hanno maggiormente tiroiditi o morbo di Basedow. Vi dico che se una
bambina presenta una tiroidite importante o un morbo di Basedow, dovete valutarne attentamente la
crescita, potrebbe non crescere perché ha anche la sindrome di Turner, pur essendo ben fatta e non
avendo le malformazioni…chiaramente non vi sbilanciate, come ho fatto io, a dare sentenze. Altre
alterazioni possibili sono:palato ogivale, pterigio del collo,epicanto, strabismo, sordità, malformazione
ossee (come quella già detta del quarto metacarpo), a livello degli organi interni possiamo avere la valvola
aortica bicuspide,la coartazione aortica (che è abbastanza specifica della sindrome ti Turner), come ve ne
accorgete? Mettete un fonendoscopio sulla linea interscapolare e sentite un soffio, oppure misurate la
pressione, la trovate ipertesa, ad esempio se una ragazzina di 14 anni ha 150/110 di pressione non
cominciate a pensare che abbia anomalie cardiovascolari strane ecc, potrebbe avere la coartazione aortica,
quindi misurate la pressione agli arti inferiori; io racconto sempre il caso di questo ragazzo, con una
pressione di 180/120,visto anche da altri colleghi,sottoposto a indagini di tutti i tipi, si pensava al Cohn( non
so se avremo il tempo di parlarne o qualcuno ve ne ha già parlato dell’iperaldosteronismo);dopo aver
escluso la diagnosi di feocromocitoma, Chon, la misurazione della pressione agli arti inferiori era bassa e poi
è bastato fare un ecocardiogramma, ben fatto, con lo studio della radice aortica ed è venuto fuori che
aveva una coartazione aortica. L’altra alterazione viscerale che può essere presente nella sindrome di
Turner è il rene a ferro di cavallo o l’ipoplasia renale, cioè hanno i reni fusi per i poli inferiori; questo è
importante perché talora queste ragazze vanno dal nefrologo per l’edema ai piedi, cioè il medico dice loro
“ ah ma tu hai l’edema, vuoi vedere che hai la sindrome nefrosica, vai dal nefrologo” e il nefrologo, se è
bravo, riconosce il rene a ferro di cavallo, ma capisce che non è una patologia di sua competenza (il rene a
ferro di cavallo, pur essendo più soggetto a eventuali insulti, è una malformazione con cui si può convivere).
Allora perché queste ragazze hanno i problemi? Perché la X abbiamo detto che viene persa nel momento
della formazione dell’embrione o perché un ovocita è fecondato e in un secondo momento perde il
cromosoma; si ritiene che in realtà quello che tende a perdersi sia il cromosoma Y e quindi che le donne
con la sindrome di Turner siano dei maschi mancati, però i mosaici sono dovuti a un errore successivo alla
fecondazione, quando nei primi processi replicativi alcune linee cellulari perdono la seconda X e si ha un
cariotipo 45,X/46,XX. Qual è la frequenza di questa sindrome alla nascita? 1:2500 donne alla nascita, se vi
ricordate la frequenza della sindrome di Klinefelter era 1:650/1:800, quindi circa tre volte più frequente. Se
WWW.SUNHOPE.IT
però andiamo a vedere le amniocentesi, il 3% dei feti femmina (quindi un numero molto alto) può
presentare il cariotipo 45,X o delle varianti e il 7-10% di tutti gli aborti spontanei è la monosomia della X,
quindi questa è una delle principali cause di aborto. L’aborto è un meccanismo, come dire, eugenetico, di
pulizia genetica e una delle principali eliminazioni riguarda proprio i feti con una sola X, perché la
monosomia della X è ritenuta una condizione di scarsa sopravvivenza, anche se come abbiamo visto è
compatibile con un fenotipo accettabile, ma c’è tuttavia una riduzione dell’aspettativa di vita di 13 anni (
rispetto alla media delle donne normali) e si ha un aumento della complessiva mortalità pari a 3 volte,
quindi è una condizione più a rischio per cui il nostro sistema si protegge. Quindi ricordatevi che questa è
una delle malformazioni cromosomiche più frequenti, una delle più frequenti cause di aborto, però per
fortuna la frequenza dei nati vivi con sindrome di Turner è piuttosto bassa. Riassumendo la sindrome di
Turner non è solo ipogonadismo ma anche malformazione, linfedema,tutte quelle alterazioni di cui
abbiamo visto prima, come la sordità, che in passato, non essendo riconosciuta, era ulteriore causa di
deficit mentale; oggi le famiglie, sotto questo aspetto ,sono molto più attente nel riconoscere problemi
come questo e sappiamo di molte ragazze, affette da questa sindrome, che si sono laureate o comunque
sono avanzate dal punto di vista intellettuale, a conferma che non avere una X non fa niente al cervello. Se
dovesse venire una paziente vostra con sindrome di Turner,che ha fatto l’esame del cariotipo ed è stato
trovato un frammento della Y dovete avvisarla del rischio maggiore che si possa formare un tumore; a
questo punto o fa un intervento profilattico e si toglie le gonadi (ma quasi nessuno vuole farlo) o deve fare
un monitoraggio periodico, almeno l’ecografia, perché se vediamo aumentare l’ovaio o addirittura
comparire una finta mestruazione (si tratta di una perdita ematica, senza che la paziente abbia preso la
pillola),perché questo può produrre anche steroidi,potrebbe essere che è cresciuto un gonadoblastoma. Io
direi che la cosa migliore è consigliare di togliere le ovaie. Quindi la sindrome di Turner è caratterizzata
da:FSH alto, estradiolo basso,assenza della cromatina sessuale. Quest’ultima l’abbiamo nominata parlando
della sindrome di Klinefelter e vi ho spiegato che nel paziente con questa sindrome, che è un maschio, c’è la
possibilità di avere questo triangolino sulla mucosa orale,perché corrisponde a uno dei due cromosomi X
che va in eteropicnosi,cosa che avviene normalmente nelle donne: se facciamo uni striscio buccale e lo
coloriamo con la fucsina, vedremo questo frammentino, perché nelle donne ci sono due cromosomi X,uno
dei quali è dormiente e eteropicnotico. Nel maschio invece non lo troviamo( ha una sola X), a meno che
non abbia la sindrome di Klinefelter; invece in quella di Turner avviene l’inverso perché c’è un solo
cromosoma X, l’altro non c’è, quindi non troveremo il frammentino, quindi la strisciata colorata con la
fucsina sarà uguale a quella del maschio. Ovviamente questo è un test di screening se io ad esempio voglio
vedere su 1000 ragazzi in una scuola o su un gruppo di neonati, quanti sono quelli con la sindrome di
Turner, senza dover ricorrere al cariotipo, ma non è un esame diagnostico al 100%, perché se ho una
struttura alterata, come l’Xp o Xr o Xi, la cromatina esce lo stesso positiva (la X è anomala ma c’è).Veniva
fatto una volta alle atlete, prima delle gare, per sapere se c’erano travestiti, non nel senso classico e banale
del termine, ma per esempio per individuare uno pseudoermafrodita che si spacciava per una femmina,
avendo la femminilizzazione testicolare: bastava fare lo striscio buccale (oggi basta una PCR e in due ore hai
il risultato). Vi ricordo altre cause ipogonadiche: PCO, tumori, la POF, cioè la menopausa precoce, ovvero
quando ad esempio una ragazza ha avuto le mestruazioni ,ma all’improvviso le perde e ha le gonadotropine
aumentate e l’ovaio atrofico,cosa che può succedere per cause autoimmuni,per malattie genetiche;quello
che voglio ricordarvi è che rientrano nell’ambito degli ipogonadismo primari, quelli con le gonadotropine
aumentate e evitate sempre da medici di usare con la paziente il termine “menopausa precoce”, perché se
io dico a una ventenne “tu sei in menopausa”, le ho dato un’etichetta terribile, considerando anche il fatto
che oggi possiamo dare gli estroprogestinici e questa ragazza avrà le sue mestruazionei, avrà la sua vita
sessuale e starà bene finchè noi la supplementeremo con gli estrogeni, in più se vuole un figlio, sapete che
oggi esiste l’ovodonazione, quindi per quanto artificiosa e complessa sia, è una possibilità. Per cui dare
WWW.SUNHOPE.IT
questa etichetta non fa altro che fornire ulteriori motivi di nevrosi; è molto importante la terminologia, il
modo con cui noi approcciamo il paziente, per cui dire “hai l’amenorrea ipergonadotropa”, non è un gioco
di parole, è la definizione corretta che impatta meglio con la paziente, così come possiamo dire al paziente
“sei ipotiroideo”invece di dirgli “tu sei cretino”. Tra le cause benigne di amenorrea secondaria ricordatevi
l’atrofia dell’endometrio, l’isterectomia: la donna che ha avuto un’isterectomia va in amenorrea, ma ha le
ovaie funzionanti e fortunatamente oggi i ginecologi hanno capito che non bisogna toglierle, quindi non
sono ipogonadiche e se gli fate il prelievo, L’FSH e LH sono normali e lo stesso vale in caso di atrofia
dell’endometrio, per esempio una donna che ha avuto un aborto o più di uno, può avere un raschiamento
eccessivo tale che la linea endometriale è stata superata, sono state tolte anche le staminali endometriali,
per cui questa donna non ha più il flusso, ma non è ipogonadica, quindi ribadiamo il concetto che
amenorrea non equivale sempre a ipogonadismo. Ricordatevi ancora che ci sono cause fisiologiche di
amenorrea secondaria:
-gravidanza:quando una mamma viene e dice “mia figlia non ha il flusso da due mesi” ,la invitate a
aspettare fuori mentre parlate con la figlia, alla quale chiederete se è in cinta, perché è capitato tante volte
l’arrovellamento del medico, della madre e la poverina in realtà era in cinta e non aveva il coraggio di dirlo;
-allattamento: in questa fase è normale che il flusso non ci sia;
-menopausa: è un evento fisiologico, chiaramente da datare, è facile attribuirla a una donna di 48 anni o
più,ma non è lo stesso nella donna di 30 anni.
Allora come facciamo la diagnostica? Ovviamente l’esame clinico,il dosaggio di prolattina e TSH, perché
sapete che una delle principali cause di amenorrea è l’iperprolattinemia ( io non ve ne ho parlato ma
immagino lo abbiano fatto parlando delle patologie ipotalamiche e ipofisarie),il dosaggio dell’FSH ( se è
basso possiamo pensare a ipogonadismo ipogonadotropo,se è alto pensiamo a una forma primaria, se
normale in concomitanza di normali livelli di estrogeni e ovaio normale all’ecografia è importante
considerare vagina e utero, potrebbe avere una Rokitansky, se è una forma primaria, cioè una
malformazione utero-vaginale). Come possiamo poi integrare i dosaggi a scopo di verifica? Dando un
progestinico (progesterone): se io do il progesterone a una ragazza in amenorrea questa non avrà la
mestruazione. Se la vostra ragazza non ha il flusso, la prima cosa che uno fa, qual è? Le fa fare la fiala di
prontogest, il progestinico ( è la tecnica più semplice, a parte andare a fare l’hCG), se dopo 7 giorni ha il
flusso ve la siete scampata,se no dovrete cominciare a chiedervi “come lo dovrei chiamare?”, se non ha il
flusso non è detto che sia incinta, potrebbe essere una rokitansky se non ha mai avuto il flusso,può essere
un ipogonadismo ipergonadotropo, quindi se io somministro il pregestinico e non ho la mestruazione si può
trattare di una di queste situazioni. Posso poi dare l’estroprogestinico ( la pillola) per un mese, se ho il
flusso escludo la malformazione utero-vaginale, se non ho il flusso non posso escluderla e quindi devo fare
una buona endoscopia o ecografia endovaginale. Se io invece do il progestinico e si presenta la
mestruazione, è probabile che la mia paziente abbia un’anovulazione cronica o è una ragazza con problemi
di ciclo, per esempio ha l’ovaio policistico,l’iperandrogenismo,l’anoressia lieve. Questo mi serve a farvi
capire come ,combinando l’informazione che viene dal dosaggio ormonale e dalla banale somministrazione
di progesterone,noi possiamo ottenere un risultato diagnostico e per ricordarvi come funziona il
progesterone, cioè stimolando lo sviluppo dell’endometrio: finchè lo diamo l’endometrio cresce, appena lo
togliamo l’endometrio si sfalda. Su questo principio si basa il test, che chiaramente funziona solo se c’è
almeno un minimo di produzione estrogenica, ma se noi abbiamo un difetto ovarico importante o le ovaie
sono state asportate o c’è una menopausa definitiva, pur dando il progesterone, la mestruazione non
WWW.SUNHOPE.IT
viene, allora bisogna dare l’estroprogestinico ( dando prima un po’ di estrogeni e poi il progesterone, viene
il ciclo). C’è una domanda finale ma non si riesce a capire niente!!!
WWW.SUNHOPE.IT
Lezione di endocrinologia del 29.11.2013
Prof. Sinisi
Luigi Coppola
METABOLISMO CALCIO FOSFORICO
Gran parte del calcio dell’organismo si trova nelle ossa (8.9-10 mg/dl o 2.2-2.5mmol).Il calcio si divide in
calcio libero (50%),calcio legato a proteine(40%) E calcio complessato (12%).
Per calcolare il calcio legato a proteine la formula è:8 per albumina più 2 per globulina più 3.
Per calcolare il calcio corretto la formula è:calcio misurato più 0.8x (4-albumina).
Il calcio che abbiamo deriva da uno scambio tra osso rene e sistema G. I.. L’equilibrio è mantenuto
attraverso l’introduzione con la dieta di 1 g di calcio al giorno perche ne eliminiamo 800 mg con le feci e
200mg con le urine. Il protagonista principale è il PTH che agisce sul rene determinando il riassorbimento
del 20 % soltanto del recupero renale di calcio (poiché l’80% è riassorbito a livello del tubulo prossimale in
modo passivo ),agisce sull’osso favorendo l’apposizione di calcio (ad alte concentrazione stimola l’attività
degli osteoclasti favorendo il riassorbimento osseo).
Riferendoci alla slide possiamo vedere come la secrezione di paratormone è strettamente regolata ed ha un
andamento sinusoide. Se la concentrazione di calcio ionizzato scende al di sotto di 1,2 mmol / l scatta una
secrezione enorme di paratormone,viceversa se la concentrazione da 1,2 passa a 1,5 noi abbiamo un blocco
della secrezione. Questo significa che il range di concentrazione di calcio ionizzato deve essere regolato
strettamente ,questo sistema è strettamente sensibile alle concentrazioni di calcio. L’organismo ha bisogno di
controllare il calcio sierico. A livello osseo il PTH abbiamo detto attiva il riassorbimento osseo se è in alte
concentrazioni,ma lo fa in maniera indiretta,attraverso il legame con gli osteoblasti che poi attiveranno gli
osteoclasti .La vitamina D è un ormone introdotto con l alimentazione che per essere attivo deve subire
alcune idrossilazioni una delle quali a livello renale. L’attività del 1 alfa idrossilasi renale è controllata dal
paratormone,se manca il paratormone il rene non può idrossilare la vitamina D che quindi non diventa
ormone ed ecco perché nelle insufficienze renali abbiamo iperparatiroidismo secondario .La vitamina D è
l'altro attore di questa regolazione dove il regista è il paratormone L altro effetto del paratormone a livello
renale,oltre a quello di attivare la vitamina D è quello di riassorbire calcio ed eliminare fosfato, ma il PTH
non agisce sul tubulo prossimale ( dove avviene il riassorbimento dell’ 80-85% di calcio, ma è un
riassorbimento di drenaggio ?? ) ma a livello del tubulo distale e del dotto collettore dove determina il
riassorbimento di circa il 20% di calcio cioè quei 200 mg riassorbiti sotto il controllo del paratormone oltre
WWW.SUNHOPE.IT
agli 8800 mg riassorbiti a livello prossimale. Vale lo stesso per il fosfato quello che vi ho detto,il fosfato
segue a ruota il calcio.
FATTORI CHE INFLUENZANO IL TRASPORTO RENALE DÌ Pi
POSITIVAMENTE
1. APPORTO RIDOTTO DI Pi
2. PTH BASSO
3. VD3
4. IPOCALCEMIA, IPOCAPNIA
NEGATIVAMENTE
1. AUMENTATO APPORTO DI Pi CON LA DIETA
2. PTH AUM
3. IPERCa
4. FGF23 O FOSFATONINA
La fosfatonina prodotta dall’osso agisce su un recettore chiamato FGFR che dimerizza col recettore klotho
modulando in maniera negativa la secrezione di PTH,aumenta quindi i fosfati e riduce il livello di
paratormone.
IPERPARATIROIDISMO PRIMARIO(PHPT)
L iperparatiroidismo primario è un alterazione del metabolismo fosfocalcico dovuta ad un eccessiva
secrezione di paratormone non regolata dai livelli di calcio. Ci troviamo di fronte quindi al paradosso dove i
livelli di calcio sono alti e il PTH pure è elevato. Nell’PHPT manca il feedback negativo in cui il calcio in
eccesso inibisce la secrezione di PTH,quindi caratteristica fondamentale è LIVELLI DÌ CALCIO ALTI O AI
LIMITI ALTI E PRESENZA DÌ LIVELLI DÌ PTH INAPPROPIATAMENTE AUMENTATI .L’ incidenza
e di 42/ 100000,quindi è una condizione abbastanza frequente, la prevalenza è dello 0.3 % della popolazione
generale,l’incidenza e del 2% nelle donne dopo i 60 anni,il rapporto F/M è di 2 a 1,le donne sono più colpite,
dopo la menopausa compare di più questo problema,conseguenza del calo degli estrogeni ,normalmente
aventi un effetto protettivo sull’osso. Nel 90% dei casi l’IPER PTH è sporadico ed e dovuto ad un adenoma ,
un iperplasia delle paratiroidi e , in meno del 1%dei casi, ad un carcinoma. La causa più frequente è
l’adenoma. Può essere familiare nel restante 10 % dei casi. Può presentarsi nella MEN 1,nella MEN2A,alla
FHH ( ipercalcemia ipocalciurica familiare ) e alla HPT-JT dove è associato a tumore mandibolare, e a una
forma di iperparatiroidismo familiare idiopatico. Quindi abbiamo varie forme legate a mutazioni genetiche
implicate nell’alterazione del patwhay di secrezione del PTH. Queste forme qua sono molto particolari
essendo presenti soprattutto nei soggetti giovani mentre abbiamo visto che la prevalenza di forma sporadica
aumentava dopo i 60 anni. Studiando queste forme si sono compresi i meccanismi di regolazione della
secrezione del paratormone. La MEN 1 è caratterizzata da mutazioni della menina, la MEN 2 da mutazioni d
i RET, l’ipercalcemia ipocalciurica familiare presenta mutazione del recettore per il calcio,
l’iperparatiroidismo familiare isolato più il tumore della mandibola (HPT-JAV TUMOR SINDROM) è
associato a mutazioni della parafibromina,nell’iperparatirodismo familiare isolato ancora non si conosce il
meccanismo molecolare.
Dal punto di vista patologico 3 sono le lesioni che determinano iperparatiroidismo sporadico e sono l’
WWW.SUNHOPE.IT
adenoma (85 % dei casi) l’iperplasia e il carcinoma. Nell’ iperplasia vi è l’aumento di volume di tutte e 4 le
ghiandole paratiroidi e quindi questo è un problema perche in caso di intervento di paratiroidectomia ,la
rimozione di una ghiandola non preserverà da eventuali recidive. L’iperplasia è responsabile dell’15%
dell’iperparatiroidismo mentre il carcinoma dell’ 1% dei casi.
La diagnosi differenziale tra adenoma e carcinoma può essere difficile ma se già notiamo le dimensioni
vediamo che il carcinoma è più grande dell’adenoma e nel carcinoma abbiamo una sproporzione tra le
dimensioni e i livelli di calcio sierico. Come si fa diagnosi? Una sintomatologia specifica non c’è ma ci sono
una serie di sintomi che si possono utilizzare:
1. calcemia elevata riscontrata in seguito ad un esame di routine;
2. paziente che presenta calcoli renali o osteoporosi;
3. elevata concentrazione di PTH scoperto durante un esame di valutazione per l’osteoporosi.
Quali sono i fattori di rischio che predispongono il nostro paziente all’iperparatiroidismo primario?
1. I difetti genetici : inattivazione della menina,attivazione della ciclina d1;
2. La storia di irradiazione del collo ( pazienti con linfoma,malattia neoplastica);
3. La terapia con litio che fa perdere il calcio a livello del tubulo distale;
4. I pazienti con deficiente apporto di calcio e vitamina D ( come gli anziani ) ;
5. La menopausa, perché la carenza di estrogeni altera il metabolismo fosfocalcico e in un soggetto
predisposto favorisce l’iperparatiroidismo,ecco perché l’iperparatiroidismo è più frequente dopo i 60
anni.
IPERCALCEMIA IPOCALCIURICA FAMILIARE (FHH )
•
FAMILIARITA’
•
EREDITARIETA’ DOMINANTE
•
LIEVE AUMENTO Ca E Mg sierici
•
NORMALI LIVELLI DÌ PTH
•
NORMALI LIVELLI DÌ 1,25VD3
•
Ca URINARIO BASSO
•
CLEARANCE Ca/CLEARANCE Cr <0.01
Queste forme vanno sospettate se dovesse presentarsi il paziente giovane con osteoporosi inspiegata, non
dobbiamo meravigliarci se in questi pazienti trovassimo livelli normali o quasi normali di PTH e
1,25VD3,se andassimo a fare il rapporto clearance Ca / clearance Cr ed esce <0.01,il soggetto avrebbe FHH.
Questa forma di iperparatiroidismo ha portato alla scoperta dei recettori del calcio,le cui mutazioni sono alla
base di questa sindrome. Queste mutazioni sono responsabili non solo di un elevato set point della
secrezione calcio regolata del PTH nelle cellule paratiroidee, ma anche di un eccessivo riassorbimento di
calcio nella porzione corticale dell’ ansa di henle .
IPTHp ADENOMA PATOGENESI:
Nell‘adenoma cosa si verifica? C’è una proliferazione delle cellule della paratiroide,queste cellule si
espandono,una di queste cellule durante l’espansione può avere un alterazione del sensore del calcio ,quindi
si selezionano cellule che hanno un sensore meno sensibile al calcio. Se dovessimo prendere in
considerazione una donna in menopausa ,in cui si abbassano gli estrogeni,aumenta la liberazione di calcio
dall’osso ,è necessario che sia prodotto più paratormone per compensare, quindi le cellule delle paratiroide
di questa donna in menopausa si moltiplicano. Nella moltiplicazione si può verificare che una cellula che
abbia già fattori predisponenti diventi anomala,cioè perda il normale set point del sensore,produca più
WWW.SUNHOPE.IT
paratormone e allora diventi un adenoma,questo è il meccanismo. Lo studio dei meccanismi delle forme
familiari ha aperto la strada alla comprensione dei meccanismi dell’ adenoma .Quindi alla base della
formazione dell’adenoma o dell’iperplasia vi è un insensibilità al calcio circolante ,occorrono livelli di calcio
circolanti più elevati per bloccare la secrezioni di PTH e la spiegazione di questo è venuta fuori quando
abbiamo scoperto la presenza di questi sensori per il calcio .Che succede quando o per un iperplasia o per un
adenoma o per un carcinoma abbiamo elevati livelli sierici di PTH? la prima cosa che il PTH fa è aumentare
il riassorbimento di calcio dall’ osso,a livello renale viene incrementato il riassorbimento nel tubulo
distale,non sarà più 20 % ma 30 %,quindi 2 meccanismi fondamentali uno sul osso uno sul rene che mi
aumentano il calcio nel sangue, che poi mi porta ad aumento della calciuria .Contemporaneamente il PTH
inibisce l’assorbimento a livello renale del fosforo per cui ho fosfaturia, avrò ipercalciuria e iperfosfaturia
mentre avremo ipercalcemia e ipofosfatemia,dati paradigmatici dell’iperparatiroidismo. L eccesso di PTH
aumenta l’attivazione della forma attiva di vitamina D che aumenta l’assorbimento intestinale di calcio
Quindi ricapitolando abbiamo ipercalcemia, ipofosfatemia ,ipercalciuria,iperfosfaturia e perdita di osso
corticale che è il principale bersaglio. Quindi ad una paziente che arriva con ipercalcemia fosfaturia
osteoporosi calcoli renali bisogna chiedere oltre che la concentrazione di calcio e fosforo urinaria e
plasmatica,anche il PTH e la vitamina D .Quando abbiamo iperparatiroidismo con calcemia normale? Nelle
forme intermittenti,nelle fasi iniziali,nei pazienti con iperparatirodismo normocalcemico con calcio totale
normale e aumento del calcio ionizzato e poi l’ipercalcemia mascherata dove c’è un deficit di vitamina D di
cui noi introduciamo precursori con l’alimentazione che poi subiranno varie idrossilazioni ,la prima a livello
cutaneo,la seconda a livello epatico la terza a livello renale. Quindi un soggetto che introduce poca vitamina
D con l’alimentazione, o un soggetto che si espone poco ai raggi solari ,o ancora un soggetto con
insufficienza renale,può avere un deficit di vitamina D che condiziona i livelli di calcio,abbassandoli in un
soggetto con iperparatiroidismo. Quindi se si presenta un soggetto con una calcemia normale e un PTH
ALTO e VITAMINA D BASSA, somministrando vitamina D per 3 mesi la calcemia sale subito. Questa
condizione è sempre più frequente non solo negli anziani ma anche nei giovani. A livello renale abbiamo
detto arriva una grande quantità di calcio e fosfato e il rene si difende buttandolo fuori,aumentando la
calciuria e la fosfaturia,ma se si determina un enorme sovraccarico,una condizione infiammatoria,un
cambiamento di ph vi sarà precipitazione di calcoli. Quindi un altro dei sintomi dell’ipercalcemia che si è
creata , è la litiasi renale,che può essere uno dei sintomi con cui si presenta il paziente. Perché si crea la
precipitazione ? Perché l’ipercalcemia determina perdita di sali,per eliminare Sali dobbiamo eliminare anche
acqua,aumenta la perdita,l’escrezione di acqua,c’è una concentrazione del liquido extracellulare ,quindi
arriva a livello renale un liquido più concentrato che peggiora la situazione,a questo si aggiunge la presenza
di anoressia, nausea e vomito che possono essere presenti nel paziente con iperparatiroidismo che
determinano ulteriore contrazione del volume extracellulare, maggiore contrazione di soluti e quindi più
facilità a precipitare .Più soluti sono presenti nel liquido,più facilmente precipitano,questo è il meccanismo
attraverso cui si realizza la nefrocalcinosi. Ecco perché la medicina pratica suggerisce di bere molta acqua ,a
basso contenuto di calcio non quella del rubinetto che è ricchissima di calcio. L’effetto sull’osso è dovuta
alla bivalenza del paratormone che ha un effetto anche anabolizzante. Per esempio se ho delle fratture
vertebrali io posso curarmi con iniezioni di PTH; Allora vi chiederete ma il prof ci ha detto stronzate ?NO
perché il PTH ha anche effetti catabolici : attiva gli osteoclasti ,lo sviluppo degli osteoclasti,inibisce la sintesi
di collagene, inibisce lo sviluppo degli osteoblasti, fa degradare la matrice,quindi ha effetti bivalenti ma
quando la sua soglia supera un certo valore prevalgono gli effetti catabolici e quindi il risultato finale e che
l’osso si impoverisce della matrice ossea e abbiamo la liberazione di una serie di markers di attività
osteoclastica come :L’idrossiprolina urinaria,i crosslinks del collagene,la fosfatasi acida tartrato resistente
.Tutti questi valori si alterano in senso positivo indicando un effetto distruttivo dell’osso. Questi markers
comunque ,tranne in casi particolari come le forme subcliniche, non vengano mai usati in diagnostica.
L’effetto del PTH si esplica essenzialmente sull’osso corticale,con la rottura delle trabecole soprattutto delle
ossa lunghe come il femore,il radio che sono più colpite in caso di osteoporosi insorta su
iperparatiroidismo,meno evidenti sono gli effetti sulle ossa lombari. Se il paziente presenterà un esteso
WWW.SUNHOPE.IT
coinvolgimento delle ossa lombari in caso di osteoporosi,difficilmente si tratterà di un iperparatiroidismo
.Se viene una paziente,donna di 50 anni , che ha una frattura a livello femorale è più facile si tratti di un
IPERPTH,se una paziente si presenta con una frattura vertebrale,questa potrebbe essere dovuta
probabilmente a una metastasi o a osteoporosi di altra natura. Domanda : ( non si sente molto bene )
probabilmente in base a che cosa il PTH ha un effetto stimolante o inibente. Il prof risponde in base alla
soglia,quando il PTH supera una certa soglia ,quando arriva molto PTH anziché attivare la sintesi di matrice
ossea da parte degli osteoblasti,attiva gli effetti opposti. Infatti noi in terapia andiamo a bloccare la
secrezione di PTH,non interveniamo sull’osso. Le alterazioni ossee, presenti in meno del 10% dei casi, sono
il risultato di un lunghissimo periodo d’azione del PTH e della mancanza degli estrogeni e sono
rappresentate da:
-Fratture ossee ( soprattutto ossa lunghe,meno ossa vertebrali);
-dolori ossei;
-aumento fosfatasi alcalina;
-aumento attività osteoclastica;
-lesioni cistiche (tumori bruni);
-fibrosi del midollo, riassorbimento osso corticale con osteoporosi.
Quindi l’effetto principale del PTH è di indebolire le trabecole delle ossa lunghe e determinarne la frattura
spontanea. Domanda :perché l’uomo è protetto dall’osteoporosi? Perche dal testosterone si forma un
quantitativo di estradiolo sufficiente alla protezione ossea,infatti l’uomo osteoporotico chi è? È quello che
non ha il testosterone,l’ipogonadico,oltre a quello che avrà patologie ossee per conto suo. Quindi nonostante
i livelli di testosterone calino con l’età l’uomo avrà sempre un quantitativo basale di testosterone e quindi di
estradiolo che lo renderà più protetto,ma è ovvio che con l’avanzare dell’età se il soggetto assume meno
calcio,se si espone meno al sole,se avrà un qualche difetto della funzione renale,se ha qualche patologia
testicolare che gli abbassa la produzione di testosterone e quindi di estradiolo,allora avremo l’uomo
osteoporotico.
L’iperparatiroidismo sul rene determina nefrocalcinosi,nefrolitiasi,diabete insipido nefrogeno,sull’osso
fratture e dolori ossei,a livello del tratto G. I. determina dolori addominali,pancreatiti,ulcera peptica ( perche
il calcio aumenta la secrezione acida gastrica ),a livello dell’SNC determina debolezza muscolare
fascicolazioni,atrofia,depressione letargia coma .L’iperparatiroidismo può inoltre determinare gotta
,anemia,ipertensione,ipertrofia del ventricolo sinistro,calcificazione dei tessuti molli .Quindi a causa degli
effetti pleiotropici del calcio la regolazione deve essere molto stretta .Quindi non abbiamo una
sintomatologia specifica come per esempio l’ipertiroideo che aveva fibrillazione,dimagrimento,qua invece
possiamo avere calcolosi,disturbi a livello osseo,a livello addominale,possiamo avere debolezza
muscolare,prurito (che se compare in una donna di 60 anni con storia di calcoli è molto sospetto)
disturbi psichici (letargia, psicosi,depressione,paranoia,confusione,stupore,coma).Le pazienti in alcuni casi
appariranno depresse e si rifiutano di collaborare,questo è un effetto dell’eccesso di calcio. Se arriva una
paziente con tutti i sintomi e segni descritti (confusione, debolezza, depressione ,osteoporosi ecc vedi slide),
quali analisi di laboratorio andiamo a richiedere? Calcio,fosforo,calciuria,fosfaturia.Il calcio nel siero sarà
alto,il fosforo basso,nelle urine il calcio sarà alto e il fosforo sarà normale o alto. A livello radiologico
abbiamo riassorbimento sub periosteo,cranio a sale e pepe,tumori bruni e cisti ossee. Si tratta comunque di
situazioni molto rare,è più facile trovare il calcolo,trovare l’osteoporosi con dolori modesti. Dagli esami di
laboratorio usciranno livelli di PTH elevati,livelli di vitamina D attiva elevata ma quando l’apporto è alto
altrimenti abbiamo l’adenoma mascherato. Il CAMP si dosa solo in ipoparatiroidismo. È importante
ricordare che ipercalcemia non significa iperparatiroidismo,infatti il PHPT è caratterizzato da livelli elevati
di calcio e di PTH,in presenza invece di livelli elevati di calcio e bassi di PTH può avere una sarcoidosi ,una
neoplasia come per esempio metastasi da carcinoma mammario. Infatti l’ipercalcemia il più delle volte è
legata al cancro ma può essere anche un PHPT. Per distinguere andiamo a vedere i livelli di PTH,bassi nella
prima condizione,alti nella seconda. Di fronte ad un ipercalcemia facciamo prima di tutto una valutazione
clinica: nel 90% dei casi quando c’è ipercalcemia o c’è un PHPT o una neoplasia. Ci possono essere delle
WWW.SUNHOPE.IT
ipercalcemie croniche asintomatiche,ci può essere una produzione ectopica di PTH , ma è rarissima. Bisogna
comunque fare un attenta anamnesi atta a valutare una familiarità,l’utilizzo di farmaci o di un eccesso di
vitamina D , che possono dare questa condizione .Sulla base della valutazione clinica,dosiamo il PTH,se lo
troviamo alto .allora sarà un iperparatiroidismo primario. Se il PTH è basso e la calcemia è salita
acutamente,può essere che si tratti di una neoplasia. Infatti se troviamo che la calcemia fino a 2 mesi fa era
normale e all’ improvviso è salita può essere che si tratti di una metastasi ossea da tumore primitivo
prostatico o mammario. Se invece la crescita della calcemia è cronica ed io ho il paziente in follow up per la
sarcoidosi ( che sappiamo essere una condizione che colpisce i polmoni,le ossa dove abbiamo una
produzione in situ di vitamina D) questa condizione porterà ad un maggior assorbimento di calcio e il
paziente va incontro ad un ipercalcemia. SI tratta però di una crescita cronica. Quindi PTH basso ,calcemia
che sale cronicamente,pensiamo ad una sarcoidosi oppure ad utilizzo eccessivo di vitamina D.
La differenza ce la fa il rapporto tra clearance di creatinina e clearance del calcio.
Una volta fatta diagnosi si PHPT sulla base dei segni clinici e degli esami di laboratorio,come faccio a sapere
se è un iperplasia,un adenoma o un carcinoma ? Devo fare la diagnostica d’immagine, che si basa
sull’ecografia (con una sensibilità che va dal 34 al 92% e falsa positività dal 4 al 25%) e sulla scintigrafia
con tecnezio sestamibi (scintigrafia diversa da quella della tiroide con un marcatore particolare) che ha una
sensibilità del 55-100% e falsi positivi 0-15% .Se combinassi ecografia e scintigrafia potrei arrivare alla
diagnosi. I limiti di queste metodiche sono rappresentati dalla coesistenza di noduli tiroidei che possono
inficiare sul risultato,per questo devo combinare queste 2 metodiche. La risonanza e la TAC non servono
WWW.SUNHOPE.IT
molto,vanno fatte solo se l’adenoma è localizzato a livello intratoracico,come a livello timico( il prof fa un
esempio di una sua paziente che ha un adenoma a livello dell’arco aortico,che non può essere operata .Questa
localizzazione ectopica l’ha scoperta facendo una scintigrafia,osservando una captazione sul cuore ed è stata
confermata con la RM).Quindi solo come secondo step utilizziamo TC e RM .Le tecniche invasive (
angiografia ) si facevano quando non c’erano TC e RM
Se c’è un adenoma bisogna operare,se c’è un iperplasia è un po’ difficile perche si andrebbe a rimuovere sia
tiroide e che paratiroidi. Comunque la prima terapia è medica: aumentare l’apporto di liquidi e diminuire
quello di calcio; terapia con estrogeni,che favorisce l’apposizione ossea soprattutto se siamo di fronte ad una
donna in menopausa;i fosfati che favoriscono la perdita di calcio dal rene;la calcitonina che si usava in
passato perché favorisce l’apposizione di calcio nell’osso .La novità è rappresentata dai calcio mimetici,che
sono mimetici del calcio e vanno ad agire sul sensore del calcio bloccando la secrezione di PTH,quello che
dovrebbe fare il calcio ma non riesce a fare. Noi possiamo non operare quando il paziente ha una forma lieve
di PHPT,quando non siamo sicuri della presenza dell’adenoma, ma dobbiamo operare quando ? Quando la
malattia è sintomatica,quando il calcio sierico è maggiore di 11.4 mg/dl,quando c’è una severa ipercalciuria (
maggiore di 400 mg/ die,infatti il paziente può andare incontro ad una severa insufficienza renale),quando
c’è una forte riduzione dell’osso trasecolare e corticale appurato con radiografia e MOC,quando c’è un
deficit di vitamina D( perché è un adenoma mascherato ),quando c’è una ridotta clearance della creatinina (
indizio di danno renale ),età giovanile. Il paziente che non ha questi parametri si può portare avanti con
terapia medica,il cui cardine è il calcio mimetico la cui dose è dai 60 ai 120 mg al giorno e che va a bloccare
la secrezione di PTH .In verità funziona abbastanza bene abbassando il calcio ,riducendo la calcemia prima
di un intervento mentre il PTH si abbassa modestamente o non si abbassa proprio.
La frequenza delle varie alterazioni è diversa:
WWW.SUNHOPE.IT
Un paziente che ha angiofibromi e un PTH elevato va indagato per altri tumori
La differenza fra MEN2A e MEN2B la fa l’habitus marfanoide.
Nella MEN2A l’Elemento caratterizzante è il carcinoma midollare della tiroide (MTC) accompagnato da
feocromocitoma e iperplasia delle paratiroidi. Anche nella MEN 2B abbiamo MTC,FEO ma qui abbiamo
anche habitus marfanoide,ganglioneuromi intestinali e neurinomi mucosali.
Quindi l’iperparatiroidismo si può inserire anche in queste condizioni e ciò è da tenere in considerazione
quando abbiamo escluso le altre cause e ci troviamo di fronte soggetti giovani con segni clinici caratteristici
(habitus marfanoide ecc ).
WWW.SUNHOPE.IT