IMPIEGO DELLA SPETTROSCOPIA DI AUTOFLUORESCENZA
DI TESSUTI PER LA DIAGNOSI DI TUMORI
G. Bottiroli, A.C. Croce, D. Locatelli, K.S. Lanza, E. Benericetti(*), P. Spinelli(§) e R.
Marchesini(§)
Centro Studi Istochimica CNR - Piazza Botta, 10; 27100 Pavia (*)Azienda Ospedaliera E. Morelli - 23035
Sondalo (SO) (§)Istituto Tumori - Via Venezian, 1; 20133 Milano
La maggior parte dei costituenti di cellule e tessuti, eccitati opportunamente, emettono fluorescenza
nell’intervallo spettrale dall’UV al vicino IR. Poiché i fluorofori endogeni sono coinvolti sia nei processi
metabolico-funzionali sia nell’organizzazione del tessuto, è ragionevole supporre che alterazioni di questo,
conseguenti a stati patologici, determinano modificazioni nella natura, concentrazione, distribuzione e
microambiente dei fluorofori stessi, con conseguente variazione delle proprietà di autofluorescenza utili a fini
diagnostici. Su questo razionale si sono sviluppate tecniche diagnostiche minimamente invasive di applicabilità
clinica, con particolare riferimento alla localizzazione e demarcazione delle masse tumorali. Sono qui presentate
due applicazioni, che si riferiscono ad adenomi e adenocarcinomi del colon-retto, e glioblastoma (GBL) del
cervello.
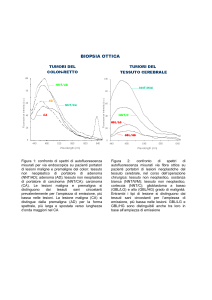
Nel primo caso si tratta di una tecnica diagnostica attuabile per via endoscopica mediante fibre ottiche,
impiegante una lampada al mercurio per l’eccitazione (366, 405 nm) e un multicanale ottico per l’analisi del
segnale di autofluorescenza. Misure eseguite su un numero indicativo di pazienti hanno evidenziato che le
lesioni maligne e pre-maligne sono discriminabili dal tessuto normale circostante sia per l’ampiezza del segnale
(la neoplasia da un segnale di autofluorescenza minore) che per il profilo spettrale (la neoplasia ha emissione
spostata a lunghezze d’onda maggiori). La lesione pre-maligna si differenzia dalla maligna per il profilo
spettrale. L’analisi microspettrofluorimetrica e di imaging di fluorescenza su sezioni di tessuto da sala operatoria
ha consentito di caratterizzare i principali responsabili del segnale di autofluorescenza misurato in vivo e di
interpretare le differenze riscontrate. L’impiego di un modello Montecarlo di simulazione della propagazione di
luce nel tessuto ha evidenziato il ruolo fondamentale dell’organizzazione istologica ai fini delle caratteristiche
del segnale di fluorescenza: l’invasività della neoplasia, infatti, comporta una riduzione del contributo del
collagene della sottomucosa, che rappresenta il componente a più alta efficienza di fluorescenza.
Nel caso del GBL l’applicazione della tecnica di autofluorescenza è stata finalizzata a fornire al
neurochirurgo uno strumento di supporto nella valutazione dei margini della massa tumorale utilizzabile in
tempo reale durante l’intervento chirurgico. E’ noto che questi tumori presentano spesso un aspetto non
facilmente distinguibile dal tessuto sano, ponendo il problema di un’asportazione eccessiva (problemi di natura
neurologica per il paziente) o insufficiente (comparsa di recidive) di tessuto. Misure eseguite sui diversi tipi di
tessuto cerebrale durante l’intervento hanno indicato che il tessuto tumorale è caratterizzato da un segnale di
autofluorescenza pari a circa 1/5 e 1/3 rispettivamente della materia bianca e della corteccia, con spostamento
significativo del picco di emissione verso lunghezze d’onda maggiori. Il supporto di analisi biochimiche e
istochimiche su campioni di tessuto prelevati durante l’intervento lascia supporre che all’origine delle differenze
vi sia una sostanziale modificazione delle proprietà ottiche tra i diversi tessuti.