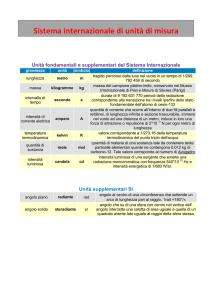
la differenza, però, una radiazione emessa da un nucleo atomico concentra questa energia in un
unico processo microscopico, e può quindi avere effetti drastici. Da questo punto di vista è di
estrema importanza la grande differenza tra le energie in gioco nei processi elettronici e in quelli
nucleari per capire i meccanismi e gli effetti delle radiazioni nucleari. Infatti - come già abbiamo
menzionato nell’Introduzione al Cap. 1 e vedremo meglio nel seguito - tutti i processi chimici, ed
anche i processi vitali, dipendono unicamente dagli elettroni esterni dell’atomo: le radiazioni nucleari
possiedono energie talmente più grandi da spezzare i legami chimici e modificare le molecole; i nuclei
atomici instabili non sono riconoscibili dall’organismo, ma una volta che siano al suo interno il loro
decadimento provoca danni gravissimi.
Altre unità pratiche per l’energia. In altri tipi di problemi risulta comodo utilizzare altre unità di
misura pratche dell’energia. All’estremo opposto dei processi atomici, nella vita quotidiana sono
vivente, anzi, ”organizza” la materia inerte, cioè crea ordine. Questo è possibile perché esso ”scarica” nell’ambiente circostante un disordine maggiore di quello che crea. Il flusso di materia e di
energia che attraversa l’organismo è cioè tale da consentire all’organismo, per i processi specifici che
lo caratterizzano, di creare e di mantenere quest’ordine, mentre la materia e l’energia che escono dall’organismo sono degradate, come richiesto dal secondo principio della termodinamica. Rprenderemo
queste considerazioni nel →Cap. 4.
---o0o--ULTERIORI PROBLEMI SUL CAP. 2
2.12.
UNA PRIMA
DIGRESSIONE
SUGLI
ORGANISMI
VIVENTI
195
Problema
2.a. Si fornisce
una quantità
di calore
di 500 kcal
a 2 kg d’acqua a 80 ◦ C e a pressione
normale: quanto vapore viene prodotto?
Problema 2.b. Si ha una massa di 1 kg di ghiaccio a −10 ◦ C: che cosa accade se al ghiaccio viene
fornita una quantità di calore (a) di 50 kcal; o (b) di 2 kcal; oppure (c) di 100 kcal? Oppure (d) gli
viene tolta una quantità di calore di 10 kcal?
Problema 2.c. Un cubetto di ghiaccio di massa mg = 50 g alla temperatura di 0 ◦ C viene posto
all’interno di un recipiente cubico di lato 1 m, a pareti termicamente isolanti, contenente aria a
pressione normale (densità d = 1, 3 g/dm3 ) alla temperatura ta = 20 ◦ C: determinare la temperatura
e la composizione del sistema all’equilibrio (per i valori dei calori specifici v. Tabella 2.2).
Problema 2.d. Quando un sistema termodinamico riceve calore è vero che esso ”si riscalda”?
Problema 2.e. Calcolo realistico di un calorimetro. Un pezzo di ferro di massa m F = 100 g alla
temperatura tF = 90 ◦ C viene posto in un calorimetro che contiene una massa ma = 1 kg d’acqua
a temperatura ta = 20 ◦ C; le pareti del calorimetro assorbono una certa quantità di calore e si è
determinata la loro capacità termica, che risulta Ccal = 45 cal/◦ C. Quando si raggiunge l’equilibrio
termico, la temperatura risulta teq = 22, 2 ◦ C: determinare il calore specifico e il calore molare del
ferro.
Problema 2.f . Calcolare il tempo necessario per liquefare 100 g di ferro inizialmente alla temperatura di 1500 ◦ C in un forno che gli fornisce una potenza costante di 50 W (per le caratteristiche
del ferro si vedano le Tabelle 2.2 e 2.3).
Problema 2.g. In una stanza di volume 300 m3 alla temperatura di 30 ◦ C si lascia evaporare
acqua finché il vapore raggiunge la saturazione: determinare la massa totale del vapore d’acqua,
supponendo che esso ubbidisca alla legge dei gas ideali (la pressione di vapore saturo a 30 ◦ C è di
4,2·103 N/m2 ).
Problema 2.h. L’equazione di stato di un gas reale è rappresentata con buona approssimazione
dall’equazione di van der Waals, per una mole
!
a "
P + 2 (V − b) = RT ,
V
dove a e b sono parametri caratteristici del gas: calcolare l’espressione del lavoro eseguito da una
mole di gas reale in una espansione isoterma in cui il suo volume passa dal valore Vi al valore Vf .
Problema 2.i. Un gas ideale che occupa inizialmente un volume di 1 m3 raddoppia di volume in
una trasformazione nella quale la pressione varia secondo la legge P = αV 2 , con α = 5 atm/m6 (cfr.
un caso concreto nel Problema seguente): determinare il lavoro eseguito dal gas nell’espansione.
Problema 2.l. Un gas ideale viene riscaldato lentamente in una trasformazione lungo la quale la
pressione è direttamente proporzionale al volume, e passa dallo stato iniziale (P 0 , V0 ) allo stato finale
(3P0 , 3V0 ): determinare il lavoro eseguito dal gas e la relazione che lega la temperatura al volume nel
corso della trasformazione.
Problema 2.m. A quanti J corrisponde l’energia di 1 kWh (chilowattora)?
Problema 2.n. Una molla di costante elastica k = 103 N/m viene allungata di 10 cm dalla
posizione di equilibrio: calcolare il lavoro eseguito dalla forza elastica e il suo segno. Discutere il
lavoro minimo che deve eseguire la persona che allunga la molla e il suo segno.
- - - o0o - - SOLUZIONI DEGLI ESEMPI NEL TESTO E DEGLI ULTERIORI PROBLEMI
Soluzione 2.2. La temperatura finale tf è ovviamente intermedia tra le due remperature di 20 ◦ C e
90 ◦ C. Per calcolarla si considera che il calore viene scambiato tra le due masse d’acqua: non essendovi
Angelo Baracca - Ulteriori Esercizi e Problemi sul Capitolo 2
Pag. 1
196
disp
Q#
cioè
Que
Dal
I
dire
S
Que
que
S
mas
200
S
Q"
all
da c
Si o
il fa
spec
S
2.12. UNA PRIMA DIGRESSIONE SUGLI ORGANISMI VIVENTI
201
Soluzione 2.a. Perché l’acqua vaporizzi a pressione normale occorre portarla a 100 ◦ C. A seconda
del calore totale che viene fornito sono possibili vari casi: o questo calore non è sufficiente a portare
l’acqua a 100 ◦ C; oppure esso è sufficiente a riscaldare l’acqua a questa temperatura ed a vaporizzarne
una parte; o ancora esso è sufficiente a vaporizzare tutta l’acqua ed a riscaldare il vapore a più di
100 ◦ C. Per portare l’acqua a 100 ◦ C è necessaria una quantità di calore
"(risc)
Q
◦
◦
= ma · ∆T = (2 kg)(1 kcal/kg · C)(20 C) = 40 kcal ;
per vaporizzare tutta l’acqua occorre un calore supplementare
(vap)
Q"(vap) = qlat
· ma = (540 kcal/kg)(2 kg) = 1080 kcal .
Nel caso del problema 40 kcal sono utilizzate per portare l’acqua a 100 ◦ C, mentre le restanti 460
kcal vaporizzano una massa di acqua
mvap
202
CAPITOLO 2. L’ENERGIA
Soluzione 2.c. Per determinare la composizione finale del sistema occorre confrontare il calore
Qf us che deve assorbire il ghiaccio per fondere con il calore Qtot che può cedere l’aria se si raffreddasse
fino a 0 ◦ C
Qf us = mg · qf us = (50 g)(80 cal/g) = 4 kcal
Qtot = (d · V ) · c(aria)
· ∆t = (1, 3 · 103 g)(0, 17 cal/g ·◦ C)(20 ◦ C) = 4, 42 kcal .
s
L’aria riesce quindi a fondere tutto il ghiaccio prima di raffreddarsi a 0 ◦ C, per cui continua a cedere
calore all’acqua di fusione: lo stato di equlibrio del sistema è quindi costituito da acqua liquida ed
aria ad una temperatura 0 ◦ C < teq <20 ◦ C. Per determinare teq occorre uguagliare la quantità di
calore assorbita dal ghiaccio per fondere e dall’acqua risultante per riscaldarsi con la quantità di
calore ceduta dall’aria nel raffreddarsi
mg · qf us + mg · c(acqua)
(teq − 0 ◦ C) = ma · c(aria)
(20 ◦ C − teq ) ,
s
s
da cui si ottiene (ogni addendo è espresso in cal)
460 kcal
= 0, 85 kg .
=
540 kcal/kg
4 · 103 + 50 · teq = 4, 42 · 103 − (1, 3 · 103 )(0, 17) · teq
Soluzione 2.b. Nei primi tre casi, i processi possibili, a seconda della quantità di calore che viene
fornita, sono il riscaldamento del ghiaccio, la sua fusione parziale o completa, e nell’ultimo caso il
riscaldamento dell’acqua; le quantità di calore necessarie sono rispettivamente
◦
◦
Q"(risc) = mg · c(g)
s · ∆T = (1 kg)(0, 5 kcal/kg · C)(10 C) = 5 kcal ,
(fus)
Q"(fus) = qlat · mg = (1 kg)(80 kcal/kg) = 80 kcal .
Nei tre casi gli stati finali del sistema sono allora: (a) una miscela di acqua e ghiaccio a 0 ◦ C composta
da una massa d’acqua
45 kcal
= 0, 56 kg
ma =
80 kcal/kg
e una massa di ghiaccio
teq = 1, 55 ◦ C .
Soluzione 2.d. Abbiamo insistito sul fatto che gli effetti dei trasferimenti di calore sono molti
(variazione della pressione, del volume, della resistenza elettrica, della costante dielettrica, ecc.).
Benché accada comunemente che quando un sistema riceve calore la sua temperatura aumenti, ciò
non è sempre vero: ad esempio, nelle transizioni di fase la temperatura rimane costante; oppure contemporaneamente al trasferimento di calore potrebbe diminuire sensibilmente la pressione sul sistema,
in modo tale che la sua dilatazione dia complessivamente un abbassamento della sua temperatura.
Soluzione 2.e. Occorre uguagliare il calore ceduto dal ferro con quello assorbito dall’acqua e dalle
pareti del calorimetro
(ma · c(acqua)
+ Ccal )(teq − ta ) = mF · c(ferro)
(tF − teq ) ,
s
s
da cui si ottiene
(ferro)
cs
mg = 0, 44 kg .
(b) ghiaccio alla temperatura tg data dalla relazione
"
Q
tg =
(g)
= mg · cs · (tg +
(g)
Q! − mg ·cs ·10 ◦ C
(g)
mg ·cs
(ferro)
10 C) , da cui
=
cmol
◦
=−6 C
(che si poteva anche ricavare direttamente da una proporzione: se 5 kcal riscaldano il ghiaccio di 10
C, 2 kcal lo riscaldano di 4 ◦ C); (c) acqua ad una temperatura data da
◦
ma · c(acqua)
· ∆t = 15 kcal , cioè ta = 15 ◦ C .
s
(g)
− Q# − mg ·cs ·10 ◦ C
(g)
mg ·cs
=
− 10kcal − (1 kg)(0,5 kcal/kg·◦ C)(10 ◦ C)
(1 kg)(0,5 )
11 · 10−2 cal/g·◦ C .
= (11 · 10−2 cal/g ·◦ C)(56 g/mol) = 6, 16 cal/mol ·◦ C = 25, 8 J/mol ·◦ C .
Soluzione 2.f . Il ferro deve venire riscaldato dalla temperatura iniziale tF = 1500 ◦ C alla temperatura di fusione tf us = 1530 ◦ C e poi deve venire fuso: questo processo richiede una quantità di
calore
(ferro)
(tf us − tF ) + mF · qf us
Q" = mF · cs
= (100 g)(0, 11 cal/g◦ C)(1530 − 1500)◦ C+(100 g)(49 cal/g)
= 5· 230 cal = 21· 893 J .
Per fornire questa quantità di calore il forno impiega un tempo
Nel caso (d) si ha ghiaccio a temperatura più bassa, cioè
tg =
+Ccal )(teq −ta )
(tF −teq )
cal/◦ C] (2,2 ◦ C)
= [(300+45)
=
(100 g)[(90−22,2) ◦ C]
Il numero di massa del ferro è 56, per cui il suo calore molare risulta
◦
2kcal − (1 kg)(0,5 kcal/kg·◦ C)(10 ◦ C)
(1 kg)(0,5 )
(acqua)
= (ma ·cs mF
= − 30 ◦ C
t=
Q
21· 983 J
=
" 438 s = 7 min 18 s .
P
50 J/s
Angelo Baracca - Ulteriori Esercizi e Problemi sul Capitolo 2
Pag. 2
2.12. UNA PRIMA DIGRESSIONE SUGLI ORGANISMI VIVENTI
203
Soluzione 2.g. Dalla legge dei gas ideali si determina il numero di moli di vapore per unità di
volume che corrispondono alla pressione di 4,2·103 N/m2 alla temperatura di (273+30) K
N
V
=
2
3
N/m
= (8,3 4,2·10
= 1, 7 mol/m3
J/K·mol)(303 K)
3
= (1, 7 mol/m )(18 g/mol) = 30 g/m3 .
P
RT
Quindi la massa totale di vapore contenuta nella stanza è di
RT
a
−
,
V −b V2
La molla esegue un lavoro negativo (resistente) poiché si oppone all’allungamento; la forza elastica ha
verso opposto alla deformazione. Una persona che allunga la molla deve eseguire un lavoro positivo
maggiore o uguale al lavoro resistente della molla, cioè positivo e maggiore di 5 J: quanto maggiore di
5 J è il lavoro che si esegue, tanto più rapidamente si allunga la molla (in realtà non si può neppure
realizzare l’allungamento eseguendo il lavoro minimo di 5 J, perché in tal caso la forza che si applica
alla molla è esattamente uguale ed opposto alla forza elastica, quindi la molla non si allunga).
per cui il lavoro risulta, essendo T , a e b costanti,
=
Vi
!Vf " RT
−
V −b
Vi
= RT
!Vf
Vi
1
V −b
= RT · ln
a
V2
#
dV
dV - a
Vf − b
Vi − b
+a
Soluzione 2.i.
L!
term =
!Vf
Vi
P · dV
=α·
!Vf
V 2 · dV =
Vi
5 atm/m6
(23
3
6
"
α
3
Vf3 − Vi3
!Vf
V
$i
1
V2
1
Vf
La legge con cui varia la temperatura del gas durante la trasformazione si ottiene sostituendo la
(7.153)
(2.34) nell’equazione di stato
PV
P0
T =
·V2 .
=
NR
N RV0
Soluzione 2.m. Un chilowattora corrisponde all’energia totale eseguita in un’ora sviluppando la
potenza costante di 1 kW = 103 W. Pertanto
Soluzione 2.n. Il lavoro eseguito dalla forza elastica Fel = −kx della molla nell’allungamento vale
'0,1 m
&
! 0,1 m
! 0,1 m
(−kx) dx = −k 0
x · dx = −k 12 x2 0
Lel = 0
1
3
−2
2
= − 2 (10 N/m)(10 m ) = −5 J .
cioè ben 9 litri d’acqua allo stato di vapore!
Soluzione 2.h. La dipendenza della pressione dal volume è data da
!Vf
L!
isoterm = P · dV
CAPITOLO 2. L’ENERGIA
E(1 kWh) = (103 W)(3.600 s) = 3, 6 · 106 J .
mvap = (30 g/m3 )(300 m3 ) = 9 kg ,
P =
204
dV
−
1
Vi
%
#
− 13 ) m9
=
1
5
(5
atm/m
)(10
N/m2 ·atm)(7 m9 ) = 11, 7 · 105 J .
3
Soluzione 2.l. Se indichiamo con P = kV la legge della trasformazione, la costante k si determina
dall’equazione di stato per lo stato iniziale
P0 V0 = N RT0 ,
ma P 0 = kV 0 ,
0
per cui kV02 = N RT0 , e quindi k = NVRT
=
2
0
P0 V0
V02
=
P0
V0
.
La relazione tra la pressione e il volume durante la trasformazione è quindi
P =
P0
V,
V0
(2.34)
per cui il lavoro eseguito dal gas durante il processo di riscaldamento vale
L!
term
=
=
3V
!0
P · dV =
V0
P0 1
V0 2
(9V02
−
P0
V0
V02 )
3V
!0
V0
V · dV
= 4P0 V0 .
Angelo Baracca - Ulteriori Esercizi e Problemi sul Capitolo 2
Pag. 3