LA NOMENCLATURA DELLE SOSTANZE CHIMICHE
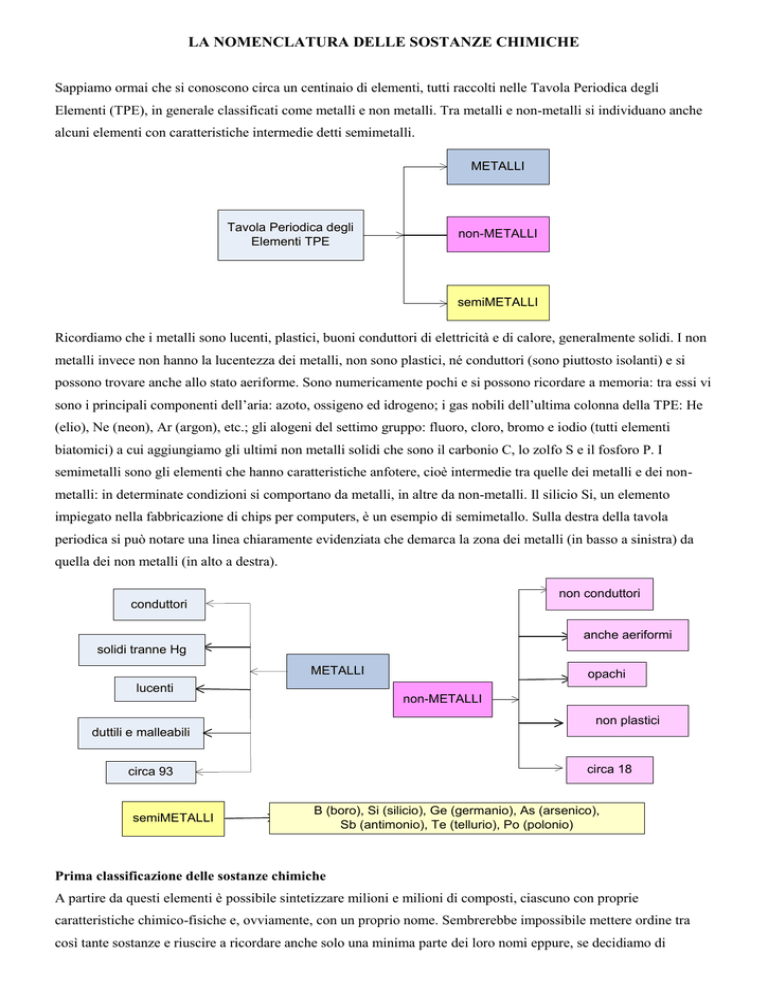
Sappiamo ormai che si conoscono circa un centinaio di elementi, tutti raccolti nelle Tavola Periodica degli
Elementi (TPE), in generale classificati come metalli e non metalli. Tra metalli e non-metalli si individuano anche
alcuni elementi con caratteristiche intermedie detti semimetalli.
METALLI
Tavola Periodica degli
Elementi TPE
non-METALLI
semiMETALLI
Ricordiamo che i metalli sono lucenti, plastici, buoni conduttori di elettricità e di calore, generalmente solidi. I non
metalli invece non hanno la lucentezza dei metalli, non sono plastici, né conduttori (sono piuttosto isolanti) e si
possono trovare anche allo stato aeriforme. Sono numericamente pochi e si possono ricordare a memoria: tra essi vi
sono i principali componenti dell’aria: azoto, ossigeno ed idrogeno; i gas nobili dell’ultima colonna della TPE: He
(elio), Ne (neon), Ar (argon), etc.; gli alogeni del settimo gruppo: fluoro, cloro, bromo e iodio (tutti elementi
biatomici) a cui aggiungiamo gli ultimi non metalli solidi che sono il carbonio C, lo zolfo S e il fosforo P. I
semimetalli sono gli elementi che hanno caratteristiche anfotere, cioè intermedie tra quelle dei metalli e dei nonmetalli: in determinate condizioni si comportano da metalli, in altre da non-metalli. Il silicio Si, un elemento
impiegato nella fabbricazione di chips per computers, è un esempio di semimetallo. Sulla destra della tavola
periodica si può notare una linea chiaramente evidenziata che demarca la zona dei metalli (in basso a sinistra) da
quella dei non metalli (in alto a destra).
non conduttori
conduttori
anche aeriformi
solidi tranne Hg
METALLI
lucenti
opachi
non-METALLI
non plastici
duttili e malleabili
circa 18
circa 93
semiMETALLI
B (boro), Si (silicio), Ge (germanio), As (arsenico),
Sb (antimonio), Te (tellurio), Po (polonio)
Prima classificazione delle sostanze chimiche
A partire da questi elementi è possibile sintetizzare milioni e milioni di composti, ciascuno con proprie
caratteristiche chimico-fisiche e, ovviamente, con un proprio nome. Sembrerebbe impossibile mettere ordine tra
così tante sostanze e riuscire a ricordare anche solo una minima parte dei loro nomi eppure, se decidiamo di
catalogare le sostanze in base al loro comportamento chimico, questa miriade di composti si riconduce a poche
categorie fondamentali.
Per una prima definizione operativa riprendiamo alcune nozioni di uso comune e già incontrate in questo corso. Le
sostanze possono essere classificate in basiche o acide: si dicono basiche le sostanze dal sapore amaro, che al tatto
sono scivolose come il sapone, in grado di neutralizzare l’azione degli acidi e di far virare al blu una cartina
tornasole, in generale sono caustiche e corrosive; sono acide le sostanze dal sapore aspro, capaci di corrodere i
metalli e il marmo, in grado di neutralizzare l’azione delle basi e di far virare al rosso la cartina tornasole. Le
sostanze basiche si ottengono a partire dai metalli mentre quelle acide a partire dai non metalli.
Sono infatti i metalli che tendono a reagire con l’ossigeno per formare ossidi basici, composti cioè formati da due
elementi (composti binari) che sono il metallo in questione e l’ossigeno. Ad esempio il sodio e lo zinco possono
combinarsi con l’ossigeno per dare i rispettivi ossidi di sodio e zinco le cui formule sono Na2O e ZnO. Il rapporto
di combinazione tra i due elementi dipende dalla loro valenza: l’ossigeno ha sempre valenza 2, tranne nei perossidi
come l’acqua ossigenata in cui ha valenza 1, il sodio, elemento del primo gruppo della TPE, ha sempre valenza 1
mentre lo zinco ha sempre valenza 2 (ricordiamo che per valenza si intende il numero di atomi di idrogeno che un
atomo di un elemento è in grado di legare).
I metalli possono anche combinarsi con l’idrogeno dando origine agli idruri, composti sempre binari
metallo/idrogeno molto più instabili degli ossidi e dunque di uso meno frequente. Ad esempio sodio e zinco
formano rispettivamente l’idruro di sodio NaH e l’idruro di zinco ZnH2.
+ ossigeno
+ idrogeno
IDRURI
OSSIDI BASICI
METALLI
Da un punto di vista chimico un non metallo forma con l’ossigeno composti binari chiamati ossidi acidi (detti
comunemente anidridi). Ad esempio il carbonio si combina bruciando con l’ossigeno e forma il biossido di
carbonio o anidride carbonica CO2, mentre in difetto di ossigeno si forma il monossido di carbonio CO, spesso
presente nelle gallerie. Lo zolfo (con valenza 4 o 6) si combina con l’ossigeno per dare rispettivamente il biossido
di zolfo SO2 (o anidride soloforosa) e il triossido di zolfo SO3 (o anidride solforica). I non metalli possono
combinarsi anche con l’idrogeno dando origine agli idracidi, composti sempre binari non-metallo/idrogeno. Gli
idracidi principali, con caratteristiche acide, sono quelli che derivano formalmente dall’unione degli elementi F, Cl,
Br, I (cioè gli alogeni, tutti con valenza 1) e S (con valenza 2) con H. Le formule dei principali idracidi sono quindi
HF, HCl, HBr, HI e H2S.
+ ossigeno
+ idrogeno
IDRACIDI
non-METALLI
OSSIDI ACIDI
METALLI
sono
semiMETALLI
ANFOTERI
comportandosi da
non-METALLI
Prima di approfondire la classificazione delle sostanze chimiche è bene imparare a conoscere e usare correttamente
il numero o i numeri di ossidazione di un elemento.
Principali categorie di sostanze chimiche e loro nomenclatura
In generale abbiamo già visto che i metalli tendono a formare ossidi basici per reazione diretta con l’ossigeno e
idruri per reazione diretta con l’idrogeno; i non metalli invece formano rispettivamente ossidi acidi, detti
comunemente anidridi, e idracidi o acidi binari quando reagiscono con l’idrogeno.
IDRACIDI
(o acidi binari)
IDRURI
+ H2 (g)
METALLI
+ H2 (g)
TPE
NON METALLI
+ O2 (g)
+ O2 (g)
OSSIDI ACIDI
(o anidridi)
OSSIDI BASICI
Lo schema si estende con gli idrossidi e gli acidi ossigenati che si ottengono generalmente facendo reagire
rispettivamente gli ossidi basici e gli ossidi acidi con l’acqua. I sali binari si ottengono formalmente (ma non
praticamente) a partire dagli idruri e dagli idracidi; quelli ternari, che contengono l’ossigeno oltre alla componente
metallica e non metallica, si possono ottenere facendo reagire gli idrossidi con gli acidi ossigenati. Lo schema
proposto vuole suggerire una strategia semplificata per ricordare le varie categorie di sostanze a partire dagli
elementi presenti. Le reazioni di sintesi delle varie sostanze sono infatti molte più di quelle indicate dallo schema e,
addirittura, la reazione di sintesi proposta per i sali binari a partire dagli idruri e dagli idracidi non viene mai
utilizzata.
SALI BINARI
+ H2
IDRACIDI
(o acidi binari)
IDRURI
+ H2 (g)
METALLI
+ H2 (g)
TPE
NON METALLI
+ O2 (g)
+ O2 (g)
OSSIDI ACIDI
(o anidridi)
OSSIDI BASICI
+ H2O(l)
+ H2O(l)
OSSIACIDI
(o acidi ossigenati o
acidi ternari)
IDROSSIDI
(o basi)
SALI TERNARI
+ H2O
Ai fini della nomenclatura è utile raggruppare le varie classi in due grandi categorie: i composti binari e i composti
ternari.
Esercizi:
1) Completa le seguenti frasi-reazione utilizzando correttamente le regole della nomenclatura tradizionale.
Soluzioni: a) ossido basico b) non metallo, ossigeno c) idrossido d) idrossido e) non metallo f) idrogeno g) idruro, idracido
h) acqua
I composti binari
Tutti i composti binari sono costituiti da due soli elementi e, a seconda dei legami fra i loro elementi, possono
essere ulteriormente distinti in composti ionici e molecolari. I composti ionici vedono un elemento metallico legarsi
con un elemento non metallico; la differenza di elettronegatività si attesta su valori uguali o superiori a 1,9 (scala di
elettronegatività secondo Pauling), per cui il metallo cede interamente i suoi elettroni di valenza e si carica
positivamente trasformandosi in catione o ione positivo; il non metallo riceve l’elettrone o gli elettroni ceduti e si
carica negativamente diventando anione o ione negativo. Il legame ionico determina una struttura solida in cui gli
ioni di segno opposto si dispongono nello spazio in posizioni regolari in modo tale da ottimizzare le interazioni
elettrostatiche. Sono composti binari e ionici gli ossidi basici, gli idruri e i sali binari, che, come vedremo, possono
essere alogenuri (cloruri, bromuri, etc.) e solfuri.
COMPOSTI BINARI
IONICI
MOLECOLARI
OSSIDI
BASICI
SALI
(alogenuri,
solfuri)
OSSIDI ACIDI
IDRURI
IDRACIDI
IDRURI
COVALENTI
Sono composti binari e molecolari gli ossidi acidi (o anidridi), gli idracidi (o acidi binari) e gli idruri covalenti.
Mentre gli idruri ionici sono composti dell’idrogeno con metalli fortemente elettropositivi, tipicamente metalli del I
e II gruppo, gli idruri covalenti sono composti dell’idrogeno con semimetalli e non metalli (gruppi IV, V,VI).
Esempi di tali composti sono il metano CH4 e l’ammoniaca NH3. A differenza degli idruri ionici questi sono
costituiti da molecole e sono spesso liquidi o gassosi a temperatura ambiente (gli idruri ionici sono tutti solidi).
I composti ternari
I composti ternari sono formati dalla combinazione di tre elementi differenti. I principali composti ternari sono gli
idrossidi e gli ossiacidi, che si ottengono a partire dai rispettivi ossidi con l’acqua, e i sali degli ossiacidi. Come
evidenziato dallo schema che segue i soli composti ternari molecolari sono gli ossiacidi, non contenendo alcuna
componente metallica.
COMPOSTI TERNARI
IONICI
IDROSSIDI
SALI DEGLI
OSSIACIDI
MOLECOLARI
OSSICIADI (o acidi ternari
o acidi ossigenati)
Esercizio:
1) Classifica le seguenti categorie di sostanze in composti binari CB o ternari CT, ionici CI o molecolari CM
Categorie
Composti Binari
Composti ionici
CB/Ternari CT
CI/molecolari CM
a) Sali degli ossiacidi:
b) anidridi:
c) idracidi:
d) ossidi basici:
e) idruri:
f) solfuri:
g) idrossidi:
h) acidi ossigenati:
i) ossidi basici:
Soluzioni: a) CT,CI; b) CB,CM; c) CB,CM; d) CB,CI; e) CB, CI; f) CB,CI; g) CT,CI; h) CT,CM; i) CB,CI
Categorie, reazioni chimiche e nomenclatura
Tentiamo ora una categorizzazione più approfondita considerando alcune importanti reazioni chimiche per la
sintesi delle sostanze con indicazioni relative alla loro nomenclatura. L’esigenza di assegnare un nome all’enorme
numero di sostanze naturali e artificiali fu avvertita ancora nel 1787 da Antoine Lavoisier. Lo scienziato individuò i
numeri di valenza più comuni di alcuni importanti elementi e assegnò desinenze diverse a ioni diversi dello stesso
elemento: ad esempio chiamò ione solforoso lo zolfo con valenza 4 e ione solforico quello valenza 6. Le desinenze
oso e ico accompagnano da allora tutti i composti contenenti i due ioni in questione per cui avremo che, per
reazione con l’ossigeno si ottengono l’anidride solforosa SO2 e l’anidride solforica SO3, per reazione con l’acqua si
ottengono invece rispettivamente l’acido solforoso H2SO3 e l’acido solforico H2SO4. I nomi dei principali ioni di
elementi metallici e non vengono elencati in una tabella che segue, assieme a quelli di alcuni esempi di composti
già ordinati nelle rispettive categorie. Oggi per individuare il nome delle sostanze vi sono delle regole elaboratore
da una associazione internazionale denominata International Union of Pure and Applied Chemistry (IUPAC) in un
congresso del 1959 che però fanno fatica a sradicare la nomenclatura tradizionale che trova proprio con Lavoisier
le sue origini.
Ossidi basici e acidi
Una classica reazione per la sintesi di un ossido basico è quella che avviene tra il nastro di magnesio solido e
l’ossigeno atmosferico:
L’ossido ottenuto viene comunemente chiamato ossido di magnesio; secondo la IUPAC trattasi invece del
monossido di magnesio, ad indicare che il numero di atomi di ossigeno che si legano a un atomo di magnesio è 1. Il
magnesio nel composto ottenuto ha carica +2 e viene chiamato ione magnesio.
Una classica reazione per la sintesi di un ossido acido è invece quella che si forma secondo il seguente schema:
Il prodotto di reazione viene comunemente chiamato anidride solforosa, dato che lo ione S+4 è tradizionalmente
definito ione solforoso. La IUPAC assegna al prodotto il nome di diossido di zolfo, per indicare che il numero di
atomi di ossigeno che si legano con un atomo di zolfo è due.
Un’ulteriore reazione di sintesi di un ossido è la seguente:
Il prodotto di sintesi è comunemente chiamato ruggine mentre il nome tradizionale è ossido ferrico, trattandosi
dello ione trivalente Fe+3. La IUPAC gli assegna invece il nome di triossido di diferro, sempre ad indicare il
numero di atomi dei due elementi che si combinano tra loro.
Nomenclatura tradizionale e IUPAC di alcuni ossidi basici
elemento
Cu
Sn
numero di
formula
nome tradizionale
nome IUPAC
+1
Cu2O
ossido rameoso
monossido di dirame
+2
CuO
ossido rameico
monossido di rame
+2
SnO
ossido stannoso
monossido di stagno
+4
SnO2
ossido stannico
diossido di stagno
ossidazione
Nomenclatura tradizionale e IUPAC di alcuni ossidi basici
elemento
C
N
Cl
numero di
formula
nome tradizionale
nome IUPAC
+2
CO
ossido di carbonio
monossido di carbonio
+4
CO2
anidride carbonica
diossido di carbonio
+3
N2O3
anidride nitrosa
triossido di diazoto
+5
N2O5
anidride nitrica
pentolssido di diazoto
+1
Cl2O
anidride ipoclorosa
monossido di dicloro
+3
Cl2O3
anidride clorosa
triossido di dicloro
+5
Cl2O5
anidride clorica
pentossido di dicloro
+7
Cl2O7
anidride perclorica
eptaossido di dicloro
ossidazione
Esercizi:
1) Completa le reazioni proposte stabilendo se si tratta di una reazione di sintesi di un ossido acido o basico e
scrivendo il nome del prodotto
sintesi ossido basico: ossido di sodio
…………………………………………………..
sintesi ossido acido: anidride nitrica
…………………………………………………..
…………………………………………………..
…………………………………………………..
……………………: monossido di carbonio
Soluzioni:
;
, sintesi anidride ipoclorosa; c)
, sintesi ossido di piombo IV; …
;
Idruri, idracidi
La reazione di sintesi dell’idruro di sodio è la seguente:
Il nome IUPAC del prodotto è diidruro di magnesio, dovendo specificare il numero di atomi di idrogeno che si
legano con un atomo di magnesio. Il prefisso mono per quest’ultimo viene omesso perché non necessario.
Analogamente la reazione di sintesi dell’idruro ferrico è la seguente:
IL nome IUPAC del prodotto è triidruro di ferro.
La sintesi dell’idracido a partire da zolfo e idrogeno elementari è rappresentata dalla seguente equazione:
Il nome tradizionale è acido solfidrico mentre quello IUPAC è solfuro di diidrogeno.
Riportiamo i nomi tradizionali e IUPAC di alcuni idruri e idracidi.
Nomenclatura tradizionale e IUPAC di alcuni idruri
elemento
Na
Cu
Al
numero di
Formula
nome tradizionale
nome IUPAC
+1
NaH
idruro di sodio
idruro di sodio
+1
CuH
idruro rameoso
idruro di rame
+2
CuH2
idruro rameico
diidruro di rame
+3
AlH3
idruro di alluminio
triidruro di alluminio
ossidazione
Nomenclatura tradizionale e IUPAC degli idracidi più comuni
elemento
numero di
ossidazione
Formula
nome tradizionale
nome IUPAC
F
-1
HF
acido fluoridrico
fluoruro di idrogeno
Cl
-1
HCl
acido cloridrico
cloruro di idrogeno
Br
-1
HBr
acido bromidrico
bromuro di idrogeno
I
-1
HI
acido iodidrico
ioduro di idrogeno
Gli idruri covalenti già ricordati tendono ad avere nome comune come evidenziato dalla tabella che segue:
elemento
numero di
ossidazione
Formula
nome comune
nome IUPAC
C
-4
CH4
metano
tetraidruro di carbonio
N
-3
NH3
ammoniaca
triidruro di azoto
Si
+4
SiH4
silano
tetraidruro di silicio
P
+3
PH3
fosfina
tetraidruro di fosforo
Esercizi:
1) Completa le reazioni proposte stabilendo se si tratta di una reazione di sintesi di un idruro o di un idracido e
scrivendo il nome del prodotto
sintesi idruro: idruro di potassio
sintesi ………….: acido cloridrico
…………………………: idruro di calcio
……………………………………………………………
……………………………………………………………
……………………………………………………………
…………………………………………………ammoniaca
……………………………………………………………
……………………………………………………………
Soluzioni:
, sintesi
idruro di alluminio;
, sintesi di un idruro speciale;
sintesi
idruro speciale metano
Sali binari
Esempi di reazioni di sintesi dei sali binari vedono l’idracido reagire direttamente con il metallo, come ad esempio
accade tra l’acido cloridrico e lo zinco:
dove i prodotti di reazione sono il cloruro di zinco (dicloruro di zinco secondo la IUPAC) e l’idrogeno. Il cloruro di
zinco si può ottenere anche a partire dall’idracido e dall’ossido basico:
I Sali binari sono ottenuti formalmente sostituendo allo ione (o agli ioni) H+ degli idracidi uno ione metallico. Sono
dunque composti ionici binari che non contenengono l’ossigeno. Va osservato che la desinenza idrico dell’acido
binario si trasforma nella desinenza uro nel sale binario come evidenziato dallo specchietto e dalla tabella che
seguono.
nome acido
nome sale
-idrico
-uro
La nomenclatura tradizionale e IUPAC vengono quasi a coincidere come si può osservare anche dalla tabella che
Nomenclatura tradizionale e IUPAC di alcuni sali binari
ione
formula
metallico
sale binario
HF
Na+1
HCl
idracido
nome tradizionale
nome IUPAC
NaF
fluoruro di sodio
fluoruro di idrogeno
Ca+2
CaCl2
cloruro di calcio
dicloruro di calcio
HBr
Al+3
AlBr3
bromuro di alluminio
tribromuro di alluminio
H2S
Fe+3
Fe2S3
solfuro ferrico
trisolfuro di diferro
Esercizi:
1) Completa le reazioni proposte scrivendo il nome del sale binario ottenuto:
solfuro di zinco
………………………………..
………………………………..
………………………………..
………………………………..
………………………………..
solfuro di calcio
Soluzioni:
;
rameico;
, cloruro
solfuro di bario;
, cloruro di alluminio;
Idrossidi e ossiacidi
Idrossidi e ossiacidi sono composti ternari in cui sono rispettivamente presenti il metallo (o non metallo),
l’idrogeno con numero di ossidazione +1 e l’ossigeno con numero di ossidazione -2. Gli idrossidi sono quindi
composti ionici, mentre gli ossiacidi composti covalenti.
La classica reazione di sintesi di un idrossido vede il rispettivo ossido basico reagire con l’acqua. La reazione di
sintesi dell’idrossido di magnesio è infatti la seguente:
La nomenclatura IUPAC assegna al prodotto lo stesso nome della tradizionale eccettuato il prefisso “di” di
diidrossido di magnesio.
Nel caso reagisca invece l’ossido ferrico con l’acqua si ha che la reazione correttamente bilanciata è la seguente:
Il nome tradizionale del prodotto: idrossido ferrico, deriva appunto da quello dello ione ferro trivalente: (ione
ferrico), mentre il nome assegnato dalla IUPAC è di triidrossido di ferro.
Analogamente la classica reazione di sintesi di un ossiacido vede la corrispondente anidride reagire con l’acqua. La
reazione di sintesi dell’acido solforico parte dall’anidride solforica in cui l’atomo di zolfo ha numero di ossidazione
+6 (trattasi cioè dello ione solforico):
Mentre la nomenclatura tradizionale conserva le desinenze oso e ico previste per gli ioni non metallici di partenza,
quella IUPAC si fa decisamente più complicata: il nome tradizionale di acido solforico diventa quello di acido
tetraossosolforico (VI). La nomenclatura IUPAC inizia cioè con il termine acido analogamente a quella
tradizionale; segue il nome del non metallo che assume sempre la desinenza ico, poi il suo numero di ossidazione
posto tra parentesi.
Seguono i nomi tradizionali e IUPAC di alcuni idrossidi e ossiacidi.
elemento
numero di
formula
nome tradizionale
nome IUPAC
+1
NaOH
idrossido di sodio
idrossido di sodio
+1
CuOH
idrossido rameoso
monoidrossido di rame
+2
Cu(OH)2
idrossido rameico
diidrossido di rame
Al
+3
Al(OH)3
idrossido di alluminio
triidrossido di alluminio
Sn
+4
Sn(OH)4
idrossido stannico
tetraidrossido di stagno
formula
nome tradizionale
nome IUPAC
+4
H2SO3
acido solforoso
acido triossosolforico (IV)
+3
HNO2
acido nitroso
acido diossonitrico (III)
+5
HNO3
acido nitrico
acido diossonitrico (V)
C
+4
H2CO3
acido carbonico
acido triossocarbonico (IV)
Cl
+1
HClO
acido ipocloroso
acido ossoclorico (I)
Cl
+3
HClO2
acido cloroso
acido diossoclorico (III)
Cl
+5
HClO3
acido clorico
acido triossoclorico (V)
Cl
+7
HClO4
acido perclorico
acido tetraossoclorico (VII)
Na
Cu
elemento
S
N
ossidazione
numero di
ossidazione
Esercizi:
1) Completa le reazioni proposte stabilendo se si tratta di una reazione di sintesi di un idrossido o di un ossiacido e
scrivendo il nome del prodotto
idrossido rameoso
acido carbonico
………………………………..
………………………………..
………………………………..
………………………………..
………………………………..
………………………………..
Soluzioni:
;
idrossido di bario;
acido solforico
acido perclorico;
, acido nitroso;
Sali ternari
I composti ionici in questione si possono ottenere facendo reagire direttamente il metallo con l’acido, come ad
esempio avviene nella reazione tra magnesio e acido solforico:
Lo stesso sale si ottiene però anche a partire dall’ossido di magnesio e l’acido solforico:
oppure a partire dall’idrossido di magnesio e l’acido solforico:
E’ possibile anche far reagire direttamente l’ossido acido con quello basico come segue:
Per attribuire il nome tradizionale ai sali ternari è utile riferirsi al seguente specchietto:
nome acido
nome sale
-oso
-ito
-ico
-ato
per sostituzione dello ione (o degli ioni) idrogeno di un acido ternario con desinenza oso con uno ione metallico si
ottiene un sale ternario con desinenza ito; per sostituzione dello ione (o degli ioni) idrogeno di un acido ternario
con desinenza ico con uno ione metallico si ottiene un sale ternario con desinenza ato.
La sostituzione dei due ioni idrogeno dell’acido solforico con uno ione metallico determina la formazione di un
sale con desinenza ato: il solfato di magnesio.
La nomenclatura IUPAC dei sali ternari parte dal nome dell’acido (il termine acido viene soppresso) alla cui
desinenza ico sostituisce la desinenza ato; segue il nome del catione metallico e, come sempre, si utilizzano i
prefissi per specificare il numero degli atomi o gruppi di atomi.
Nomenclatura tradizionale e IUPAC di alcuni sali ternari
acido
nome
ternario
tradizionale
H2SO3
HClO4
H3PO4
HNO2
H2SO4
nome IUPAC
acido
acido triossosolforico
solforoso
(IV)
acido
acido tetraossoclorico
perclorico
(VII)
acido
acido tetraosso
fosforico
fosforico (V)
acido nitroso
acido diossonitrico
(III)
acido
acido
solforico
tetraossosolforico (VI)
ione
formula
nome
metallico
sale ternario
tradizionale
Na+1
Na2SO3
Sn+4
Sn(ClO4)4
Fe+2
Fe3(PO4)2
Cu+2
Cu(NO2)2
Al+3
Al2(SO4)3
nome IUPAC
solfito di
triossosolfato (IV) di
sodio
sodio
perclorato
tetraossoclorato (VII)
stannico
di stagno (IV)
fosfato ferroso
tetraossofosfato (V)
di ferro (II)
nitrito
diossonitrato (III) di
rameico
rame (II)
solfato di
tetraossosolfato (VI)
alluminio
di alluminio
In generale, le reazioni di sintesi dei sali, sia ternari che binari, si possono ottenere secondo il seguente schema, in
cui si osserva come la coppia di reattivi possa essere indifferentemente costituita da un metallo o un ossido basico o
un idrossido e da un idracido o da un ossiacido o da una ossido acido. Ovviamente i sali binari si ottengono solo a
partire dagli idracidi.
=
IDRACIDI
(o acidi binari)
METALLI
OSSIACIDI
(o acidi ossigenati o
acidi ternari)
+
OSSIDI BASICI
SALI BINARI
IDROSSIDI
(o basi)
=
SALI TERNARI
OSSIDI ACIDI
(o anidridi)
Esercizi
1) Completa le reazioni che seguono. Cerca di dare un nome a tutte le sostanze che partecipano e scrivi quello del
sale ternario che si ottiene dalla reazione.Stabilisci anche se si tratta di una reazione di scambio semplice o di
scambio doppio.
scambio semplice: solfato di calcio
scambio doppio: ………………..
………………………………….
………………………………….
………………………………….
………………………………….
……………………….………….
……………………….………….
………………………….
……………………….………….
Soluzioni:
;
nitrato di magnesio;
solfito di sodio;
, nitrato di magnesio
Ancora esercizi
1) Determina la formula chimica che si stabilisce tra le seguenti coppie di ioni:
-
-2
-3
a) Na+/H-, Rb+/OH-, Cu+2/ Cl-, Fe+3/MnO4 , Ca+2/H-, N+3/O-2, Ni+2/SO4 , Mn+3/S-2, Al+3/PO4
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
b) Completa la tabella riempiendo ogni cella con la formula corretta
2) Assegna il nome tradizionale o la formula alle seguenti sostanze divise in categorie:
a) CuO, HgO, SO2, PbO2, ossido di alluminio, anidride ipobromosa, anidride nitrica, ossido cobaltoso, ossido di
litio
…………………………………………………………………………………………………………………………
b) MgH2, HI, HBr, PH3, metano, idruro di alluminio, acido cianidrico, idruro di calcio
…………………………………………………………………………………………………………………………
c) SnCl4, Fe2S3, SnCl4, PbF4, Ca(HS)2, NH4CN, KHS, bisolfuro di zinco, bromuro di ammonio, cloruro stannoso
…………………………………………………………………………………………………………………………
d) CuOH, HBrO, Sn(OH)4, HIO4, H2SiO3, H3BO3, idrossido piombico, acido nitroso, acido fosforico, idrossido di
argento
…………………………………………………………………………………………………………………………
-
-2
-
-
e) BrO , SO3 , ClO , HS , ione clorato, ione carbonato, ione nitrito, ione cloruro, ione diidrogeno fosfato
…………………………………………………………………………………………………………………………
f) Al(ClO4)3, LiHSO4, CuSO4, Cu(NO2)2, NaNO3, carbonato di litio, nitrato di bario, solfato acido di magnesio,
perclorato di calcio, solfito acido di zinco
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
3) Completa correttamente le seguenti reazioni con coefficienti stechiometrici, nomi e formule e tipi di reazioni
a) … Na (s) + … O2 (g)
Sodio
→
……………….
b) ….. Al (s) + 3 …… (g)
alluminio
…………..
→
…. ……….. (s)
→
…. ………….(s)
……. ………. (s)
…………..
Idruro di calcio
………………….
e) …… …………. (s) + ….. H2O (l) → 2 Fe(OH)3 (aq)
………………….
………………….
reazione di ………………………………..
reazione di ……………………………..
………………………
g) …. …………….. (g) + H2O (l) → ……. ……………(aq)
………………….
reazione di ……………………………..
………………………
f) …… ………(s) + …….. ………. (g) → 2 SO3 (g)
Anidride nitrosa
reazione di ………………………………..
Ossido di piombo IV
d) ….. Ca (s) + ……. ………(g) →
……………………..
reazione di ………………………………..
Ossido di alluminio
………………….
Ossido ferrico
reazione di sintesi di un ossido basico
………………………..
……………….
c) …. Pb (s) + ….. O2 (g)
…. Na2O (s)
Acido nitroso
reazione di ……………………………..
h) …… Cl2O7 (g) + ….. .…… (l) → …. ………….(aq)
…………………….
………………….
reazione di ……………………………...
Acido perclorico
i) …… Cl2 (g) + …… H2 (g) → ….. …………… (g)
…………………….
reazione di ………………………………..
…………………. ………………….
l) Ba(OH)2(aq) + 2 HNO2(aq) → Ba(NO2)2(aq) + 2H2O(l)
reazione di ……………………………..
………………………………………………………………………………………….
m) ……………………………………………………………………
reazione di …………………………..
Ossido di litio + acido cloridrico → cloruro di litio + acqua
n) …. Fe(s) + …. H2SO4(aq) → …. …………….+ …… …………
reazione di …………………………..
……………………………………………………………………………………..
o) ……………………………………………………………………
reazione di …………………………..
Ossido di calcio + anidride carbonica → …………………………………………….
p) …. LiOH(s) + …. ………………. → ….. LiNO3(aq) + ………
reazione di …………………………..
……………………………………………………………………………………………………..
q) …………………………………………………………………
reazione di …………………………..
Ossido di alluminio + anidride carbonica → carbonato di alluminio + acqua
r) ……………………………………………………………………
reazione di …………………………..
zinco + acido cloridrico → ……………………………………………………………
s) …. Mg(s) + …. H2SO4(aq) → …. MgSO4(s) + ….. H2(g)
reazione di …………………………..
…………………………………………………………………………………………
t) ………………………………………………………………………
reazione di …………………………..
Idrossido di calcio + acido solforico → ………………………………………………………….
u) …… MgO(s) + ….. H2SO4(aq) → ……. …… ……. (s) + …… H2O(l)
reazione di …………………..
………………………………………………………………………………………………………….
v) … MgO(s) + …. SO3(aq) → ……………….(s)
reazione di …………………………..
………………………………………………………………………………………..
Soluzioni: 1) a) NaH, RbOH, CuCl2, Fe(MnO4)3, CaH2, N2O3, NiSO4, Mn2S3, AlPO4; b) KBr, KNO3, KPO4, K2CO3, K2O;
MgBr2, Mg(NO3)2, Mg3(PO4)2, MgCO3, MgO; AlBr3, Al(NO3)3, AlPO4, Al2(CO3)3, Al2O3; 2) a) ossido rameoso, ossido
mercuroso, anidride solforosa, ossido piombico, Al 2O3, Br2O, N2O5, CoO, Li2O b) idruro di magnesio, acido iodidrico, acido
bromidrico, fosfina, CH4, AlH3, HCN, CaH2; e) ione ipobromito, ione solfito, ione ipoclorito, ClO 4-, CO3-2, NO2-, Cl-, H2PO4-;












