DIDATTICA ATTIVA - Approfondimento
Il buco dell’ozono
L’atmosfera è l’involucro gassoso che circonda la Terra.
Le principali sostanze aeriformi che la compongono sono
l’azoto N2, l’ossigeno O2, l’argo Ar, il vapore acqueo H2O
e il diossido di carbonio CO2. Corpi solidi, come le meteore, bruciano attraversando l’atmosfera. Lo strato di gas
atmosferici è anche in grado di fermare gran parte delle
radiazioni a elevata energia provenienti dal Sole. Queste
radiazioni sono assorbite prima di raggiungere la superficie terrestre.
Tra i gas atmosferici in grado di assorbire le radiazioni
più pericolose, come le radiazioni ultraviolette (UV), un
ruolo importante è rivestito dall’ozono O3, un composto
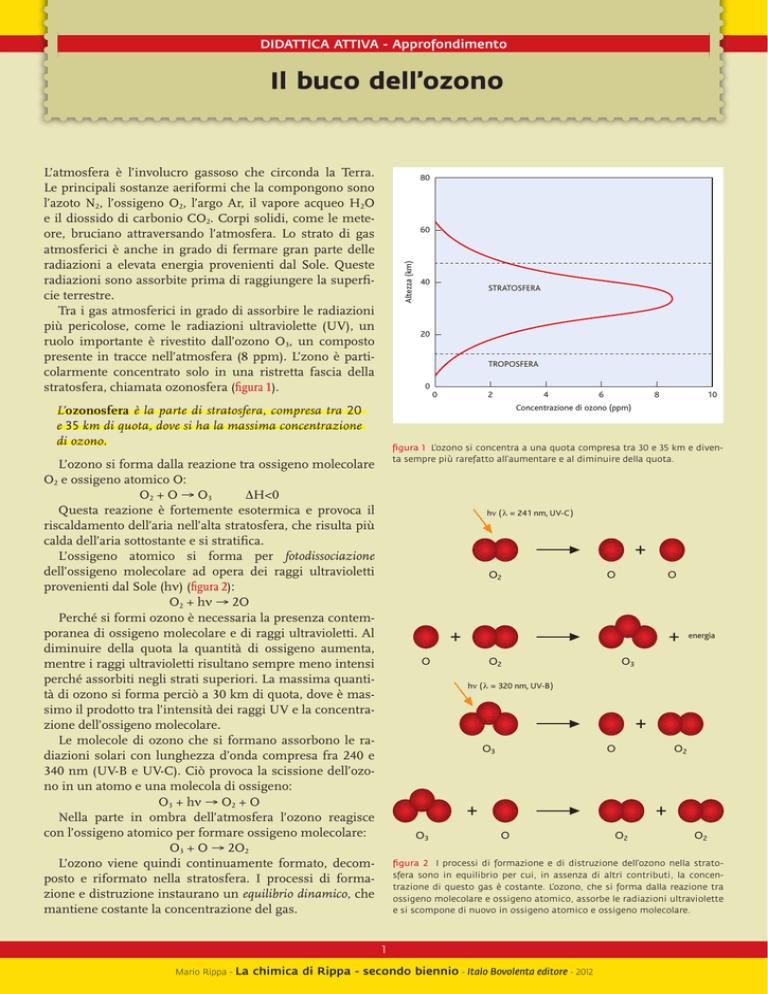
presente in tracce nell’atmosfera (8 ppm). L’zono è particolarmente concentrato solo in una ristretta fascia della
stratosfera, chiamata ozonosfera (figura 1).
80
Altezza (km)
60
40
STRATOSFERA
20
TROPOSFERA
0
L’ozonosfera è la parte di stratosfera, compresa tra 20
e 35 km di quota, dove si ha la massima concentrazione
di ozono.
0
2
4
8
10
figura 1 L’ozono si concentra a una quota compresa tra 30 e 35 km e diventa sempre più rarefatto all’aumentare e al diminuire della quota.
L’ozono si forma dalla reazione tra ossigeno molecolare
O2 e ossigeno atomico O:
O2 + O → O3
∆H<0
Questa reazione è fortemente esotermica e provoca il
riscaldamento dell’aria nell’alta stratosfera, che risulta più
calda dell’aria sottostante e si stratifica.
L’ossigeno atomico si forma per fotodissociazione
dell’ossigeno molecolare ad opera dei raggi ultravioletti
provenienti dal Sole (hν) (figura 2):
O2 + hν → 2O
Perché si formi ozono è necessaria la presenza contemporanea di ossigeno molecolare e di raggi ultravioletti. Al
diminuire della quota la quantità di ossigeno aumenta,
mentre i raggi ultravioletti risultano sempre meno intensi
perché assorbiti negli strati superiori. La massima quantità di ozono si forma perciò a 30 km di quota, dove è massimo il prodotto tra l’intensità dei raggi UV e la concentrazione dell’ossigeno molecolare.
Le molecole di ozono che si formano assorbono le radiazioni solari con lunghezza d’onda compresa fra 240 e
340 nm (UV-B e UV-C). Ciò provoca la scissione dell’ozono in un atomo e una molecola di ossigeno:
O3 + hν → O2 + O
Nella parte in ombra dell’atmosfera l’ozono reagisce
con l’ossigeno atomico per formare ossigeno molecolare:
O3 + O → 2O2
L’ozono viene quindi continuamente formato, decomposto e riformato nella stratosfera. I processi di formazione e distruzione instaurano un equilibrio dinamico, che
mantiene costante la concentrazione del gas.
hν (λ = 241 nm, UV-C)
O2
O
O
energia
O
O2
O3
hν (λ = 320 nm, UV-B)
O3
O3
O
O
O2
O2
O2
figura 2 I processi di formazione e di distruzione dell’ozono nella stratosfera sono in equilibrio per cui, in assenza di altri contributi, la concentrazione di questo gas è costante. L’ozono, che si forma dalla reazione tra
ossigeno molecolare e ossigeno atomico, assorbe le radiazioni ultraviolette
e si scompone di nuovo in ossigeno atomico e ossigeno molecolare.
1
Mario Rippa - La
6
Concentrazione di ozono (ppm)
chimica di Rippa - secondo biennio - Italo Bovolenta editore - 2012
DIDATTICA ATTIVA - Approfondimento
A partire dal 1974 i ricercatori hanno osservato, nei
mesi di settembre-ottobre, una diminuzione stagionale
della concentrazione di ozono nella stratosfera in corrispondenza dell’Antartide e hanno identificato il fenomeno con il nome di buco dell’ozono (figura 3).
1979
Il buco dell’ozono consiste in una significativa diminuzione della quantità di ozono stratosferico, che si
osserva nel corso della primavera australe al di sopra
dell’Antartide e che dura un paio di mesi.
Alla fine di questo periodo l’ozono distrutto non si ricrea completamente, per cui ogni anno il buco si ripresenta con dimensioni sempre maggiori.
L’assottigliamento dello strato di ozono risulta più
marcato alle alte latitudini soprattutto per l’azione determinante del clima sui meccanismi di degradazione dell’ozono. Le basse temperature sono in grado di trasformare
alcune sostanze da una forma inattiva a una forma attiva
nei confronti dell’ozono. Durante la notte polare l’atmosfera si raffredda e si ha diminuzione di pressione. Questo effetto, unito alla rotazione terrestre, crea un vortice
di aria fredda e si ha l’isolamento di grandi masse d’aria
polare per molti mesi consecutivi. Quando la temperatura
raggiunge –80 °C, si formano nubi, chiamate nubi stratosferiche polari, che rappresentano la superficie ideale per
la liberazione di atomi di alogeni. Questi atomi provocano
l’inizio di una catena di reazioni che comportano la degradazione dell’ozono.
Per esempio, gli atomi di cloro si combinano con l’ozono formando monossido di cloro e ossigeno molecolare:
Cl + O3 → ClO + O2
Il monossido di cloro si combina poi con un atomo
di ossigeno liberando ossigeno molecolare e un atomo
dell’alogeno, che ricomincia il processo:
ClO + O → Cl + O2
Un solo atomo di cloro può decomporre migliaia di
molecole di ozono.
La principale fonte di atomi di cloro è dovuta all’uomo
ed è rappresentata dai clorofluorocarburi, in sigla CFC. I
CFC sono sostanze utilizzate in modo massiccio a partire dal dopoguerra fino alla fine degli anni ’80 del secolo
scorso come propellenti nelle bombolette spray e come
fluidi refrigeranti nei frigoriferi. I CFC furono immessi sul mercato in quanto non tossici, stabili e inerti. Proprio l’inerzia chimica è la causa della loro pericolosità nei
confronti dello strato di ozono. Questi gas infatti permangono nell’atmosfera anche un centinaio di anni, risalgono lentamente e alla fine arrivano nella stratosfera. Qui i
CFC sono decomposti dai raggi ultravioletti per formare
fluorocarburi FC e liberare atomi di cloro e bromo, che
decompongono le molecole di ozono:
CFC + hν → Cl + FC
1994
2010
figura 3 Attraverso l’utilizzo di diverse colorazioni, le immagini satellitari mostrano la consistenza dello strato di ozono al di sopra dell’Antartide.
La massima concentrazione di ozono è indicata dai colori verde e giallo,
concentrazioni inferiori sono indicate in blu, mentre la concentrazione minima è rappresentata in viola. Le immagini scattate in tre anni differenti,
il 1979, il 1994 e il 2010, mostrano come nel 1979 non vi fossero zone povere
di ozono. Nel 1994 si è registrata la minima concentrazione di ozono al di
sopra dell’Antartico, come è dimostrato dall’ampia zona colorata di viola.
Successivamente il trend si è invertito e nel 2010 si è registrato il valore di
concentrazione di ozono più alto del decennio.
2
Mario Rippa - La
chimica di Rippa - secondo biennio - Italo Bovolenta editore - 2012
DIDATTICA ATTIVA - Approfondimento
radiazioni UV aumenta il rischio di contrarre un tumore
della pelle, a seguito di mutazioni del DNA delle cellule
epiteliali.
Nel 1995 il Premio Nobel per la chimica fu assegnato
all’olandese Paul Jozef Crutzen e agli statunitensi Mario
José Molina e Frank Sherwood Rowland per il loro lavoro
sulla formazione e decomposizione dell’ozono. Per la prima volta l’Accademia delle scienze svedese premiò scienziati attivi nel campo della chimica dell’atmosfera, dando
dignità scientifica a ricerche in campo ambientale.
La produzione di CFC è stata vietata nei Paesi sviluppati nel 1995 a seguito degli accordi internazionali stabiliti con il protocollo di Montreal del 1987 (figura 4). Nonostante ciò, la concentrazione di CFC in atmosfera è ancora
molto alta e sta diminuendo entamente. Si stima che il
buco dell’ozono sarà presente fino al 2075.
L’assottigliamento dello strato di ozono comporta una
diminuzione dell’assorbimento delle radiazioni UV-B, in
quanto questi raggi ultravioletti sono assorbiti esclusivamente dall’ozono e non dall’ossigeno. L’esposizione alle
1 400
Migliaia di tonnellate
1 200
1 000
800
600
400
200
0
1950
1955
1960
1965
1970
1975
1980
1985
1990
1995
2000
figura 4 L’andamento della produzione mondiale
di CFC nel tempo mostra come queste sostanze
abbiano raggiunto un massimo di utilizzazione
nel 1988. A seguito di accordi internazionali, nel
giro di pochi anni la produzione di CFC è stata
poi ridotta drasticamente.
3
Mario Rippa - La
chimica di Rippa - secondo biennio - Italo Bovolenta editore - 2012












