I S T I T U T O D I I S T R U Z I O N E S U P E R I O R E
“ C O N C E T T O M A R C H E S I ”
PROGRAMMA DI SCIENZE
CLASSE
ICC
a.s. 2015/16
Prof. FERRACIN EMANUELA
TESTI : G.Valitutti, A.Tifi, A.Gentile, La chimica della Natura LMS, LE SCIENZE ZANICHELLI.
E.Lupia Palmieri, M.Parotto, ♯Terra, EDIZIONE AZZURRA, Il nostro pianeta, la
geodinamica esogena, SCIENZE ZANICHELLI.
La Chimica come scienza sperimentale: oggetto di studio della chimica e le fasi del metodo
sperimentale; l’osservazione quantitativa: grandezze fisiche e unità di misura nel Sistema
Internazionale: massa, volume, densità, temperatura, forme di energia e relative unità di misura.
Le trasformazioni fisiche della materia: Gli stati di aggregazione della materia e i passaggi di
stato, sostanze pure e miscugli omogenei ed eterogenei, curve di riscaldamento e di
raffreddamento di una sostanza pura e di un miscuglio; alcuni metodi di separazione dei miscugli:
filtrazione, cromatografia su carta, distillazione semplice e frazionata.
Le trasformazioni chimiche della materia: riconoscimento di una trasformazione chimica: i
reagenti e i prodotti; le sostanze pure semplici (elementi chimici) e composte (composti chimici),
la Tavola Periodica degli Elementi, nomi e simboli degli elementi, proprietà fisiche dei metalli,
semimetalli, non metalli.
Le teorie della materia: la legge della conservazione della materia e il bilanciamento di semplici
reazioni chimiche; le molecole e gli ioni, la simbologia chimica: rappresentazione simbolica di
atomi, molecole elementari e composte e di ioni.
Atomi, legami, reazioni: le particelle dell’atomo, numero atomico, numero di massa, massa
atomica, unità di massa atomica; i livelli energetici e le configurazioni elettroniche, gli elettroni di
valenza e l’ottetto; i legami covalente puro e covalente polare; il legame ionico; le reazioni
chimiche: rappresentazione di semplici reazioni chimiche mediante equazioni chimiche e loro
bilanciamento, significato di indice e di coefficiente.
La chimica dell’acqua: la struttura chimica dell’acqua, la polarità dell’acqua, il legame idrogeno,
proprietà fisiche (calore specifico, temperatura di ebollizione, tensione superficiale, capillarità) e
chimiche (acqua come solvente, la ionizzazione dell’acqua e il pH).
Il Pianeta Terra: origine del Sistema Solare, il modello interno della Terra, la Terra come sistema
integrato, forze esogene, forze endogene, ciclo litogenetico.
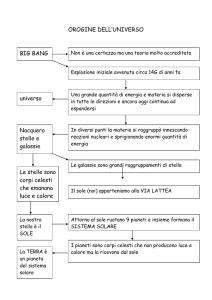
L’Universo: una sfera nello spazio, l’osservazione del cielo notturno, caratteristiche delle stelle:
composizione, spettri stellari, colore e temperature superficiali, magnitudine apparente e assoluta
delle stelle; le galassie: classificazione, La Via Lattea e il Gruppo Locale; nascita ed evoluzione
delle stelle, diagramma H-R., cenni all’origine dell’universo.
Il Sistema Solare: formazione del Sistema solare, corpi del Sistema solare e loro caratteristiche:
pianeti terrestri e pianeti gioviani, motivazione delle differenze fra pianeti gioviani e pianeti
terrestri, nanopianeti, asteroidi, comete, meteore e meteoriti; la struttura interna del Sole e la sua
atmosfera: nucleo, zona radioattiva, zona convettiva, fotosfera e i suoi fenomeni (granulazione,
macche solari). Atmosfera solare: cromosfera e corona solare.
Il moto dei pianeti attorno al Sole: prima, seconda e terza legge di Keplero, la legge della
gravitazione universale.
Il modellamento della superficie terrestre: degradazione meteorica e fisica delle rocce,
degradazione chimica delle rocce: il carsismo.
IL DOCENTE: …………………………………………
I RAPPRESENTANTI DEGLI STUDENTI: …………………………………………..