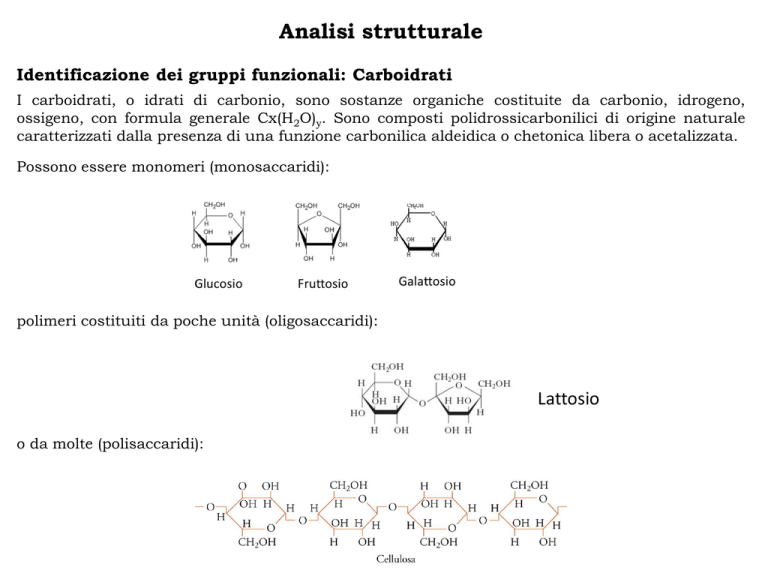
Analisi strutturale
Identificazione dei gruppi funzionali: Carboidrati
I carboidrati, o idrati di carbonio, sono sostanze organiche costituite da carbonio, idrogeno,
ossigeno, con formula generale Cx(H2O)y. Sono composti polidrossicarbonilici di origine naturale
caratterizzati dalla presenza di una funzione carbonilica aldeidica o chetonica libera o acetalizzata.
Possono essere monomeri (monosaccaridi):
polimeri costituiti da poche unità (oligosaccaridi):
Lattosio
o da molte (polisaccaridi):
Analisi strutturale
Identificazione dei gruppi funzionali: Carboidrati
I monosaccaridi sono detti comunemente zuccheri:
•
caratterizzati dal sapore dolce.
•
composti neutri, facilmente solubili in acqua, poco solubili in alcol, insolubili in
etere.
•
Possiedono più funzioni alcoliche I e II.
•
In base al numero di atomi di C e alla funzione carbonilica si, distinguono in aldosi
e chetosi e quindi aldo o cheto-triosi, tetrosi, pentosi, esosi.
•
Sono solidi cristallini o liquidi sciropposi solubili in acqua o solventi ossidrilati,
mentre i polisaccaridi sono solidi non idrosolubili.
Analisi strutturale
Identificazione dei gruppi funzionali: Carboidrati
Appartengono alla serie D quei monosaccaridi il cui stereocentro più lontano dal
gruppo aldeidico o chetonico ha, nella proiezione di Fisher (gruppo carbonilico in alto),
la stessa configurazione assoluta della D gliceraldeide (con il gruppo OH posizionato a
destra).
Nella serie L il gruppo OH si trova a sinistra, come nella L-gliceraldeide.
Analisi strutturale
Identificazione dei gruppi funzionali: Carboidrati
Nei monosaccaridi è comune la formazione intramolecolare di emiacetali per reazione
di uno dei gruppi alcolici con il carbonile. L’attacco del gruppo alcolico può avvenire
alternativamente al di sopra o al di sotto del piano del carbonile generando il
corrispondente gruppo alcolico dalla parte opposta. Infatti in soluzione esistono
principalmente nella forma emiacetalica ciclica.
C1
C5
Glucosio
Analisi strutturale
Identificazione dei gruppi funzionali: Carboidrati
Per la forma emiacetalica ciclica, Haworth ha proposto la proiezione piranosica o furanosica. Nella
struttura emiacetalica il carbonio carbonilico diventa asimmetrico generando i due diastereomeri
chiamati anomeri:
C5
C1, carbonio anomerico
quando l’OH si trova sotto il piano nella
proiezione di Haworth è chiamato
anomero α, posizione che corrisponde a
quella assiale nella rappresentazione a
sedia.
C5
C1
quando l’OH si trova sopra il piano nella
proiezione di Haworth è chiamato anomero
β, posizione che corrisponde a quella
equatoriale nella rappresentazione a sedia.
Analisi strutturale
Identificazione dei gruppi funzionali: Carboidrati
I due anomeri α e β del D-glucosio sono diastereoisomeri e quindi è possibile separarli
dato che hanno proprietà chimico-fisiche diverse, e la tecnica più semplice è la
cristallizzazione:
•
L’anomero α, in forma pura, si può ottenere per cristallizzazione del D-glucosio in
acqua a temperatura ambiente.
•
L’anomero β, in forma pura, si può ottenere per cristallizzazione del D-glucosio in
acido acetico.
L’α-D-glucopiranosio ha p.f. 146°C e potere rotatorio specifico [α] = +112°, mentre il βD-glucopiranosio ha p.f. 150°C e potere rotatorio specifico [α] =+18,7°.
Analisi strutturale
Identificazione dei gruppi funzionali: Carboidrati
Mutarotazione
L’α-D-glucopiranosio ha p.f. 146°C e potere rotatorio specifico [α] = +112°, mentre il β-Dglucopiranosio ha p.f. 150°C e potere rotatorio specifico [α] =+18,7°.
Sciogliendo in acqua l’α- o il β -D-glucopiranosio puro, si osserva che il potere rotatorio specifico
della soluzione, che all’inizio è di +112° o di +18,7°, converge al valore intermedio di +52,5°,
caratteristico di tutte le soluzioni acquose di D-glucosio nelle quali sono presenti all’equilibrio i due
anomeri α e β nel 36% e 64% rispettivamente, (più 0,02% della forma aldeidica libera).
Analisi strutturale
Identificazione dei gruppi funzionali: Carboidrati
Saggi di riconoscimento
Saggio di Molish (valido per tutti i carboidrati)
Saggio di Tollens
Saggio di Fehling
Validi solo per zuccheri riducenti
Sono riducenti tutti i monosaccaridi in quanto presentano la funzione aldeidica o
chetonica disponibile per le reazioni.
Tra i disaccaridi ci sono quelli riducenti che hanno almeno una funzione aldeidica o
chetonica libera e quelli non riducenti che hanno entrambi le funzioni impegnate nel
legame glicosidico
Analisi strutturale
Identificazione dei gruppi funzionali: Carboidrati
Saggio di Molish
Tutti gli zuccheri in presenza di H2SO4 conc o HCl conc. si disidratano e danno origine
al furfurolo (2-furancarbossaldeide) i pentosi e idrossimetilfurfurolo gli esosi.
Analisi strutturale
Identificazione dei gruppi funzionali: Carboidrati
Saggio di Molish
Per eseguire il saggio si mescolano in una provetta 2 mL di soluzione da testare con
due gocce del reattivo di Molisch costituito da una soluzione di α-naftolo in etanolo al
95%. Si aggiunge qualche goccia di H2SO4 conc. (fatto scendere lungo le pareti).Si
forma all’interfaccia un anello viola.
Analisi strutturale
Identificazione dei gruppi funzionali: Carboidrati
Saggio di Tollens
Saggio di Fehling
Validi solo per zuccheri riducenti
Sono riducenti tutti i monosaccaridi in quanto presentano la funzione aldeidica o
disponibile per le reazioni. I chetosi si convertono, nell’ambiente basico in cui si
conducono i saggi, in aldosi attraverso un intermedio enediolico.
Analisi strutturale
Identificazione dei gruppi funzionali: Carboidrati
Saggio di Fehling
Il reattivo si prepara al momento dell’uso mescolando volumi uguali di reattivo Fehling
A (CuSO4.5H2O) e di Fehling B (tartrato di sodio e potassio - sale di Seignette). Si
mescola il reattivo preparato con una soluzione acquosa dell’aldeide. Per riscaldamento
il Cu2+ viene ridotto dall’aldeide a Cu+ che precipita come ossido di rame (Cu2O) rosso.
RCHO + 2 Cu2+ + 5 OH- RCOOH + Cu2O + 3 H2O
Analisi strutturale
Identificazione dei gruppi funzionali: Carboidrati
Saggio di Tollens (saggio dello specchio d’argento)
Esecuzione del saggio:
si prepara in provetta il reattivo al momento dell’uso mescolando AgNO3 e NaOH 2M
AgNO3 + NaOH AgOH↓ + NaNO3
Si aggiunge NH3 2M per disciogliere il precipitato di AgOH che si è formato.
AgOH + 2 NH3 [Ag(NH3)2]OH
Si aggiunge il composto in esame e si lascia a riposo per 10’ e poi si scalda a 50°C per
5’. In caso positivo si deposita uno strato di Ag metallico (specchio) sulle pareti della
provetta
2 [Ag(NH3)2]OH + RCHO RCOONH4 + 2 Ag + 3 NH3 + H2O
Analisi strutturale
Identificazione dei gruppi funzionali: Carboidrati
Derivati cristallini
Osazoni:
Sono derivati cristallini ad alto peso molecolare con p.f. netti, di colore giallo chiaro.
La sostanza (0,2 g) si scioglie in acqua, si addiziona 1 ml di soluzione acquosa di
fenilidrazina cloridrato (0,4 g) e sodio acetato (0,6 g) in 4 ml di acqua e si lascia a
b.m.b. per 30 min.. Al termine dopo raffreddamento si filtra il solido formatosi, del
quale si esegue il punto di fusione.
Analisi strutturale
Identificazione dei gruppi funzionali: Alcoli
Gli alcoli sono composti contenenti un gruppo ossidrilico legato ad un atomo di
carbonio alifatico.
Si possono avere alcoli primari, secondari o terziari a seconda che l’OH sia legato
rispettivamente a un RCH2-, a R2CH- o a un R3C- ; inoltre la presenza di tali gruppi,
grazie alla loro capacità di formare legami idrogeno, determina per questi composti una
spiccata idrosolubilità ed una minore volatilità rispetto ai composti con ugual numero
di atomi di carbonio.
Analisi strutturale
Identificazione dei gruppi funzionali: Alcoli
Stato fisico
Alcoli che contengono fino a 12 atomi di carbonio sono liquidi dall’odore caratteristico,
mentre i termini superiori possono essere liquidi densi o solidi bassobollenti, dall’odore
sgradevole.
Solubilità
I primi 3 termini sono solubili in acqua, mentre il butanolo lo è solo per l’8%, il
pentanolo per il 3%, l’esanolo per l’ 1%, con più di 7 atomi di carbonio sono insolubili.
Sono tutti solubili in etere. All’aumentare del numero dei gruppi ossidrilici aumenta la
solubilità in acqua e la viscosità.
Per quanto riguarda il punto di ebollizione, la scala osservabile è III° < II° <I°. Gli alcoli
III°, infatti, hanno difficoltà a formare legami H.
alcool
n-butanolo
n-pentanolo
n-esanolo
solubilità in H2O
8% (v/v)
2% (v/v)
0.6% (v/v)
caso particolare i polialcoli
quelli lineari sono solubili in
H2O se (n°C / n°OH) < 3-4
quelli ramificati sono solubili
in H2O se (n°C / n°OH) < 4-5
Analisi strutturale
Identificazione dei gruppi funzionali: Alcoli
Gli alcoli sono composti anfoteri:
•
il debole carattere acido (pKa ~15) viene messo in evidenza dal fatto che formano
alcolati in presenza di sodio metallico:
2R―OH + 2Na → 2R―ONa + H2(g)↑
•
il debole carattere basico viene messo in evidenza dal fatto che formano, in
ambiente acido, sali di ossonio
Analisi strutturale
Identificazione dei gruppi funzionali: Alcoli
Reattività:
• Gli alcoli primari e secondari hanno proprietà riducenti nei confronti di ossidanti
energici come il triossido di cromo CrO3 in ambiente acido, riducendo questo a Cr3+
(giallo-verde) mentre i terziari non sono ossidabili.
• Gli alcoli primari e secondari liquidi possono essere ossidati con reticella di Cu ad
aldeidi e chetoni rispettivamente e i prodotti di ossidazione vengono evidenziati con
i reattivi caratteristici del gruppo.
• Gli alogeni (acqua di cloro, di bromo e soluzione iodo-iodurata) ossidano i primari e i
secondari prima ad aldeidi e chetoni poi formano i corrispondenti α-alogenoderivati.
• Il KMnO4 all’1 o 2 % in soluzione di acido acetico si decolora rapidamente se
trattato con alcoli primari o secondari, mentre rimane invariato per i terziari.
•
Possono reagire da:
Nucleofili - sostituzione nucleofila o addizione nucleofila
Elettrofili - in ambiente acido la protonazione del’ossigeno alcolico rende elettrofilo l’atomo di C cui
esso è legato e suscettibile di attacco nucleofilo.
Analisi strutturale
Identificazione dei gruppi funzionali: Alcoli
Saggi di riconoscimento
1.
Saggio con Na metallico
2.
Saggio dello xantogenato (alcoli primari e secondari)
3.
Saggio di Angeli e Rimini
4.
Saggio di Lucas (alcoli solubili in H2O, distinzione tra primari, secondari e terziari)
5.
Ossidazione con CrO3 o KMnO4 (alcoli primari e secondari)
Analisi strutturale
Identificazione dei gruppi funzionali: Alcoli
1. Saggio con Na metallico
2 ROH + 2 Na 2 RONa + H2
Non specifico - positivo per tutti i composti con H a carattere acido.
Adatto agli alcoli con numero di atomi di C compreso tra 3 e 8. Quelli a più basso PM
sono difficili da rendere anidri (condizione necessaria ad effettuare il saggio), quelli con
PM maggiore reagiscono troppo lentamente (non apprezzabile lo sviluppo di H2).
Analisi strutturale
Identificazione dei gruppi funzionali: Alcoli
2. Saggio dello xantogenato
Dato solo da alcoli primari e secondari
Xantogenato di potassio - giallo
Gli xantogenati gialli che si formano si fanno reagire con ammonio molibdato: si
formano composti colorati in violetto.
Gli xantogenati di alcoli terziari si formano ugualmente ma danno idrolisi molto
rapidamente e la reazione non si percepisce.
Interferiscono gli esteri di alcoli primari e secondari che nelle condizioni di reazione
danno parziale idrolisi e positività al saggio.
Esecuzione del saggio - 1 goccia di sostanza + 10 di Et2O e 2 di CS2 + 200 mg di KOH
polverizzata. Si agita per 5’ e si aggiungono 2 gocce di ammonio molibdato, si acidifica
con H2SO4 e si aggiunge qualche goccia di CHCl3. La fase organica si colora di violetto.
Analisi strutturale
Identificazione dei gruppi funzionali: Alcoli
3. Saggio di Angeli e Rimini
Per trattamento dell’alcool con CH3COCl in presenza di una base (N,N-dimetil-anilina)
si ottiene il corrispondente acetato. Questo si fa reagire con idrossilammina cloridrato
a pH 8 e poi con FeCl3 a pH acido.
Analisi strutturale
Identificazione dei gruppi funzionali: Alcoli
4. Saggio di Lucas
Il reattivo di Lucas è costituito da una soluzione satura di ZnCl2 in HCl conc.
La reazione converte l’alcool nel corrispondente cloruro alchilico che essendo insolubile
in H2O intorbida la soluzione.
La reattività e la velocità della reazione dipendono dall’alcool:
Allilici, benzilici e terziari reagiscono immediatamente
Secondari reagiscono entro pochi minuti
Primari non reagiscono
La reazione procede con meccanismo SN1 - via carbocatione - la velocità della reazione
dipende dalla stabilità del carbocatione formato; più è stabile più è rapida la reazione.
Analisi strutturale
Identificazione dei gruppi funzionali: Alcoli
5. Ossidazione a composti carbonilici
Con CrO3
La soluzione inizialmente limpida e arancione diventa torbida e verdastra
3 RCH2OH + 4 CrO3 + 6 H2SO4 3 RCOOH + 2 Cr2(SO4)3 + 9 H2O
3 R2CHOH + 2 CrO3 + 3 H2SO4 3 R2CO + Cr2(SO4)3 + 6 H2O
Con KMnO4
La soluzione inizialmente violetta si decolora
3 RCH2OH + 2 MnO4- + 6 H+ 3 RCHO + 2 Mn2+ + 8 H2O
3 R2CHOH + 2 MnO4- + 6 H+ 3 R2CO + 2 Mn2+ + 8H2O
Esecuzione del saggio - 4-5 gocce della sostanza + 5 ml di soluzione di KMnO4 in
H2SO4 4M. Si agita per qualche minuto e poi si aggiunge H2C2O4 fino a decolorazione
del KMnO4. Si aggiunge qualche goccia di soluzione di 2,4-dinitrofenilidrazina in HCl.
Si forma un precipitato giallo di 2,4-dinitrofenilidrazide
Analisi strutturale
Identificazione dei gruppi funzionali: Fenoli
I fenoli sono sostanze nelle quali sull’anello aromatico sono presenti uno o più gruppi
OH. Sono fortemente associati tramite leg H intermolecolari.
Stato fisico
Sono liquidi con p.e. elevato o sono solidi. Sono incolori i liquidi e bianchi i solidi;
possono apparire leggermente colorati per la presenza di tracce di prodotti di
ossidazione. Hanno un odore caratteristico.
Solubilità
Il fenolo è parzialmente solubile in acqua (10%) mentre gli altri sono in genere
insolubili in H2O e solubili in Et2O.
Sono solubili in NaOH al 10% ed in NaHCO3 al 5%
Analisi strutturale
Identificazione dei gruppi funzionali: Fenoli
Sono acidi deboli:
ArOH + H2O ArO- + H3O+
I fenoli sono più acidi (Ka=10-10) degli alcoli (Ka=10-16) e meno degli acidi carbossilici
(Ka=10-5). In termini elettronici la maggiore acidità dei fenoli si spiega con la
stabilizzazione derivante dalla possibilità di delocalizzare la carica negativa per
risonanza su tutto l’anello aromatico.
Negli alcoli, invece, manca tale effetto stabilizzante a carico dello ione alcolato.
Analisi strutturale
Identificazione dei gruppi funzionali: Fenoli
•
•
La presenza di gruppi elettron-attrattori migliora l’effetto di dispersione della carica
aumentando l’acidità del composto.
I gruppi elettron-donatori rendono invece più difficile la dispersione della carica
negativa e quindi ne diminuiscono l’acidità.
effetto dei sostituenti sull’acidità dei fenoli
Sostituente
effetto induttivo
Alchile
elettron-donatore
CN, -COR, -NO2
elettron-attrattore
effetto mesomerico
diminuisce
elettron-attrattore
elettron-attrattore
prevale
-OH, -OR
meta
-OH, -OR
para
alogeno
meta
elettron-attrattore
alogeno
para
elettron-attrattore
prevale
elettron-attrattore
effetto sull’acidità
aumenta
aumenta
elettron-donatore
prevale
diminuisce
aumenta
elettron-donatore
aumenta
Analisi strutturale
Identificazione dei gruppi funzionali: Fenoli
Fenolo Ka 1.1x10-10
Sostituente
orto
meta
para
-NO2
6.0x10-8
5.0x10-9
6.9x10-8
-Cl
7.7x10-9
1.6x10-9
6.3x10-10
-CH3
6.3x10-11
9.8x10-11
6.7x10-11
Fenolo
Ka 1.1x10-10
orto-NO2
6.0x10-8
meta-NO2
5.0x10-9
para-NO2
6.9x10-8
2,4-dinitro
1.0x10-4
2,4,6-trinitro
0.38
Analisi strutturale
Identificazione dei gruppi funzionali: Fenoli
Saggi di carattere generale
1. Ricerca aromaticità Positivo saggio di Friedel-Craft (solo se in posizione o e p non
ci sono gruppi disattivanti)
2. Ricerca delle insaturazioni Decolorazione soluzione Br2 con sviluppo di HBr
3. Ricerca delle insaturazioni Positivo il saggio di Bayer
Saggi di riconoscimento
1.
Riconoscimento del carattere acido
2.
Saggio con cloruro ferrico
3.
Saggio di Liebermann (per fenoli con posizione p libera)
4.
Copulazione con Sali di diazonio
5.
Saggi delle ftaleine
Derivati cristallini
Analisi strutturale
Identificazione dei gruppi funzionali: Fenoli
1. Riconoscimento del carattere acido
I fenoli sono solubili in NaOH 2M. I nitrofenoli sono solubili anche in Na2CO3 sat.
2. Saggio con cloruro ferrico
Quasi tutti i fenoli, in soluzione acquosa o alcolica formano complessi colorati con lo
ione Fe3+. Il colore del complesso è spesso rosso-violetto e dipende dal fenolo.
Monofenoli viola
Orto-difenoli verde scuro
Para-difenoli colorazioni non persistenti perché vengono rapidamente ossidati a
chinoni
Interferiscono acidi carbossilici, enoli,
idrossipiridine, idrossichinoline, acidi idrossammici.
Analisi strutturale
Identificazione dei gruppi funzionali: Fenoli
3. Saggio di Liebermann
I fenoli con la posizione para libera danno con NaNO2 in H2SO4 2M composti colorati in
rosso violetto che per successiva alcalinizzazione virano al verde-blu.
Si mescola la sostanza con 1 ml H2O e si aggiungono 2-3 gocce di reattivo di
Liebermann (1ml di H2SO4 conc + 20 mg di NaNO2). Agitare e scaldare leggermente:
appare una colorazione rosso-arancio. Diluendo la soluzione in acqua e KOH si
osserva un viraggio di colore al blu-viola, in acqua e H2SO4 si osserva un viraggio di
colore al verde.
Analisi strutturale
Identificazione dei gruppi funzionali: Fenoli
3. Saggio di Liebermann
La reazione è una SEA in para al gruppo fenolico. I fenoli sostituiti con gruppi
fortemente disattivanti (NO2, COOH, CHO, COCH3) non danno la reazione. Anche
alcuni polifenoli non danno la reazione (escluso la resorcina)
Analisi strutturale
Identificazione dei gruppi funzionali: Fenoli
4. Copulazione con sali di diazonio
I fenoli con la posizione para o orto libera vengono fatti copulare in ambiente
debolmente basico con il sale di diazonio della p-nitroanilina.
Esecuzione saggio
Provetta A: 2 gocce di anilina vengono sciolte in 1 ml HCl dil. Si raffredda con bagno di
ghiaccio e si aggiungono 5-6 gocce di NaNO2 5% (o KNO2). Formazione del sale di
diazonio.
NaNO2 + HCl HNO2 + NaCl
HNO2 + HCl NO+ + H2O + Cl-
Analisi strutturale
Identificazione dei gruppi funzionali: Fenoli
4. Copulazione con sali di diazonio
Esecuzione saggio
Provetta B: La sostanza si solubilizza in NaOH 10% e si raffredda con bagno di ghiaccio
e si aggiunge il contenuto della provetta B. Copulazione.
Analisi strutturale
Identificazione dei gruppi funzionali: Fenoli
5. Saggio delle ftaleine
I fenoli condensano con anidride ftalica in H2SO4 o ZnCl2 per dare derivati del
trifenilmetano (ftaleine) colorati in ambiente basico.
HO
O
OH
OH
2
+
O
HO
O
-
OH
H2SO4
O
O
OH- / H2O
O
OH
O
COO
O
fenolftaleina
incolore
O
O
HO
2
+
H2SO4
O
- 2 H2O
-
COO
rosso
HO
OH
O
HO
OH
OH-
O
O
OH- / H2O
-
O
O
H+
O
OH
O
fluoresceina
-
incolore
H+
O
-
H+
H+
- H2O
-
COO
-
giallo-verde
COO
incolore
-
-
Analisi strutturale
Identificazione dei gruppi funzionali: Fenoli
Derivati cristallini
•
Esteri:
•
Acetil derivati
•
Benzoati
•
p-toulensolfonati
• 2,4-dinitrofenileteri
• Acidi arilossiacetici
Analisi strutturale
Identificazione dei gruppi funzionali: Fenoli
Derivati cristallini
•
Esteri:
•
Acetil derivati
•
Benzoati
La reazione è nota come Shotten-Baumann e si esegue dibattendo a freddo il,
fenolo con cloruro di benzoile in ambiente basico .
Analisi strutturale
Identificazione dei gruppi funzionali: Fenoli
Derivati cristallini
•
Esteri:
•
p-toulensolfonati
• 2,4-dinitrofenileteri
• Acidi arilossiacetici
Analisi strutturale
Identificazione dei gruppi funzionali: Eteri
Sono composti in cui è presente un ponte ossigeno legato a 2 atomi di C alifatici o
aromatici.
R-O-R
Ar-O-Ar
Alchilici
Arilici
R-O-Ar
Alchilarilici
Stato fisico
Gli eteri alifatici a basso PM sono liquidi bassobollenti, all’aumentare del PM
diminuisce la volatilità.
Gli eteri arilici e alchilarilici sono liquidi, quelli superiori sono solidi
Solubilità
Gli eteri alifatici sono insolubili in H2O e solubili nei solventi organici. Sono anche
solubili in HCl conc. e H2SO4 conc. per formazione dei sali di ossonio
R-O-R + HCl R-OH+-R + Cl-
Analisi strutturale
Identificazione dei gruppi funzionali: Eteri
Sono scarsamente reattivi, analogamente agli idrocarburi, quindi non si effettua un
riconoscimento chimico diretto con saggi specifici. Si procede per esclusione e con
l’ausilio di tecniche spettroscopiche.
Ci sono alcune reazioni che permettono di differenziare gli idrocarburi dagli eteri
1. Saggio con iodio
Si basa sulla variazione di colore di una soluzione di I2 in CS2 quando si aggiunge un
etere o un idrocarburo. In presenza di un etere il colore della soluzione vira dal viola al
bruno, in presenza di un idrocarburo la soluzione rimane violetta
2.
Saggio del Ferrox
Il ferrox (esatiocianato ferrato (III) ferrico) intensamente colorato di rosso si solubilizza
in numerosi composti contenenti N, S o O, tra cui gli eteri, escluso alcuni ad alto PM
come difenil o naftileteri.
Analisi strutturale
Identificazione dei gruppi funzionali: Alogeno derivati
1.
Sali alogenidrici di basi organiche
2.
Cloruri acilici
3.
Cloruri alchilici e arilici
Analisi strutturale
Identificazione dei gruppi funzionali: Alogeno derivati
Sali alogenidrici di basi organiche
Es: R-NH3+XSono in solubili in H2O, e danno idrolisi acida. Se provengono da basi molto deboli in
soluzione acquosa si può avere la precipitazione della base libera.
Il riconoscimento prevede l’identificazione separata dell’alogenuro e dell’ammina.
L’alogenuro si riconosce precipitandolo come AgX da una soluzione acidificata con
HNO3 e trattata con AgNO3.
X- + AgNO3 AgX + NO3L’ammina viene separata per trattamento con una base forte, isolata per filtrazione se
solida o estrazione con solvente organico (Et2O) e riconosciuta.
R-NH3+Cl- + NaOH RNH2 + Na+ + Cl- + H2O
Se il composto è insolubile in acqua il saggio si effettua in EtOH
Analisi strutturale
Identificazione dei gruppi funzionali: Alogeno derivati
Alogenuri acilici
Hanno tutti odore pungente e sgradevole. Sono molto reattivi verso la SN, l’alogeno
rappresenta un buon gruppo uscente
derivati degli acidi carbossilici alifatici
liquidi bassobollenti i primi termini, solidi bassofondenti i superiori.
derivati degli acidi carbossilici aromatici
liquidi altobollenti i primi termini e solidi quelli superiori.
Analisi strutturale
Identificazione dei gruppi funzionali: Alogeno derivati
Alogenuri acilici
Sono solubili in Et2O e insolubili in H2O.
In H2O possono sciogliersi più o meno lentamente a causa della reazione di idrolisi con
formazione di acido carbossilico e acido alogenidrico.
RCOX + H2O RCOOH + HX
La velocità di idrolisi dipende dalla natura dell’alogenuro acilico
RCOX (basso PM) > RCOX (alto PM) > ArCOX > RSO2X > ArSO2X
Analisi strutturale
Identificazione dei gruppi funzionali: Alogeno derivati
Riconoscimento
1. Saggio di Angeli e Rimini
Si effettua trattando l’alogenuro con EtOH, poi con idrossilammina cloridrato e poi con
FeCl3, tutte le reazioni si effettuano nelle condizioni viste per gli acidi carbossilici
2. Precipitazione dell’alogenuro
Si effettua l’idrolisi e si riconosce lo ione alogenuro come alogenuro di Ag.
3. Preparazione di derivati cristallini
Si possono preparare tutti i derivati cristallini degli acidi carbossilici la cui
preparazione preveda l’attivazione dell’acido carbossilico come cloruro acilico (ammidi,
esteri)
Analisi strutturale
Identificazione dei gruppi funzionali: Alogeno derivati
Alogenuri alchilici e arilici
R-X
Ar-X
Serie alifatica: gassosi i primi termini, solidi quelli ad alto PM liquidi quelli intermedi.
Serie aromatica: liquidi i primi termini e solidi quelli superiori.
Quelli volatili hanno odore sgradevole, alcuni sono lacrimogeni.
I p.f. e i p.e. aumentano con il PM, a parità di radicale alchilico o arilico p.e. e p.f.
aumentano con il peso atomico dell’alogeno.
Sono solubili in Et2O e insolubili in H2O.
Analisi strutturale
Identificazione dei gruppi funzionali: Alogeno derivati
Alogenuri alchilici e arilici
Riconoscimento alogenuri arilici - non ci sono saggi specifici
Riconoscimento alogenuri alchilici:
1. Saggio con AgNO3 alcolico
2. Saggio con NaI in acetone
Analisi strutturale
Identificazione dei gruppi funzionali: Alogeno derivati
Saggio con AgNO3 alcolico
Alla sostanza in esame si aggiunge una soluzione etanolica di AgNO3, la soluzione
rimane limpida. Si scalda a bagno maria e si misura il tempo necessario alla
formazione di precipitato. Nelle condizioni di reazione avviene una reazione di tipo SN1
(via carbocatione) con eliminazione dell’alogenuro; la velocità dipende sia dal radicale
alchilico che dall’alogeno.
A parità di alogeno la velocità diminuisce nell’ordine
Allilico, benzilico > terziario> secondario > primario
A parità di radicale la velocità varia in base all’alogeno nell’ordine
R-I > R-Br > R-Cl > R-F
Analisi strutturale
Identificazione dei gruppi funzionali: Alogeno derivati
Alogenuri alchilici - Saggio con AgNO3 alcolico
In base alla velocità di reazione possiamo dividere gli alogenuri in due gruppi
1.
2.
3.
Alogenuri che danno rapidamente precipitato a freddo (i Sali alogenidrici delle basi
e gli alogenuri acilici reagiscono nelle stesse condizioni)
Alogenuri allilici e benzilici
Alogenuri terziari
Ioduri e bromuri anche se secondari e primari
Alogenuri che danno lentamente precipitato a caldo
Cloruri alchilici secondari e primari
Alogenuri arilici attivati da gruppi elettronattratori in orto o para
Alogenuri che non danno precipitato neppure per prolungato riscaldamento
Alogenuri arilici non attivati
Analisi strutturale
Identificazione dei gruppi funzionali: Alogeno derivati
Alogenuri alchilici - Saggio con NaI in acetone - (cloruri e bromuri alchilici)
Ad una soluzione dell’alogenuro alchilico in acetone anidro si aggiunge NaI disciolto in
acetone anidro.
R-Cl + NaI R-I + NaCl
R-Br + NaI R-I + NaBr
Dalla velocità e dalle condizioni in cui la reazione avviene si hanno informazioni sulla
natura dell’alogenuro alchilico. La reazione procede via SN2.
La velocità di reazione degli alogenuri varia con l’ordine
I° > II° > III°
Per l’alogeno si ha
R-Br > R-Cl
Complessivamente si osserva che
Bromuri primari danno precipitato a T amb. In circa 3’
Bromuri secondari e terziari danno precipitato dopo i 3’
Cloruri primari e secondari danno precipitato dopo riscaldamento a 50°C
Cloruri terziari non reagiscono