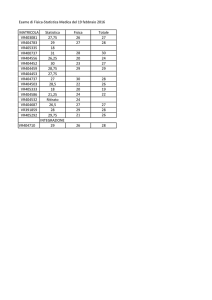
3° settimana di docenza, 23-28 SETTEMBRE
Master in “aspetti regolatori, brevettuali e farmaco economici dello sviluppo dei farmaci”
AULA D5, Dipartimento di Scienze Chimiche e Farmaceutiche
Giorno
Data
Ore
Lunedì
23 Settembre
9:00-13:00
Martedì
Argomento
1.Metodologia di sviluppo dei farmaci/device
2. Strategie ed Organizzazione di un piano clinico di sviluppo
3. Key Performance Indicators
Docente
M. PAGLIONE , Direttore
Medico- Myriad Genetics
14:00-17:00
1.Riunione kick off piano di sviluppo clinico: go/no go
2. Piano di sviluppo clinico: chi fa cosa (criteri RACI)
3. Monitoraggio sviluppo clinico ed eventuali correttivi
17:00-18:00
Conduzione di Studi Late Phase e Studi Osservazionali:
Regolamentazione e Scopi
Mirella ZAFFUTO (UniFe)HE&OR, MA Consultant
Elementi e sistemi di farmacovigilanza e farmacoepidemiologia con valutazione del rischio dei farmaci:
Reporting attivo e passivo
Prof. TANGANELLI (UniFe)
24 Settembre
9:00-11:00
11:00-13:00
Metodologie di Farmacovigilanza; l'attività di
Angella BENINI,
Responsabile
Farmacovigilanza-
Note
14:00-18:00
Farmacovigilanza nella provincia di Ferrara
Dipartimento Farmaceutico
Interaziendale - AUSL
Ferrara
Sperimentazione Clinica in Italia e all’estero
Le CRO –Contract Research Organization
I ruoli e le opportunità di crescita professionale nelle
CRO
Mariapia CIRENEI -General
manger of Busisness
Administration, PAREXEL
Decreto CRO
Mercoledì
Alberto CAVENAGHIi Avvocato
25 Settembre
9:00-11:00
11:00-13:00
La sicurezza d’impiego del farmaco: differenze e
similitudini tra studio farmacologico e tossicologico:
Test di tossicità acuta, cronica e riproduttiva
Mutagenesi e cancerogenesi
Richiesta Autorizzazione Studi Clinici VS Autorità
Competenti:- Procedure UE: esame direttive esistenti e
nuovo regolamento UE
- Esame dell’attuale status di implementazione della
Direttiva nelle varie realtà nazionali / procedure nazionali
per invio CTA e richiesta approvazione (approccio
comparato)
Prof. MORARI (UniFe)
Cristina LUPO Manager –
Regulatory Department,
PAREXEL
14:00-16:00
- Status quo in Italia Inquadramento regolatorio del
farmaco sperimentale:
- Regolamentazione GMP
- IMP/NIMP
- Etichettatura
- Gestione farmaco sperimentale (es. farmaco scaduto)
Marco CASUCCI Consultant
– Regulatory Departement,
PAREXEL
Senior PAREXEL
Analisi statistica dei dati
16:00-18:00
Esercitazione di statistica
Elena FORINI Statistica
Sanitaria – AOSP Ferrara
18:00-19:00
Giovedì
26 Settembre
9:00-15:00
Conduzione Sperimentazione Clinica: Attività Pratica
Monitoraggio Studi Interventistici , Visita D’Inizio, Visita
di Monitoraggio, Gestione Chiusura Centro(titolo da
definire)
15:30-17:00
Sviluppo clinico di un farmaco:sfide e innovazione
17:00-19:00
Esercitazione di statistica
Venerdì
27 Settembre
9:00-11:00
La raccolta e la gestione dei dati di uno studio clinico.
Il ruolo del data manager
D'APOLITO - Direttore
Clinical Research
CROMSOURCE,
Loredana BergaminiDirettore Medico, Janssen
Italia S.p.A. , Johnson &
Johnson
Elena FORINI Statistica
Sanitaria – AOSP Ferrara
Matteo BARION, Senior
Data Manager, CROS NT
11:00-17:00
17:00-19:00
Sabato
28 Settembre
9:00-11:00
1. Biosimilars:backgroung, challenges and opportunities
Fausto BERTI Director
2. Pre-Clinical, Clinical Development and regulatory
Clinical Development Mylan
Aspects of Biosimilars
Pharmaceuticals
3. Biosimilars:commercial landscape
Esercitazione di statistica
Team “virtuale”: la comunicazione e i rapporti all’interno
di un team di lavoro internazionale
Elena FORINI Statistica
Sanitaria – AOSP Ferrara
Francesca Cellauro, Project
Manager / Country Manager
Quintiles-Outcome
Stefano Gallina,
Regional Quality Oversight
Manager, Janssen Italia
11:00-13:00
1. Quality Assurance Vs Quality Control
2. Preparazione , Ispezioni e Audits
3. Esempi
S.p.A. , Johnson &
Johnson
14:30-18:30
Brevetto
Anna Pezzoli