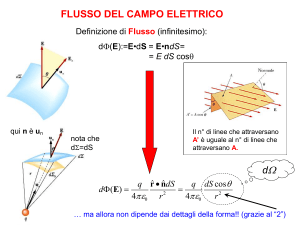
DISPENSE DI FISICA (II PARTE)
Unità 1
Temperatura e dilatazione termica
Scale termometriche
La materia è formata da molecole ognuna delle quali ha una sua velocità e, di conseguenza, una sua energia cinetica.
Tanto maggiore è l'energia cinetica di queste molecole, tanto maggiore è la temperatura. Infatti la temperatura di un
corpo è un indice dell'agitazione termica, ossia dell'energia cinetica delle molecole che compongono il corpo. Per
renderci conto di ciò è sufficiente accendere un fuoco e osservare le molecole d'aria presenti nei dintorni: ci accorgiamo
subito che l'aumento di temperatura nei pressi del fuoco comporta un aumento della velocità delle molecole.
La misura della temperatura, che è una grandezza fisica fondamentale nel Sistema Internazionale, si basa su due
fenomeni fisici distinti che andremo ad analizzare in dettaglio: l'equilibrio termico e la dilatazione termica.
Cominciamo a studiare l'equilibrio termico: quando poniamo a contatto due corpi aventi temperatura diversa, le molecole
di questi due corpi subiscono continui urti e in questi urti il corpo più caldo cede energia cinetica al corpo più freddo
finché le molecole dei due corpi vengono ad avere in media la stessa energia cinetica. A livello macroscopico questo si
riflette nel fatto che i due corpi vengono ad avere la stessa temperatura.
L'altro fenomeno su cui si basa la misura della temperatura è la dilatazione termica, ossia l'effetto per il quale quando
scaldiamo un corpo, esso si dilata. Su questi due principi fisici si basa il termometro clinico. Infatti quando poniamo il
termometro clinico a contatto con la nostra pelle, cediamo parte del nostro calore al termometro finché si arriva a una
temperatura di equilibrio (che praticamente coincide con quella del nostro corpo). Il mercurio presente all'interno del
termometro clinico si dilata a causa dell'aumento di temperatura e dalla dilatazione termica del mercurio possiamo
risalire alla temperatura del nostro corpo.
Per tarare un termometro è importante fissare delle temperature di riferimento. Queste temperature sono: 0°C
(temperatura di fusione del ghiaccio a pressione atmosferica) e 100°C (temperatura di evaporazione dell'acqua). Questo
intervallo di 100°C viene poi diviso in 100 parti uguali per definire il grado Celsius (°C), detto anche grado centigrado.
Questa prima scala di temperatura, che è quella che usiamo quotidianamente, prende il nome di scala centigrada o
scala Celsius.
Esistono altre scale di temperatura, a cominciare dalla temperatura assoluta, che si misura in gradi Kelvin (K). È
anch'essa una scala centigrada ma tutte le temperature risultano traslate rispetto alla scala Celsius. In generale, se
indichiamo con TC la temperatura del corpo in gradi Celsius e con TK la temperatura dello stesso corpo in gradi Kelvin
vale la seguente relazione TK = TC + 273.15. In particolare, la temperatura 0 K = -273.15°C corrisponde al cosiddetto
zero assoluto. Questa è una temperatura limite: è infatti impossibile scendere al di sotto dello zero assoluto. Questa
temperatura corrisponde infatti a energia cinetica nulla da parte di tutte le molecole. Nella pratica, è molto difficile
raggiungere lo zero assoluto anche se con le moderne tecniche si sono raggiunte temperature dell'ordine del µK (10 -6 K).
Le temperature più alte presenti in natura si raggiungono invece nel centro delle stelle: ad esempio, all'interno del Sole si
raggiungono i 3 milioni di gradi Kelvin.
Una terza scala termometrica è utilizzata nei paesi anglosassoni e prende il nome di scala Fahrenheit. In tale scala la
temperatura di fusione del ghiaccio, 0°C, corrisponde a 32°F mentre la temperatura di ebollizione dell'acqua, 100°C,
corrisponde a 212°F. È chiaro già da questa corrispondenza che la scala Fahrenheit non è una scala centigrada.
Dilatazione lineare
Come abbiamo detto nella precedente sezione, uno dei principi fisici su cui si basa la misura della temperatura con un
termometro clinico è la dilatazione termica che in questa sezione andremo ad analizzare un po' più in dettaglio.
Quando vengono riscaldati i corpi si dilatano. Consideriamo ad esempio un'asta di lunghezza l 0 a una temperatura
iniziale T0. Portiamo l'asta a una temperatura finale T in modo tale che la variazione di temperatura sia uguale a ΔT = T T0. L'asta si allungherà di una quantità pari a Δl, come indicato nella figura seguente:
Sperimentalmente si verifica che l'allungamento Δl è direttamente proporzionale alla
lunghezza iniziale dell'asta l0 e alla variazione della temperatura ΔT, ossia Δl = λ l 0
ΔT. Il coefficiente di proporzionalità λ prende il nome di coefficiente di dilatazione
lineare. Dal momento che λ = Δl / (l0 · ΔT) avremo che il coefficiente di dilatazione
lineare si misura in °C-1 oppure in K-1.
1
Il coefficiente di dilatazione lineare dipende dalla sostanza che prendiamo in esame. Nella tabella seguente riportiamo i
valori di λ per alcune sostanze:
Sostanza
Piombo
Alluminio
Ferro
Acciaio
λ (°C-1)
2.9·10-5
2.4·10-5
1.2·10-5
1.2·10-5
Dilatazione volumica
Un discorso analogo a quello che abbiamo visto nella precedente sezione vale se abbiamo a che fare con dei solidi
tridimensionali anziché con delle aste. Supponiamo per semplicità di considerare un cubo di lato iniziale l 0 e, di
conseguenza, di volume iniziale V0 = (l0)3. Supponiamo anche di andare ad aumentare la temperatura da T0 a T0 + ΔT.
Ognuno dei lati del cubo subirà una dilatazione lineare, ossia la lunghezza finale del lato sarà l = l 0 + Δl. Andiamo a
calcolarci il volume finale del cubo:
V = l3 = (l0 + Δl)3 = (l0)3 + 3 · (l0)2 · Δl + 3 · l0 · (Δl)2 + (Δl)3.
Ora la dilatazione termica Δl è in genere un numero piccolo, pertanto nella precedente espressione, quando eleviamo al
quadrato o al cubo Δl otterremo degli addendi trascurabili rispetto agli altri termini. Pertanto, ricordandoci anche che Δl
= λ · l0 · ΔT, possiamo approssimare il volume del cubo come segue:
V ≈ (l0)3 + 3 · (l0)2 · λ · l0 · ΔT = (l0)3 + 3 · λ · (l0)3 · ΔT = V0 + 3 · λ · V0 · ΔT.
In definitiva, la variazione di volume dovuta alla dilatazione termica è ΔV = k · V0 · ΔT, dove k = 3 · λ è il cosiddetto
coefficiente di dilatazione volumica. Come conseguenza del fatto che la dilatazione di un cubo o di un qualunque
solido tridimensionale può avvenire lungo tre distinte direzioni abbiamo che il coefficiente di dilatazione volumica è il
triplo del coefficiente di dilatazione lineare.
Gas ideali
Legge di Boyle
La pressione p è data dalla forza F che si esercita su una certa superficie divisa per l'area A di tale superficie. In questa
sezione vogliamo studiare l'equilibrio dei gas e la pressione risulta essere una delle grandezze fondamentali in termini
delle quali descrivere il comportamento di un gas ideale. Infatti quando le molecole del gas urtano contro le pareti del
recipiente che le contiene esercitano una forza ed è questa forza che determina la pressione del gas.
Il volume V del gas invece coincide con il volume del recipiente che contiene il gas, dal momento che i gas non sono
dotati di volume proprio. Accanto alla pressione p e al volume V, altre grandezze fisiche che caratterizzano un gas sono
la temperatura T e la quantità di gas che indicheremo con il simbolo n. La mole, unità di misura fondamentale del
Sistema Internazionale, è stata definita nel 1971 dal Comitato Internazionale dei Pesi e delle Misure come la quantità si
sostanza di un sistema che contiene tante entità elementari quanti atomi sono contenuti in 0.012 kg di carbonio-12. In
particolare, 1 mole corrisponde a 6.02 · 1023 molecole.
Quando un gas è in equilibrio la pressione p, il volume V, la temperatura T e la quantità di gas n non sono tutte
grandezze fisiche indipendenti ma sono legate tra loro da certe relazioni che andremo ora ad esaminare in dettaglio.
Cominciamo con l'analizzare una trasformazione che avviene a temperatura T costante e a n costante. Se andiamo a
comprimere il gas, riducendo il suo volume V, aumentano gli urti delle molecole con le pareti e conseguentemente
aumenta la forza e la pressione esercitata dalle molecole sulle pareti. In questo caso la pressione p e il volume V del gas
non sono grandezze indipendenti ma sono legate tra loro dalla relazione p · V = costante. Questa legge prende il nome
di legge di Boyle. Pressione e volume a temperatura costante sono inversamente proporzionali: se raddoppiamo
(triplichiamo) una delle due grandezze fisiche, l'altra si dimezza (diventa uguale a 1 / 3). Dal momento che nel Sistema
Internazionale la pressione p si misura in N / m 2 e il volume in m3, la costante che compare nella legge di Boyle si misura
in N / m2 · m3 = N · m = J, ossia in joule.
Supponiamo invece di considerare un gas a pressione p e temperatura T fissate. Vale in questo caso la legge di
Avogadro: una mole di gas occupa lo stesso volume, qualunque sia il tipo di gas che prendiamo in considerazione. Ad
esempio, una mole di gas alla pressione p = 1 atm e alla temperatura T = 0°C occupa un volume V = 22.4 l = 22.4 dm3.
È interessante osservare come questa proprietà sia totalmente indipendente dalla massa del gas: una mole di elio He 2
ha una massa di 4 g, mentre una mole di ossigeno O 2 ha una massa di 32 g. Ciò nonostante, entrambi i campioni di gas
a 1 atm di pressione e a 0°C di temperatura occupano un volume di 22.4 l: tutte le leggi sui gas ideali dipendono dalla
quantità di sostanza, intesa come numero di moli del gas, non dalla massa del campione.
Leggi di Gay-Lussac
Consideriamo un gas ideale a pressione costante. In questo caso il volume V e la temperatura TC, misurata in gradi
Celsius, sono legati tra loro dalla seguente relazione: V = V 0 (1 + a · TC) dove V0 è il volume occupato dal gas a 0 °C ed
il coefficiente a = 1 / 273.15 °C-1.
2
Questa legge prende il nome di legge di Gay-Lussac. Dal grafico riportato
nella figura sopra scopriamo che il volume di un gas diventa uguale a zero alla
temperatura TC = -273.15 °C, ossia allo zero assoluto. Questo è un altro modo
per convincersi dell'impossibilità di andare al di sotto dello zero assoluto. Se
potessimo andare al di sotto dello zero assoluto ci ritroveremmo con dei volumi
negativi! La legge di Gay-Lussac assume una forma semplificata se la
riscriviamo in termini della temperatura espressa in gradi Kelvin T = T C +
273.15. Infatti V = V0 · (1 + TC / 273.15) può essere riscritta come V = V0 ·
(273.15 + TC) / 273.15, ossia V = V0 · T / T0 dove T0 = 273.15 K è la temperatura alla quale il volume del gas è uguale a
V0. In altre parole, il volume e la temperatura assoluta di un gas ideale sono direttamente proporzionali.
Esiste anche un'altra legge dovuta a Gay-Lussac: essa descrive il comportamento di un gas a volume costante ed è
esattamente analoga alla precedente, ossia la pressione p e la temperatura in gradi Celsius T C sono legate tra loro dalla
seguente relazione: p = p0 (1 + a · TC) dove p0 è la pressione del gas a 0 °C. La costante a = 1 / 273.15 °C -1 anche in
questo caso.
Anche in questo caso la pressione diventa uguale a 0 a -273.15 °C e la legge
può essere riscritta in termini della temperatura in gradi Kelvin T come p = p 0 · T
/ T0, ossia a volume costante, abbiamo che la pressione e la temperatura
assoluta di un gas ideale sono direttamente proporzionali.
Equazione di stato dei gas perfetti
In questa sezione vogliamo vedere come esista il modo per riassumere in un'unica equazione la legge di Boyle, la legge
di Avogadro e le leggi di Gay-Lussac. Prima di ricavarci questa equazione vogliamo rappresentare la legge di Boyle e la
legge di Gay-Lussac nel piano di Clapeyron. Il piano di Clapeyron è un diagramma cartesiano che ha in ascissa il
volume e in ordinata la pressione del gas. Un gas viene ad essere univocamente determinato da un punto nel piano di
Clapeyron: infatti la quantità di gas n è un numero generalmente fissato e, come vedremo derivando la legge dei gas
perfetti, la conoscenza della pressione p e del volume V determina in maniera univoca la temperatura T del gas.
Il grafico della legge di Boyle sul piano di Clapeyron è dato da un ramo d'iperbole. Le leggi di Gay-Lussac sono
rappresentate invece da due semirette parallele agli assi cartesiani.
Supponiamo di considerare una mole di gas e di partire da un certo punto (p 0, V0) del piano di Clapeyron caratterizzato
da pressione p0 = 1 atm e volume V0 = 22.4 l. Se invece di avere una mole di gas ne abbiamo n l'equazione che
caratterizza i gas diventa:
p · V = n · R · T.
Questa è l'equazione di stato dei gas perfetti, valida a patto di esprimere la temperatura T in gradi Kelvin. Tale
equazione riassume in sé tutte le altre equazioni. Infatti a T costante ritroviamo la legge di Boyle: p · V = costante. A V
costante riotteniamo che p è proporzionale a T mentre a p costante riotteniamo che V è proporzionale a T, ossia le due
leggi di Gay-Lussac.
Unità 2
Termologia
Calore specifico
Legge fondamentale della termologia
Ci sono diversi modi per aumentare la temperatura di una sostanza liquida, come ad esempio l'acqua: ponendo la
sostanza a diretto contatto con una fiamma, agitando l'acqua, esponendo l'acqua ai raggi del sole oppure facendo
passare corrente nell'acqua. Un'esperienza fondamentale al riguardo è quella del mulinello di Joule schematizzato
nella figura che segue:
3
L'energia potenziale dei pesi si converte progressivamente in energia
cinetica di rotazione del cilindro e delle pale ad esso collegate. Tali pale
agitano l'acqua contenuta nel recipiente. Alla fine, quando i pesi
giungono a terra, il sistema progressivamente si ferma e, se si misura
la temperatura dell'acqua, si scopre che è aumentata. Di quanto?
Supponiamo che ΔE sia la perdita di energia meccanica del sistema
(coincidente con l'energia potenziale gravitazionale iniziale dei pesi).
Indichiamo invece con ΔT l'aumento di temperatura dell'acqua. Quello
che si scopre è che il rapporto tra la variazione di energia ΔE e la
variazione di temperatura ΔT è uguale a una costante C, detta
capacità termica dell'acqua.
La capacità termica è una caratteristica della sostanza che stiamo considerando ma dipende anche dalla massa m della
sostanza. È abbastanza intuitivo infatti che, a parità di energia fornita, riusciamo a riscaldare molto più facilmente un
corpo che ha una piccola massa (nella fattispecie una piccola quantità di acqua). Infatti la capacità termica C può essere
riscritta come C = c · m, dove c è una costante che dipende dalla sostanza in esame e prende il nome di calore
specifico, m è invece la massa della sostanza. In definitiva possiamo riscrivere la variazione di energia meccanica dei
pesi ΔE come ΔE = c · m · ΔT. Vale la pena menzionare fin da subito il valore del calore specifico dell'acqua che
useremo spesso negli esercizi: c = 4186 J / (kg · K). Questo significa che sono necessari 4186 J di energia per alzare di
1 grado Kelvin la temperatura di 1 kg di acqua. Questo valore elevato rende l'acqua uno stabilizzatore termico: i terreni
ricchi di acqua, i mari o i laghi si riscaldano molto di meno rispetto ai terreni aridi o ai deserti.
L'energia meccanica dei pesi non viene dunque persa ma viene acquistata sotto forma di calore dall'acqua. Il calore
acquistato o ceduto da una sostanza che aumenta la sua temperatura di ΔT è uguale a
Q = c · m · ΔT.
Questa relazione prende il nome di legge fondamentale della termologia.
Poiché il calore ceduto determina un aumento della temperatura, ossia, a livello microscopico, un aumento dell'energia
cinetica delle molecole, possiamo concludere che il calore è una forma di energia, detta anche energia termica. Se
teniamo in considerazione questo fatto, possiamo dire che quella che si conserva non è l'energia meccanica ma la
somma di energia meccanica ed energia termica. Quando ci sono degli attriti sappiamo che l'energia meccanica non si
conserva. Ora abbiamo scoperto qual è la ragione: in presenza di attriti parte dell'energia meccanica viene convertita in
energia termica, ossia in calore.
Per concludere questa sezione, vogliamo menzionare come un'altra unità di misura molto usata per il calore sia la
caloria: una caloria è la quantità di calore necessaria per portare 1 g d'acqua dalla temperatura di 14.5°C alla
temperatura di 15.5°C. È facile rendersi conto che le definizioni di caloria e di calore specifico dell'acqua implicano la
seguente equivalenza: 1 cal = 4.186 J. Se usiamo la caloria come unità di misura del calore, il calore specifico verrà ad
essere misurato in cal / (g°C).
Trasferimenti di energia
Cambiamenti di stato
Calore latente di fusione
Lo scopo principale di questa sezione è quello di provare come il calore ceduto a un corpo non sempre implichi un
aumento di temperatura. L'eccezione è costituita dai cambiamenti di stato. Quando noi forniamo calore a un blocco di
ghiaccio, la temperatura del ghiaccio aumenta fino ad arrivare a 0°C. Se forniamo ulteriore calore notiamo che la
temperatura del ghiaccio non aumenta ma rimane costante. In questa fase infatti il calore fornito serve per far fondere il
ghiaccio.
Quando tutto il ghiaccio è fuso, il calore che forniamo all'acqua serve di nuovo per aumentare la sua temperatura finché
arriviamo a una temperatura di 100°C. A quel punto il calore ulteriore che cediamo serve al nuovo cambiamento di stato,
da liquido a gas. In questa fase di nuovo la temperatura rimane costante finché tutta l'acqua non è evaporata.
L'andamento della temperatura T in funzione del calore Q è riportato nel
seguente grafico:
Dopo questa introduzione qualitativa cerchiamo di capire quanto calore
serve per far fondere una massa m di ghiaccio o di una qualunque
sostanza allo stato solido. È abbastanza intuitivo che questo calore risulta
tanto maggiore quanto maggiore è la massa m di sostanza da fondere. In
particolare, il calore di fusione Q e la massa m sono direttamente
proporzionali Q = λf · m. Il coefficiente di proporzionalità prende il nome di
calore latente di fusione e dipende dalla sostanza che prendiamo in
esame. Dal momento che λf = Q / m la sua unità di misura nel Sistema
Internazionale è il J / kg. Nel caso particolare dell'acqua abbiamo che λf =
3.34 · 105 J / kg. Questo significa che, a pressione atmosferica, per fondere
1 kg di ghiaccio servono 3.34 · 105 J.
4
È importante precisare a pressione atmosferica perché, se cambiamo la pressione, le grandezze fisiche che
caratterizzano il cambiamento di stato cambiano. Ad esempio, se aumentiamo la pressione sul ghiaccio possiamo
abbassare la temperatura di fusione al di sotto degli 0°C. Ci si può rendere conto di ciò mantenendo a qualche grado
sotto lo zero un blocco di ghiaccio. Appoggiando sopra tale blocco un filo dotato alle sue estremità di due pesi, abbiamo
che la pressione esercitata dal filo sul ghiaccio abbassa la temperatura di fusione e il ghiaccio sotto il filo comincia a
fondere. Il filo riesce a penetrare nel blocco di ghiaccio mentre al di sopra del filo la pressione torna ad essere quella
atmosferica e si ricrea il blocco di ghiaccio visto che siamo a una temperatura inferiore a 0°C. In questo modo il filo
riesce ad attraversare completamente il blocco di ghiaccio!
Calore latente di evaporazione
Abbiamo visto nella precedente sezione che i cambiamenti di stato avvengono a temperatura costante ma con scambio
di calore. Di seguito riportiamo i nomi e le temperature che caratterizzano i cambiamenti di stato dell'acqua.
In alcuni casi (es.: naftalina) è possibile far avvenire il cambiamento di stato da solido a gas senza passare attraverso la
fase liquida. Questo processo prende il nome di sublimazione. Il passaggio opposto da gas a solido prende invece il
nome di brinamento, dal momento che la brina ne è un tipico esempio.
Il calore latente di evaporazione dipende dalla sostanza che prendiamo in considerazione. Come il calore latente di
fusione, anche il calore latente di evaporazione è direttamente proporzionale alla massa m, ossia Q = λ v · m. Il
coefficiente di proporzionalità λv dipende dalla sostanza che prendiamo in considerazione. Nel caso dell'acqua a
pressione atmosferica λv = 2.25 · 106 J / kg. Questo vuol dire che serve una quantità di calore pari a Q = 2.25 · 10 6 J per
far evaporare 1 kg di acqua. Viceversa, la condensazione di 1 kg di acqua porta a una cessione di Q = 2.25 · 10 6 J per
ogni kilogrammo.
L'elevato calore latente di evaporazione rende l'acqua molto efficace nello spegnimento del fuoco: infatti l'evaporazione
dell'acqua in prossimità di un incendio permette di assorbire notevoli quantità di calore alla sostanza che brucia. Inoltre, il
vapor acqueo che si crea, avvolgendo il corpo in fiamme, ne ostacola l'afflusso dell'ossigeno necessario per la
combustione.
Anche nel processo di evaporazione bisogna specificare la pressione alla quale avviene il processo. Ad esempio, la
temperatura di evaporazione dell'acqua aumenta all'aumentare della pressione, come emerge dal seguente grafico:
A 0.7 atmosfere (pressione che si ha per esempio a 3000 m di altezza) la temperatura di evaporazione dell'acqua è
inferiore a 90°C. Questo è il motivo per cui la pasta in montagna si scuoce. Il
fatto che la temperatura di evaporazione diminuisca al diminuire della
pressione comporta anche la necessità per gli astronauti nello spazio di
indossare delle tute pressurizzate, in grado di evitare l'evaporazione del
sangue che altrimenti potrebbe avvenire anche alla temperatura della
navicella.
Su questi principi fisici si basa anche la macchinetta per il caffè espresso. La
parola stessa espresso deriva da extra pressione. Nella macchinetta del caffè
il vapore presente al di sopra dell'acqua genera una pressione sull'acqua che risale per il condotto centrale. La polvere di
caffè è stata compressa ed oppone resistenza. In queste condizioni la pressione di vapore cresce, l'acqua bolle a 120°C
e la sua capacità di estrarre aroma dal caffè è notevolmente accresciuta. Su meccanismi analoghi si basa il
funzionamento della pentola a pressione.
Propagazione del calore
In generale abbiamo visto che, quando forniamo calore ad un corpo, la sua temperatura aumenta oppure, se siamo in
prossimità di un cambiamento di stato, la temperatura non aumenta ma il calore viene utilizzato per indurre il
cambiamento di fase della sostanza in esame. Ma quando forniamo calore a un corpo, come avviene la propagazione
del calore al suo interno?
Esistono tre modi diversi con cui si propaga il calore:
1.
conduzione: avviene nei solidi. L'energia termica viene trasferita attraverso la vibrazione degli atomi che
costituiscono il solido ma non c'è trasferimento di materia.
5
2.
3.
convezione: avviene nei fluidi. L'acqua quando si scalda subisce un processo di dilatazione termica:
all'aumentare del volume diminuisce la densità, quindi l'acqua calda tende a salire. Le molecole d'acqua si
spostano e si mescolano tra loro (moti convettivi),
irraggiamento: avviene anche in assenza di materia, grazie alla propagazione della radiazione
elettromagnetica (ad esempio quella proveniente dal Sole).
Il calore si propaga dal corpo a temperatura più alta a quello a temperatura più bassa in maniera rapida se il materiale ha
una elevata conducibilità termica k (ad esempio nei metalli), in maniera lenta se il materiale ha una bassa conducibilità
termica (ad esempio negli isolanti).
Unità 3
ELEMENTI DI ELETTROSTATICA
Introduzione
Tra tutti i tipi di forza che abbiamo incontrato in meccanica, solo la forza peso e quella di gravitazione universale
derivano dalla proprietà delle masse di attirare altre masse. Tutte le altre forze, quella elastica, le reazioni vincolari, le
forze di attrito, la tensione nelle funi, ecc., altro non sono che manifestazioni dell’interazione elettromagnetica.
Nella vita di tutti i giorni è però la forza peso quella di cui ci accorgiamo di più, non fosse altro per la fatica che bisogna
fare per sollevare pesi, salire e scendere scale, ecc. Anche nell’antichità, del resto, l’esistenza di una proprietà non
spiegabile in termini di forza gravitazionale era stata notata solo per il fatto che pezzi di ambra (electron in greco, da cui
poi il nome di elettricità), strofinati con un panno, erano in grado di attirare minuscole particelle di foglie secche o di
polvere. La forza di interazione tra l’ambra e le particelle attirate era sorprendentemente intensa, riusciva, infatti, a
vincere la forza peso e ad accelerare verso l’alto le particelle di polvere.
La carica elettrica
Il fatto che le interazioni elettromagnetiche, pur essendo molto più intense delle forze di interazione gravitazionali, si
pensi che la forza elettrostatica tra due protoni è 1040 volte più grande della loro interazione gravitazionale, siano rimaste
nascoste, direi quasi soffocate, dalla forza peso, dipende da una misteriosa simmetria della natura: la carica esiste in
due tipi diversi a cui convenzionalmente è stato attribuito il nome di positiva e negativa.
Al contrario quindi della massa, che è tutta dello stesso tipo e, per questo motivo, tutti i corpi che possiedono una massa
si attirano l’uno con l’altro, la carica elettrica esiste in due forme diverse:
cariche dello stesso tipo si respingono, cariche di tipo diverso si attraggono. I corpi che contengono un’eguale quantità di
carica dei due tipi, si dicono neutri, hanno una carica complessiva nulla e non subiscono, né esercitano, forze elettriche.
Questa è la condizione normale dei corpi che ci circondano: essi contengono tanta carica positiva quanta negativa. È
questa perfetta simmetria che nasconde i fenomeni elettrici.
La carica elettrica è una proprietà delle particelle che costituiscono gli atomi.
Con questo termine, si identificano i mattoni che costituiscono le molecole. Queste ultime rappresentano l’elemento
indivisibile che conserva ancora tutte le proprietà della sostanza in esame. Molte sostanze hanno molecole costituite da
singoli atomi. Come abbiamo già discusso, nel caso di alcune sostanze che alla temperatura ambiente sono solide, gli
atomi sono organizzati in una struttura ordinata che costituisce il reticolo cristallino.
Dalla discussione sulla struttura atomica risulta che la carica elettrica è trasportata dalle particelle che costituiscono gli
atomi in particolare dai protoni e dagli elettroni. Abbiamo anche visto che sia i protoni che gli elettroni trasportano la
stessa carica ma di segno opposto:
carica elettrica elementare:
e = 1.6·10-19C
Non è stata trovata finora alcuna particella avente una carica più piccola della carica dell’elettrone.
Quindi la carica elettrica è quantizzata, cioè ogni altra carica elettrica sarà un multiplo intero della carica dell’elettrone.
In un sistema isolato, la somma delle cariche positive e negative si mantiene costante. Tale enunciato esprime la legge
di conservazione della carica elettrica
Fenomeni di elettrizzazione
Se gli atomi di un corpo acquistano o perdono elettroni, il corpo stesso risulta possedere rispettivamente un eccesso di
cariche negative o di cariche positive e quindi risulta elettrizzato.
Un corpo si dice elettrizzato se al suo interno viene a mancare l'equilibrio tra elettroni e protoni, cioè tra cariche negative
e cariche positive.
Un corpo può essere elettrizzato in vari modi:per strofinio, per contatto e per induzione.
Elettrizzazione per strofinio:
Certi corpi hanno la proprietà di elettrizzarsi se vengono strofinati con un panno di lana.
Questo metodo viene detto elettrizzazione per strofinio.
Strofinando con un panno di lana il vetro o materiale simile al vetro, in essi si manifesta elettricità positiva: durante lo
strofinio si ha un trasferimento di elettroni dal vetro alla lana, perciò il vetro risulta elettrizzato positivamente mentre la
lana negativamente.
Strofinando con un panno di lana l' ebanite o sostanze simili, in esse si manifesta elettricità negativa: in questo caso
avviene il trasferimento di elettroni dalla lana all' ebanite, perciò quest’ultima risulta elettrizzata negativamente, mentre la
lana positivamente
6
Elettrizzazione per contatto:
L' elettrizzazione per contatto consiste nell' elettrizzare un corpo neutro ponendolo a contatto con uno carico.
Se disponiamo di un oggetto elettricamente carico e lo portiamo a contatto con un corpo neutro attraverso la zona di
contatto avviene il trasferimento di un certo numero di cariche elettriche dal primo corpo al secondo.
Poichè subito dopo il passaggio i due corpi presentano elettricità dello stesso segno, essi tenderanno a respingersi.
Elettrizzazione per induzione:
L'elettrizzazione per induzione consiste nel produrre una separazione di cariche in un corpo neutro avvicinando ad esso
un corpo carico.
Se accostiamo una bacchetta di vetro, oppure una bacchetta di ebanite elettrizzate a dei pezzetti di carta, questi in
entrambi i casi vengono attratti dalla bacchetta.
Questo fenomeno avviene perchè un corpo carico, cioè elettrizzato, è in grado di elettrizzare un corpo neutro, cioè di
provocare in quest’ultimo una separazione di cariche per semplice avvicinamento, cioè senza che vi sia stato passaggio
diretto di cariche nei due corpi.
Conduttori e isolanti
Rispetto alla capacità di trasportare le cariche elettriche, i materiali possono essere classificati in conduttori e isolanti.
Si chiamano conduttori le sostanze in cui le cariche si possono muovere liberamente, mentre si chiamano isolanti tutte le
sostanze in cui le cariche non si possono muovere o si muovono con grande difficoltà.
Sono conduttori tutti i metalli, gli organismi viventi e la grafite; sono isolanti la plastica, il vetro e il legno. I conduttori non
possono essere elettrizzati per strofinìo.
Ripetendo l' esperimento d' elettrizzazione per strofinìo con una forchetta metallica, invece che con l' ebanite, si osserva
che i pezzettini di carta non vengono attratti.
Possiamo strofinare il metallo della forchetta con la lana quanto vogliamo, ma non sarà possibile esercitare nessuna
forza verso la carta.
Questo accade perchè i metalli disperdono velocemente le cariche elettriche acquisite con lo strofinìo. Le cariche infatti
si disperdono nel terreno, passando attraverso la mano, il braccio e il corpo di chi l'impugna. Si può ovviare a questo
isolando il metallo con un manico di plastica, in questo caso sarà possibile elettrizzare per strofinio anche un metallo.
Nei conduttori gli elettroni sono liberi di muoversi. La causa del comportamento dei conduttori risiede nella struttura dei
loro atomi. Gli elettroni non sono fortemente legati ai loro nuclei ma possono muoversi da un atomo all' altro. E' proprio il
movimento libero degli elettroni a conferire ai conduttori la proprietà di trasportare l' elettricità.
Negli isolanti gli elettroni sono legati al loro nucleo e difficilmente possono spostarsi da un punto all' altro.
La legge di Coulomb
La forza di attrazione o di repulsione tra due corpi puntiformi carichi elettricamente è direttamente proporzionale al
prodotto delle cariche possedute dai due corpi e inversamente proporzionale al quadrato della loro distanza.
F k
k0 = 9·109 N·m2/C2
q1 q2
r2
Calcolata ne vuoto.
In generale si è portati ad utilizzare un’altra costante, detta costante dielettrica del mezzo considerato:
mentre con 0 = 1/4··k0
si indica la costante dielettrica nel vuoto
= 1/4··k
r = / 0 si indica la costante dielettrica relativa ed è sempre maggiore di 1.
0= 8,85·10-12 C2/N·m2
F
= 0·r
q1 q2
4
r2
1
Unità 4
Corrente elettrica
Definizione di corrente
Nei metalli sono presenti uno o due elettroni per atomo nei livelli più esterni. Questi elettroni sono poco legati ai rispettivi
atomi e pertanto sono dotati di una grande mobilità. Quando inseriamo un filo di materiale conduttore in un circuito
elettrico, ossia quando colleghiamo il filo ai due capi di un generatore, ad esempio una pila, gli elettroni più esterni,
carichi negativamente, si dirigono verso il polo positivo generando in questo modo una grande quantità di cariche in
movimento: ha così origine una corrente elettrica.
In particolare, si definisce corrente i il rapporto tra la quantità di carica elettrica Q che passa attraverso una sezione
unitaria del circuito, e l'intervallo di tempo Δt in cui questo passaggio avviene: i = Q / Δt. L'unità di misura della corrente
7
nel Sistema Internazionale è l'ampere. Dal momento che la carica Q si misura in coulomb e il tempo in secondi avremo
che 1 A = 1 C / 1 s. Per convenzione il verso della corrente coincide con quello in cui si muovono le cariche positive,
quindi dal polo positivo al polo negativo del generatore. Quindi il verso della corrente non coincide con il verso del moto
degli elettroni.
Per misurare la corrente si usa uno strumento detto amperometro che va inserito in serie con l'utilizzatore X come nella
figura di sinistra. Per misurare la differenza di potenziale presente tra due punti, ad esempio ai capi dell'utilizzatore X,
dobbiamo usare uno strumento detto voltmetro e inserirlo in parallelo all'utilizzatore X come nella figura di destra:
In generale, il ruolo del generatore è quello di mantenere in moto le
cariche elettriche all'interno del circuito elettrico fornendo loro
l'energia necessaria. Ai capi di ogni utilizzatore ci ritroviamo poi
parte di questa differenza di potenziale.
Definizione di resistenza e prima legge di Ohm
Abbiamo visto nella precedente sezione che la differenza di potenziale ΔV fornita dal generatore mette in movimento le
cariche elettriche in un circuito dando origine a una corrente elettrica i. A parità di differenza di potenziale applicata, la
corrente i che passa in un circuito dipende dalle caratteristiche del materiale conduttore che si è utilizzato. Ogni
conduttore manifesta infatti una certa resistenza al passaggio della corrente, dovuta agli urti tra le cariche degli elettroni
in movimento all'interno del conduttore e gli atomi delle impurità presenti nel circuito.
In termini matematici si definisce resistenza R di un conduttore il rapporto tra la differenza di potenziale ΔV applicata e
l'intensità di corrente i, ossia R = ΔV / i. Dal momento che la corrente i compare al denominatore abbiamo che in un
conduttore con grande resistenza R circola una piccola corrente i, viceversa un conduttore con piccola resistenza R è
caratterizzato da elevate correnti i. L'unità di misura della resistenza è l'ohm (simbolo Ω, omega maiuscola): 1 Ω = 1 V / 1
A.
In generale, all'aumentare della differenza di potenziale ΔV aumenta anche la corrente i ma ci sono varie possibili
relazioni tra i e ΔV a seconda del conduttore che prendiamo in considerazione. C'è però una categoria importante,
costituita dai conduttori metallici, per i quali possiamo dire qualcosa di più. Infatti per i conduttori metallici vale la prima
legge di Ohm, ossia la differenza di potenziale ΔV ai capi di un conduttore e la corrente i che vi circola sono
direttamente proporzionali: ΔV = R · i e la resistenza R è la costante di proporzionalità. La curva caratteristica risulta
pertanto una semiretta passante per l'origine:
Dunque se misuriamo con un voltmetro la differenza di potenziale ΔV e con un
amperometro la corrente i scopriamo che in un metallo il rapporto R = ΔV / i è
costante. Nei conduttori metallici la resistenza non dipende dalla differenza di
potenziale ΔV che applichiamo al conduttore.
Da cosa dipende allora la resistenza in un conduttore metallico? La risposta è data
dalla seconda legge di Ohm. La resistenza R in un conduttore metallico dipende dal
materiale di cui è fatto il filo, dalla sua lunghezza l e dalla sua sezione A. Più
precisamente, R = ρ l / A, ossia la resistenza è direttamente proporzionale alla lunghezza l del filo e inversamente
proporzionale all'area A della sezione. La costante di proporzionalità ρ (simbolo che corrisponde alla lettera greca ro)
dipende dal tipo di metallo che prendiamo in considerazione e va sotto il nome di resistività. Nella seguente tabella
riportiamo la resistività di alcuni metalli comuni:
Metallo
Rame
ρ (Ω · m) 1.7 ·
10-8
Argento Acciaio Alluminio
1.6 · 10-8 2 · 10-7 2.8 · 10-8
Resistività piccola vuol dire piccola resistenza, ossia buona capacità di condurre elettricità. Dal momento che ρ = R · A /
l, l'unità di misura della resistività nel Sistema Internazionale è l'ohm per metro (&Omega · m).
Effetto Joule
Ricordiamo che la potenza assorbita da un utilizzatore è data dalla formula P = ΔV · i. Se il conduttore soddisfa la prima
legge di Ohm ΔV = R · i con R costante. In questo caso possiamo perciò riscrivere la potenza assorbita dal conduttore
come P = R · i2. Questa formula gioca un ruolo importante nell'effetto Joule che andremo ora a illustrare.
8
Nel corso delle nostre lezioni di fisica abbiamo più volte parlato di energia. Finora abbiamo introdotto tre diverse forme di
energia: l'energia meccanica o lavoro che può a sua volta essere presente sotto forma di energia cinetica, energia
potenziale gravitazionale ed energia potenziale elastica. Abbiamo poi introdotto l'energia termica o calore e infine
l'energia elettrica. Abbiamo più volte detto che l'energia non si crea e non si distrugge ma si può trasformare da una
forma all'altra. L'effetto Joule descrive la trasformazione di energia elettrica in energia termica, ossia in calore.
Se avviciniamo una mano a una lampadina accesa sentiamo del calore, perché la corrente elettrica passando attraverso
il filo di tungsteno incontra una certa resistenza R al suo passaggio. La resistenza gioca nei fenomeni elettrici il ruolo
dell'attrito, nel senso che ostacola il passaggio delle cariche elettriche. L'energia elettrica che viene convertita in calore
per effetto Joule è data dalla seguente formula: Q = P · Δt = ΔV · i · Δt = R · i 2 · Δt. Questa legge prende anche il nome
di legge di Joule.
Moltissimi sono gli elettrodomestici che si basano sull'applicazione dell'effetto Joule: dalla lavatrice allo scaldabagno,
dalla stufa elettrica alla piastra metallica, dal fornelletto all'asciugacapelli al tostapane. Tutti questi elettrodomestici
assorbono energia elettrica per convertirla in calore tramite l'effetto Joule. Ricordiamo ora che il calore che forniamo a
una certa sostanza di calore specifico c comporta un aumento di temperatura ΔT regolato dalla legge fondamentale della
termologia: Q = c m ΔT. Uguagliando questa espressione al calore prodotto per effetto Joule: c m ΔT = R i 2 Δt possiamo
ad esempio ricavarci l'aumento di temperatura ΔT dell'acqua dello scaldabagno.
Conduttori in parallelo
Nella precedente sezione abbiamo visto che ogni conduttore è caratterizzato da una sua resistenza R. Le resistenze (o,
più precisamente, i resistori) sono il secondo utilizzatore che entra nei circuiti elettrici, a fianco dei condensatori. Il
simbolo con cui si indica una resistenza in un circuito è
. Come i condensatori, anche le resistenze possono
essere collegate tra loro in serie o in parallelo. In questa sezione cominciamo ad analizzare il collegamento di due
resistenze in parallelo.
Per poter analizzare il collegamento di resistenze in parallelo dobbiamo preliminarmente enunciare il primo principio di
Kirchoff. Consideriamo un nodo di un circuito, ossia un punto nel quale convergono più conduttori, come nella figura
sottostante.
Il primo principio di Kirchoff afferma che la somma delle correnti che entrano in un
nodo è uguale alla somma delle correnti che escono dal nodo: i 1 + i2 = i3 + i4 + i5. Il
primo principio di Kirchoff è una diretta conseguenza del principio di conservazione
della carica elettrica, in base al quale in un certo intervallo di tempo la carica elettrica
che entra in un nodo del circuito deve essere uguale alla carica elettrica che esce.
Abbiamo ora tutti gli elementi per studiare il collegamento dei conduttori in parallelo.
Supponiamo di avere due resistenze collegate in parallelo come nella figura seguente:
Applicando il primo principio di Kirchoff abbiamo che la corrente i che entra nel
nodo è uguale alla somma delle correnti che ne escono: i = i 1 + i2. Si definisce
resistenza equivalente quella resistenza che, sostituita al posto delle due
resistenze in parallelo, produce nel circuito elettrico lo stesso effetto. Per trovare
la resistenza equivalente è importante notare come la differenza di potenziale ai
capi delle due resistenze in parallelo è la stessa ed è uguale alla differenza di
potenziale ΔV fornita dal generatore. Applicando il primo principio di Kirchoff
possiamo andare a calcolarci l'inverso della resistenza equivalente: 1 / R e = i /
ΔV = (i1 + i2) / ΔV = i1 / ΔV + i2 / ΔV = 1 / R1 + 1 / R2. Dunque se le resistenze sono collegate in parallelo si sommano gli
inversi delle resistenze. La potenza assorbita è invece uguale alla somma delle potenze assorbite: P = i · ΔV = (i 1 + i2)
ΔV = P1 + P2.
L'importanza del collegamento in parallelo sta nel fatto che il circuito elettrico presente nelle nostre case è un circuito in
parallelo: quando accendiamo un elettrodomestico andiamo ad aggiungere una resistenza in parallelo, la resistenza
equivalente del circuito diminuisce e in questo modo viene assorbita una quantità maggiore di corrente.
Conduttori in serie
In questa sezione vogliamo trovare la resistenza equivalente nel caso di due
conduttori collegati in serie, come nella figura seguente
Se colleghiamo due resistenze in serie è l'intensità di corrente ad essere la
stessa in tutte le resistenze. La differenza di potenziale (o tensione) fornita dal
generatore ΔV si ritrova invece in parte ai capi della prima resistenza ΔV 1 e in
parte ai capi della seconda resistenza ΔV2. Avremo perciò: ΔV = ΔV1 + ΔV2. La
resistenza equivalente Re è data da: Re = ΔV / i = ΔV1 / i + ΔV2 / i = R1 + R2.
9
Dunque nel collegamento in serie le resistenze si sommano.
Anche le potenze assorbite si sommano nel collegamento di resistenze in serie. Infatti la potenza assorbita è data da: P
= i · ΔV = i · (ΔV1 + ΔV2) = P1 + P2.
Ora che abbiamo introdotto il collegamento in serie e in parallelo delle resistenze possiamo spendere qualche parola in
più sugli amperometri e i voltmetri. Abbiamo già detto che gli amperometri vanno inseriti in serie mentre i voltmetri vanno
inseriti in parallelo, come nella figura seguente:
Ora sia l'amperometro che il voltmetro sono dotati di una loro resistenza interna. Cerchiamo di capire come devono
essere tali resistenze interne per non interferire con la misura. Cominciamo dal caso dell'amperometro: essendo inserito
in serie, la resistenza equivalente è Re = R + r. Affinché la resistenza equivalente non si discosti di molto dalla resistenza
R è necessario che la resistenza interna dell'amperometro risulti essere piccola, in modo che R e ≈ R.
Diverso è invece il discorso relativo al voltmetro. Infatti affinché il voltmetro non assorba troppa corrente del circuito è
necessario che la resistenza interna del voltmetro sia il più grande possibile. Un altro modo per rendersi conto di ciò è
quello di considerare la formula per la resistenza equivalente quando il collegamento è in parallelo: 1 / R e = 1 / R + 1 / r.
Affinché la resistenza interna del voltmetro contribuisca il meno possibile alla resistenza equivalente bisogna fare in
modo che 1 / r ≈ 0. L'inverso di r è prossimo a zero solo quando la resistenza interna r, che compare al denominatore, è
un numero molto grande.
10